Реакции с образованием осадков.ppt
- Количество слайдов: 38

Реакции с образованием и растворением осадков Гетерофазные реакции

Применение гетерофазных реакций 1. Перевод вещества из твердой фазы в раствор при пробоподготовке. (Растворение металла в соляной кислоте. ) 2. Разделение веществ при избирательном растворении: фазовый анализ, элюирование, выщелачивание. (Вытяжка солей из почв. ) 3. Разделение и концентрирование веществ при осадкообразовании. (Отделение железа от меди при осаждении аммиаком. ) 4. Разделение и концентрирование веществ при соосаждении. (Концентрирование радия при соосаждении с сульфатом бария). 5. Осадительное титрование. 6. Гравиметрия.

Описание равновесий гетерофазных реакций Растворение в системе соль – Н 2 О =1 ≈0 Условие образования осадка (пересыщенный раствор) Условие растворения осадка (ненасыщенный раствор)

Факторы, влияющие на растворимость 1. Температура. 2. Природа растворителя и растворенного вещества. Правило: «Подобное растворяется в подобном» . 3. Концентрация общего иона - осадителя. 4. Ионная сила (концентрация индифферентного электролита) раствора над осадком. 5. Концентрация комплексообразующих агентов. 6. р. Н раствора (концентрация сильной кислоты).
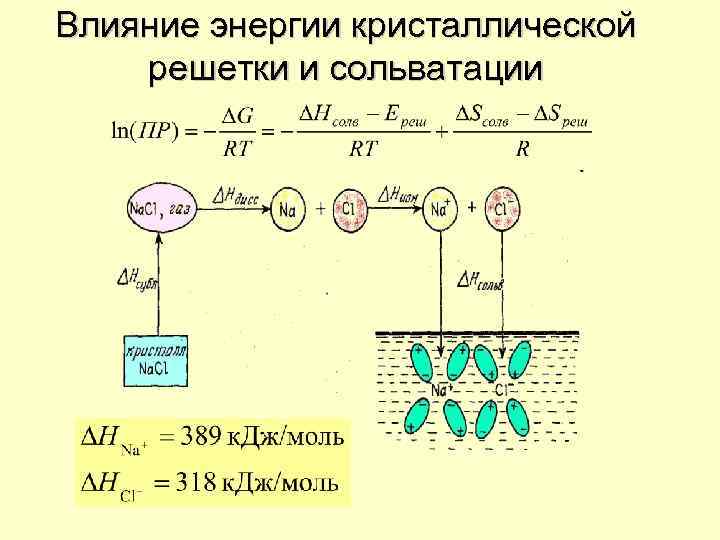
Влияние энергии кристаллической решетки и сольватации
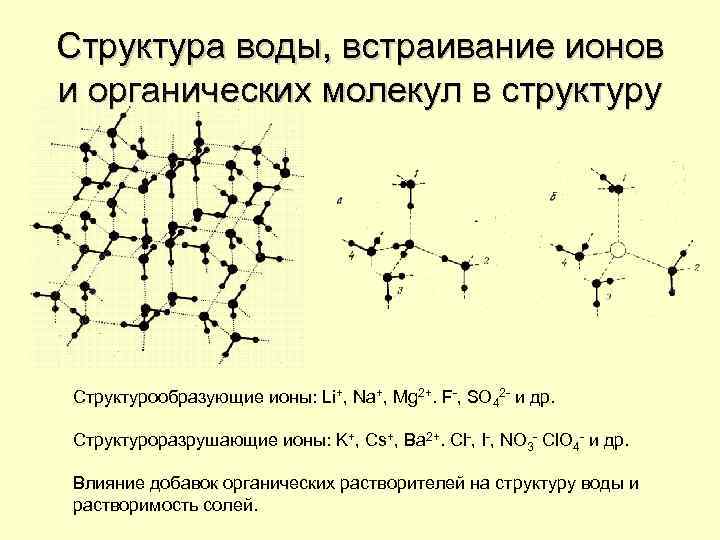
Структура воды, встраивание ионов и органических молекул в структуру Структурообразующие ионы: Li+, Na+, Mg 2+. F-, SO 42 - и др. Структуроразрушающие ионы: K+, Cs+, Ba 2+. Cl-, I-, NO 3 - Cl. O 4 - и др. Влияние добавок органических растворителей на структуру воды и растворимость солей.
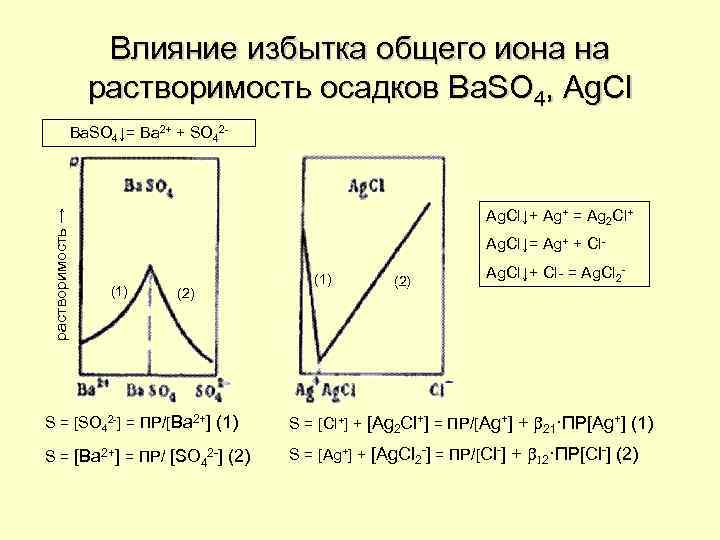
Влияние избытка общего иона на растворимость осадков Ba. SO 4, Ag. Cl растворимость → Ba. SO 4↓= Ba 2+ + SO 42 - Ag. Cl↓+ Ag+ = Ag 2 Cl+ Ag. Cl↓= Ag+ + Cl(1) (2) Ag. Cl↓+ Cl- = Ag. Cl 2 - S = [SO 42 -] = ПР/[Ba 2+] (1) S = [Cl+] + [Ag 2 Cl+] = ПР/[Ag+] + b 21·ПР[Ag+] (1) S = [Ba 2+] = ПР/ [SO 42 -] (2) S = [Ag+] + [Ag. Cl 2 -] = ПР/[Cl-] + b 12·ПР[Cl-] (2)

Влияние ионной силы раствора Пример: Ba. SO 4↓= Ba 2+ + SO 42 -

Влияние р. Н на растворимость солей слабых кислот Ca. C 2 O 4↓= Ca 2+ + C 2 O 42 - - главная реакция C 2 O 42 - + H+ = HC 2 O 42 - + H+ = H 2 C 2 O 4 побочные реакции

Влияние комплексообразования Ag. Cl↓= Ag+ + Cl- - главная реакция Ag+ + NH 3 = [Ag. NH 3]+ Ag+2 NH 3 = [Ag(NH 3)2 ]+ Растворимость в 0, 1 М аммиаке: побочные реакции

Стадии образования осадка 1. 2. 3. 4. 5. Десольватация ионов Образование зародышей Рост первичных центров кристаллизации Выделение из раствора твердой фазы Старение осадка Стадии 1 – 5 являются коллоидно-химическими стадиями, обуславливающими высокую степень дисперсности и многофазность осаждаемого вещества и, как следствие, большой избыток поверхностной энергии.
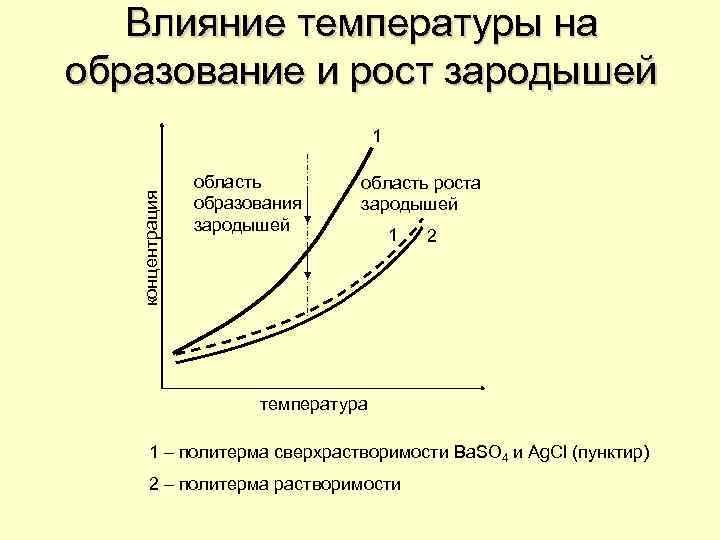
Влияние температуры на образование и рост зародышей концентрация 1 область образования зародышей область роста зародышей 1 2 температура 1 – политерма сверхрастворимости Ba. SO 4 и Ag. Cl (пунктир) 2 – политерма растворимости
Основные типы осадков Кристаллические Аморфные
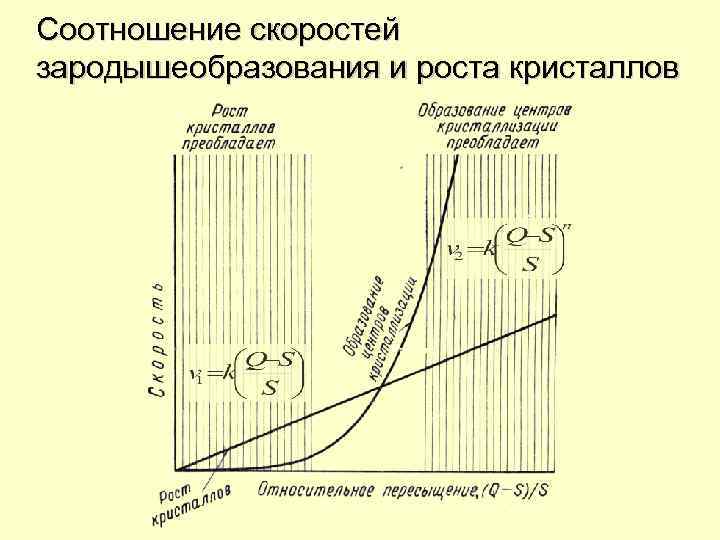
Соотношение скоростей зародышеобразования и роста кристаллов

Растворимость метастабильных осадков 1. 2. 3. Свежеосажденный Ba. SO 4 растворим в разбавленной уксусной кислоте. При старении осадка хорошо растворимый в кислотах a-Co. S переходит в плохо растворимую форму b-Co. S. Ca. C 2 O 4· 3 H 2 O → Ca. C 2 O 4· 2 H 2 O → Ca. C 2 O 4·H 2 O (изменение химического состава осадка). Влияние размера частиц осадка - уравнение Оствальда - Френдлиха

Факторы определяющие структуру и чистоту осадков при их образовании 1. Температура. 2. Скорость прибавления осадителя. 3. Степень пересыщение раствора осаждаемым веществом. 4. Соосаждение примесей. 5. Образование коллоидных растворов. 6. Старение осадка.

Условия для получения кристаллический осадков 1. Нужно уменьшать относительное пересыщение раствора. 2. Избегать использования затравок, вызывающих индуцированную нуклеацию. 3. Замедлять осаждение. 4. Оставлять осадок над маточным раствором для старения. 5. Использовать гомогенное осаждение. (C 2 H 5)2 SO 4 +2 H 2 O = 2 C 2 H 5 OH + SO 42 - + 2 H+

Условия образования аморфных осадков 1. Вести осаждение из горячего раствора при перемешивании в присутствии коагулянта – высаливателя. 2. Старение осадка проводить в горячем растворе. 3. Использовать гомогенное осаждение. (NH 2)2 C(O) +2 H 2 O = 2 NH 4+ + CO 322 Fe(H 2 O)3+ + 3 CO 32 - = 2 Fe(OH)3↓ + 3 H 2 CO 3↑
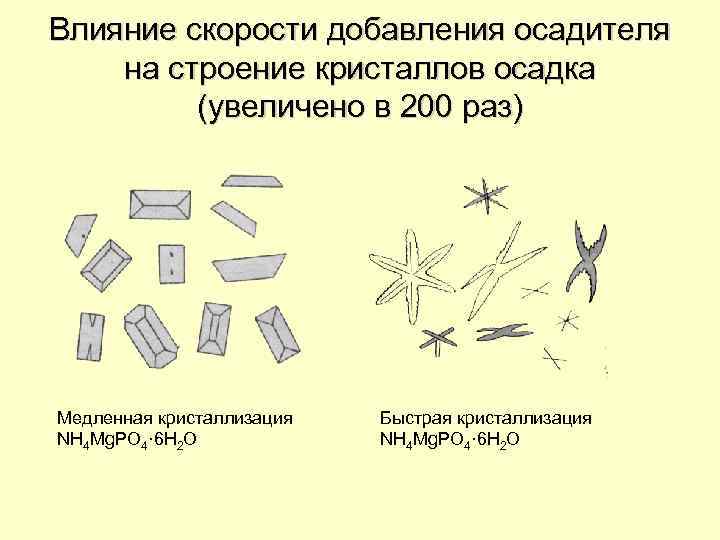
Влияние скорости добавления осадителя на строение кристаллов осадка (увеличено в 200 раз) Медленная кристаллизация NH 4 Mg. PO 4· 6 H 2 O Быстрая кристаллизация NH 4 Mg. PO 4· 6 H 2 O
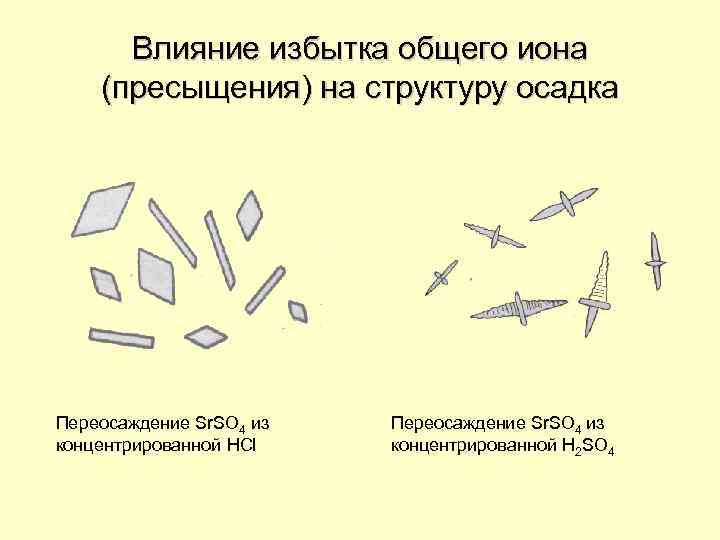
Влияние избытка общего иона (пресыщения) на структуру осадка Переосаждение Sr. SO 4 из концентрированной HCl Переосаждение Sr. SO 4 из концентрированной H 2 SO 4
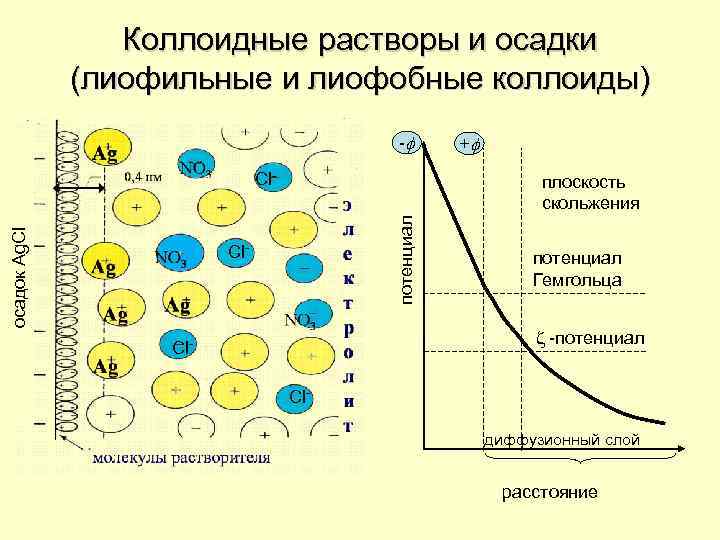
Коллоидные растворы и осадки (лиофильные и лиофобные коллоиды) -f плоскость скольжения потенциал осадок Ag. Cl Cl- +f Cl- потенциал Гемгольца z -потенциал Cl. Cl- диффузионный слой расстояние
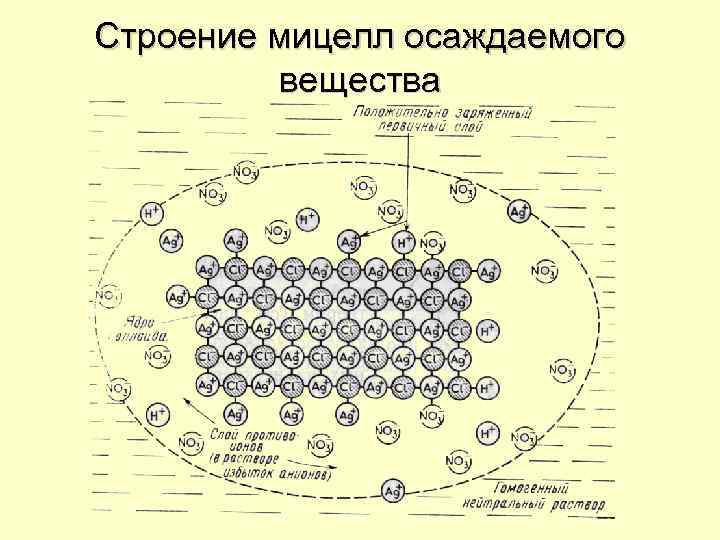
Строение мицелл осаждаемого вещества
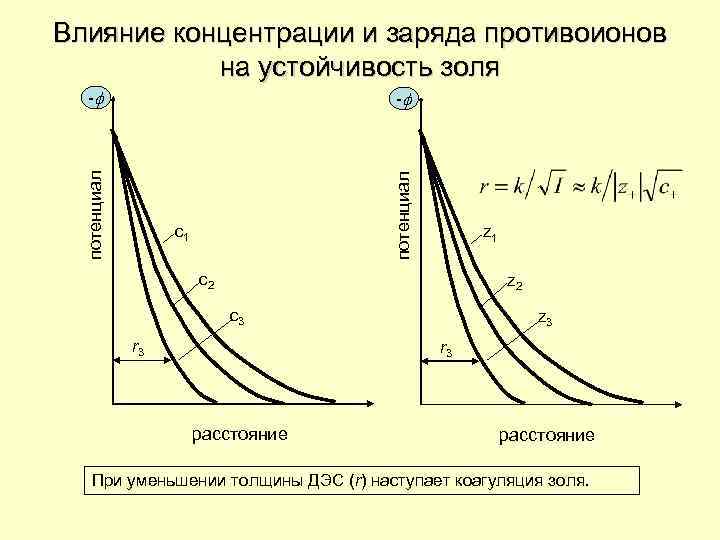
Влияние концентрации и заряда противоионов на устойчивость золя -f потенциал -f c 1 z 1 c 2 z 2 c 3 r 3 z 3 r 3 расстояние При уменьшении толщины ДЭС (r) наступает коагуляция золя.

Правила коагуляции 1. Порог коагуляции тем ниже, чем выше заряд электролита и чем сильнее химическое сродство противоиона коагулянта с адсорбированными ионами в поверхностном слое ядра мицеллы. ск(Pb 2+)<ск(Mg 2+), т. к. b(Pb. Cl+)>>b(Mg. Cl+). 2. С увеличением температуры порог коагуляции уменьшается благодаря десорбции ионов и воды поверхностного слоя. 3. Растворы гидрофильных коллоидов малочувствительны к коагулянтам. 4. Лиофильные коллоиды могут оказывать либо защитное действие, либо обратное сенсибилизирующее действие на гидрофобные коллоиды. (сульфат бария + желатин; кремневая кислот + желатин). 5. Процесс коагуляции обратим (явление пептизации). 6. Аморфные осадки – это скоагулированные коллоиды

Процессы при старении осадка 1. Перекристаллизация. Повышение температуры и уменьшении р. Н раствора способствует перекристаллизации. Оствальдовское старение: 2. Переход метастабильных модификаций с стабильные. (a-Co. S → b-Co. S) 3. Термическое старение в следствии большей подвижности ионов и молекул осадка. 4. Химическое старение, т. е. изменение состава осадка. (Ca. C 2 O 4· 3 H 2 O → Ca. C 2 O 4· 2 H 2 O → Ca. C 2 O 4·H 2 O). 5. Упрочнение коагуляционных контактов аморфных осадков. Возникают легко промываемые и фильтрующиеся осадки, составленные из частиц
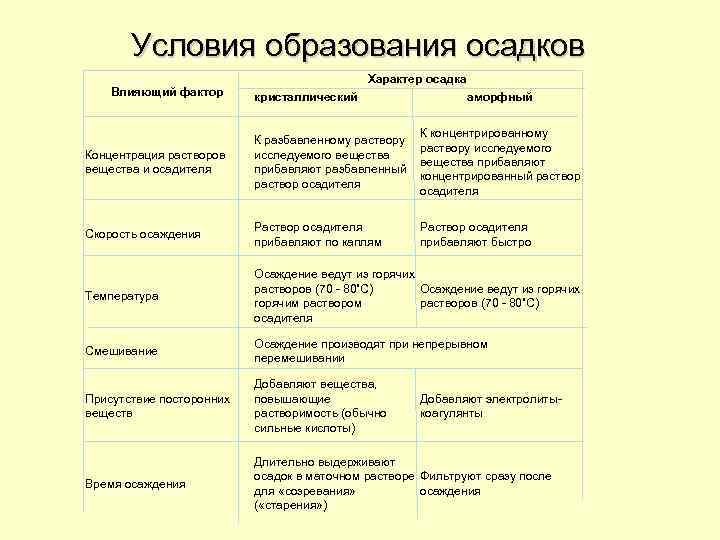
Условия образования осадков Влияющий фактор Характер осадка кристаллический аморфный Концентрация растворов вещества и осадителя К разбавленному раствору исследуемого вещества прибавляют разбавленный раствор осадителя К концентрированному раствору исследуемого вещества прибавляют концентрированный раствор осадителя Скорость осаждения Раствор осадителя прибавляют по каплям Раствор осадителя прибавляют быстро Температура Осаждение ведут из горячих растворов (70 - 80˚С) Осаждение ведут из горячих горячим растворов (70 - 80˚С) осадителя Смешивание Осаждение производят при непрерывном перемешивании Присутствие посторонних веществ Добавляют вещества, повышающие растворимость (обычно сильные кислоты) Время осаждения Длительно выдерживают осадок в маточном растворе Фильтруют сразу после для «созревания» осаждения ( «старения» ) Добавляют электролитыкоагулянты

Процессы загрязнения осадков 1. Совместное осаждение, например Fe(OH)3 и Al(OH)3 при р. Н=2 -3 2. Соосаждение: адсорбция, инклюзия, окклюзия, сокристаллизация (изоморфное осаждение). 3. Послеосаждение. (Mg. C 2 O 4 на Ca. C 2 O 4·H 2 O ). Основной причиной загрязнения осадка является соосаждение.

Соосаждение за счет адсорбции. (правила Паннета – Фаянса - Хана) 1. 2. 3. 4. В первую очередь адсорбируются собственные ионы осадка и во вторую очередь посторонние противоионы. (Ag. I·Ag+¦NO 3 -). При прочих равных условиях преимущественно адсорбируются ионы, концентрация которых больше. Многозарядные ионы адсорбируются сильнее однозарядных. Преимущественно адсорбируются ионы, изоморфные ионам осадка.
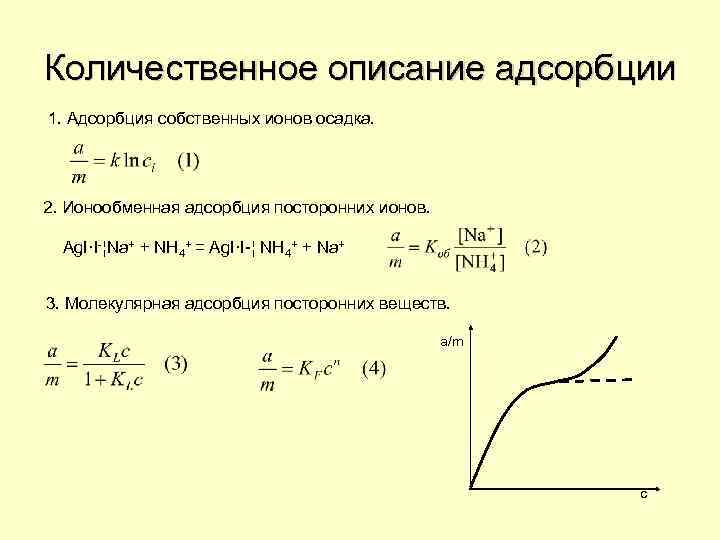
Количественное описание адсорбции 1. Адсорбция собственных ионов осадка. 2. Ионообменная адсорбция посторонних ионов. Ag. I·I-¦Na+ + NH 4+ = Ag. I·I-¦ NH 4+ + Na+ 3. Молекулярная адсорбция посторонних веществ. a/m c

Изоморфное соосаждение При образовании твердых растворов один из ионов кристаллической решетки замещается другим ионом при условии, что заряды их одинаковы, размеры близки, а строение кристаллических решеток (сингонии) одинаковы. C Zn. Hg(SCN)2 соосаждаются Со 2+ (r=0, 082 нм), Cu 2+(0, 080) и Fe 2+(0, 078) C Ba. SO 4 соосаждается Ra. SO 4, т. к. r(Bа 2+) = 0, 143 нм, r(Rа 2+) = 0, 152 нм Соосаждение ионных пар: Ba. SO 4↓ + KMn. O 4; Ba. SO 4 ↓ + KBF 4.
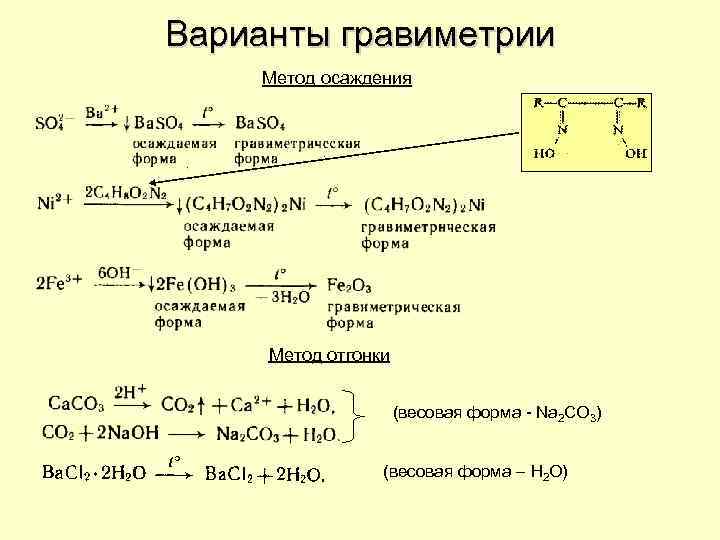
Варианты гравиметрии Метод осаждения Метод отгонки (весовая форма - Na 2 CO 3) (весовая форма – H 2 O)

Прибор для определения влажности сыпучих веществ термогравиметрическим методом

Примеры гравиметрический определений
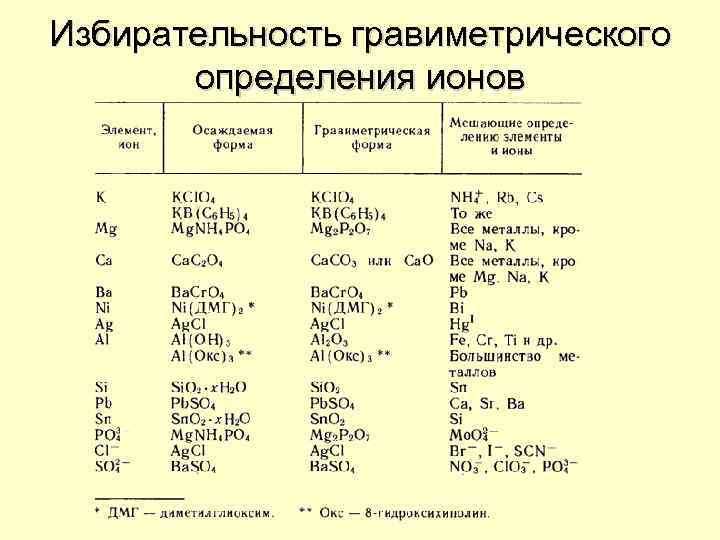
Избирательность гравиметрического определения ионов
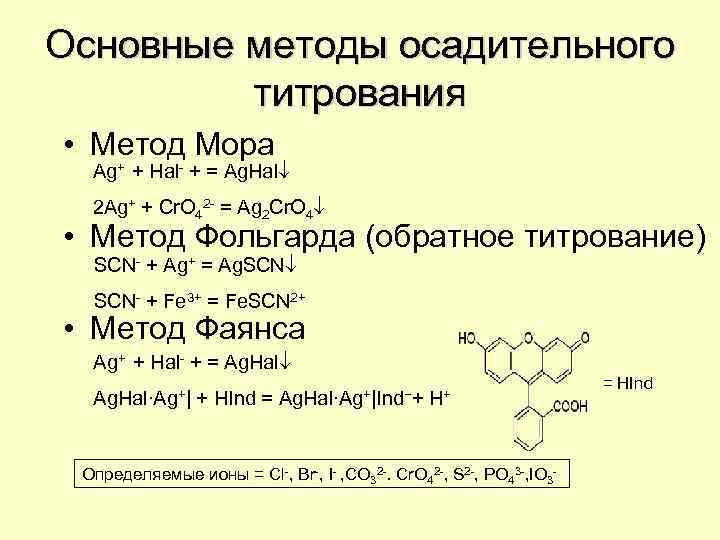
Основные методы осадительного титрования • Метод Мора Ag+ + Hal- + = Ag. Hal 2 Ag+ + Cr. O 42 - = Ag 2 Cr. O 4 • Метод Фольгарда (обратное титрование) SCN- + Ag+ = Ag. SCN- + Fe 3+ = Fe. SCN 2+ • Метод Фаянса Ag+ + Hal- + = Ag. Hal∙Ag+| + HInd = Ag. Hal∙Ag+|Ind−+ H+ Определяемые ионы = Cl-, Br-, I- , CO 32 -. Cr. O 42 -, S 2 -, PO 43 -, IO 3 - = HInd

Влияние концентрации определяемого иона на величину скачка (метод Мора) Br- + Ag+ = Ag. Br 2 Ag+ + Cr. O 42 - = Ag 2 Cr. O 4
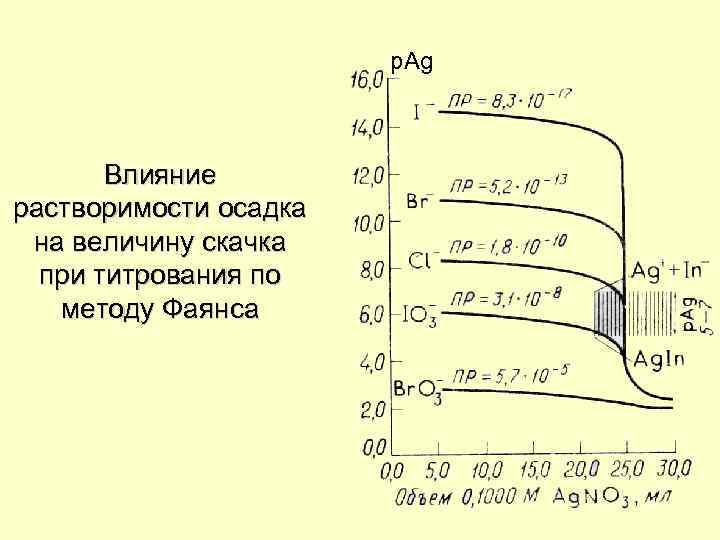
p. Ag Влияние растворимости осадка на величину скачка при титрования по методу Фаянса
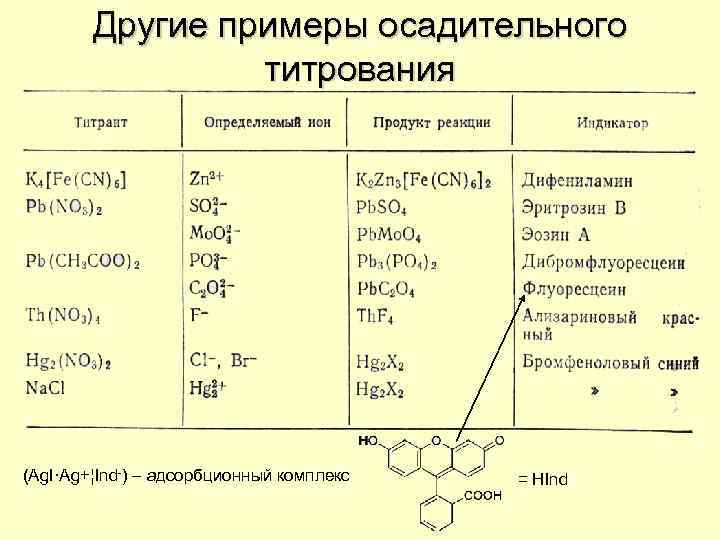
Другие примеры осадительного титрования (Ag. I·Ag+¦Ind-) – адсорбционный комплекс = HInd
Реакции с образованием осадков.ppt