Реакции ионного обмена Карташова.ppt
- Количество слайдов: 17

Реакции ионного обмена Карташова Людмила Александровна учитель химии МБОУ «СОШ № 27 с углубленным изучением отдельных предметов» г. Балаково Саратовской области

Разминка для ума 1. Положительно заряженный электрод - анод 2. Отрицательно заряженный электрод - катод 3. Направленное движение заряженных частиц - электрический ток 4. Положительно заряженные частицы 5. Отрицательно заряженные частицы - катионы анионы

Разминка для ума 6. Вещества, водные растворы или расплавы которых проводят электрический ток – электролиты 7. Вещества, водные растворы или расплавы которых не проводят электрический ток – неэлектролиты 8. Процесс распада электролита на ионы при растворении или расплавлении вещества – диссоциация
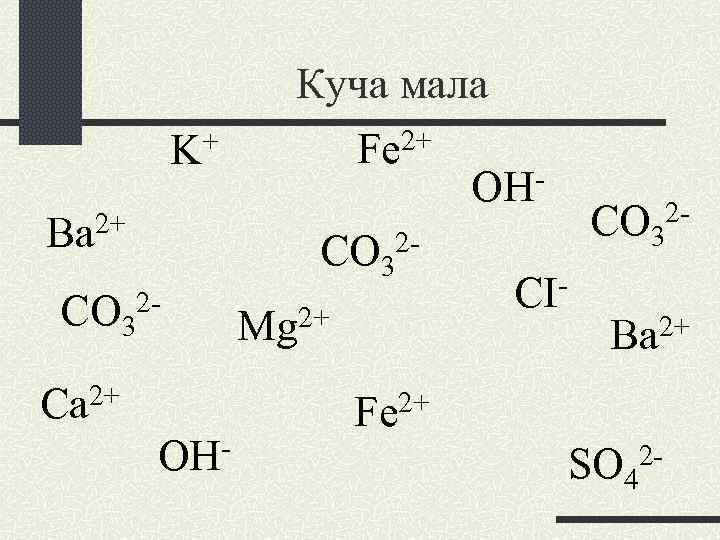
Куча мала + Fe 2+ K OH 2+ CO 32 Вa CO 32 CICO 322+ 2+ Mg Вa Ca 2+ OH- Fe 2+ SO 42 -
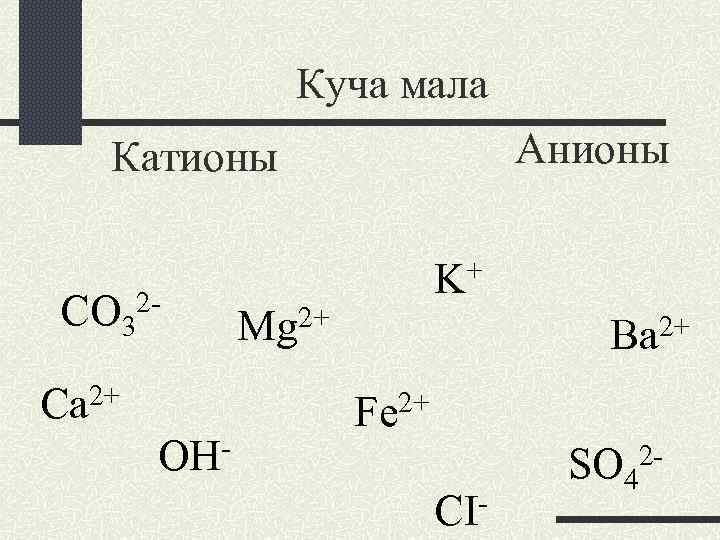
Куча мала Анионы Катионы CO 32 Ca 2+ OH- + K 2+ Mg 2+ Вa Fe 2+ CI- SO 42 -
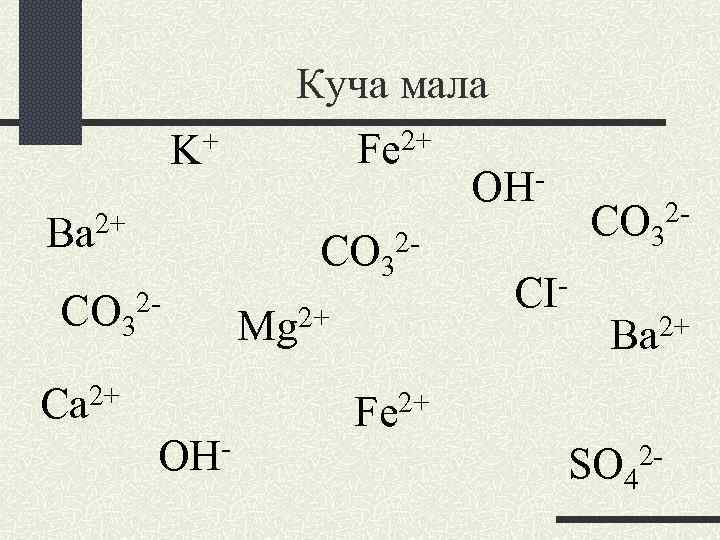
Куча мала + Fe 2+ K OH 2+ CO 32 Вa CO 32 CICO 322+ 2+ Mg Вa Ca 2+ OH- Fe 2+ SO 42 -
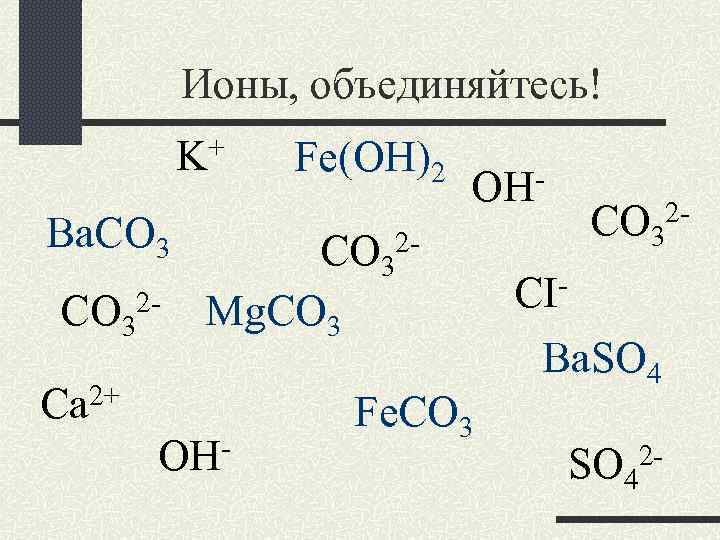
Ионы, объединяйтесь! K+ Вa. CO 32 - Fe(OH)2 OH- CO 32 Mg. CO 3 Ca 2+ OH- Fe. CO 32 - CIВa. SO 42 -

Реакций ионного обмена Реакции между ионами называют ионными реакциями, а уравнения таких реакций – ионными уравнениями. Большинство химических реакций протекают в растворах. Растворы электролитов содержат ионы, поэтому такие реакции сводятся к реакциям между ионами. Эти реакции по правилу Бертолле, т. е. только в том случае, если в результате образуется осадок, газ или малодиссоциирующее вещество (например , H 2 O)
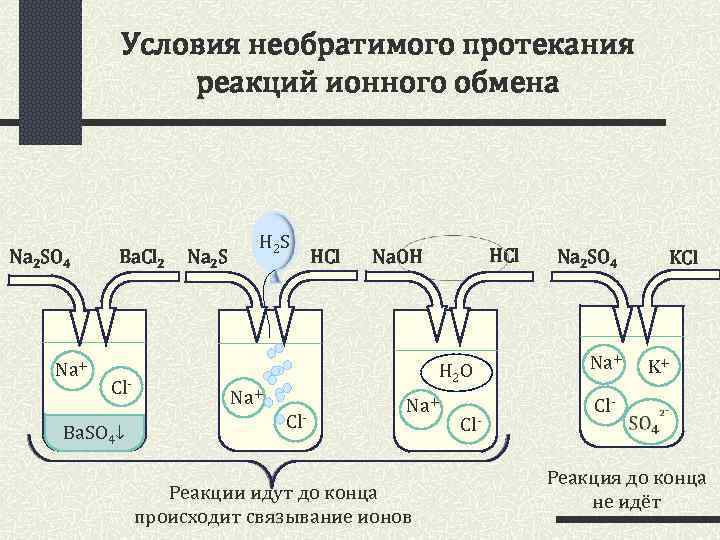
Условия необратимого протекания реакций ионного обмена Na 2 SO 4 Na+ Ba. Cl 2 Cl- Ba. SO 4↓ Na 2 S HCl HCl Na. OH H 2 O Na+ Cl- Na+ Реакции идут до конца происходит связывание ионов Cl- Na 2 SO 4 KCl Na+ Cl- K+ Реакция до конца не идёт

Правила составления ионных уравнений При составлении ионных уравнений следует руководствоваться тем, что вещества малодиссоциирующие, нерастворимые и газообразные записываются в молекулярной форме. Вещество, выпадающее в осадок, обозначают стрелочкой , направленной вниз, а выделяющееся в виде газа, стрелочкой, направленной вверх.

Правила составления ионных уравнений Сокращённое ионное уравнение – это уравнение в общем виде. Оно показывает суть происходящих процессов. Например, в случае образования сульфата бария совершенно не имеет значения, в состав каких электролитов входили ионы Ba 2+ и SO 42 Ba 2+ + SO 42 - = Ba. SO 4 ↓ Ba(NO 3)2 Ba. Cl 2 K 2 SO 4 H 2 SO 4

Правила составления ионных уравнений

Правила составления ионных уравнений Пример: Взаимодействие сульфата натрия с хлоридом бария. 5. Запишем уравнение в ионное уравнение. 1. По таблице растворимости определим 2. Расставимполное ионное уравнение виде: 3. Сократим одинаковые молекулярном коэффициенты 6. Составим сокращённоеионы в левой и правой части 4. Полного ионного уравнения. нерастворимые вещества. Обозначим их стрелкой вниз. + 2 Cl 2 Na. SO 4 + Ba 2+-2 = Ba. SO 4↓ +2 Na+Na 2 + Ba. Cl Ba. SO 4 2 2 Cl Na. Cl + Ba 2+ + = Ba. SO 4↓ = +

Примеры реакций ионного обмена Молекулярное уравнение реакции растворимой соли со щелочью: Cu. Cl 2 + 2 KOH = 2 KCl + Cu(OH)2. Полное ионное уравнение реакции: Cu 2+ + 2 Cl– + 2 K+ + 2 OH– = 2 K+ + 2 Cl– + Cu(OH)2. Cокращенное ионное уравнение реакции: Cu 2+ + 2 OH– = Cu(OH)2.

Примеры реакций ионного обмена

Примеры реакций ионного обмена

Домашнее задание § 37, подготовка к практической работе № 6 с. 237, Задание для любознательных: изучить этикетки от бутылок с минеральной водой. На них записан состав воды в виде ионов. Составить формулы веществ и дать им название.
Реакции ионного обмена Карташова.ppt