e664551bba993b40dc17273d4fe49484.ppt
- Количество слайдов: 22

 Разминка: определите вид химической связи HNO 3 Cl 2 KHSO 4 H 2 O Na. OH Ca. O Cu
Разминка: определите вид химической связи HNO 3 Cl 2 KHSO 4 H 2 O Na. OH Ca. O Cu
 Н∙ +∙Н → Н: Н Обменный механизм образования связи . . NH 3 + HCl + _ → [NH 4]Cl Донорно-акцепторный механизм образования связи
Н∙ +∙Н → Н: Н Обменный механизм образования связи . . NH 3 + HCl + _ → [NH 4]Cl Донорно-акцепторный механизм образования связи
 Исследовательский урок химии в 11 классе Комплексные соединения. Строение. Классификация и номенклатура.
Исследовательский урок химии в 11 классе Комплексные соединения. Строение. Классификация и номенклатура.
 Цели урока: § повторить виды химической связи § сформировать понятие о составе и строении § § § комплексных соединений, познакомиться с основами координационной теории А. Вернера, на примере комплексных соединений расширить понятие о многообразии веществ, рассмотреть классификацию и номенклатуру комплексных соединений.
Цели урока: § повторить виды химической связи § сформировать понятие о составе и строении § § § комплексных соединений, познакомиться с основами координационной теории А. Вернера, на примере комплексных соединений расширить понятие о многообразии веществ, рассмотреть классификацию и номенклатуру комплексных соединений.
 Решите задачу Молярная масса соединения равна 329 г/моль. Массовая доля К, С, Fe и N соответственно равны: 35, 56%; 21, 88 %; 17, 02%; 25, 54%. Определите молекулярную формулу вещества.
Решите задачу Молярная масса соединения равна 329 г/моль. Массовая доля К, С, Fe и N соответственно равны: 35, 56%; 21, 88 %; 17, 02%; 25, 54%. Определите молекулярную формулу вещества.
 Решение Дано: Запишем элементы по возрастанию электроотрицательности Ответ:
Решение Дано: Запишем элементы по возрастанию электроотрицательности Ответ:
 Проблема 1 -Что это за соединение? К какому классу оно относится? K 3 Fe. C 6 N 6 3 КСN · Fe(СN)3
Проблема 1 -Что это за соединение? К какому классу оно относится? K 3 Fe. C 6 N 6 3 КСN · Fe(СN)3
 Лабораторный опыт 1). Внесите кристаллы исследуемого вещества в пламя спиртовки. Отметьте цвет пламени и сделайте вывод. 2). Растворите вещество в воде и проделайте качественную реакцию на ион железа (III) с роданидом калия. Прокомментируйте наблюдения. 3). Сделайте вывод о составе данного вещества.
Лабораторный опыт 1). Внесите кристаллы исследуемого вещества в пламя спиртовки. Отметьте цвет пламени и сделайте вывод. 2). Растворите вещество в воде и проделайте качественную реакцию на ион железа (III) с роданидом калия. Прокомментируйте наблюдения. 3). Сделайте вывод о составе данного вещества.
 Проблема 2 -Как может быть построен ион, содержащий железо? И как построено это соединение в целом? К 3[Fe (CN)6 ] – комплексное соединение
Проблема 2 -Как может быть построен ион, содержащий железо? И как построено это соединение в целом? К 3[Fe (CN)6 ] – комплексное соединение
![_ +. . N H 3 + H Cl + _ → [NH 4] _ +. . N H 3 + H Cl + _ → [NH 4]](https://present5.com/presentation/e664551bba993b40dc17273d4fe49484/image-11.jpg) _ +. . N H 3 + H Cl + _ → [NH 4] Cl Ион аммония – комплексный ион
_ +. . N H 3 + H Cl + _ → [NH 4] Cl Ион аммония – комплексный ион
![Строение комплексного соединения Комплексообразователь К 3 [Fe (CN) 6 ] ___________ внешняя сфера внутренняя Строение комплексного соединения Комплексообразователь К 3 [Fe (CN) 6 ] ___________ внешняя сфера внутренняя](https://present5.com/presentation/e664551bba993b40dc17273d4fe49484/image-12.jpg) Строение комплексного соединения Комплексообразователь К 3 [Fe (CN) 6 ] ___________ внешняя сфера внутренняя сфера координационное лиганд число
Строение комплексного соединения Комплексообразователь К 3 [Fe (CN) 6 ] ___________ внешняя сфера внутренняя сфера координационное лиганд число
 А. Вернер Л. А. Чугаев
А. Вернер Л. А. Чугаев
 «Только с появлением теории Вернера химия комплексных соединений утратила характер лабиринта или темного леса, в котором исследователь рисковал заблудиться… ныне в этом лесу проложены широкие дороги…» Л. Чугаев.
«Только с появлением теории Вернера химия комплексных соединений утратила характер лабиринта или темного леса, в котором исследователь рисковал заблудиться… ныне в этом лесу проложены широкие дороги…» Л. Чугаев.
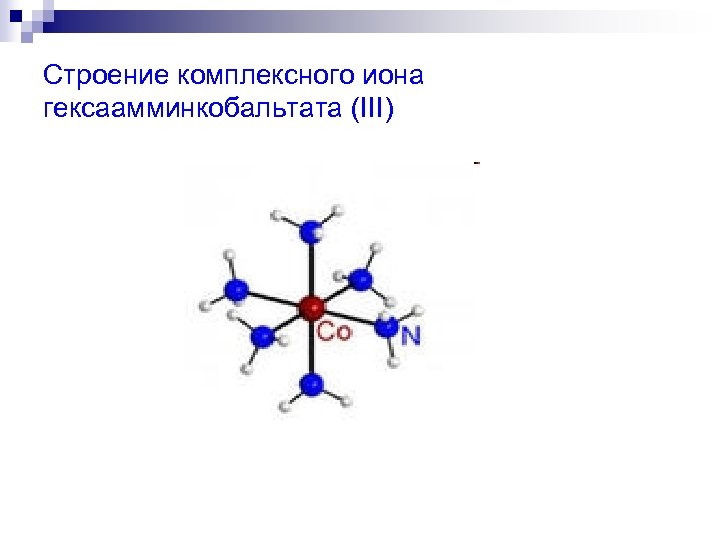 Строение комплексного иона гексаамминкобальтата (III)
Строение комплексного иона гексаамминкобальтата (III)
![Классификация. В зависимости от природы лиганда различают: 1) аквакомплексы [Сr (Н 2 О)6] Сl Классификация. В зависимости от природы лиганда различают: 1) аквакомплексы [Сr (Н 2 О)6] Сl](https://present5.com/presentation/e664551bba993b40dc17273d4fe49484/image-16.jpg) Классификация. В зависимости от природы лиганда различают: 1) аквакомплексы [Сr (Н 2 О)6] Сl 3; 2) аммиакаты [ Сu (NН 3)4] SО 4; 3) гидроксокомплексы К 2[Zn (ОН)4]; 4) ацидокомплексы К 4 [Fe (CN) 6 ].
Классификация. В зависимости от природы лиганда различают: 1) аквакомплексы [Сr (Н 2 О)6] Сl 3; 2) аммиакаты [ Сu (NН 3)4] SО 4; 3) гидроксокомплексы К 2[Zn (ОН)4]; 4) ацидокомплексы К 4 [Fe (CN) 6 ].
 Номенклатура Н 2 О – NН 3 – Сl– NО 2 - – СN- – ОН - – SО 42 - – СО - «аква-» «аммин-» «хлоро-» «нитро-» «циано-» «гидроксо-» «сульфато-» «карбонил»
Номенклатура Н 2 О – NН 3 – Сl– NО 2 - – СN- – ОН - – SО 42 - – СО - «аква-» «аммин-» «хлоро-» «нитро-» «циано-» «гидроксо-» «сульфато-» «карбонил»
![Упражнение в номенклатуре. 1. Назовите вещества: Nа+[Аl+3(ОН-)4] - тетрагидроксоалюминат натрия [ Со+3(NН 30)4 (NО Упражнение в номенклатуре. 1. Назовите вещества: Nа+[Аl+3(ОН-)4] - тетрагидроксоалюминат натрия [ Со+3(NН 30)4 (NО](https://present5.com/presentation/e664551bba993b40dc17273d4fe49484/image-18.jpg) Упражнение в номенклатуре. 1. Назовите вещества: Nа+[Аl+3(ОН-)4] - тетрагидроксоалюминат натрия [ Со+3(NН 30)4 (NО 2 -)Сl-]Сl. О- -перхлорат хлоронитротетраамминкобальта (III) 4 [ Сu+2(NН 30)4] SО 4 -2 - сульфат тетраамминмеди (II) 2. Напишите формулы Хлорид гексааквахрома (III) [Сr+3(Н 2 О)6] Сl 3 Тетрагидроксоцинкат (II) калия К 2+[Zn+2(ОН)-4] -
Упражнение в номенклатуре. 1. Назовите вещества: Nа+[Аl+3(ОН-)4] - тетрагидроксоалюминат натрия [ Со+3(NН 30)4 (NО 2 -)Сl-]Сl. О- -перхлорат хлоронитротетраамминкобальта (III) 4 [ Сu+2(NН 30)4] SО 4 -2 - сульфат тетраамминмеди (II) 2. Напишите формулы Хлорид гексааквахрома (III) [Сr+3(Н 2 О)6] Сl 3 Тетрагидроксоцинкат (II) калия К 2+[Zn+2(ОН)-4] -
![Назовите исследуемое вещество. К 3[Fe (CN) 6 ] Гексацианоферрат (III) калия Назовите исследуемое вещество. К 3[Fe (CN) 6 ] Гексацианоферрат (III) калия](https://present5.com/presentation/e664551bba993b40dc17273d4fe49484/image-19.jpg) Назовите исследуемое вещество. К 3[Fe (CN) 6 ] Гексацианоферрат (III) калия
Назовите исследуемое вещество. К 3[Fe (CN) 6 ] Гексацианоферрат (III) калия
 Самостоятельная работа. I вариант I I вариант Напишите формулы веществ: Тетрагидроксокупрата (II) натрия Гексанитрокобальтата (III) калия 1. 2. Назовите вещества: [ Рt(NН 3)3 Сl]Сl К[ Рt(NН 3)Сl 3]
Самостоятельная работа. I вариант I I вариант Напишите формулы веществ: Тетрагидроксокупрата (II) натрия Гексанитрокобальтата (III) калия 1. 2. Назовите вещества: [ Рt(NН 3)3 Сl]Сl К[ Рt(NН 3)Сl 3]
![I вариант 1. Тетрагидроксокупрат (II) натрия Na 2 [ Cu (OH)4] 2. [ Рt(NН I вариант 1. Тетрагидроксокупрат (II) натрия Na 2 [ Cu (OH)4] 2. [ Рt(NН](https://present5.com/presentation/e664551bba993b40dc17273d4fe49484/image-21.jpg) I вариант 1. Тетрагидроксокупрат (II) натрия Na 2 [ Cu (OH)4] 2. [ Рt(NН 3)3 Сl]Сl Хлорид хлоротриамминплатины (II) I I вариант Гексанитрокобальтат (III) калия K 3 [ Co (NO 2)6] К[ Рt(NН 3)Сl 3] Трихлороамминплатинат (II) калия
I вариант 1. Тетрагидроксокупрат (II) натрия Na 2 [ Cu (OH)4] 2. [ Рt(NН 3)3 Сl]Сl Хлорид хлоротриамминплатины (II) I I вариант Гексанитрокобальтат (III) калия K 3 [ Co (NO 2)6] К[ Рt(NН 3)Сl 3] Трихлороамминплатинат (II) калия
 Задание на дом. 1. 2. 3. § 12 стр. 76 -80, упр. 2 Конспект. Определите массовые доли элементов в желтой кровяной соли. К 4 [Fe (CN) 6 ]
Задание на дом. 1. 2. 3. § 12 стр. 76 -80, упр. 2 Конспект. Определите массовые доли элементов в желтой кровяной соли. К 4 [Fe (CN) 6 ]


