разделы биофизики, изучающие

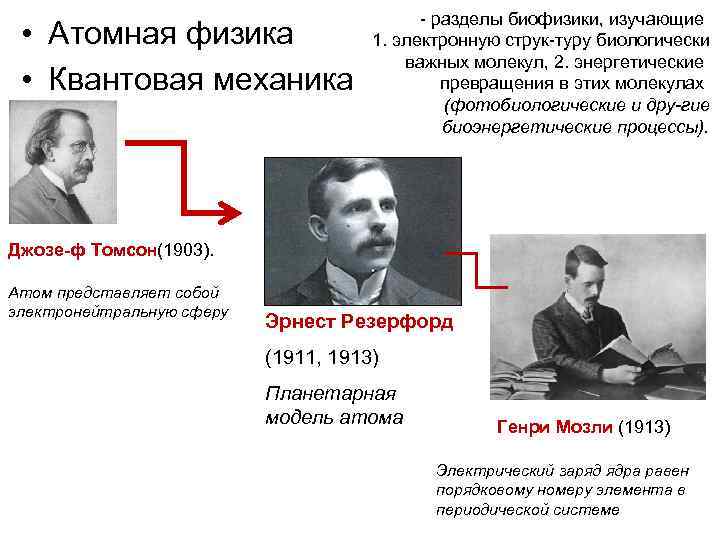
разделы биофизики, изучающие • Атомная физика 1. электронную струк туру биологически важных молекул, 2. энергетические • Квантовая механика превращения в этих молекулах (фотобиологические и дру гие биоэнергетические процессы). Джозе ф Томсон(1903). Атом представляет собой электронейтральную сферу Эрнест Резерфорд (1911, 1913) Планетарная модель атома Генри Мозли (1913) Электрический заряд ядра равен порядковому номеру элемента в периодической системе
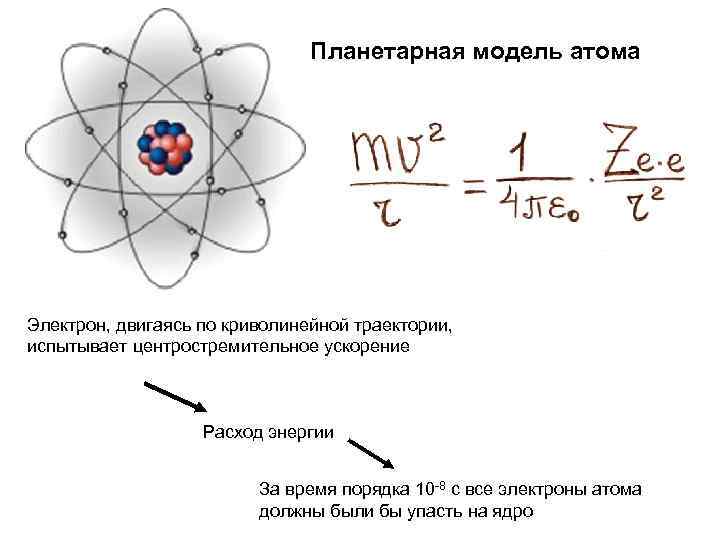
Планетарная модель атома Электрон, двигаясь по криволинейной траектории, испытывает центростремительное ускорение Расход энергии За время порядка 10 8 с все электроны атома должны были бы упасть на ядро

Постулаты Бора 1913 г. • Первый постулат. Условие стационарности: электрон в атоме может находиться только в некоторых определенных устойчивых состояниях, называемых стационарными, или квантовыми, каждому из которых соответствует определенная энергия Еn. В этих состояниях атом не излучает. Из всех возможных состояний в атоме реализуются только те, для которых момент импульса элек тронов на орбите равен целому числу постоянных Планка h (h = 6, 63· 10 34 Дж·с), деленных на 2π: L = mrv = n·h/2π где n = 1, 2, 3, …. Эта формула называется условием квантова ния орбит. • Второй постулат. При переходе из одного стационарного состояния в другое (и только при этом) атом излучает или поглощает энергию электромагнитного излучения определенными порциями – квантами, или фотонами: Е кон – Е нач = hν условие частот

Радиусы ста ционарных круговых орбит электрона rn= ε 0 h 2 / πе 2 m. Z · n 2 • Полная энергия электрона принимает только некоторые разрешенные значения, зависящие от целого числа n • С ростом числа n энергия увеличивается • На большом расстоянии от ядра при r ∞ энергия Е∞ становится равной 0, электрон может уйти из атома. Этот процесс называется ионизацией атома. • Энергия ионизации равна полной отрицательной энергии электрона в атоме: В стабильных атомах электроны находятся в энергетических состояниях, соответствующих Е ион = Е∞ Е полн минимальной энергии. Если атому сообщить энергию, то электрон переходит на более удаленную орбиту от ядра такое состояние атома называется возбужденным.
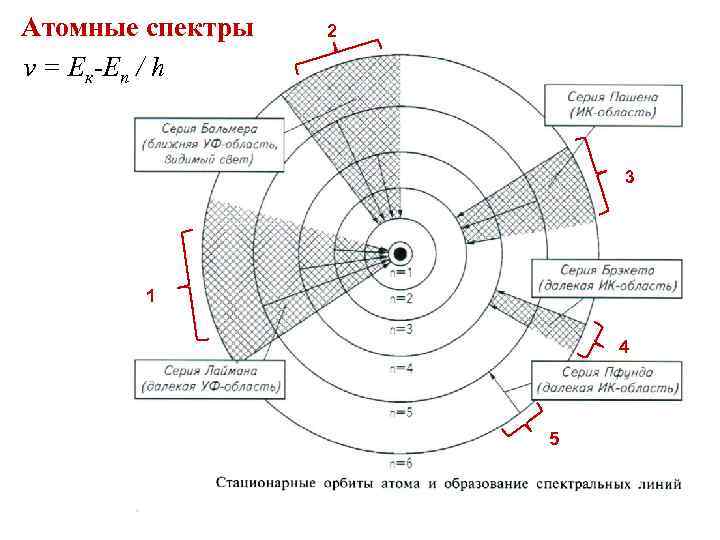
Атомные спектры 2 ν = Ек-Еn / h 3 1 4 5

Фотофизические и фотохимические превращения биосистем Функции света в живых системах: Энергетическая – обеспечение живых систем свободной энергией солнца. Информационная – обеспечение взаимодействия живых систем с окружающей средой. Классификация фотобиологических процессов. А) с энергетической т. з. 1. Эндергонические фотобиологические реакции 2. Экзергонические фотобиологические реакции 3. В) с функционально физиологической т. з (биологической стороны): 4. Энергетические фотобиологические р ции 5. Информационные фотобиологические р ции 6. Фотобиосинтетические реакции 7. Деструктивно – модифицирующие фотобиологические реакции : летальные мутационные патофизиологические.

Общая схема фотобиологических процессов. Отдельный фотобиологический процесс представляет собой сложную последовательность различных стадий : 1. Поглощение энергии фотона хромофорной группой биомолекулы и образование электронно возбужденных состояний системы 2. Миграция энергии электронного возбуждения 3. Первичный фотофизический акт и появление первичных фотопродуктов 4. Промежуточные стадии, включающие перенос заряда 5. Образование стабильных химических продуктов 6. Физиолого биохимические процессы 7. Конечный фотобиологический эффект.

Люминесценция – спонтанное излучение тела, избыточное при данной температуре тела над тепловым излучением, длительность которого значительно превышает период световых волн. Период световых волн составляет 10 15 c, а длительность люминесценции как минимум 10 10 c.

По виду возбуждения различают следующие типы люминесценции: • Фотолюминесценция • Рентгенолюминесценция • Радиолюминесценция • Катодолюминесценция • Электролюминесценция • Хемилюминесценция • Биолюминесценция

Механизм биохемилюминесценции определяется реакциями окисления. В биологических системах хемилюминисценция возникает при рекомбинации перекисных свободных радикалов липидов. Различные формы оксилюциферина насекомых: A — нейтральная кетоформа λmax = 618 нм B — анион (фенолят) кетоформы C — анион енольной формы, λmax = 587 нм D — енолят дианион, λmax = 556 нм

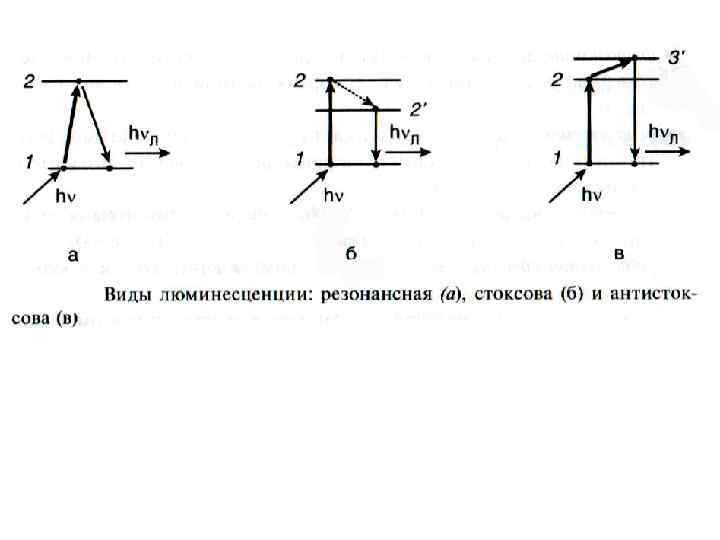
По длительности свечения: • Флуоресценция (10 8 с) – быстрое свечение, кратковременное, остаточное — излучательный переход возбужденного электрона из синглетного состояния S 1 в основное состояние S 0 • Фосфоресценция (10 3 – 10 4 с и более) – длительное свечение продолжительное — излучательный переход возбужденного электорона из триплетного состояния T 1 в основное состояние S 0

I – интенсивность люминесцентного излучения λ – длина волны Правило Стокса: Спектр люминесценции сдвинут относительно спектра вызвавшего света в сторону больших длин волн.

Энергия кванта, вызвавшего возбуждение, при поглощении его веществом, частично переходит в другие энергии: hν 0 = hν + ΔE Поэтому: hν < hν 0, λ > λ 0.
Основной энергетической характеристикой люминесценции является ее энергетический выход η отношение энергии, которая люминофором излучается, к энергии, которую люминофор поглощает: η = E/E 0 Согласно закону Вавилова энергетический выход люминесценции сначала возрастает пропорционально возрастанию длины волны возбуждающего света, а потом резко падает: η = E/E 0 = hv/(hv 0) = λ/λ 0 энергетический выход пропорционален длине волны возбуждающего света.

По методике исследования люминесцентный анализ можно представить следующей схемой: А также, люминесценцию используют для создания осветительной и регистрирующей аппаратуры (лампы дневного света, экран осциллографа).







