Разделение и концентрирование.ppt
- Количество слайдов: 18

Разделение и концентрирование в химическом анализе Способы повышения избирательности и чувствительности

Основные понятия и определения 1. Разделение – разделение смеси веществ на компоненты. 2. Концентрирование – перевод веществ пробы из большего объема в меньший. 3. Групповое и индивидуальное разделение и концентрирование. 4. Удаление матрицы – концентрирование за счет извлечение основных веществ из пробы. 5. Выделение примесей (микроэлементов) – концентрирование за счет извлечение примесей из пробы.
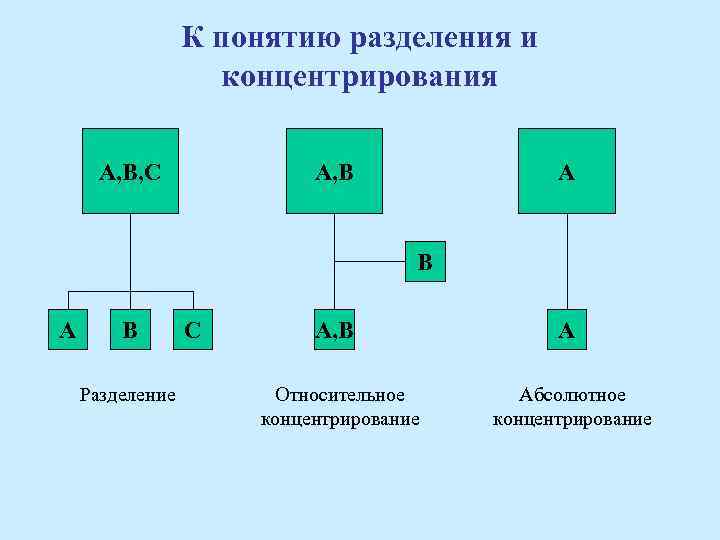
К понятию разделения и концентрирования А, В, С А А, В В А В Разделение С А, В А Относительное концентрирование Абсолютное концентрирование
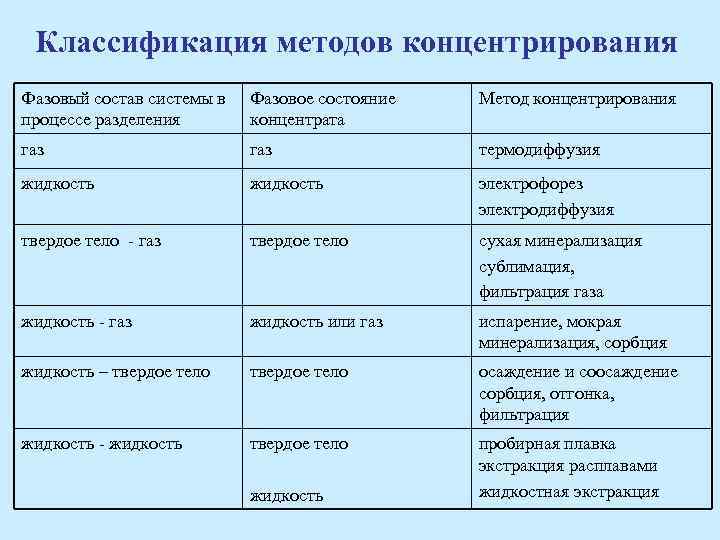
Классификация методов концентрирования Фазовый состав системы в процессе разделения Фазовое состояние концентрата Метод концентрирования газ термодиффузия жидкость электрофорез электродиффузия твердое тело - газ твердое тело сухая минерализация сублимация, фильтрация газа жидкость - газ жидкость или газ испарение, мокрая минерализация, сорбция жидкость – твердое тело осаждение и соосаждение сорбция, отгонка, фильтрация жидкость - жидкость твердое тело пробирная плавка экстракция расплавами жидкостная экстракция жидкость

Классификация основных процессов разделения и концентрирования • Процессы в однофазной системе: – Маскирование и демаскирование. – Диффузия, трансфузия, термодиффузия, электрофорез и др. динамические процессы. • Процессы в двухфазных системах: – – Осаждение и соосаждение. Жидкостная экстракция. Сорбция. Методы испарения: дистилляция и ректификация, отгонка и возгонка. Арсенал методов, основанных на разнообразных термодинамических и кинетических свойствах веществ, велик и постоянно пополняется.
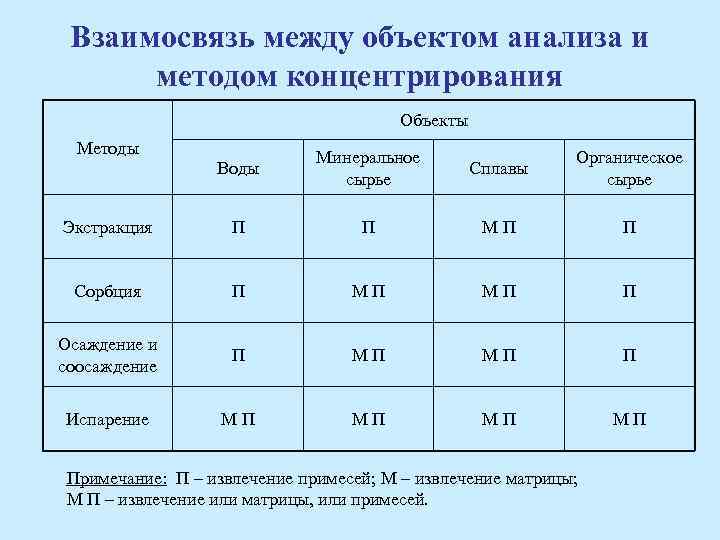
Взаимосвязь между объектом анализа и методом концентрирования Объекты Методы Воды Минеральное сырье Сплавы Органическое сырье Экстракция П П МП П Сорбция П МП МП П Осаждение и соосаждение П МП МП П Испарение МП МП Примечание: П – извлечение примесей; М – извлечение матрицы; М П – извлечение или матрицы, или примесей.

Маскирование – это подавление химической активности веществ, мешающих аналитической реакции. Термодинамическое маскирование, кинетическое маскирование. При маскировании концентрация маскируемого компонента становится недостаточной для получения аналитического сигнала.

Типы маскирователей 1. Реагенты, образующие с ионом В более прочные комплексы, чем с А. 2. Вещества, подавляющие гидролитическое осаждение металл-иона В. 3. Вещества, изменяющие степень окисления мешающего иона. 4. Вещества, переводящие мешающий ион в осадок без необходимости отделения осадка.

Типичные маскирователи при осуществлении цветных реакций

Примеры кинетического маскирования • Железо(III) не вытесняет алюминий из его комплекса с ЭДТА хотя константа образования Fe. Y+ на несколько порядков больше константы устойчивости Al. Y+. • Индуцированная свободными ионами Fe(II) реакция Mn. O 4 - + Cl- Mn 2+ + Cl 2 тормозится при добавлении фосфат-ионов.

Количественные характеристики гетерогенных процессов разделения и концентрирования Характеристики распределения Характеристика разделения Характеристика концентрирования
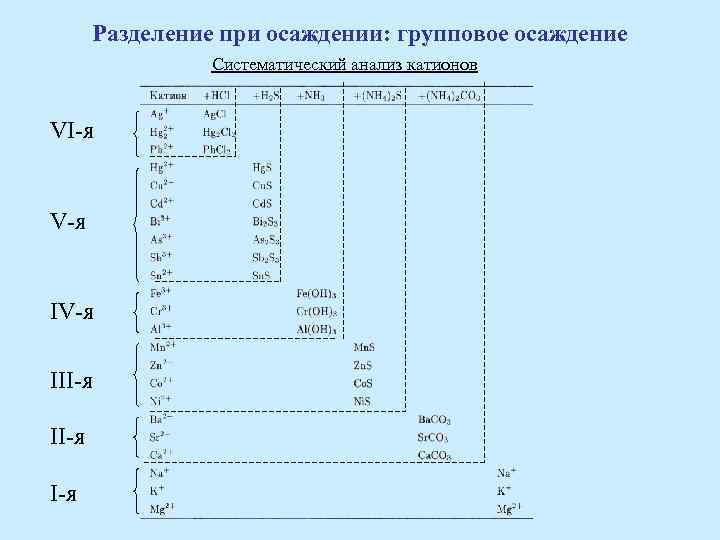
Разделение при осаждении: групповое осаждение Систематический анализ катионов VI-я V-я III-я I-я

Разделение при осаждении: осаждение матрицы

Классификация осадков 1. Кислоты и гидроксиды металлов (кремневая, оловянная, вольфрамовая кислоты, гидраты оксидов железа и алюминия). 2. Соли ряда кислот (сульфаты, хлориды, карбонаты, сульфиды, фосфаты, оксалаты) 3. Осадки с органическими реагентами (малорастворимые хелаты и ионные ассоциаты). 4. Вещества, выделяемые в элементном состоянии (ртуть, селен, теллур, золото). Почти все неорганические и органические реагенты для осаждения неорганических ионов пригодны для разделения.
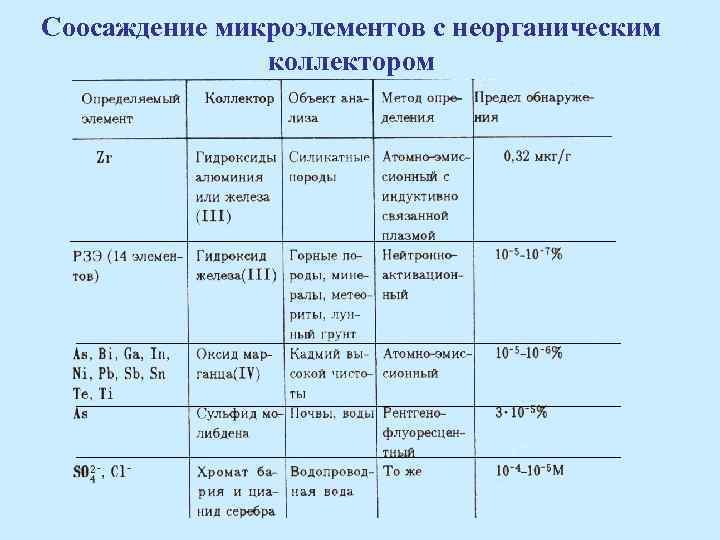
Соосаждение микроэлементов с неорганическим коллектором
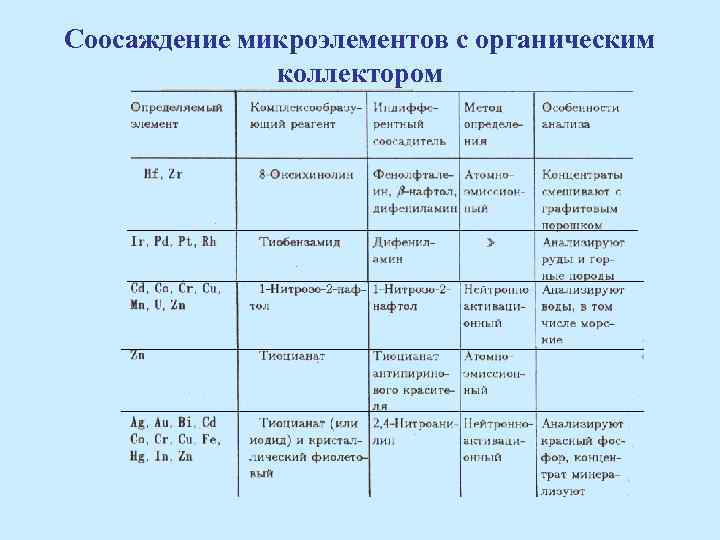
Соосаждение микроэлементов с органическим коллектором

Механизмы сорбционных процессов 1. Физическая сорбция. 2. Хемосорбция. 3. Распределение аналита между анализируемым растворов и иммобилизованным или закрепленным на твердом носителе неполярным жидким слоем. 4. Капиллярная конденсация Сорбция – процесс поглощения газов, паров, и растворенных веществ твердыми и жидкими поглотителями.

Основные типы сорбентов 1. Активные угли. 2. Ионообменные сорбенты (органические и неорганические). 3. Хелатирующие сорбенты с закрепленными функциональными группами. 4. Сорбенты, модифицированные комплексообразующими реагентами. 5. Кремнеземы и модифицированные кремнеземы. 6. Неорганические сорбенты (оксиды, гидроксиды, сульфиды, фосфаты, алюмосиликаты, гетерополикислоты и их соли, ферроцианиды и др. )
Разделение и концентрирование.ppt