Физика атомов_л4а.pptx
- Количество слайдов: 67
 Раздел В: Физика атомов и молекул Тема I. Атомные модели • 1. Модель Эрнеста Резерфорда
Раздел В: Физика атомов и молекул Тема I. Атомные модели • 1. Модель Эрнеста Резерфорда
 Ernest Rutherford 1871 — 1937 Joseph John Thomson 1856 — 1940
Ernest Rutherford 1871 — 1937 Joseph John Thomson 1856 — 1940
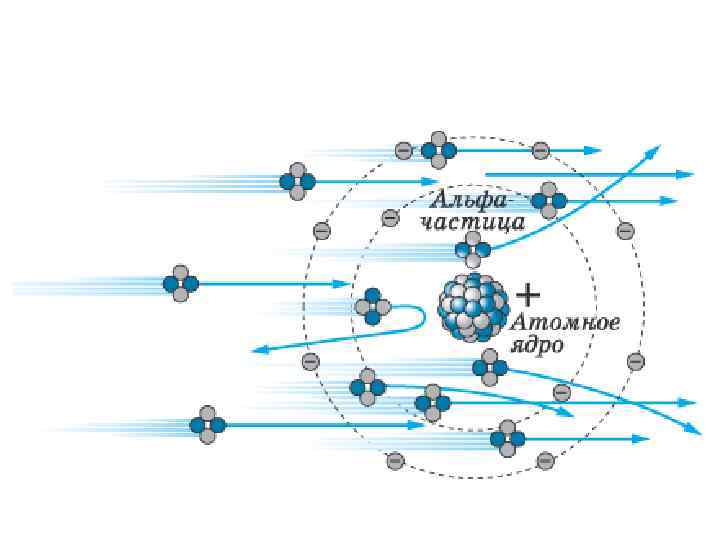
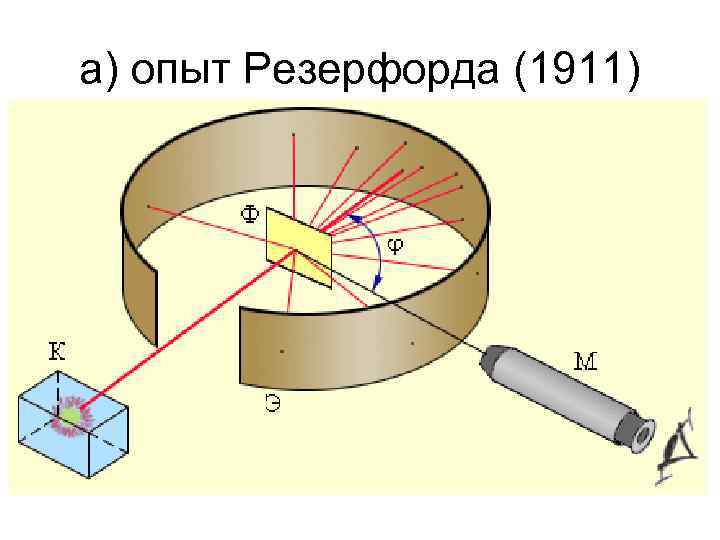 а) опыт Резерфорда (1911)
а) опыт Резерфорда (1911)
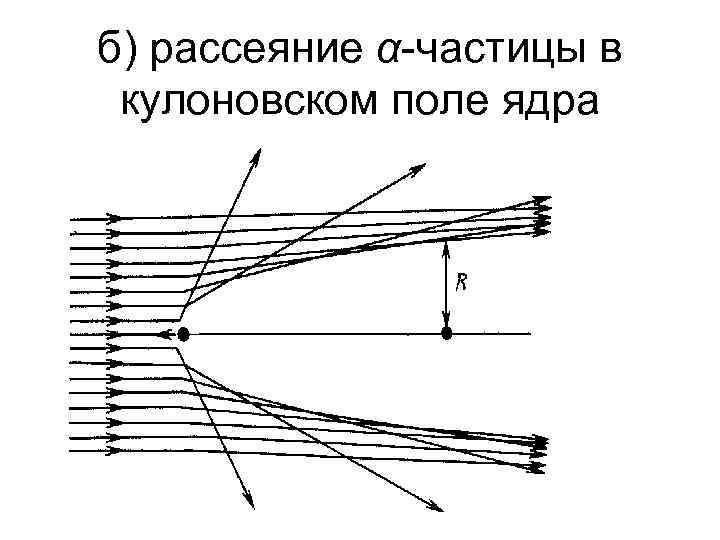 б) рассеяние α-частицы в кулоновском поле ядра
б) рассеяние α-частицы в кулоновском поле ядра
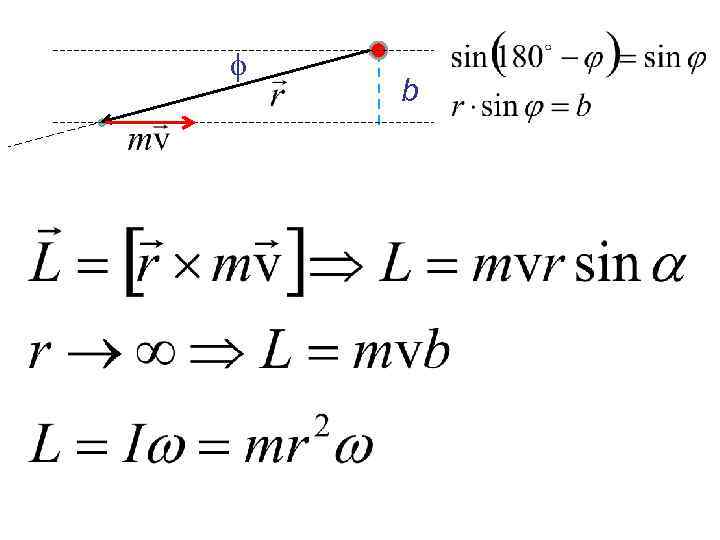 f b
f b
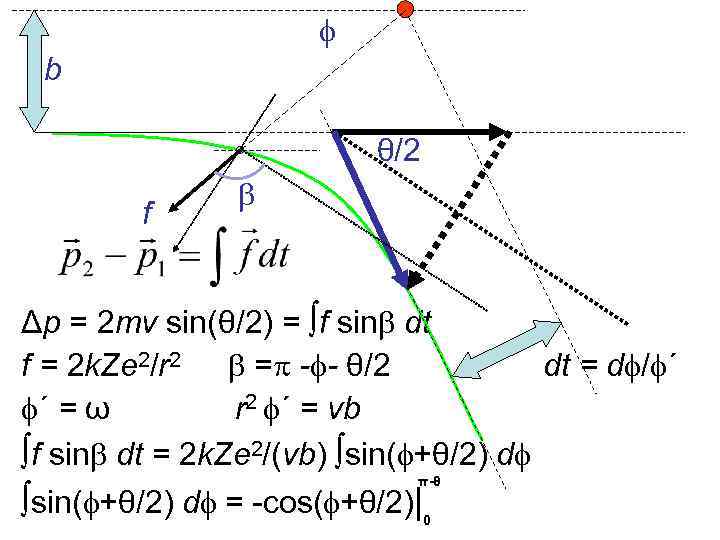 f b θ/2 f b Δp = 2 mv sin(θ/2) = ∫f sinb dt f = 2 k. Ze 2/r 2 b =p -f- θ/2 dt = df/f´ f´ = ω r 2 f´ = vb ∫f sinb dt = 2 k. Ze 2/(vb) ∫sin(f+θ/2) df π-θ ∫sin(f+θ/2) df = -cos(f+θ/2)|0
f b θ/2 f b Δp = 2 mv sin(θ/2) = ∫f sinb dt f = 2 k. Ze 2/r 2 b =p -f- θ/2 dt = df/f´ f´ = ω r 2 f´ = vb ∫f sinb dt = 2 k. Ze 2/(vb) ∫sin(f+θ/2) df π-θ ∫sin(f+θ/2) df = -cos(f+θ/2)|0
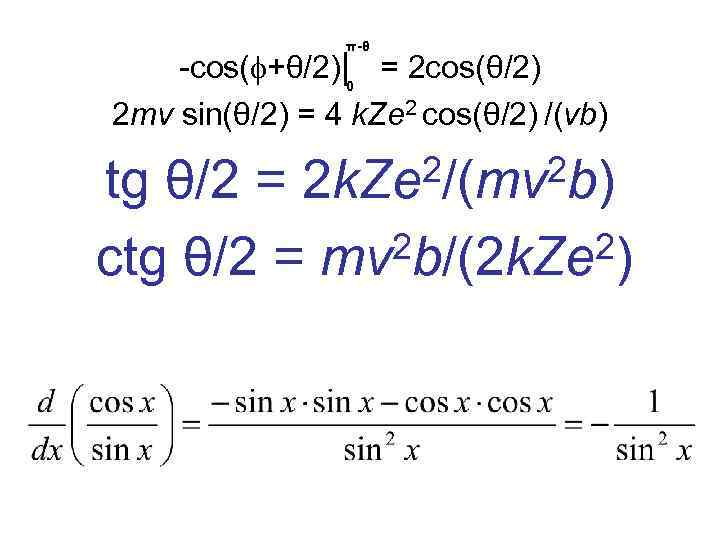 π-θ -cos(f+θ/2)|0 = 2 cos(θ/2) 2 mv sin(θ/2) = 4 k. Ze 2 cos(θ/2) /(vb) 2/(mv 2 b) 2 k. Ze tg θ/2 = 2 b/(2 k. Ze 2) сtg θ/2 = mv
π-θ -cos(f+θ/2)|0 = 2 cos(θ/2) 2 mv sin(θ/2) = 4 k. Ze 2 cos(θ/2) /(vb) 2/(mv 2 b) 2 k. Ze tg θ/2 = 2 b/(2 k. Ze 2) сtg θ/2 = mv
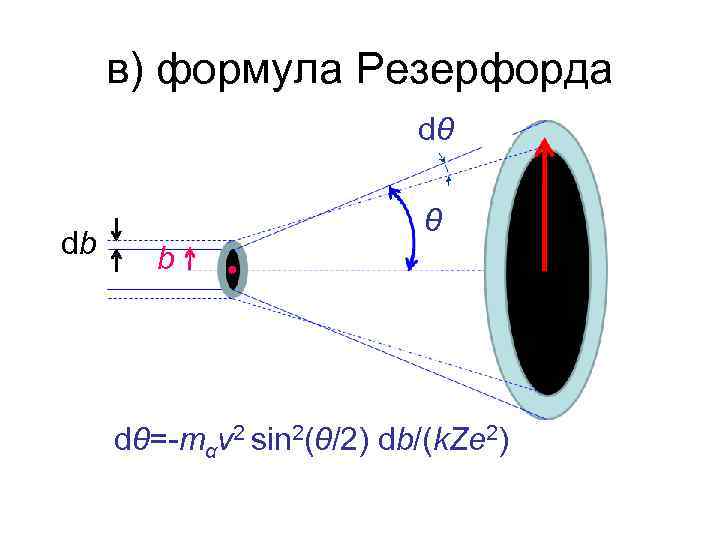 в) формула Резерфорда dθ db θ b dθ=-mαv 2 sin 2(θ/2) db/(k. Ze 2)
в) формула Резерфорда dθ db θ b dθ=-mαv 2 sin 2(θ/2) db/(k. Ze 2)
 Feedback • 1. Каковы масса и электрический заряд aчастицы ? • 2. Каков физический смысл величин db и dθ? • 3. Каков смысл знака «минус» в предыдущей формуле? • 4. Запишите основной закон динамики вращательного движения. Что такое момент силы, момент инерции, момент импульса? • 5. Почему при выводе формулы Резерфорда можно считать, что момент импульса a-частицы не меняется?
Feedback • 1. Каковы масса и электрический заряд aчастицы ? • 2. Каков физический смысл величин db и dθ? • 3. Каков смысл знака «минус» в предыдущей формуле? • 4. Запишите основной закон динамики вращательного движения. Что такое момент силы, момент инерции, момент импульса? • 5. Почему при выводе формулы Резерфорда можно считать, что момент импульса a-частицы не меняется?
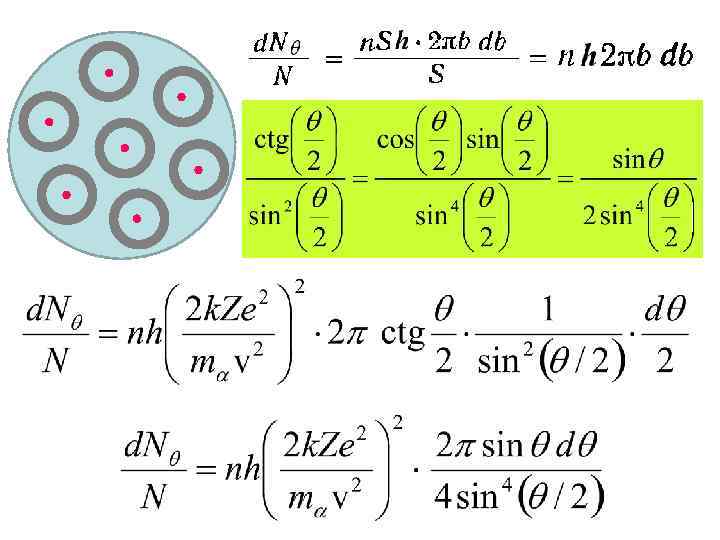
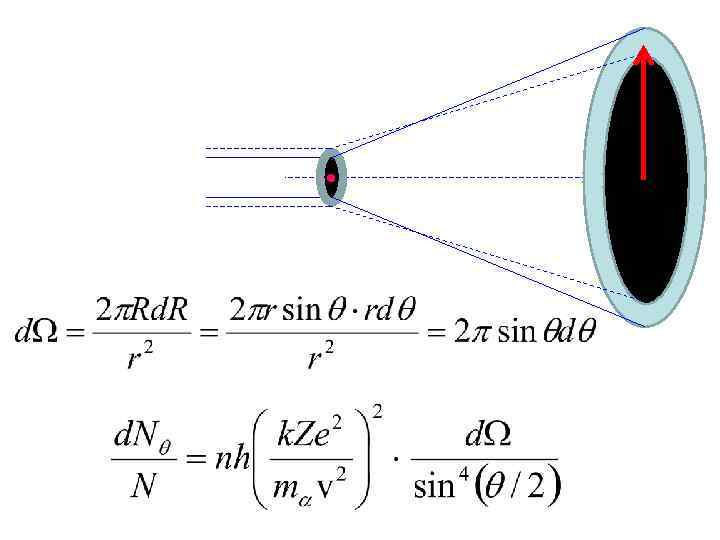
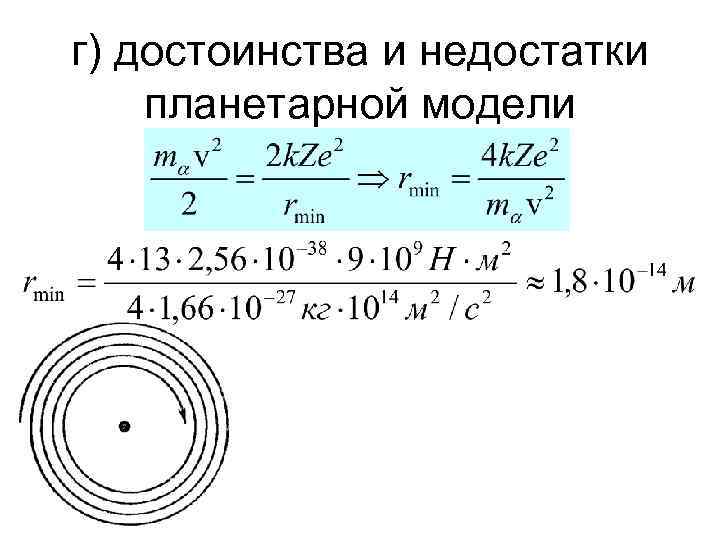 г) достоинства и недостатки планетарной модели
г) достоинства и недостатки планетарной модели
 2. Спектры излучения одноэлектронных атомных систем Модель водородоподобных ионов Нильса Бора (1913)
2. Спектры излучения одноэлектронных атомных систем Модель водородоподобных ионов Нильса Бора (1913)
 Niels Henrik David Bohr 1885 — 1962
Niels Henrik David Bohr 1885 — 1962
 а) постулат квантования орбит f mvr = nћ v= nћ/(mr) mv 2 r = k. Ze 2 f = k. Ze 2/r 2 = mv 2/r k = 9*109 Нм 2/Кл 2 mr [nћ/(mr)]2 = k. Ze 2 n 2 ћ 2 /(mr) = k. Ze 2 r = ћ 2 n 2 /(mk. Ze 2) rn = 2 n 2 /(mk. Ze 2) ћ
а) постулат квантования орбит f mvr = nћ v= nћ/(mr) mv 2 r = k. Ze 2 f = k. Ze 2/r 2 = mv 2/r k = 9*109 Нм 2/Кл 2 mr [nћ/(mr)]2 = k. Ze 2 n 2 ћ 2 /(mr) = k. Ze 2 r = ћ 2 n 2 /(mk. Ze 2) rn = 2 n 2 /(mk. Ze 2) ћ
 б) квантование энергии водородоподобного иона E = T+U = mv 2/2 – k. Ze 2/r mv 2 r/2 – k. Ze 2 = k. Ze 2/2 – k. Ze 2 = - k. Ze 2/2 E = – k. Ze 2/(2 r) = - mk 2 Z 2 e 4/(2ћ 2 n 2) En = - 2 Z 2 e 4/(2ћ 2 n 2) mk
б) квантование энергии водородоподобного иона E = T+U = mv 2/2 – k. Ze 2/r mv 2 r/2 – k. Ze 2 = k. Ze 2/2 – k. Ze 2 = - k. Ze 2/2 E = – k. Ze 2/(2 r) = - mk 2 Z 2 e 4/(2ћ 2 n 2) En = - 2 Z 2 e 4/(2ћ 2 n 2) mk
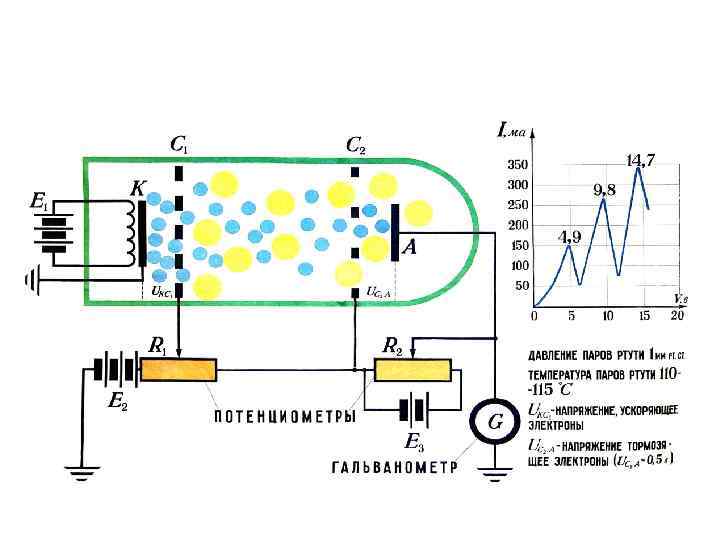
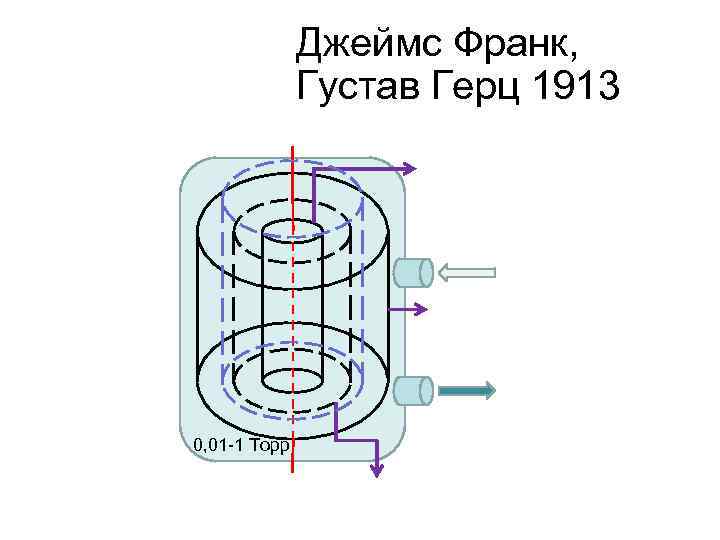 Джеймс Франк, Густав Герц 1913 0, 01 -1 Торр
Джеймс Франк, Густав Герц 1913 0, 01 -1 Торр
 в) радиус и энергия атома водорода в основном состоянии rn = ћ 2 n 2 /(mk. Ze 2) Z=1 n=1 r 1 = ћ 2 /(mke 2) = (1, 054*10 -34 Дж*с)2 /[9, 11*10 -31 кг * *9*109 Н*м 2/Кл 2 *(1, 6*10 -19 Кл)2] ≈ 0, 529* 10 -10 м En = - mk 2 Z 2 e 4/(2ћ 2 n 2 ) = – k. Ze 2/(2 rn) Z=1 n=1 E 1 = – ke 2/(2 r 1) = - 9*109 Н*м 2/Кл 2 *(1, 6*10 -19 Кл)2 : : (1, 06*10 -10 м) ≈ -21, 7*10 -19 Дж = -13, 53 э. В ДЗ № 1. Вычислите скорости электронов и радиусы их орбит для атома водорода и иона гелия в основном и первом возбужденном состоянии
в) радиус и энергия атома водорода в основном состоянии rn = ћ 2 n 2 /(mk. Ze 2) Z=1 n=1 r 1 = ћ 2 /(mke 2) = (1, 054*10 -34 Дж*с)2 /[9, 11*10 -31 кг * *9*109 Н*м 2/Кл 2 *(1, 6*10 -19 Кл)2] ≈ 0, 529* 10 -10 м En = - mk 2 Z 2 e 4/(2ћ 2 n 2 ) = – k. Ze 2/(2 rn) Z=1 n=1 E 1 = – ke 2/(2 r 1) = - 9*109 Н*м 2/Кл 2 *(1, 6*10 -19 Кл)2 : : (1, 06*10 -10 м) ≈ -21, 7*10 -19 Дж = -13, 53 э. В ДЗ № 1. Вычислите скорости электронов и радиусы их орбит для атома водорода и иона гелия в основном и первом возбужденном состоянии
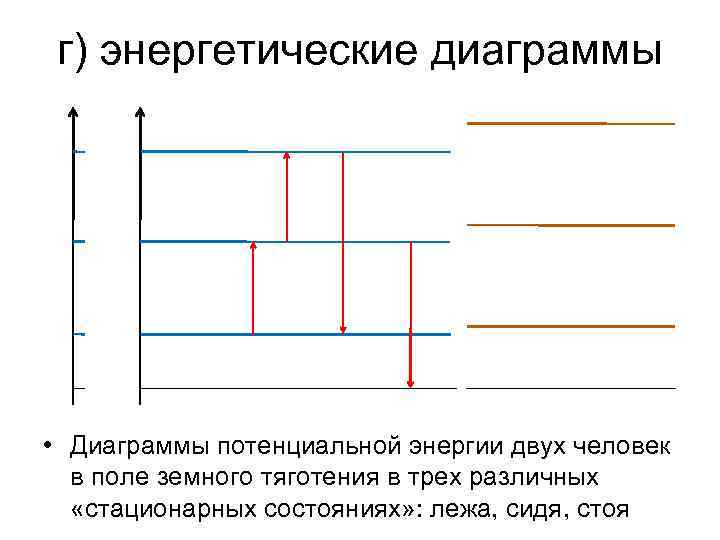 г) энергетические диаграммы • Диаграммы потенциальной энергии двух человек в поле земного тяготения в трех различных «стационарных состояниях» : лежа, сидя, стоя
г) энергетические диаграммы • Диаграммы потенциальной энергии двух человек в поле земного тяготения в трех различных «стационарных состояниях» : лежа, сидя, стоя
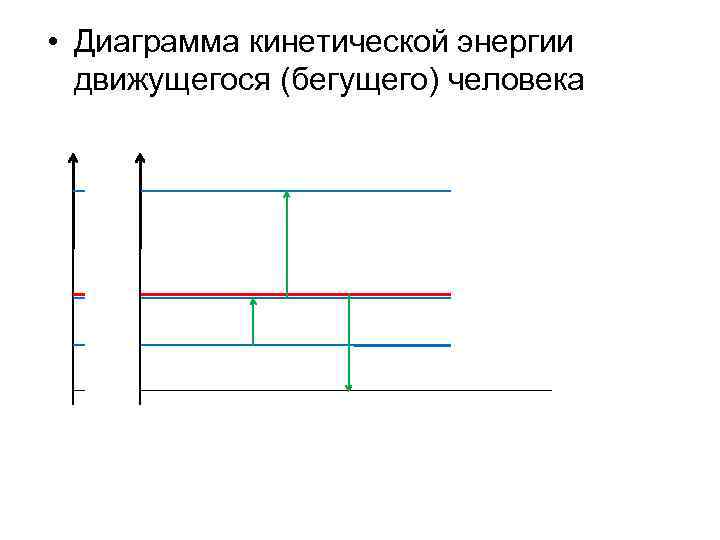 • Диаграмма кинетической энергии движущегося (бегущего) человека
• Диаграмма кинетической энергии движущегося (бегущего) человека
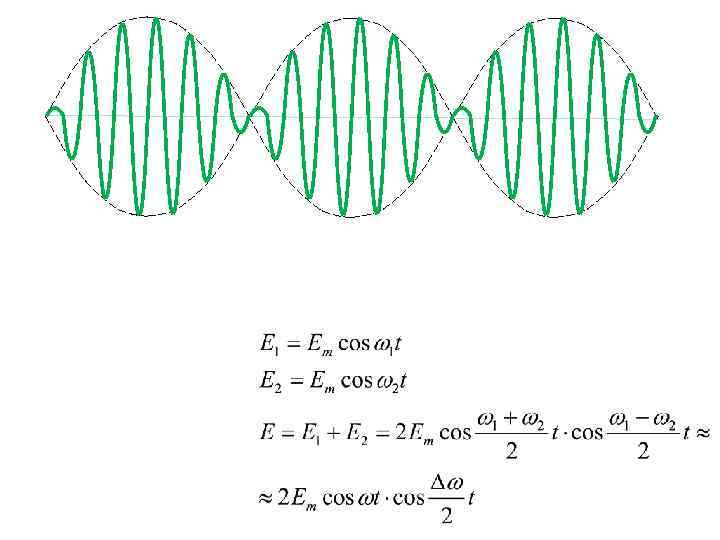
 д) постулат частот En = - mek 2 Z 2 e 4/(2ћ 2 n 2) Em = - mek 2 Z 2 e 4/(2ћ 2 m 2) ћωnm = En - Em = mek 2 Z 2 e 4/(2ћ 2)*[1/m 2 – 1/n 2] = = 13, 53 э. В*Z 2 *[1/m 2 – 1/n 2] = = 21, 7*10 -19 Дж *Z 2 *[1/m 2 – 1/n 2] Бальмер 1885 «Линия» «Серия» «Головная линия серии» Лайман Пашен Брэкетт Пфунд
д) постулат частот En = - mek 2 Z 2 e 4/(2ћ 2 n 2) Em = - mek 2 Z 2 e 4/(2ћ 2 m 2) ћωnm = En - Em = mek 2 Z 2 e 4/(2ћ 2)*[1/m 2 – 1/n 2] = = 13, 53 э. В*Z 2 *[1/m 2 – 1/n 2] = = 21, 7*10 -19 Дж *Z 2 *[1/m 2 – 1/n 2] Бальмер 1885 «Линия» «Серия» «Головная линия серии» Лайман Пашен Брэкетт Пфунд
 Постоянная Ридберга R = 21, 7*10 -19 Дж /1, 054*10 -34 Дж*с =2, 07*1016 c-1 R* = me 4/(8 h 3ε 02) = 3, 29*1015 c-1 е) спектральные термы T(1) = R/12 T(2) = R/22 ω = T(m) -T(n) ω = T 1(m) –T 2(n) T(3) = R/32 и т. д. Функции целочисленных аргументов, разности которых равны частотам излучаемых атомами фотонов
Постоянная Ридберга R = 21, 7*10 -19 Дж /1, 054*10 -34 Дж*с =2, 07*1016 c-1 R* = me 4/(8 h 3ε 02) = 3, 29*1015 c-1 е) спектральные термы T(1) = R/12 T(2) = R/22 ω = T(m) -T(n) ω = T 1(m) –T 2(n) T(3) = R/32 и т. д. Функции целочисленных аргументов, разности которых равны частотам излучаемых атомами фотонов
 Feedback • Постройте в одном масштабе энергетические диаграммы атома водорода и однозарядного иона гелия • Что называют основным состоянием атома? • Вычислите, какой кинетической энергией (в Дж) обладает электрон в основном состоянии атома водорода? • Попытайтесь сформулировать и записать определения спектральной линии, спектральной серии, головной линии спектральной серии. • Какому значению n соответствует третье возбужденное состояние двухзарядного иона лития? • Какой процесс происходит внутри иона гелия при испускании им фотона головной линии серии Пашена? Третьей линии серии Бальмера?
Feedback • Постройте в одном масштабе энергетические диаграммы атома водорода и однозарядного иона гелия • Что называют основным состоянием атома? • Вычислите, какой кинетической энергией (в Дж) обладает электрон в основном состоянии атома водорода? • Попытайтесь сформулировать и записать определения спектральной линии, спектральной серии, головной линии спектральной серии. • Какому значению n соответствует третье возбужденное состояние двухзарядного иона лития? • Какой процесс происходит внутри иона гелия при испускании им фотона головной линии серии Пашена? Третьей линии серии Бальмера?
 Терминология: описание атомных спектров Линии излучения: излучение невзаимодействующих атомов после прохождения через коллимирующую прямоугольную щель и разложения диспергирующим прибором в спектр имеет специфический для каждого сорта атомов вид дискретных различающихся по цвету линий. Каждая из них возникает в результате испускания атомами весьма близких по частоте фотонов при уменьшении энергии атома вследствие перехода из одного стационарного состояния (с более высокой энергией) в другое
Терминология: описание атомных спектров Линии излучения: излучение невзаимодействующих атомов после прохождения через коллимирующую прямоугольную щель и разложения диспергирующим прибором в спектр имеет специфический для каждого сорта атомов вид дискретных различающихся по цвету линий. Каждая из них возникает в результате испускания атомами весьма близких по частоте фотонов при уменьшении энергии атома вследствие перехода из одного стационарного состояния (с более высокой энергией) в другое
 Линии поглощения: после разложения диспергирующим прибором белого излучения, прошедшего через совокупность невзаимодействующих атомов, в спектре наблюдается ослабление или полное исчезновение света в узких (линейчатых) спектральных интервалах, набор которых является специфичным для каждого сорта атомов и совпадает по частотам с линиями спектра излучения этих же атомов. Каждый из них соответствует резонансному поглощению фотонов при увеличении энергии атомов вследствие перехода из одного стационарного состояния (с более низкой энергией) в другое
Линии поглощения: после разложения диспергирующим прибором белого излучения, прошедшего через совокупность невзаимодействующих атомов, в спектре наблюдается ослабление или полное исчезновение света в узких (линейчатых) спектральных интервалах, набор которых является специфичным для каждого сорта атомов и совпадает по частотам с линиями спектра излучения этих же атомов. Каждый из них соответствует резонансному поглощению фотонов при увеличении энергии атомов вследствие перехода из одного стационарного состояния (с более низкой энергией) в другое
 Спектральная линия: узкий интервал частот фотонов, испускаемых или поглощаемых атомами определенного сорта при переходе из одного стационарного состояния в другое Спектральная серия: совокупность спектральных линий излучения, относящихся к переходам атома из различных стационарных состояний в одно и то же состояние с меньшей энергией или линий поглощения, …
Спектральная линия: узкий интервал частот фотонов, испускаемых или поглощаемых атомами определенного сорта при переходе из одного стационарного состояния в другое Спектральная серия: совокупность спектральных линий излучения, относящихся к переходам атома из различных стационарных состояний в одно и то же состояние с меньшей энергией или линий поглощения, …
 Feedback • Какие физические величины можно использовать для характеристики спектральных линий?
Feedback • Какие физические величины можно использовать для характеристики спектральных линий?
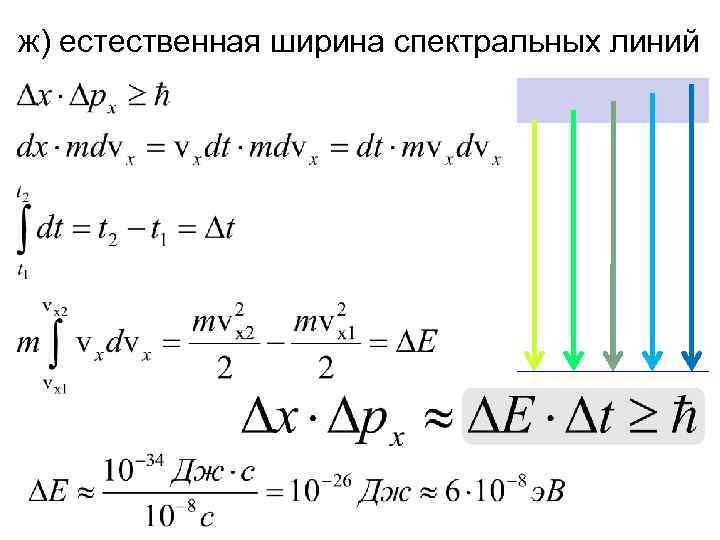 ж) естественная ширина спектральных линий
ж) естественная ширина спектральных линий
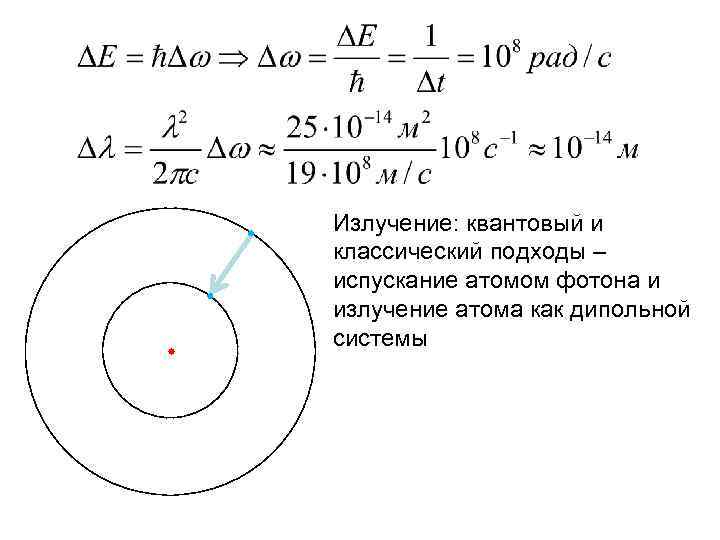 Излучение: квантовый и классический подходы – испускание атомом фотона и излучение атома как дипольной системы
Излучение: квантовый и классический подходы – испускание атомом фотона и излучение атома как дипольной системы
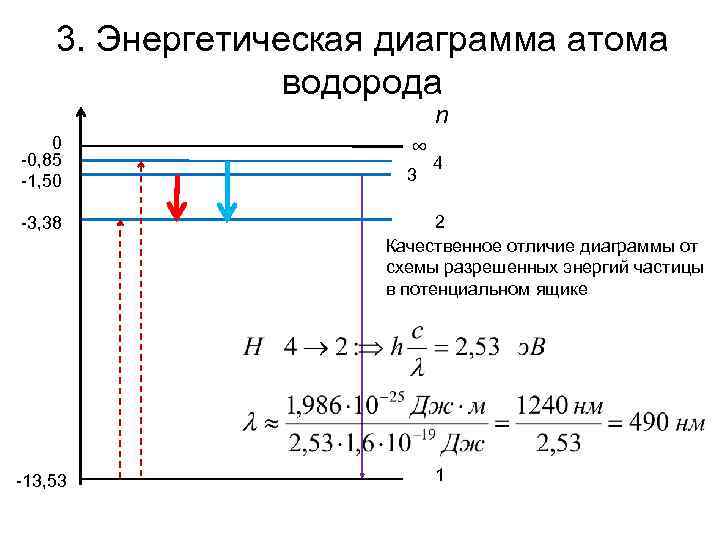 3. Энергетическая диаграмма атома водорода n 0 -0, 85 -1, 50 -3, 38 -13, 53 ∞ 3 4 2 Качественное отличие диаграммы от схемы разрешенных энергий частицы в потенциальном ящике 1
3. Энергетическая диаграмма атома водорода n 0 -0, 85 -1, 50 -3, 38 -13, 53 ∞ 3 4 2 Качественное отличие диаграммы от схемы разрешенных энергий частицы в потенциальном ящике 1
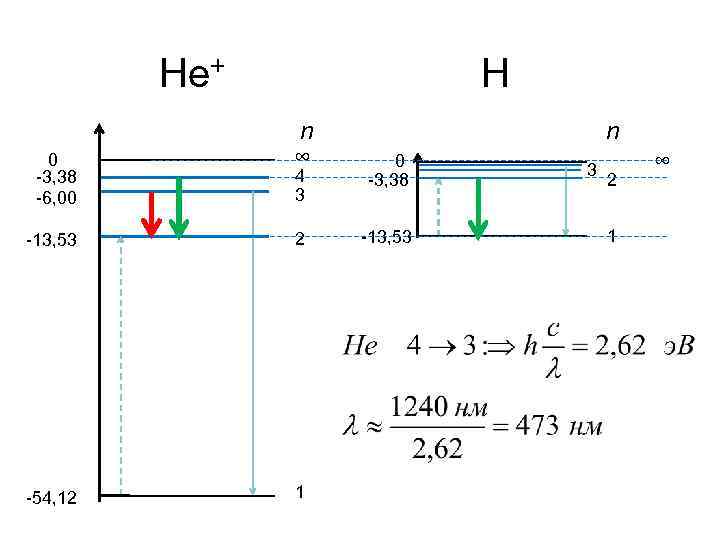 He+ 0 -3, 38 -6, 00 H n ∞ 4 3 -13, 53 2 -54, 12 1 n 0 -3, 38 -13, 53 3 2 1 ∞
He+ 0 -3, 38 -6, 00 H n ∞ 4 3 -13, 53 2 -54, 12 1 n 0 -3, 38 -13, 53 3 2 1 ∞
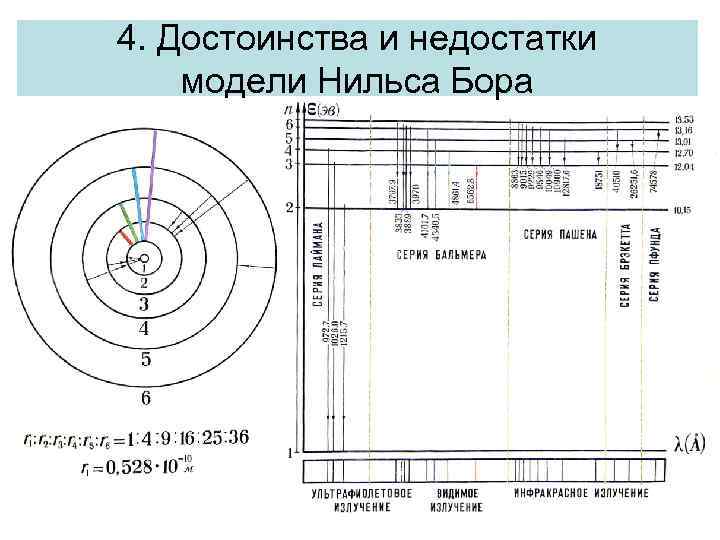 4. Достоинства и недостатки модели Нильса Бора
4. Достоинства и недостатки модели Нильса Бора
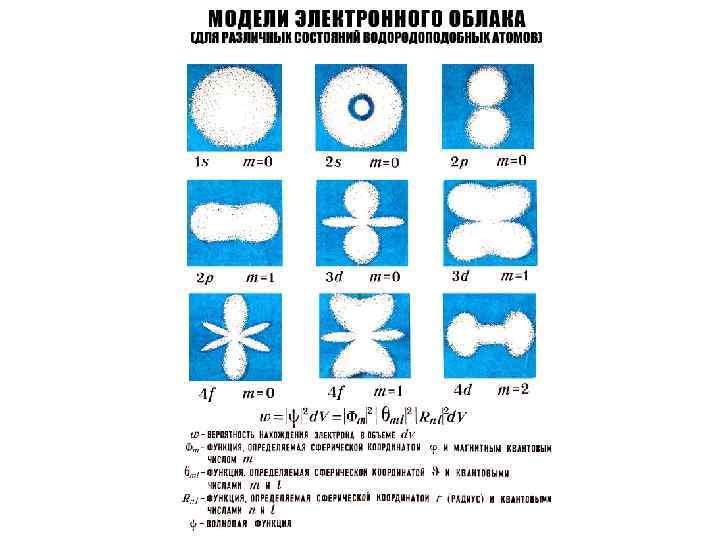
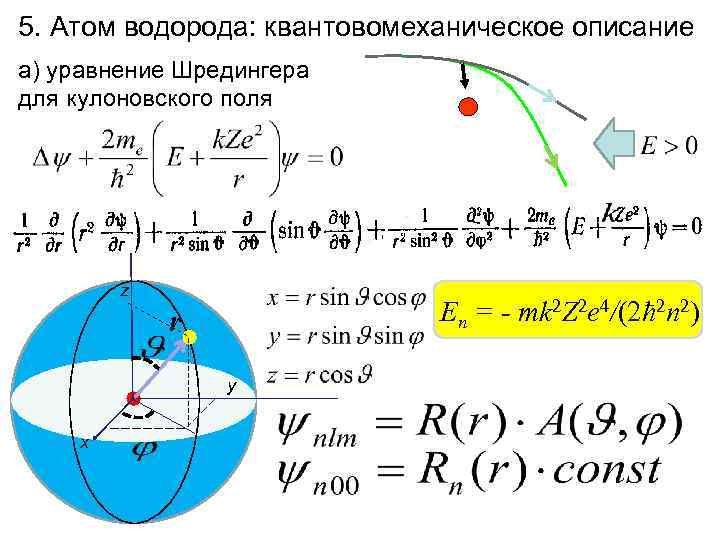 5. Атом водорода: квантовомеханическое описание а) уравнение Шредингера для кулоновского поля z En = - mk 2 Z 2 e 4/(2ћ 2 n 2) r y x
5. Атом водорода: квантовомеханическое описание а) уравнение Шредингера для кулоновского поля z En = - mk 2 Z 2 e 4/(2ћ 2 n 2) r y x
 • Электрон в водородоподобном атоме может находиться в нескольких дискретных состояниях с одним и тем же квантовым числом n>1 и одинаковой полной энергией, отличающихся квантовыми числами l и m. Эти два числа определяют различный вид волновых функций электрона в этих состояниях с одинаковой энергией
• Электрон в водородоподобном атоме может находиться в нескольких дискретных состояниях с одним и тем же квантовым числом n>1 и одинаковой полной энергией, отличающихся квантовыми числами l и m. Эти два числа определяют различный вид волновых функций электрона в этих состояниях с одинаковой энергией
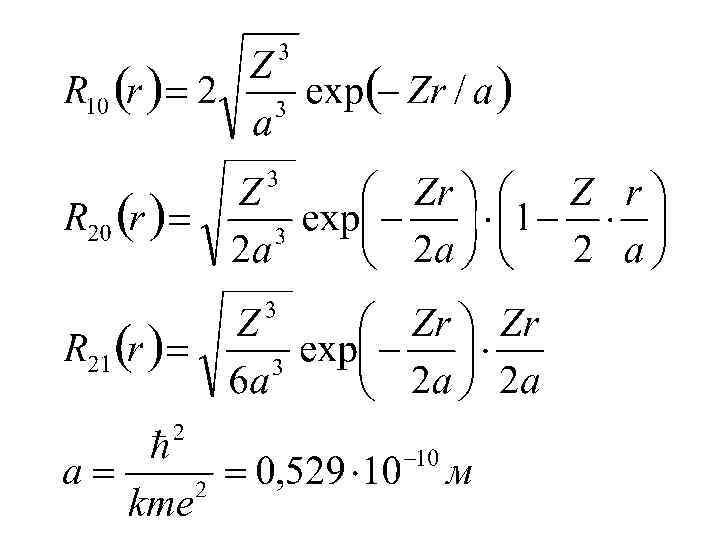
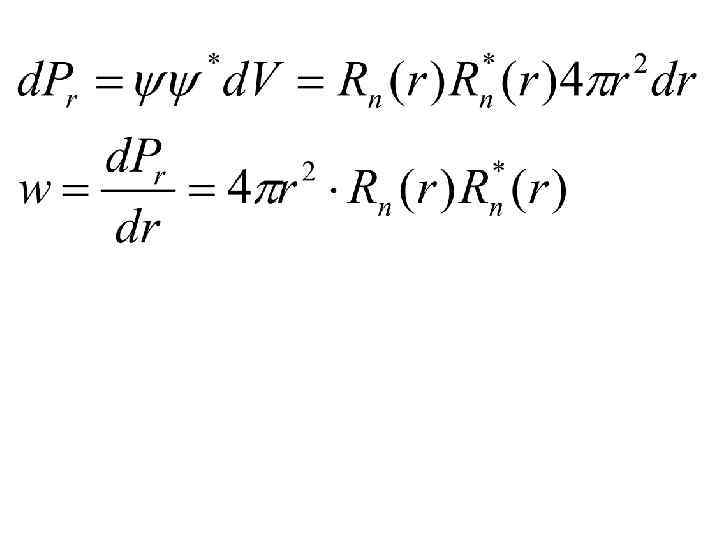
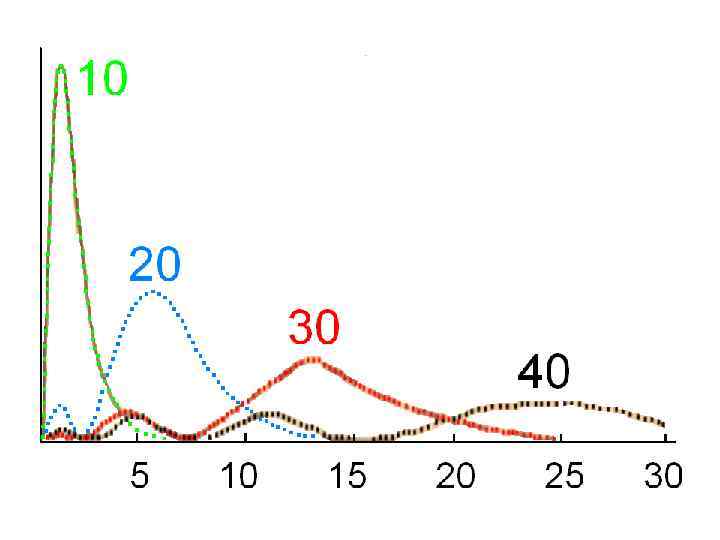
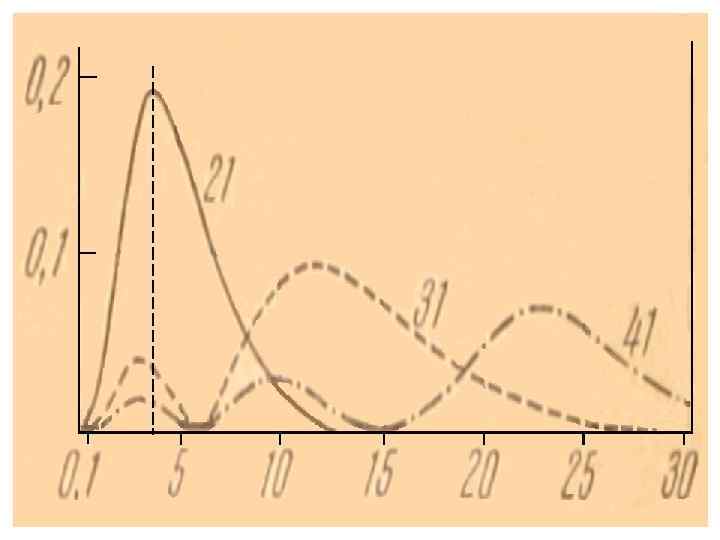
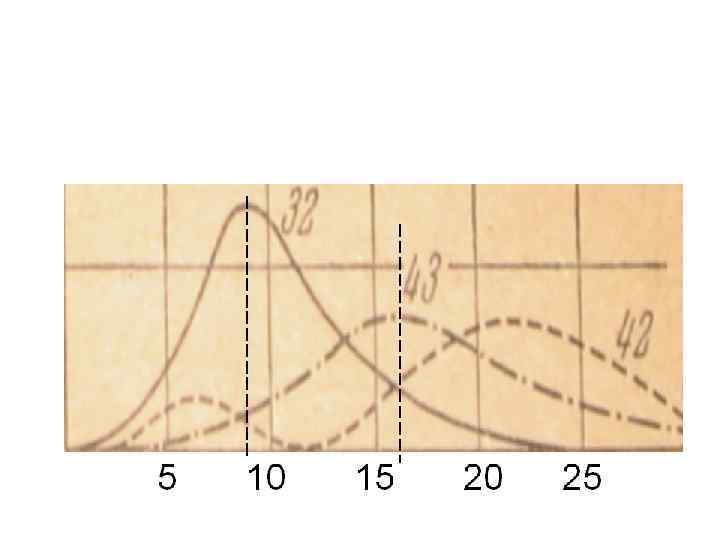
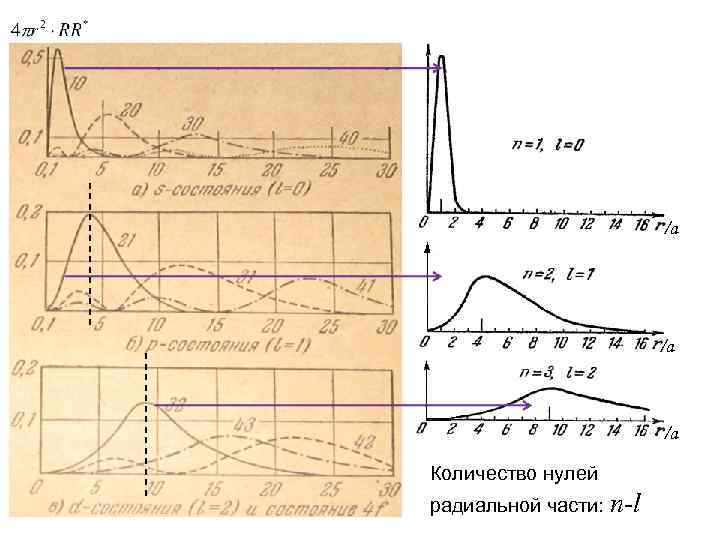 /а /а /а Количество нулей радиальной части: n-l
/а /а /а Количество нулей радиальной части: n-l
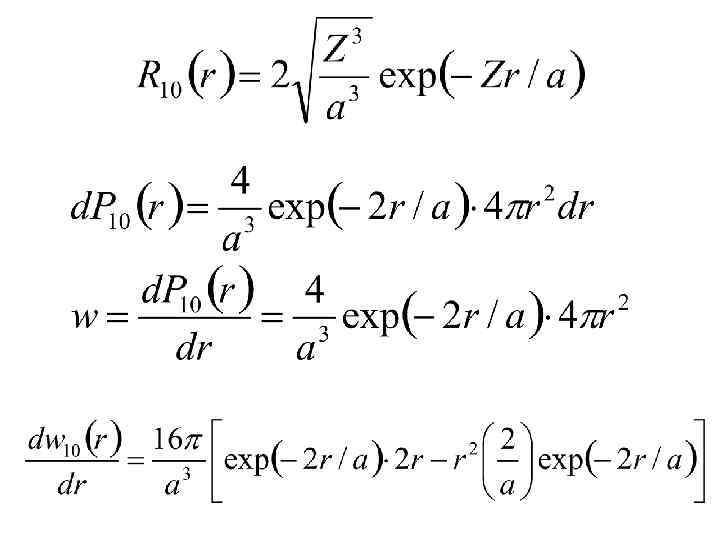
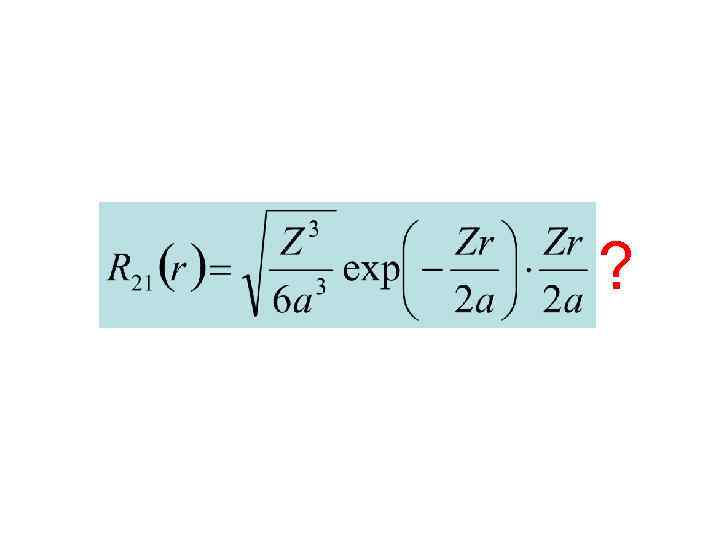 ?
?
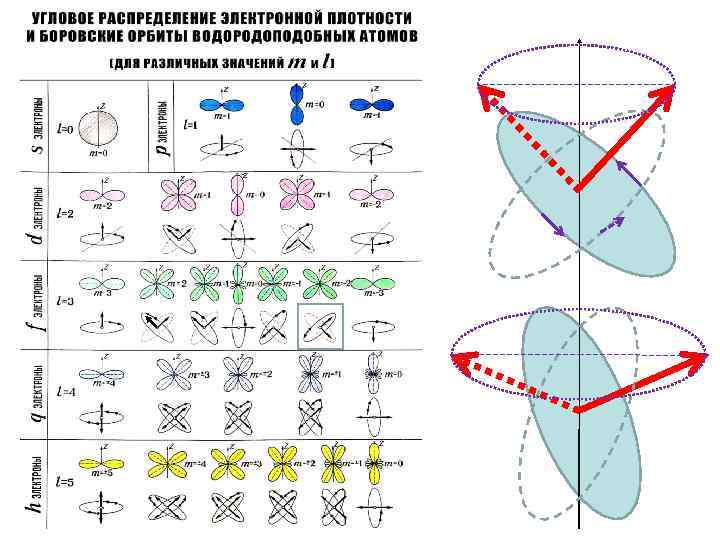
 б) квантовые числа L L
б) квантовые числа L L
 Физический смысл квантовых чисел • n определяет номер электронной оболочки в порядке удаленности от ядра. Дискретность значений n соответствует квантованию энергии атома • l определяет модуль момента импульса электрона относительно ядра. Дискретность значений l соответствует квантованию величины момента импульса электрона • m определяет проекцию вектора момента импульса электрона на физически выделенное направление в пространстве, то есть пространственную ориентацию «плоскости орбиты» и угловое распределение электронной плотности. Дискретность значений m соответствует пространственному квантованию момента импульса электрона
Физический смысл квантовых чисел • n определяет номер электронной оболочки в порядке удаленности от ядра. Дискретность значений n соответствует квантованию энергии атома • l определяет модуль момента импульса электрона относительно ядра. Дискретность значений l соответствует квантованию величины момента импульса электрона • m определяет проекцию вектора момента импульса электрона на физически выделенное направление в пространстве, то есть пространственную ориентацию «плоскости орбиты» и угловое распределение электронной плотности. Дискретность значений m соответствует пространственному квантованию момента импульса электрона
 Соотношения между квантовыми числами • В одноэлектронной системе (сферически симметричный кулоновский потенциал ядра) вид волновой функции электрона и вероятность его нахождения в заданной области пространства на расстоянии от ядра в интервале r, r+dr зависит от трех целочисленных параметров n, m и l, но энергия атома – только от n n может быть только натуральным числом (1, 2, 3, …) • l может быть равно нулю (сферически симметричное • распределения вероятности нахождения электрона относительно ядра) и не может превышать n-1 • m может быть =0, >0 и <0. Модуль m≤ l • Общее число квантовых состояний электрона с различными m и l при заданном n равно n 2
Соотношения между квантовыми числами • В одноэлектронной системе (сферически симметричный кулоновский потенциал ядра) вид волновой функции электрона и вероятность его нахождения в заданной области пространства на расстоянии от ядра в интервале r, r+dr зависит от трех целочисленных параметров n, m и l, но энергия атома – только от n n может быть только натуральным числом (1, 2, 3, …) • l может быть равно нулю (сферически симметричное • распределения вероятности нахождения электрона относительно ядра) и не может превышать n-1 • m может быть =0, >0 и <0. Модуль m≤ l • Общее число квантовых состояний электрона с различными m и l при заданном n равно n 2
 в) пространственное квантование момента импульса z 4 2 0 Вычислите модуль момента импульса L для случая, изображенного на рисунке? Какие углы может образовывать вектор момента импульса с осью z? -2 -4 Сравните с рис. 11. 6 с. 299 из [1]
в) пространственное квантование момента импульса z 4 2 0 Вычислите модуль момента импульса L для случая, изображенного на рисунке? Какие углы может образовывать вектор момента импульса с осью z? -2 -4 Сравните с рис. 11. 6 с. 299 из [1]
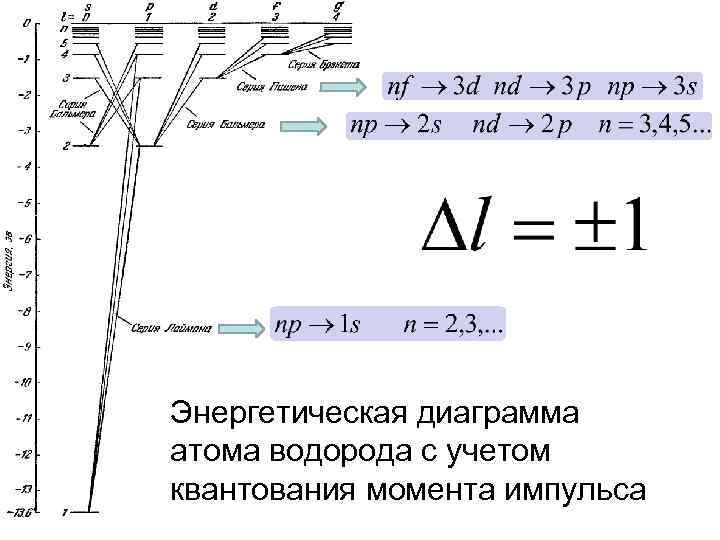 Энергетическая диаграмма атома водорода с учетом квантования момента импульса
Энергетическая диаграмма атома водорода с учетом квантования момента импульса
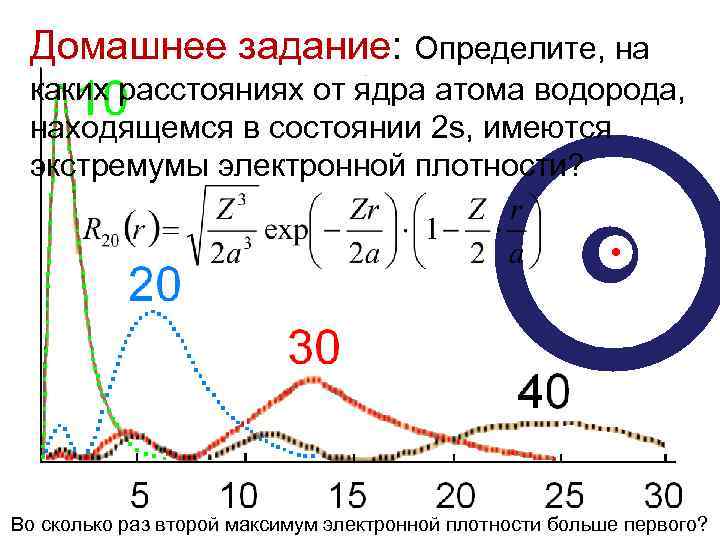 Домашнее задание: Определите, на каких расстояниях от ядра атома водорода, находящемся в состоянии 2 s, имеются экстремумы электронной плотности? Во сколько раз второй максимум электронной плотности больше первого?
Домашнее задание: Определите, на каких расстояниях от ядра атома водорода, находящемся в состоянии 2 s, имеются экстремумы электронной плотности? Во сколько раз второй максимум электронной плотности больше первого?
 Johann Jakob Balmer 1825 – 1898 Theodore Lyman 1874 -1954
Johann Jakob Balmer 1825 – 1898 Theodore Lyman 1874 -1954
 Louis Karl Heinrich Friedrich Paschen 1865 — 1947 August Herman Pfund 1879 – 1949
Louis Karl Heinrich Friedrich Paschen 1865 — 1947 August Herman Pfund 1879 – 1949
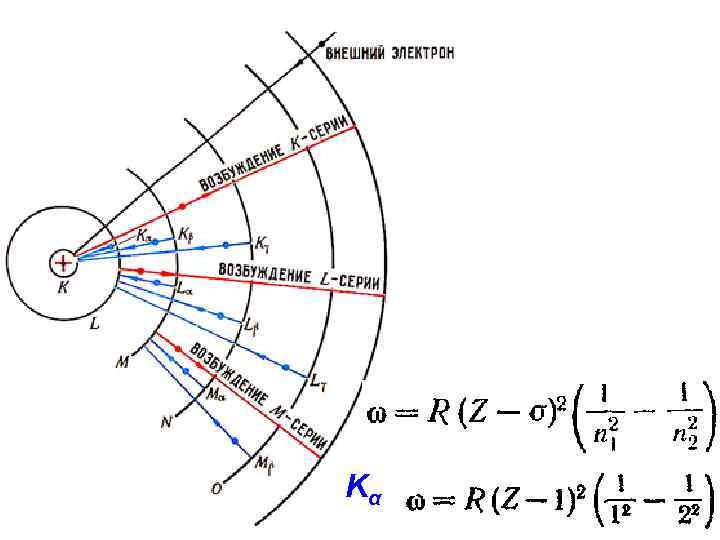
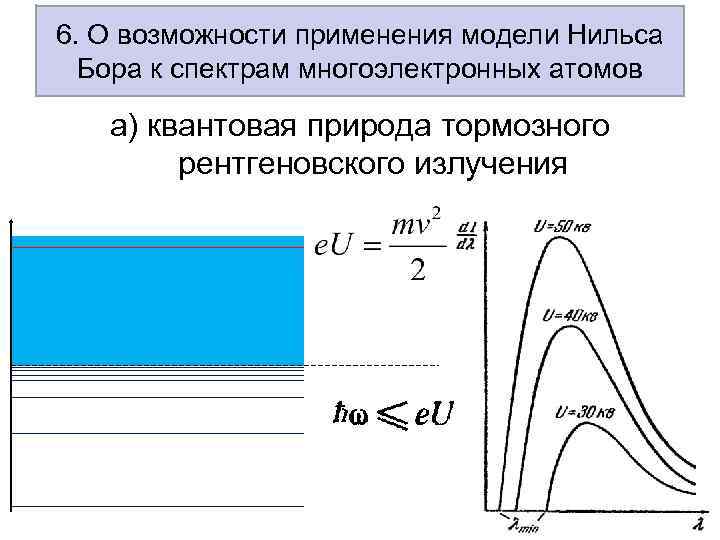 6. О возможности применения модели Нильса Бора к спектрам многоэлектронных атомов а) квантовая природа тормозного рентгеновского излучения
6. О возможности применения модели Нильса Бора к спектрам многоэлектронных атомов а) квантовая природа тормозного рентгеновского излучения
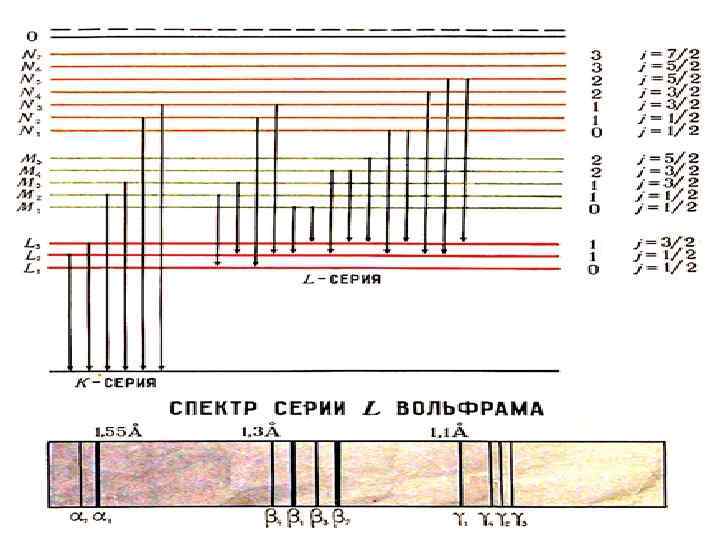
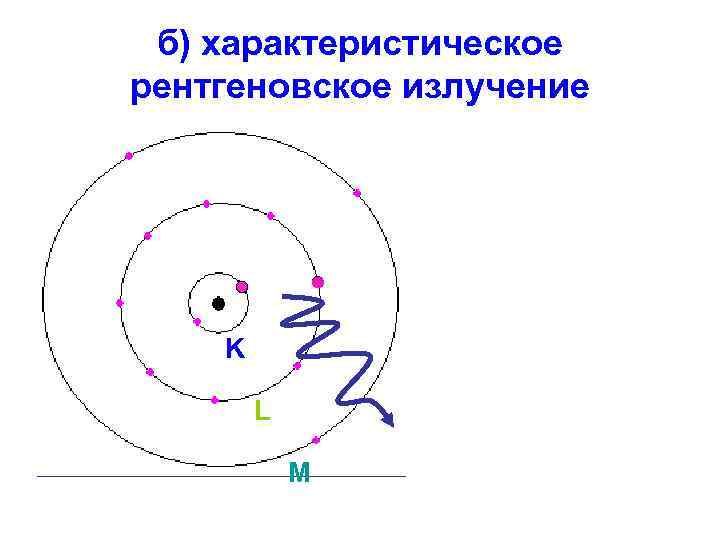 б) характеристическое рентгеновское излучение K L M
б) характеристическое рентгеновское излучение K L M
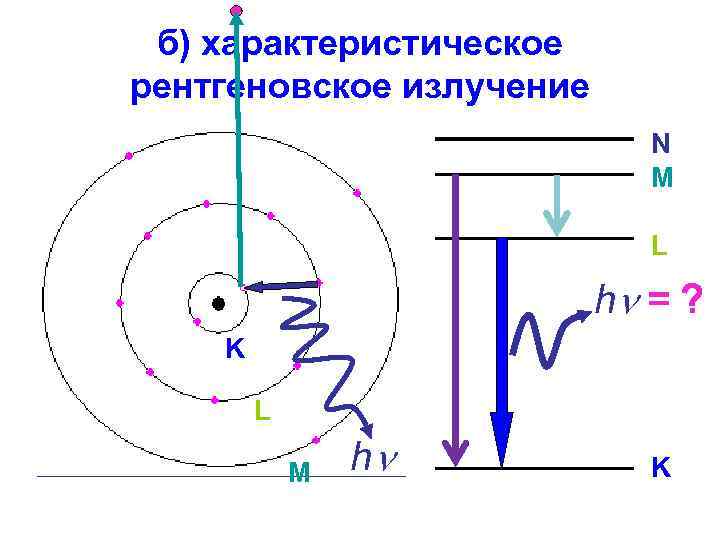 б) характеристическое рентгеновское излучение N M L hn = ? K L M hn K
б) характеристическое рентгеновское излучение N M L hn = ? K L M hn K
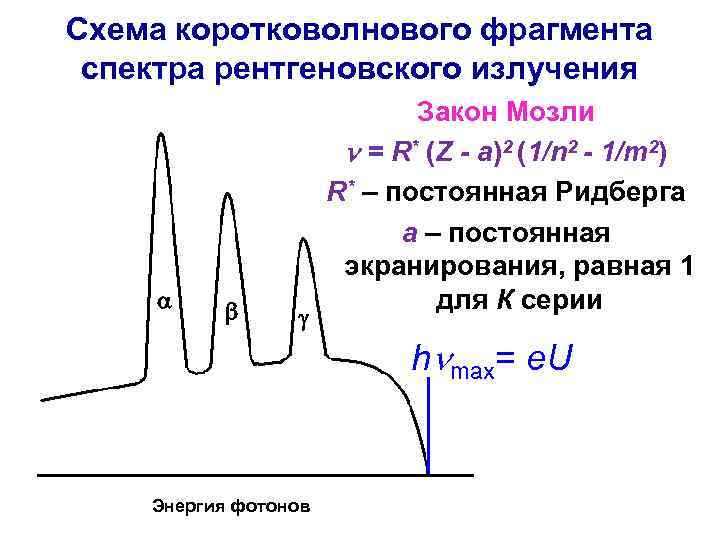 Схема коротковолнового фрагмента спектра рентгеновского излучения a b g Закон Мозли n = R* (Z - a)2 (1/n 2 - 1/m 2) R* – постоянная Ридберга a – постоянная экранирования, равная 1 для К серии hnmax= e. U Энергия фотонов
Схема коротковолнового фрагмента спектра рентгеновского излучения a b g Закон Мозли n = R* (Z - a)2 (1/n 2 - 1/m 2) R* – постоянная Ридберга a – постоянная экранирования, равная 1 для К серии hnmax= e. U Энергия фотонов
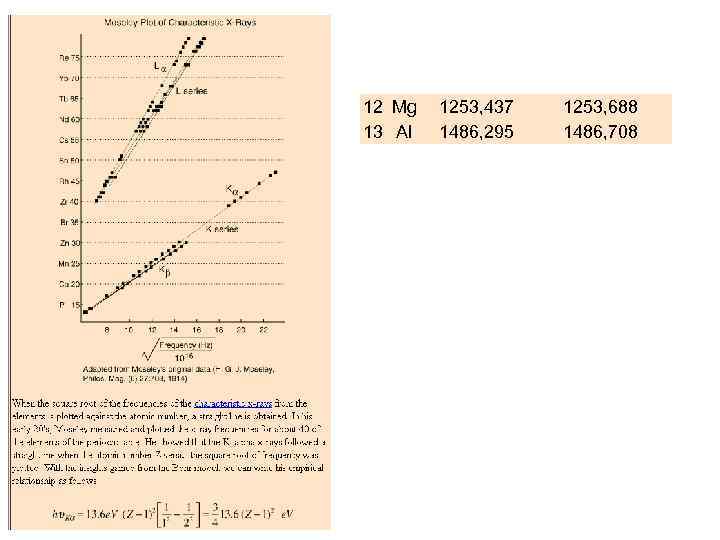 12 Mg 13 Al 1253, 437 1486, 295 1253, 688 1486, 708
12 Mg 13 Al 1253, 437 1486, 295 1253, 688 1486, 708
 Henry Moseley 1887 -1915
Henry Moseley 1887 -1915
 Kα
Kα
 в) оценка энергий фотонов hn = h. R* (Z - a)2 (1/n 2 - 1/m 2) R* = me 4/(8 h 3 e 02) = 3. 29*1015 c-1 Al Ka Z=13 a=1 hn = 3. 29*1015 c-1 * 6. 62*10 -34 Дж*с * *144*0, 75 : : 1. 6*10 -19 э. В/Дж = 1470 э. В Погрешность оценки 1. 1 % Mg Ka Z=12 a=1 СKa hn = 1235 э. В, 1. 5 % Z=6 a=1 hn = 254 э. В, эксп. 255 -285 э. В
в) оценка энергий фотонов hn = h. R* (Z - a)2 (1/n 2 - 1/m 2) R* = me 4/(8 h 3 e 02) = 3. 29*1015 c-1 Al Ka Z=13 a=1 hn = 3. 29*1015 c-1 * 6. 62*10 -34 Дж*с * *144*0, 75 : : 1. 6*10 -19 э. В/Дж = 1470 э. В Погрешность оценки 1. 1 % Mg Ka Z=12 a=1 СKa hn = 1235 э. В, 1. 5 % Z=6 a=1 hn = 254 э. В, эксп. 255 -285 э. В
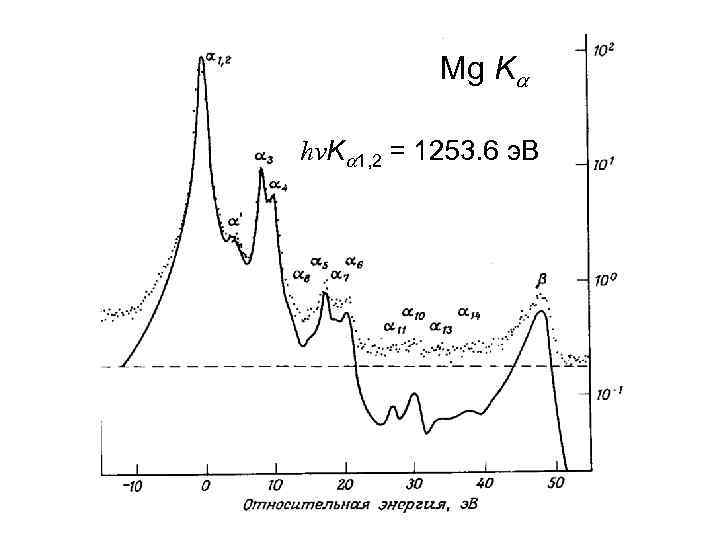 Mg Ka hνKa 1, 2 = 1253. 6 э. В
Mg Ka hνKa 1, 2 = 1253. 6 э. В
 КОНЕЦ ТЕМЫ
КОНЕЦ ТЕМЫ