Фт_Л13_Физ. атома_Студ(2сем)_13-14уг.pptx
- Количество слайдов: 16
 Раздел 5. Строение атома Лекция № 13 (2 сем. ) Физика атома Физика Самойленко П. И. стр. 294 § 16. 2
Раздел 5. Строение атома Лекция № 13 (2 сем. ) Физика атома Физика Самойленко П. И. стр. 294 § 16. 2
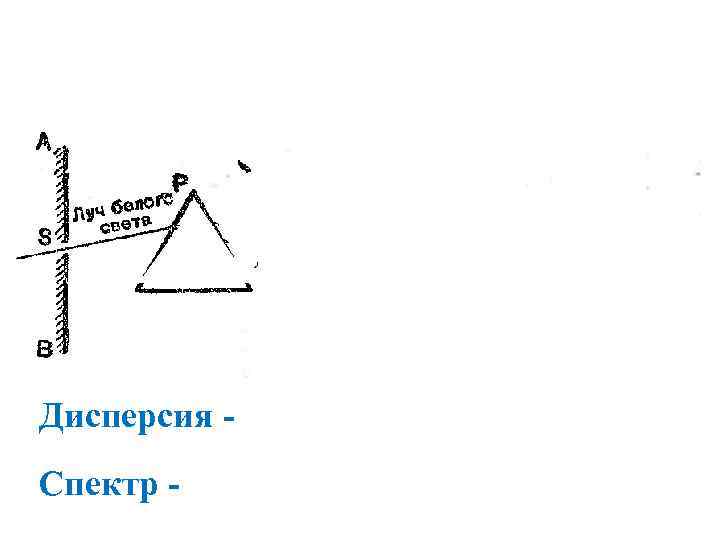 Дисперсия Спектр -
Дисперсия Спектр -
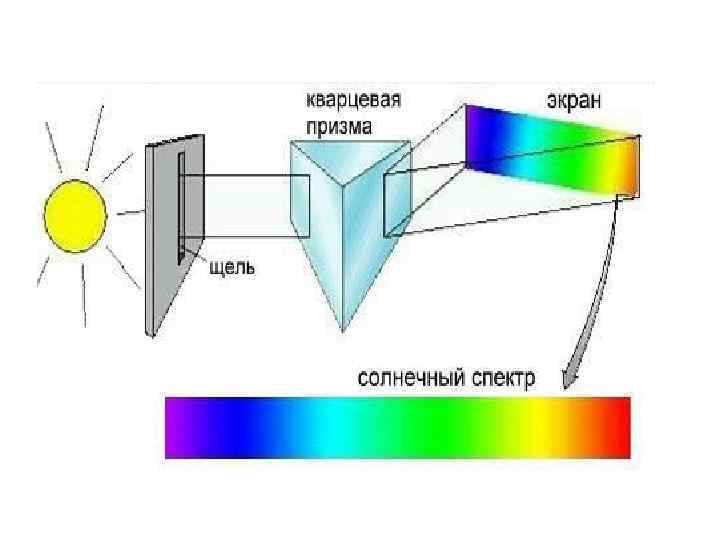
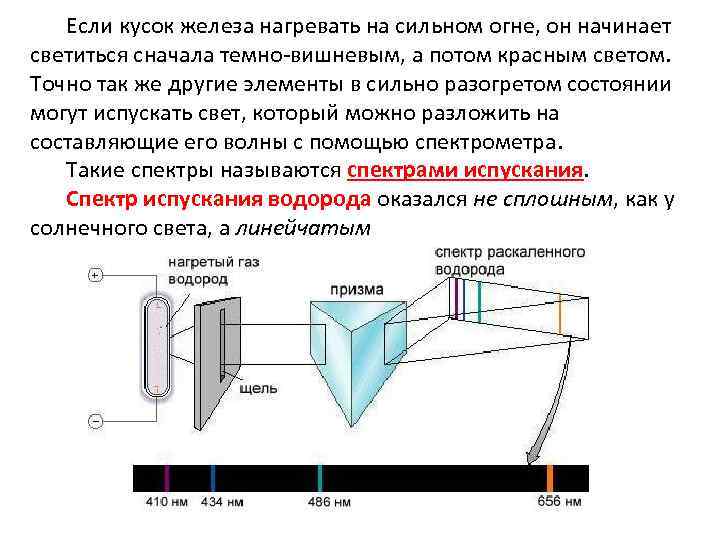 Если кусок железа нагревать на сильном огне, он начинает светиться сначала темно-вишневым, а потом красным светом. Точно так же другие элементы в сильно разогретом состоянии могут испускать свет, который можно разложить на составляющие его волны с помощью спектрометра. Такие спектры называются спектрами испускания. Спектр испускания водорода оказался не сплошным, как у солнечного света, а линейчатым
Если кусок железа нагревать на сильном огне, он начинает светиться сначала темно-вишневым, а потом красным светом. Точно так же другие элементы в сильно разогретом состоянии могут испускать свет, который можно разложить на составляющие его волны с помощью спектрометра. Такие спектры называются спектрами испускания. Спектр испускания водорода оказался не сплошным, как у солнечного света, а линейчатым
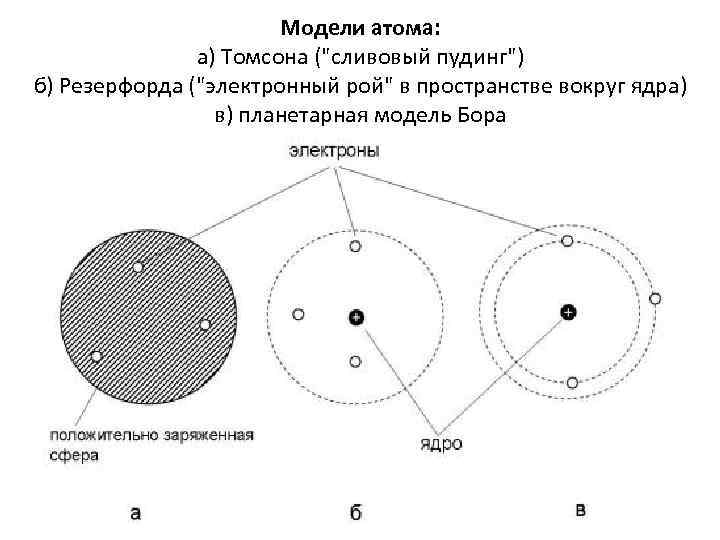 Модели атома: а) Томсона ("сливовый пудинг") б) Резерфорда ("электронный рой" в пространстве вокруг ядра) в) планетарная модель Бора
Модели атома: а) Томсона ("сливовый пудинг") б) Резерфорда ("электронный рой" в пространстве вокруг ядра) в) планетарная модель Бора
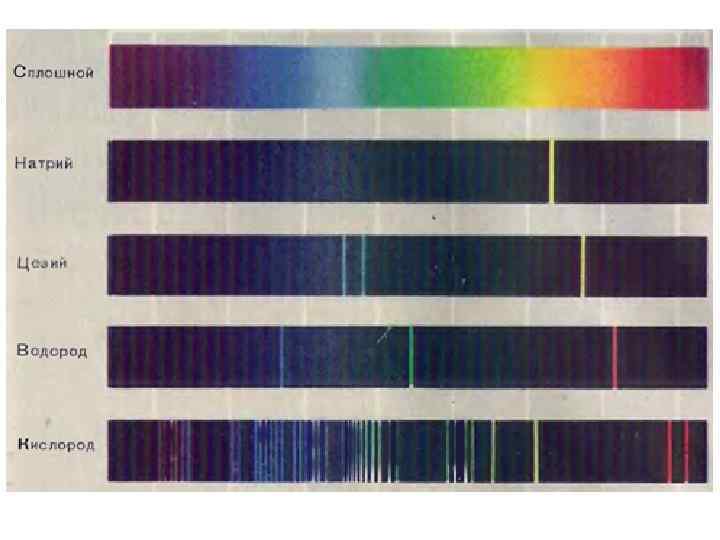
 Экспериментальный факт Если сильно разогреть газ, как это происходит в водородной лампе, то атом поглощает часть энергии. При этом электрон скачком переходит с нижней стационарной орбиты (уровня, оболочки) на более высокие стационарные орбиты (уровни, оболочки). Такой "возбужденный" атом не может долго существовать и электрон возвращается ("падает") на более низкую орбиту, выделяя при этом строго определенную порцию (квант) световой энергии. Поскольку орбит в атоме конечное число, в спектре испускаемого водородной лампой света наблюдаются не плавные переходы от одного цвета к другому, а лишь отдельные линии на черном фоне – это и есть линейчатый спектр. Число линий должно совпадать с числом электронных переходов между стационарными орбитами
Экспериментальный факт Если сильно разогреть газ, как это происходит в водородной лампе, то атом поглощает часть энергии. При этом электрон скачком переходит с нижней стационарной орбиты (уровня, оболочки) на более высокие стационарные орбиты (уровни, оболочки). Такой "возбужденный" атом не может долго существовать и электрон возвращается ("падает") на более низкую орбиту, выделяя при этом строго определенную порцию (квант) световой энергии. Поскольку орбит в атоме конечное число, в спектре испускаемого водородной лампой света наблюдаются не плавные переходы от одного цвета к другому, а лишь отдельные линии на черном фоне – это и есть линейчатый спектр. Число линий должно совпадать с числом электронных переходов между стационарными орбитами
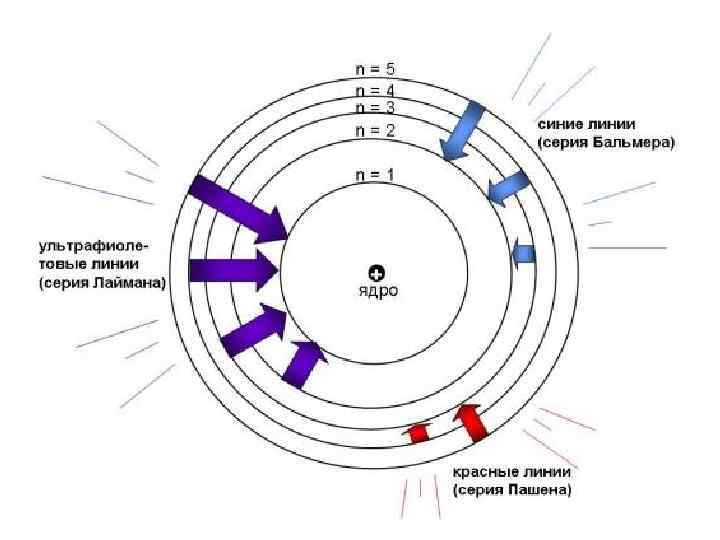
 Электронные переходы в атоме водорода: Серия Лаймана (самое богатое энергией ультрафиолетовое излучение) возникает в результате переходов с уровней n = 5, 4, 3, 2 в основное состояние (n = 1) Серия Бальмера (видимый свет) возникает при переходах с уровней n = 5, 4, 3 на уровень n = 2 Серия Пашена (красный свет) возникает в результате переходов с уровней n = 6, 5, 4 на уровень n = 3. Серии линий в спектре водорода названы именами открывших их ученых.
Электронные переходы в атоме водорода: Серия Лаймана (самое богатое энергией ультрафиолетовое излучение) возникает в результате переходов с уровней n = 5, 4, 3, 2 в основное состояние (n = 1) Серия Бальмера (видимый свет) возникает при переходах с уровней n = 5, 4, 3 на уровень n = 2 Серия Пашена (красный свет) возникает в результате переходов с уровней n = 6, 5, 4 на уровень n = 3. Серии линий в спектре водорода названы именами открывших их ученых.
 Нильс Хе нрик Дави д Бор — датский физик-теоретик и общественный деятель, один из создателей современной физики
Нильс Хе нрик Дави д Бор — датский физик-теоретик и общественный деятель, один из создателей современной физики
 1. Постулаты Бора 1. Спектры излучения атомов показали …. 2. Частота линий в серии Бальмера определяется по формуле…. . 3. Частота линий в серии Лаймана определяется по формуле …. . 4. Частота линий в серии Пашена определяется по формуле …. .
1. Постулаты Бора 1. Спектры излучения атомов показали …. 2. Частота линий в серии Бальмера определяется по формуле…. . 3. Частота линий в серии Лаймана определяется по формуле …. . 4. Частота линий в серии Пашена определяется по формуле …. .
 5. Линейчатый характер спектров говорит о …. Квант – это …. 6. Запишите первый постулат Бора…. . Условие квантования радиуса орбит - … 7. Запишите второй постулат Бора…. . 8. Запишите третий постулат Бора…. . Условие частот - … 9. Какова роль постулатов Бора?
5. Линейчатый характер спектров говорит о …. Квант – это …. 6. Запишите первый постулат Бора…. . Условие квантования радиуса орбит - … 7. Запишите второй постулат Бора…. . 8. Запишите третий постулат Бора…. . Условие частот - … 9. Какова роль постулатов Бора?
 10. Физика: стр. 308, задания № 3, № 4
10. Физика: стр. 308, задания № 3, № 4
 2. Атомы водорода по Бору 1. Формула для расчета радиуса любой стационарной орбиты Пояснить все входящие в формулу величины 2. Формула для расчета энергии электрона для любой стационарной орбиты Пояснить все входящие в формулу величины 3. Уровень энергии атома - это…. . 4. С увеличением радиуса электронной орбиты – энергия атома …. .
2. Атомы водорода по Бору 1. Формула для расчета радиуса любой стационарной орбиты Пояснить все входящие в формулу величины 2. Формула для расчета энергии электрона для любой стационарной орбиты Пояснить все входящие в формулу величины 3. Уровень энергии атома - это…. . 4. С увеличением радиуса электронной орбиты – энергия атома …. .
 5. Минимумом энергии атом обладает при …, а максимум при … 6. Квант энергии излучается при … 7. Переход атома на более далекую орбиту … 8. Чем обусловлен линейчатый характер спектра? … 9. Нормальное состояние атома –это … Нормальный уровень - это … Возбуждённый уровень – это …
5. Минимумом энергии атом обладает при …, а максимум при … 6. Квант энергии излучается при … 7. Переход атома на более далекую орбиту … 8. Чем обусловлен линейчатый характер спектра? … 9. Нормальное состояние атома –это … Нормальный уровень - это … Возбуждённый уровень – это …
 10. Общая формула частоты ν излучения атома: 11. R – это … 12. R определяется по формуле: 13. Значение квантовой теории Бора 14. Ограниченность квантовой теории Бора 15. Физика: стр. 309, задания № 6, № 7
10. Общая формула частоты ν излучения атома: 11. R – это … 12. R определяется по формуле: 13. Значение квантовой теории Бора 14. Ограниченность квантовой теории Бора 15. Физика: стр. 309, задания № 6, № 7


