ОХТ3.Простой необратимый гомогенный процесс.ppt
- Количество слайдов: 16
 Раздел 1 Закономерности управления химикотехнологическим процессом
Раздел 1 Закономерности управления химикотехнологическим процессом
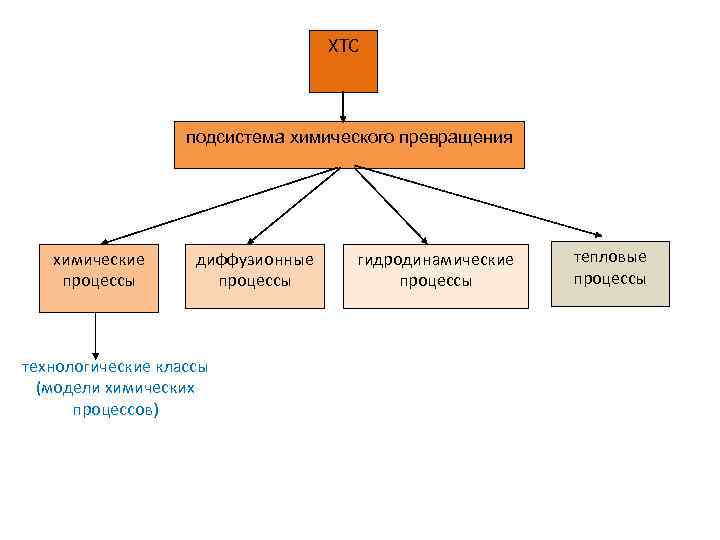 ХТС подсистема химического превращения химические процессы диффузионные процессы технологические классы (модели химических процессов) гидродинамические процессы тепловые процессы
ХТС подсистема химического превращения химические процессы диффузионные процессы технологические классы (модели химических процессов) гидродинамические процессы тепловые процессы
 Технологическая классификация химических процессов (модели химических процессов) простые процессы целевая реакция А+В С сложные процессы - последовательные (консекутивные): целевая реакция А + В С побочная реакция С + R S - параллельные: - смешанные: целевая реакция А + В С побочная реакция А + R S целевая реакция А + В С побочная реакция А + C S обратимые процессы необратимые процессы экзотермические процессы эндотермические процессы гомогенные процессы гетерогенные процессы с большим тепловым эффектом процессы с малым тепловым эффектом каталитические процессы некаталитические процессы N 2 + 3 H 2 2 NH 3, H 0
Технологическая классификация химических процессов (модели химических процессов) простые процессы целевая реакция А+В С сложные процессы - последовательные (консекутивные): целевая реакция А + В С побочная реакция С + R S - параллельные: - смешанные: целевая реакция А + В С побочная реакция А + R S целевая реакция А + В С побочная реакция А + C S обратимые процессы необратимые процессы экзотермические процессы эндотермические процессы гомогенные процессы гетерогенные процессы с большим тепловым эффектом процессы с малым тепловым эффектом каталитические процессы некаталитические процессы N 2 + 3 H 2 2 NH 3, H 0
 Закономерности управления простым необратимым процессом
Закономерности управления простым необратимым процессом
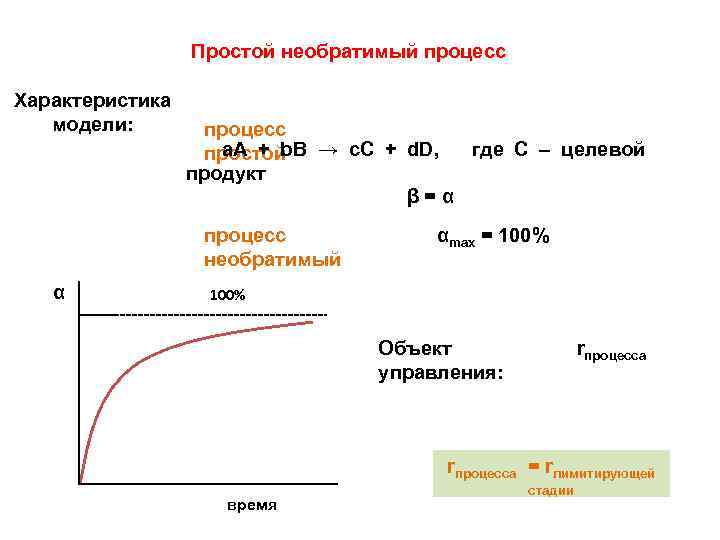 Простой необратимый процесс Характеристика модели: процесс а. А + b. В → c. С + d. D, где С – целевой простой продукт β=α процесс необратимый α αmax = 100% rпроцесса Объект управления: rпроцесса = rлимитирующей время стадии
Простой необратимый процесс Характеристика модели: процесс а. А + b. В → c. С + d. D, где С – целевой простой продукт β=α процесс необратимый α αmax = 100% rпроцесса Объект управления: rпроцесса = rлимитирующей время стадии
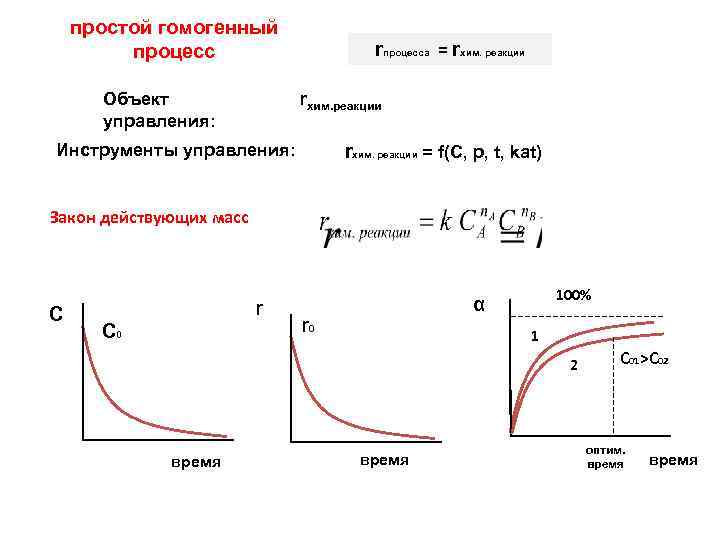 простой гомогенный процесс rпроцесса = rхим. реакции Объект управления: Инструменты управления: rхим. реакции = f(C, p, t, kat) Закон действующих масс C r C 0 100% α r 0 1 2 время С 01>С 02 оптим. время
простой гомогенный процесс rпроцесса = rхим. реакции Объект управления: Инструменты управления: rхим. реакции = f(C, p, t, kat) Закон действующих масс C r C 0 100% α r 0 1 2 время С 01>С 02 оптим. время
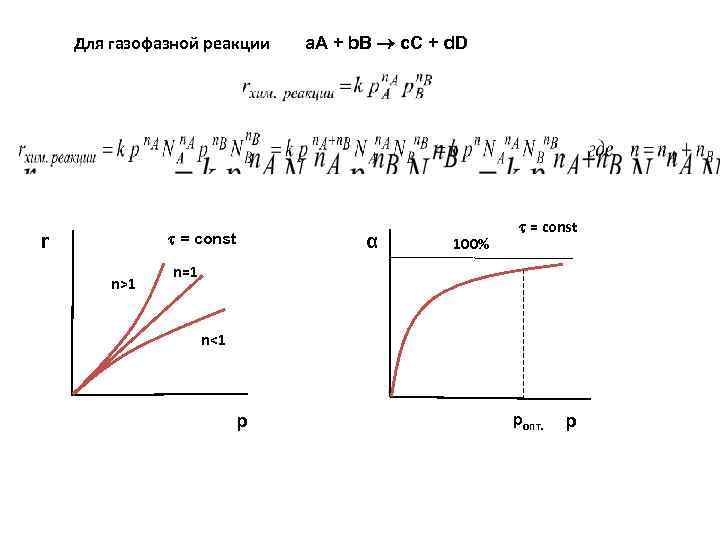 Для газофазной реакции = const r n>1 а. А + b. В c. С + d. D α 100% = const n=1 n<1 p ропт. p
Для газофазной реакции = const r n>1 а. А + b. В c. С + d. D α 100% = const n=1 n<1 p ропт. p
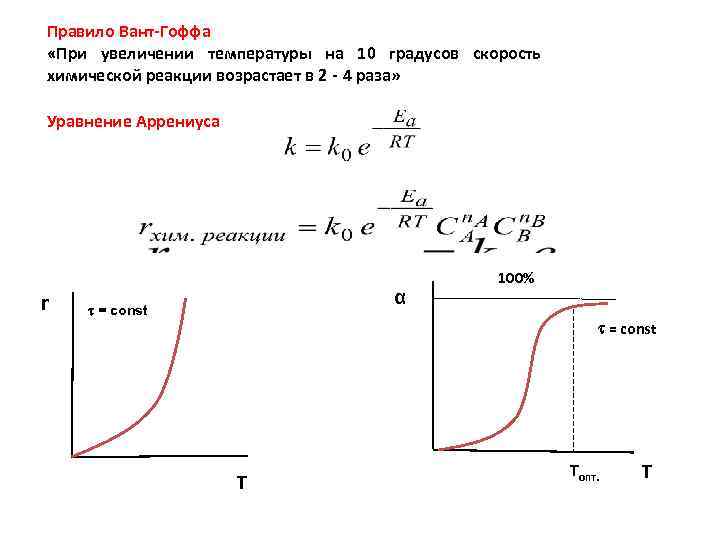 Правило Вант-Гоффа «При увеличении температуры на 10 градусов скорость химической реакции возрастает в 2 - 4 раза» Уравнение Аррениуса r α = const 100% = const Т Tопт. T
Правило Вант-Гоффа «При увеличении температуры на 10 градусов скорость химической реакции возрастает в 2 - 4 раза» Уравнение Аррениуса r α = const 100% = const Т Tопт. T
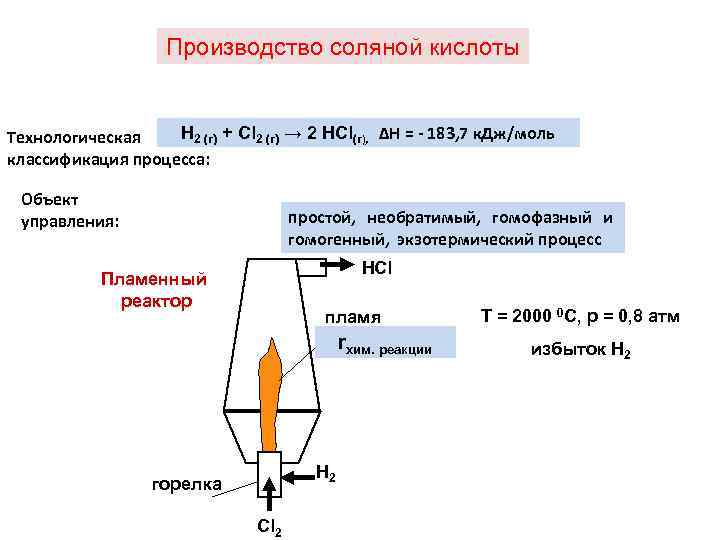 Производство соляной кислоты Н 2 (г) + Cl 2 (г) → 2 HCl(г), ∆Н = - 183, 7 к. Дж/моль Технологическая классификация процесса: Объект управления: простой, необратимый, гомофазный и гомогенный, экзотермический процесс HCl Пламенный реактор пламя rхим. реакции H 2 горелка Cl 2 Т = 2000 0 С, р = 0, 8 атм избыток Н 2
Производство соляной кислоты Н 2 (г) + Cl 2 (г) → 2 HCl(г), ∆Н = - 183, 7 к. Дж/моль Технологическая классификация процесса: Объект управления: простой, необратимый, гомофазный и гомогенный, экзотермический процесс HCl Пламенный реактор пламя rхим. реакции H 2 горелка Cl 2 Т = 2000 0 С, р = 0, 8 атм избыток Н 2
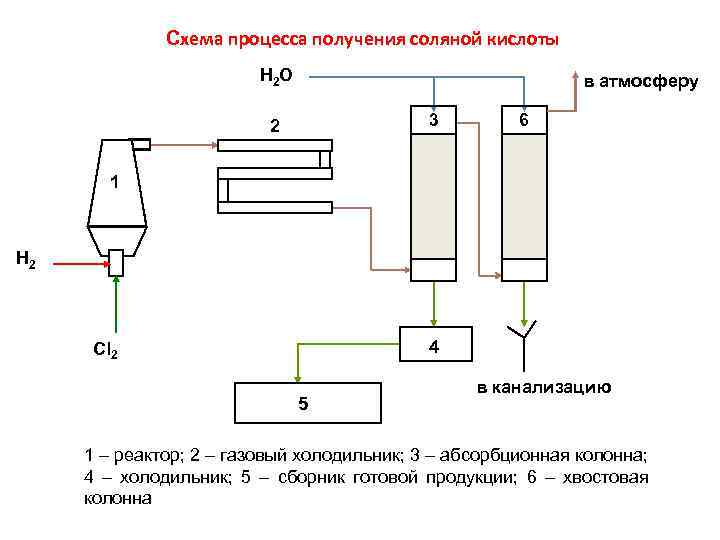 Схема процесса получения соляной кислоты H 2 O в атмосферу 3 2 6 1 H 2 4 Cl 2 5 в канализацию 1 – реактор; 2 – газовый холодильник; 3 – абсорбционная колонна; 4 – холодильник; 5 – сборник готовой продукции; 6 – хвостовая колонна
Схема процесса получения соляной кислоты H 2 O в атмосферу 3 2 6 1 H 2 4 Cl 2 5 в канализацию 1 – реактор; 2 – газовый холодильник; 3 – абсорбционная колонна; 4 – холодильник; 5 – сборник готовой продукции; 6 – хвостовая колонна
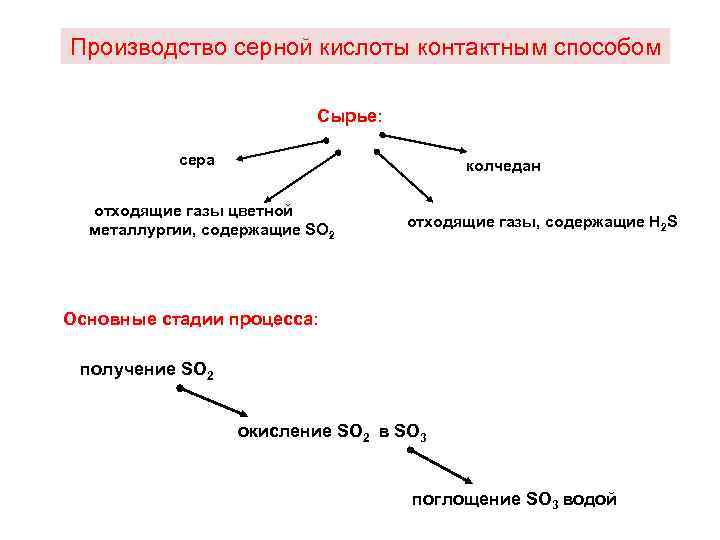 Производство серной кислоты контактным способом Сырье: сера колчедан отходящие газы цветной металлургии, содержащие SO 2 отходящие газы, содержащие Н 2 S Основные стадии процесса: получение SO 2 окисление SO 2 в SO 3 поглощение SO 3 водой
Производство серной кислоты контактным способом Сырье: сера колчедан отходящие газы цветной металлургии, содержащие SO 2 отходящие газы, содержащие Н 2 S Основные стадии процесса: получение SO 2 окисление SO 2 в SO 3 поглощение SO 3 водой
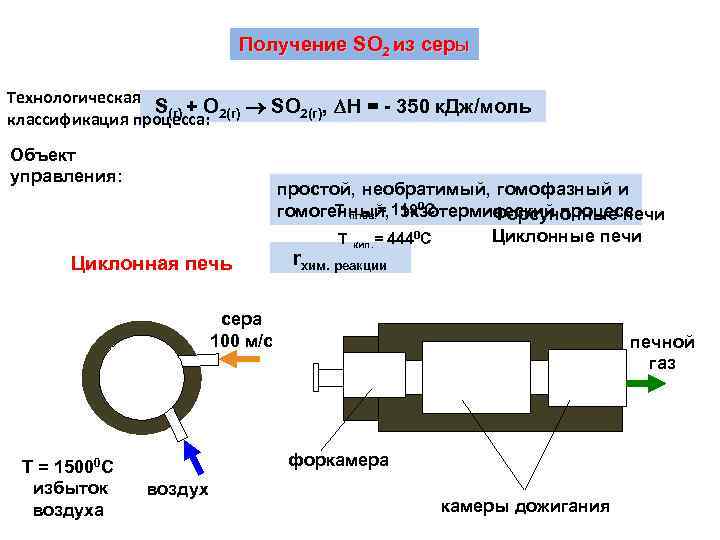 Получение SO 2 из серы Технологическая S(г) + O SO 2(г), Н = - 350 к. Дж/моль классификация процесса: 2(г) Объект управления: простой, необратимый, гомофазный и Т плав. = экзотермический процесс гомогенный, 1190 С Форсуночные печи Циклонные печи Т кип. = 4440 С Циклонная печь rхим. реакции сера 100 м/с Т = 15000 С избыток воздуха печной газ форкамера воздух камеры дожигания
Получение SO 2 из серы Технологическая S(г) + O SO 2(г), Н = - 350 к. Дж/моль классификация процесса: 2(г) Объект управления: простой, необратимый, гомофазный и Т плав. = экзотермический процесс гомогенный, 1190 С Форсуночные печи Циклонные печи Т кип. = 4440 С Циклонная печь rхим. реакции сера 100 м/с Т = 15000 С избыток воздуха печной газ форкамера воздух камеры дожигания
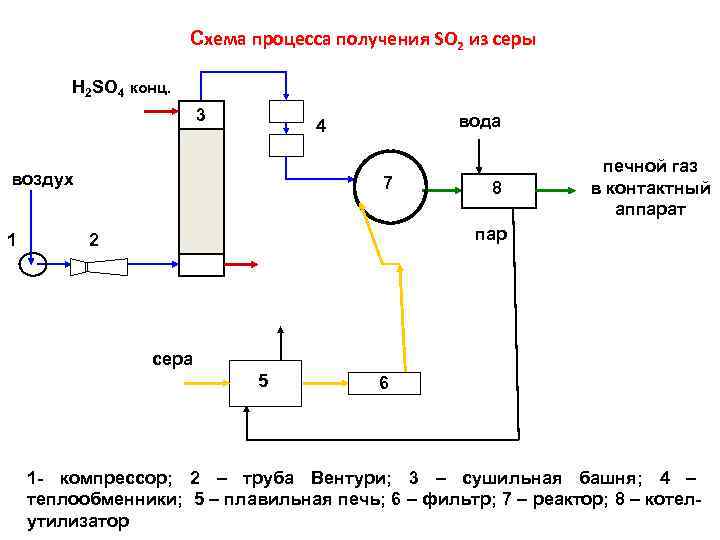 Схема процесса получения SO 2 из серы Н 2 SO 4 конц. 3 воздух 1 вода 4 7 8 печной газ в контактный аппарат пар 2 сера 5 6 1 - компрессор; 2 – труба Вентури; 3 – сушильная башня; 4 – теплообменники; 5 – плавильная печь; 6 – фильтр; 7 – реактор; 8 – котелутилизатор
Схема процесса получения SO 2 из серы Н 2 SO 4 конц. 3 воздух 1 вода 4 7 8 печной газ в контактный аппарат пар 2 сера 5 6 1 - компрессор; 2 – труба Вентури; 3 – сушильная башня; 4 – теплообменники; 5 – плавильная печь; 6 – фильтр; 7 – реактор; 8 – котелутилизатор
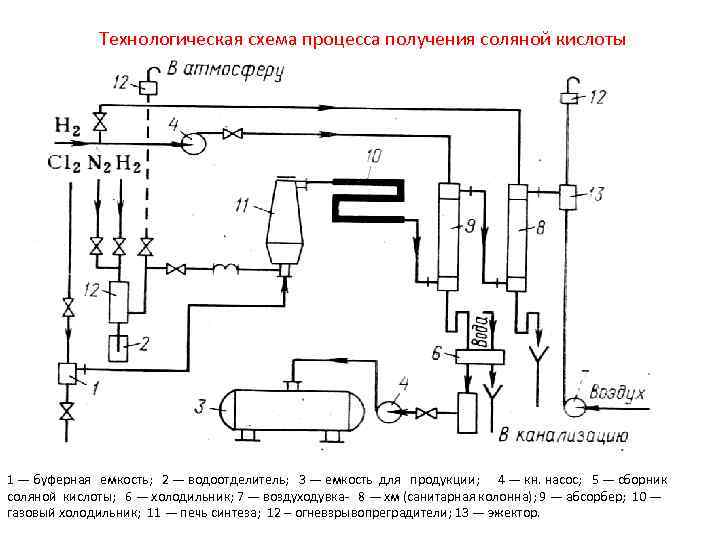 Технологическая схема процесса получения соляной кислоты 1 — буферная емкость; 2 — водоотделитель; 3 — емкость для продукции; 4 — кн. насос; 5 — сборник соляной кислоты; 6 — холодильник; 7 — воздуходувка- 8 — хм (санитарная колонна); 9 — абсорбер; 10 — газовый холодильник; 11 — печь синтеза; 12 – огневзрывопреградители; 13 — эжектор.
Технологическая схема процесса получения соляной кислоты 1 — буферная емкость; 2 — водоотделитель; 3 — емкость для продукции; 4 — кн. насос; 5 — сборник соляной кислоты; 6 — холодильник; 7 — воздуходувка- 8 — хм (санитарная колонна); 9 — абсорбер; 10 — газовый холодильник; 11 — печь синтеза; 12 – огневзрывопреградители; 13 — эжектор.
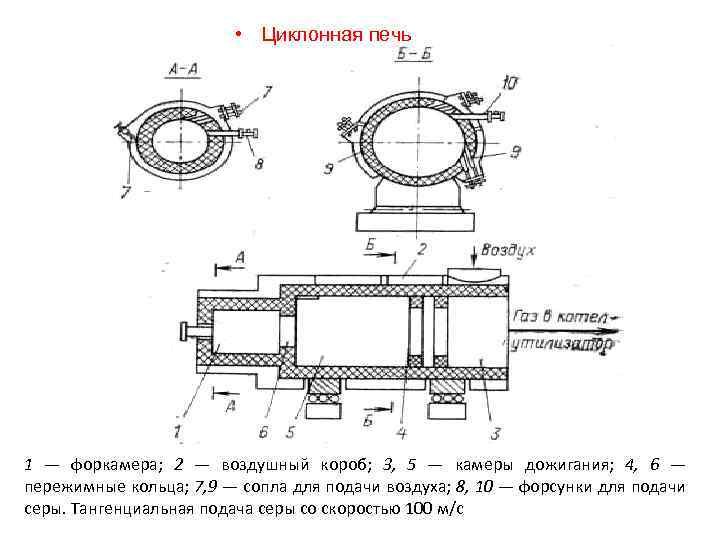 • Циклонная печь 1 — форкамера; 2 — воздушный короб; 3, 5 — камеры дожигания; 4, 6 — пережимные кольца; 7, 9 — сопла для подачи воздуха; 8, 10 — форсунки для подачи серы. Тангенциальная подача серы со скоростью 100 м/с
• Циклонная печь 1 — форкамера; 2 — воздушный короб; 3, 5 — камеры дожигания; 4, 6 — пережимные кольца; 7, 9 — сопла для подачи воздуха; 8, 10 — форсунки для подачи серы. Тангенциальная подача серы со скоростью 100 м/с
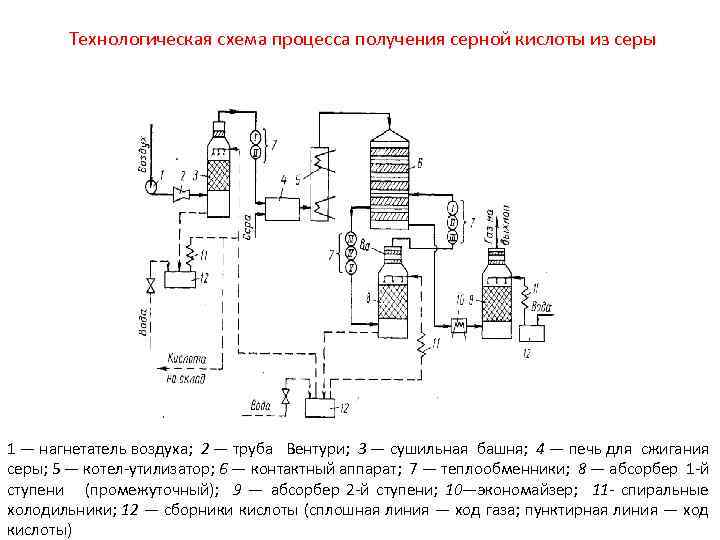 Технологическая схема процесса получения серной кислоты из серы 1 — нагнетатель воздуха; 2 — труба Вентури; 3 — сушильная башня; 4 — печь для сжигания серы; 5 — котел-утилизатор; 6 — контактный аппарат; 7 — теплообменники; 8 — абсорбер 1 -й ступени (промежуточный); 9 — абсорбер 2 -й ступени; 10—экономайзер; 11 - спиральные холодильники; 12 — сборники кислоты (сплошная линия — ход газа; пунктирная линия — ход кислоты)
Технологическая схема процесса получения серной кислоты из серы 1 — нагнетатель воздуха; 2 — труба Вентури; 3 — сушильная башня; 4 — печь для сжигания серы; 5 — котел-утилизатор; 6 — контактный аппарат; 7 — теплообменники; 8 — абсорбер 1 -й ступени (промежуточный); 9 — абсорбер 2 -й ступени; 10—экономайзер; 11 - спиральные холодильники; 12 — сборники кислоты (сплошная линия — ход газа; пунктирная линия — ход кислоты)


