7. Равновесия в растворах кислых солей. Буферные растворы.ppt
- Количество слайдов: 49
 Равновесия в растворах кислых солей (Na. HCO 3) 1
Равновесия в растворах кислых солей (Na. HCO 3) 1
 MHA M+ + HA– + H+ H 2 A 30% HA– H+ + A 2– [H+] = [A 2–] – [H 2 A] H 2 A H+ + HA– H+ + A 2– [H+] · [HA– ] K 1 = ————— [H 2 A] [H+] · [A 2– ] K 2 = ————— [HA– ] 2
MHA M+ + HA– + H+ H 2 A 30% HA– H+ + A 2– [H+] = [A 2–] – [H 2 A] H 2 A H+ + HA– H+ + A 2– [H+] · [HA– ] K 1 = ————— [H 2 A] [H+] · [A 2– ] K 2 = ————— [HA– ] 2
![[HA– ] = Cсоли [H+] · Cсоли K 1 = ————— [H 2 A] [HA– ] = Cсоли [H+] · Cсоли K 1 = ————— [H 2 A]](https://present5.com/presentation/106263550_425153937/image-3.jpg) [HA– ] = Cсоли [H+] · Cсоли K 1 = ————— [H 2 A] [H+] · [A 2– ] K 2 = ————— Cсоли [H+] · Cсоли K 2 · Cсоли 2– ] = ————— [H 2 A] = ————— [A K 1 [H+] = [A 2–] – [H 2 A] K 2 · Cсоли [H+] = ————— – ————— [H+] K 1 3
[HA– ] = Cсоли [H+] · Cсоли K 1 = ————— [H 2 A] [H+] · [A 2– ] K 2 = ————— Cсоли [H+] · Cсоли K 2 · Cсоли 2– ] = ————— [H 2 A] = ————— [A K 1 [H+] = [A 2–] – [H 2 A] K 2 · Cсоли [H+] = ————— – ————— [H+] K 1 3
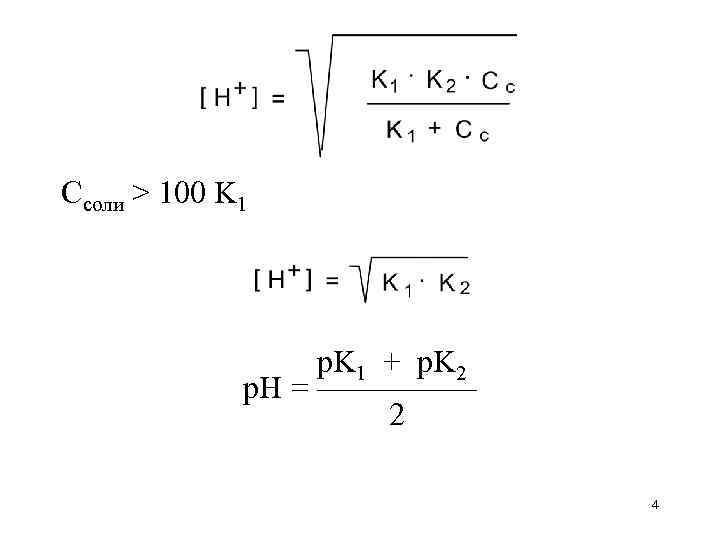 Cсоли > 100 K 1 p. K 1 + p. K 2 p. H = ————— 2 4
Cсоли > 100 K 1 p. K 1 + p. K 2 p. H = ————— 2 4
 Вычислить р. Н раствора гидрокарбоната натрия. Na. HCO 3 – кислая соль p. K 1 = 6, 35 p. K 2 = 10, 32 p. K 1 + p. K 2 p. H = ————— 2 6, 35 + 10, 32 p. H = —————— = 8, 3 2 5
Вычислить р. Н раствора гидрокарбоната натрия. Na. HCO 3 – кислая соль p. K 1 = 6, 35 p. K 2 = 10, 32 p. K 1 + p. K 2 p. H = ————— 2 6, 35 + 10, 32 p. H = —————— = 8, 3 2 5
 К 50 мл 0, 1 М раствора Na 2 CO 3 добавлено 25 мл 0, 2 М раствора HCl. Вычислить р. Н раствора. 1. Na 2 CO 3 + HCl Na. HCO 3 + Na. Cl 2. Na 2 CO 3 + 2 HCl H 2 CO 3 + 2 Na. Cl (Na 2 CO 3) = C(Na 2 CO 3) · V = 50 · 0, 1 = 0, 5 м. М (HCl) = C(HCl) · V = 25 · 0, 2 = 0, 5 м. М 6
К 50 мл 0, 1 М раствора Na 2 CO 3 добавлено 25 мл 0, 2 М раствора HCl. Вычислить р. Н раствора. 1. Na 2 CO 3 + HCl Na. HCO 3 + Na. Cl 2. Na 2 CO 3 + 2 HCl H 2 CO 3 + 2 Na. Cl (Na 2 CO 3) = C(Na 2 CO 3) · V = 50 · 0, 1 = 0, 5 м. М (HCl) = C(HCl) · V = 25 · 0, 2 = 0, 5 м. М 6
 Идет реакция: Na 2 CO 3 + HCl Na. HCO 3 + Na. Cl В растворе кислая соль p. K 1 + p. K 2 p. H = ————— 2 6, 35 + 10, 32 p. H = —————— = 8, 3 2 7
Идет реакция: Na 2 CO 3 + HCl Na. HCO 3 + Na. Cl В растворе кислая соль p. K 1 + p. K 2 p. H = ————— 2 6, 35 + 10, 32 p. H = —————— = 8, 3 2 7
 БУФЕРНЫЕ РАСТВОРЫ Буферные растворы – это растворы, сохраняющие практически постоянное значение р. Н при добавлении в него небольших количеств сильной кислоты или сильного основания 8
БУФЕРНЫЕ РАСТВОРЫ Буферные растворы – это растворы, сохраняющие практически постоянное значение р. Н при добавлении в него небольших количеств сильной кислоты или сильного основания 8
 Типы буферных растворов: 1. Слабая кислота и ее соль CH 3 COOH + CH 3 COONa – ацетатный буфер HCOOH + HCOONa – формиатный буфер 2. Слабое основание и его соль NH 4 OH + NH 4 Cl – аммиачный буфер 3. Смесь растворов двух солей Na. HCO 3 + Na 2 CO 3 – карбонатный буфер Na. H 2 PO 4 + Na 2 HPO 4 – фосфатный буфер ———— Роль к-ты Роль соли 9
Типы буферных растворов: 1. Слабая кислота и ее соль CH 3 COOH + CH 3 COONa – ацетатный буфер HCOOH + HCOONa – формиатный буфер 2. Слабое основание и его соль NH 4 OH + NH 4 Cl – аммиачный буфер 3. Смесь растворов двух солей Na. HCO 3 + Na 2 CO 3 – карбонатный буфер Na. H 2 PO 4 + Na 2 HPO 4 – фосфатный буфер ———— Роль к-ты Роль соли 9
 Расчет р. Н буферных растворов 1. Слабая кислота и ее соль с сильным основанием HA + BA BA B+ + A– HA H+ + A– 30% Диссоциация слабой кислоты подавляется за счет [A–] соли, поэтому: [HA] = Cк-ты [A–] = Ссоли 10
Расчет р. Н буферных растворов 1. Слабая кислота и ее соль с сильным основанием HA + BA BA B+ + A– HA H+ + A– 30% Диссоциация слабой кислоты подавляется за счет [A–] соли, поэтому: [HA] = Cк-ты [A–] = Ссоли 10
![[H+] · [A– ] [H+] · Ссоли Kк-ты = —————— [HA] Ск-ты [H+] Kк-ты [H+] · [A– ] [H+] · Ссоли Kк-ты = —————— [HA] Ск-ты [H+] Kк-ты](https://present5.com/presentation/106263550_425153937/image-11.jpg) [H+] · [A– ] [H+] · Ссоли Kк-ты = —————— [HA] Ск-ты [H+] Kк-ты · Ск-ты = ————— Ссоли р. Н = р. Kк-ты Ссоли + lg —— Ск-ты 11
[H+] · [A– ] [H+] · Ссоли Kк-ты = —————— [HA] Ск-ты [H+] Kк-ты · Ск-ты = ————— Ссоли р. Н = р. Kк-ты Ссоли + lg —— Ск-ты 11
 1. Слабое основание и его соль с сильной кислотой BOH + BA BA B+ + A– BOH B+ + OH– 30% Диссоциация слабого основания подавляется за счет [B+] соли, поэтому: [BOH] = Cосн [B+] = Ссоли 12
1. Слабое основание и его соль с сильной кислотой BOH + BA BA B+ + A– BOH B+ + OH– 30% Диссоциация слабого основания подавляется за счет [B+] соли, поэтому: [BOH] = Cосн [B+] = Ссоли 12
![[B+] · [OH– ] Ссоли · [OH– ] Kосн = —————— [BOH] Сосн Kосн [B+] · [OH– ] Ссоли · [OH– ] Kосн = —————— [BOH] Сосн Kосн](https://present5.com/presentation/106263550_425153937/image-13.jpg) [B+] · [OH– ] Ссоли · [OH– ] Kосн = —————— [BOH] Сосн Kосн · Сосн [OH– ] = ————— Ссоли р. OН = р. Kосн Ссоли + lg —— Сосн Ссоли р. Н = 14 – р. Kосн – lg —— Сосн 13
[B+] · [OH– ] Ссоли · [OH– ] Kосн = —————— [BOH] Сосн Kосн · Сосн [OH– ] = ————— Ссоли р. OН = р. Kосн Ссоли + lg —— Сосн Ссоли р. Н = 14 – р. Kосн – lg —— Сосн 13
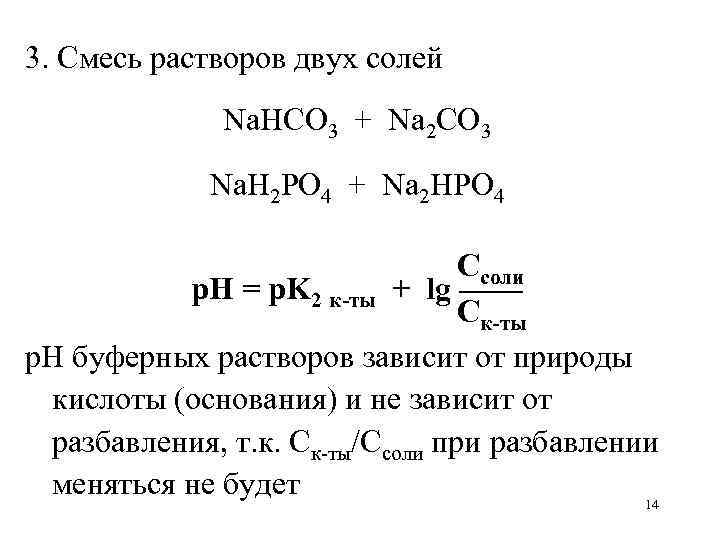 3. Смесь растворов двух солей Na. HCO 3 + Na 2 CO 3 Na. H 2 PO 4 + Na 2 HPO 4 Ссоли р. Н = р. K 2 к-ты + lg —— Ск-ты р. Н буферных растворов зависит от природы кислоты (основания) и не зависит от разбавления, т. к. Ск-ты/Ссоли при разбавлении меняться не будет 14
3. Смесь растворов двух солей Na. HCO 3 + Na 2 CO 3 Na. H 2 PO 4 + Na 2 HPO 4 Ссоли р. Н = р. K 2 к-ты + lg —— Ск-ты р. Н буферных растворов зависит от природы кислоты (основания) и не зависит от разбавления, т. к. Ск-ты/Ссоли при разбавлении меняться не будет 14
 К 25 мл 0, 2 М раствора однозамещенного фосфата калия добавлено 15 мл 0, 1 М раствора двузамещенного фосфата калия. Вычислите р. Н раствора. Решение. 1 способ: расчет с учетом разведения Na. H 2 PO 4 + Na 2 HPO 4 15 · 0, 1 Ссоли = ———— 40 25 · 0, 2 Ссоли = ———— 40 15
К 25 мл 0, 2 М раствора однозамещенного фосфата калия добавлено 15 мл 0, 1 М раствора двузамещенного фосфата калия. Вычислите р. Н раствора. Решение. 1 способ: расчет с учетом разведения Na. H 2 PO 4 + Na 2 HPO 4 15 · 0, 1 Ссоли = ———— 40 25 · 0, 2 Ссоли = ———— 40 15
 р. Н = р. K 2 к-ты Ссоли + lg —— Ск-ты р. K 2 к-ты = 7, 2 15 · 0, 1 40 р. Н = 7, 2 + lg ——— · ——— = 6, 68 40 25 · 0, 2 2 способ: расчет через количество вещества (м. Моль )= C · V(мл) (Моль) = C · V(л) 16
р. Н = р. K 2 к-ты Ссоли + lg —— Ск-ты р. K 2 к-ты = 7, 2 15 · 0, 1 40 р. Н = 7, 2 + lg ——— · ——— = 6, 68 40 25 · 0, 2 2 способ: расчет через количество вещества (м. Моль )= C · V(мл) (Моль) = C · V(л) 16
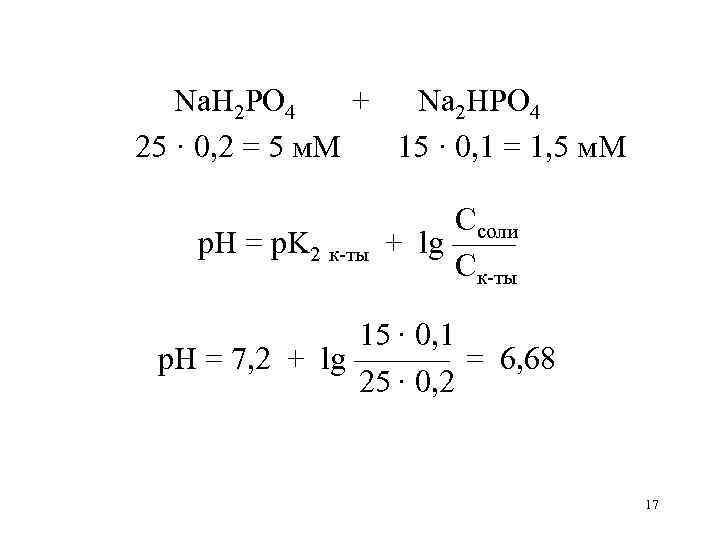 Na. H 2 PO 4 + Na 2 HPO 4 25 · 0, 2 = 5 м. М 15 · 0, 1 = 1, 5 м. М р. Н = р. K 2 к-ты Ссоли + lg —— Ск-ты 15 · 0, 1 р. Н = 7, 2 + lg ——— = 6, 68 25 · 0, 2 17
Na. H 2 PO 4 + Na 2 HPO 4 25 · 0, 2 = 5 м. М 15 · 0, 1 = 1, 5 м. М р. Н = р. K 2 к-ты Ссоли + lg —— Ск-ты 15 · 0, 1 р. Н = 7, 2 + lg ——— = 6, 68 25 · 0, 2 17
 Смешали 10 мл 0, 3 М раствора HCl и 20 мл 0, 2 М раствора NH 4 OH. Вычислите р. Н полученного раствора. NH 4 OH + HCl NH 4 Cl + H 2 O (NH 4 OH) = 20 · 0, 2 = 4 м. М (HCl) = 10 · 0, 3 = 3 м. М /Т. к. реагируют 1: 1, в избытке остается аммиак/ 3 м. М HCl и 3 м. М NH 4 OH вступают в реакцию с образованием 3 м. М NH 4 Cl и остается 1 м. М NH 4 OH В растворе слабое основание и его соль – буферный раствор 18
Смешали 10 мл 0, 3 М раствора HCl и 20 мл 0, 2 М раствора NH 4 OH. Вычислите р. Н полученного раствора. NH 4 OH + HCl NH 4 Cl + H 2 O (NH 4 OH) = 20 · 0, 2 = 4 м. М (HCl) = 10 · 0, 3 = 3 м. М /Т. к. реагируют 1: 1, в избытке остается аммиак/ 3 м. М HCl и 3 м. М NH 4 OH вступают в реакцию с образованием 3 м. М NH 4 Cl и остается 1 м. М NH 4 OH В растворе слабое основание и его соль – буферный раствор 18
 (NH 4 OH) = 4 – 3 = 1 м. М (NH 4 Cl) = 3 м. М Ссоли р. Н = 14 – р. Kосн – lg —— Сосн Из таблицы p. Kосн = 4, 75 3 р. Н = 14 – 4, 75 – lg —— = 8, 7 1 19
(NH 4 OH) = 4 – 3 = 1 м. М (NH 4 Cl) = 3 м. М Ссоли р. Н = 14 – р. Kосн – lg —— Сосн Из таблицы p. Kосн = 4, 75 3 р. Н = 14 – 4, 75 – lg —— = 8, 7 1 19
 К 50 мл 0, 1 М раствора формиата калия прилито 20 мл 0, 05 М раствора HCl. Вычислите р. Н раствора. (p. Kк-ты = 3, 75) HCOOK + HCl HCOOH + KCl 50· 0, 1=5 20· 0, 05=1 1 5– 1=4 Ссоли р. Н = р. Kк-ты + lg ——— Ск-ты 4 р. Н = 3, 75 + lg —— = 4, 35 1 20
К 50 мл 0, 1 М раствора формиата калия прилито 20 мл 0, 05 М раствора HCl. Вычислите р. Н раствора. (p. Kк-ты = 3, 75) HCOOK + HCl HCOOH + KCl 50· 0, 1=5 20· 0, 05=1 1 5– 1=4 Ссоли р. Н = р. Kк-ты + lg ——— Ск-ты 4 р. Н = 3, 75 + lg —— = 4, 35 1 20
 К 30 мл 0, 2 М раствора муравьиной кислоты прилито 20 мл 0, 1 М раствора Na. OH. Вычислите р. Н раствора. (p. Kк-ты = 3, 75) HCOOH 30· 0, 2=6 6– 2=4 + Na. OH HCOONa + H 2 O 20· 0, 1=2 2 Ссоли р. Н = р. Kк-ты + lg ——— Ск-ты 2 р. Н = 3, 75 + lg —— = 3, 45 4 21
К 30 мл 0, 2 М раствора муравьиной кислоты прилито 20 мл 0, 1 М раствора Na. OH. Вычислите р. Н раствора. (p. Kк-ты = 3, 75) HCOOH 30· 0, 2=6 6– 2=4 + Na. OH HCOONa + H 2 O 20· 0, 1=2 2 Ссоли р. Н = р. Kк-ты + lg ——— Ск-ты 2 р. Н = 3, 75 + lg —— = 3, 45 4 21
 Сколько мл 0, 2 М раствора Na. OH надо добавить к 20 мл 0, 2 М раствора уксусной кислоты, чтобы получить буферный раствор с р. Н = 4, 3? (p. Kк-ты = 4, 75) Обозначим V(Na. OH) = x CH 3 COOH + Na. OH CH 3 COONa + H 2 O 20· 0, 2=4 4– 0, 2 x 0, 2·x=0, 2 x 22
Сколько мл 0, 2 М раствора Na. OH надо добавить к 20 мл 0, 2 М раствора уксусной кислоты, чтобы получить буферный раствор с р. Н = 4, 3? (p. Kк-ты = 4, 75) Обозначим V(Na. OH) = x CH 3 COOH + Na. OH CH 3 COONa + H 2 O 20· 0, 2=4 4– 0, 2 x 0, 2·x=0, 2 x 22
 р. Н = р. Kк-ты Ссоли + lg ——— Ск-ты 0, 2 x 4, 3 = 4, 75 + lg ———— 4 – 0, 2 x x = 5, 3 (мл) 23
р. Н = р. Kк-ты Ссоли + lg ——— Ск-ты 0, 2 x 4, 3 = 4, 75 + lg ———— 4 – 0, 2 x x = 5, 3 (мл) 23
 Сколько г ацетата натрия надо добавить к 200 мл 0, 2 М раствора HCl, чтобы получить буферный раствор с р. Н = 4, 5? Пусть V = const Обозначим (CH 3 COONa) = х CH 3 COONa + HCl CH 3 COOH + Na. Cl х х – 40 200· 0, 2=40 40 24
Сколько г ацетата натрия надо добавить к 200 мл 0, 2 М раствора HCl, чтобы получить буферный раствор с р. Н = 4, 5? Пусть V = const Обозначим (CH 3 COONa) = х CH 3 COONa + HCl CH 3 COOH + Na. Cl х х – 40 200· 0, 2=40 40 24
 р. Н = р. Kк-ты Ссоли + lg ——— Ск-ты х – 40 4, 5 = 4, 75 + lg ——— 40 x = 62, 4 (м. М) = 62, 4· 10– 3 (М) m = · M = 62, 4· 10– 3 · 82 = 5, 12 (г) 25
р. Н = р. Kк-ты Ссоли + lg ——— Ск-ты х – 40 4, 5 = 4, 75 + lg ——— 40 x = 62, 4 (м. М) = 62, 4· 10– 3 (М) m = · M = 62, 4· 10– 3 · 82 = 5, 12 (г) 25
 К 20 мл 0, 2 М раствора K 2 HPO 4 добавлено 10 мл 0, 25 М раствора HCl. Вычислите р. Н полученного раствора. K 2 HPO 4 + HCl KH 2 PO 4 + KCl 20· 0, 2=4 10· 0, 25=2, 5 4– 2, 5=1, 5 р. Н = р. K 2 к-ты Ссоли + lg —— Ск-ты 1, 5 р. Н = 7, 2 + lg ——— = 6, 99 2, 5 26
К 20 мл 0, 2 М раствора K 2 HPO 4 добавлено 10 мл 0, 25 М раствора HCl. Вычислите р. Н полученного раствора. K 2 HPO 4 + HCl KH 2 PO 4 + KCl 20· 0, 2=4 10· 0, 25=2, 5 4– 2, 5=1, 5 р. Н = р. K 2 к-ты Ссоли + lg —— Ск-ты 1, 5 р. Н = 7, 2 + lg ——— = 6, 99 2, 5 26
 Буферная емкость – способность буферного раствора противодействовать изменению р. Н раствора при добавлении в него небольших количеств сильной кислоты или сильного основания. Количественно буферная емкость определяется числом молей эквивалентов сильной кислоты или сильного основания, которые необходимо добавить к 1 л буферного раствора, чтобы изменить его р. Н на единицу. 27
Буферная емкость – способность буферного раствора противодействовать изменению р. Н раствора при добавлении в него небольших количеств сильной кислоты или сильного основания. Количественно буферная емкость определяется числом молей эквивалентов сильной кислоты или сильного основания, которые необходимо добавить к 1 л буферного раствора, чтобы изменить его р. Н на единицу. 27
 Буферная емкость - b = ——— p. H b – прирост концентрации сильной кислоты или сильного основания, вызвавший изменение p. H 28
Буферная емкость - b = ——— p. H b – прирост концентрации сильной кислоты или сильного основания, вызвавший изменение p. H 28
 Расчетные формулы буферной емкости 1. Слабая кислота и ее соль с сильным основанием: Собщ·Kк-ты = 2, 3·[H+] —————— , где (Kк-ты + [H+])2 Собщ – суммарная концентрация слабой кислоты и ее соли в растворе Собщ = [A–] + [HA] 29
Расчетные формулы буферной емкости 1. Слабая кислота и ее соль с сильным основанием: Собщ·Kк-ты = 2, 3·[H+] —————— , где (Kк-ты + [H+])2 Собщ – суммарная концентрация слабой кислоты и ее соли в растворе Собщ = [A–] + [HA] 29
![2. Слабое основание и его соль с сильной кислотой: Собщ·Kсопр. к-ты = 2, 3·[H+] 2. Слабое основание и его соль с сильной кислотой: Собщ·Kсопр. к-ты = 2, 3·[H+]](https://present5.com/presentation/106263550_425153937/image-30.jpg) 2. Слабое основание и его соль с сильной кислотой: Собщ·Kсопр. к-ты = 2, 3·[H+] ———— , где (Kсопр. к-ты + [H+])2 B основание + H+ BH+ сопряженная кислота 30
2. Слабое основание и его соль с сильной кислотой: Собщ·Kсопр. к-ты = 2, 3·[H+] ———— , где (Kсопр. к-ты + [H+])2 B основание + H+ BH+ сопряженная кислота 30
 Факторы, влияющие на буферную емкость: 1. Концентрация компонентов буферной смеси 2. Соотношение концентраций компонентов буферной смеси 31
Факторы, влияющие на буферную емкость: 1. Концентрация компонентов буферной смеси 2. Соотношение концентраций компонентов буферной смеси 31
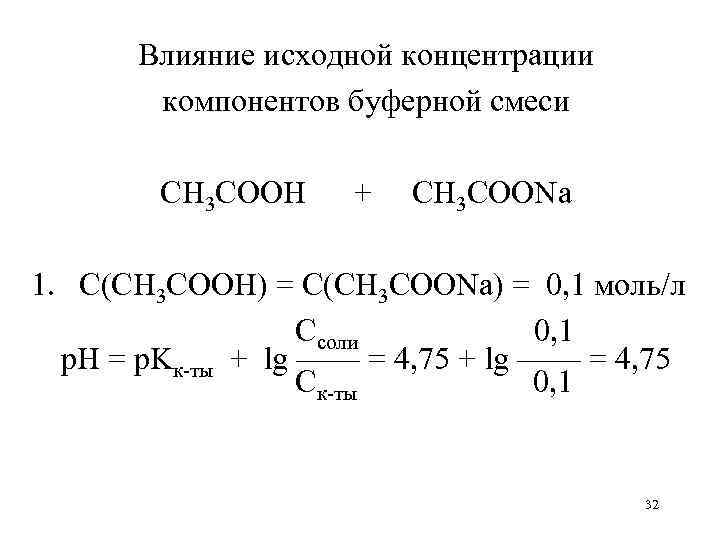 Влияние исходной концентрации компонентов буферной смеси CH 3 COOH + CH 3 COONa 1. С(CH 3 COOH) = С(CH 3 COONa) = 0, 1 моль/л Ссоли 0, 1 р. Н = р. Kк-ты + lg —— = 4, 75 Ск-ты 0, 1 32
Влияние исходной концентрации компонентов буферной смеси CH 3 COOH + CH 3 COONa 1. С(CH 3 COOH) = С(CH 3 COONa) = 0, 1 моль/л Ссоли 0, 1 р. Н = р. Kк-ты + lg —— = 4, 75 Ск-ты 0, 1 32
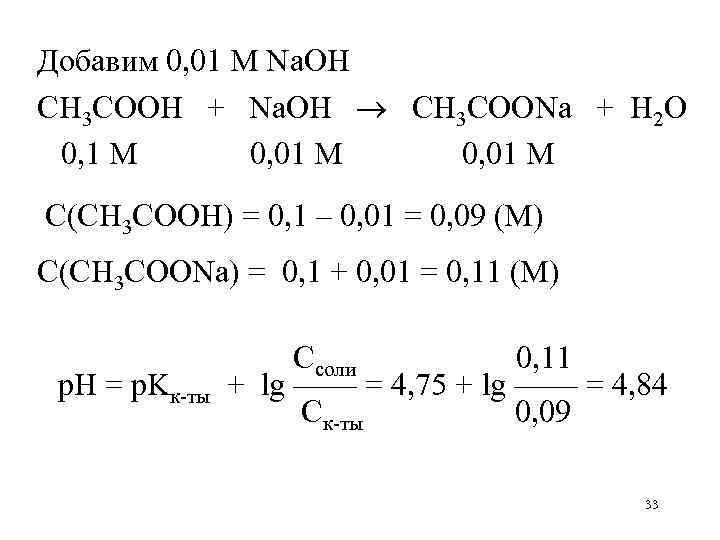 Добавим 0, 01 М Na. OH CH 3 COOH + Na. OH CH 3 COONa + H 2 O 0, 1 М 0, 01 М С(CH 3 COOH) = 0, 1 – 0, 01 = 0, 09 (М) С(CH 3 COONa) = 0, 1 + 0, 01 = 0, 11 (М) р. Н = р. Kк-ты Ссоли 0, 11 + lg —— = 4, 75 + lg —— = 4, 84 Ск-ты 0, 09 33
Добавим 0, 01 М Na. OH CH 3 COOH + Na. OH CH 3 COONa + H 2 O 0, 1 М 0, 01 М С(CH 3 COOH) = 0, 1 – 0, 01 = 0, 09 (М) С(CH 3 COONa) = 0, 1 + 0, 01 = 0, 11 (М) р. Н = р. Kк-ты Ссоли 0, 11 + lg —— = 4, 75 + lg —— = 4, 84 Ск-ты 0, 09 33
 Добавим 0, 01 М HCl CH 3 COONa 0, 1 М + HCl 0, 01 М CH 3 COOH + Na. Cl 0, 01 М С(CH 3 COOH) = 0, 1 + 0, 01 = 0, 11 (М) С(CH 3 COONa) = 0, 1 – 0, 01 = 0, 09 (М) р. Н = р. Kк-ты Ссоли 0, 09 + lg —— = 4, 75 + lg —— = 4, 66 Ск-ты 0, 11 34
Добавим 0, 01 М HCl CH 3 COONa 0, 1 М + HCl 0, 01 М CH 3 COOH + Na. Cl 0, 01 М С(CH 3 COOH) = 0, 1 + 0, 01 = 0, 11 (М) С(CH 3 COONa) = 0, 1 – 0, 01 = 0, 09 (М) р. Н = р. Kк-ты Ссоли 0, 09 + lg —— = 4, 75 + lg —— = 4, 66 Ск-ты 0, 11 34
 Таким образом: p. Hисх = 4, 75 + 0, 01 М Na. OH p. H = 4, 84 + 0, 01 М HCl p. H = 4, 66 p. H изменяется в пределах 0, 1 35
Таким образом: p. Hисх = 4, 75 + 0, 01 М Na. OH p. H = 4, 84 + 0, 01 М HCl p. H = 4, 66 p. H изменяется в пределах 0, 1 35
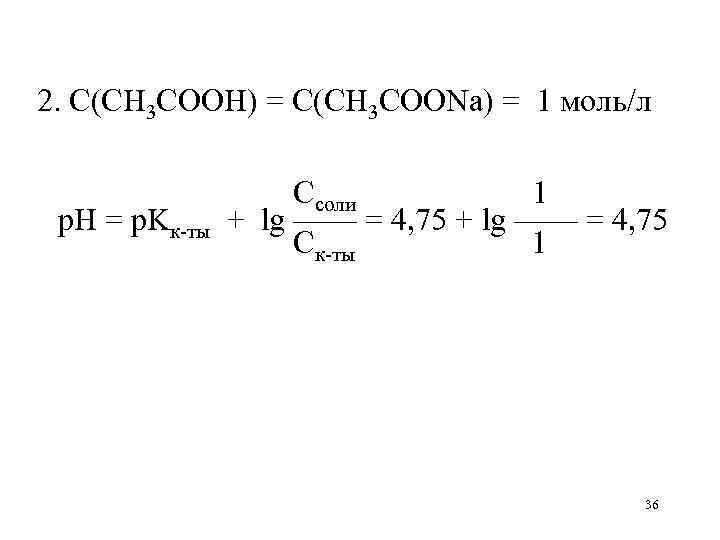 2. С(CH 3 COOH) = С(CH 3 COONa) = 1 моль/л р. Н = р. Kк-ты Ссоли 1 + lg —— = 4, 75 Ск-ты 1 36
2. С(CH 3 COOH) = С(CH 3 COONa) = 1 моль/л р. Н = р. Kк-ты Ссоли 1 + lg —— = 4, 75 Ск-ты 1 36
 Добавим 0, 01 М Na. OH CH 3 COOH + Na. OH CH 3 COONa + H 2 O 1 М 0, 01 М С(CH 3 COOH) = 1 – 0, 01 = 0, 99 (М) С(CH 3 COONa) = 1 + 0, 01 = 1, 01 (М) р. Н = р. Kк-ты Ссоли 1, 01 + lg —— = 4, 75 + lg —— = 4, 76 Ск-ты 0, 99 37
Добавим 0, 01 М Na. OH CH 3 COOH + Na. OH CH 3 COONa + H 2 O 1 М 0, 01 М С(CH 3 COOH) = 1 – 0, 01 = 0, 99 (М) С(CH 3 COONa) = 1 + 0, 01 = 1, 01 (М) р. Н = р. Kк-ты Ссоли 1, 01 + lg —— = 4, 75 + lg —— = 4, 76 Ск-ты 0, 99 37
 Добавим 0, 01 М HCl CH 3 COONa 1 М + HCl 0, 01 М CH 3 COOH + Na. Cl 0, 01 М С(CH 3 COOH) = 1 + 0, 01 = 1, 01 (М) С(CH 3 COONa) = 1 – 0, 01 = 0, 99 (М) р. Н = р. Kк-ты Ссоли 0, 99 + lg —— = 4, 75 + lg —— = 4, 74 Ск-ты 1, 01 38
Добавим 0, 01 М HCl CH 3 COONa 1 М + HCl 0, 01 М CH 3 COOH + Na. Cl 0, 01 М С(CH 3 COOH) = 1 + 0, 01 = 1, 01 (М) С(CH 3 COONa) = 1 – 0, 01 = 0, 99 (М) р. Н = р. Kк-ты Ссоли 0, 99 + lg —— = 4, 75 + lg —— = 4, 74 Ск-ты 1, 01 38
 p. Hисх = 4, 75 + 0, 01 М Na. OH p. H = 4, 76 + 0, 01 М HCl p. H = 4, 74 p. H изменяется в пределах 0, 01 Таким образом, чем больше концентрация компонентов буферной смеси, тем больше сопротивляющее действие буферного раствора 39
p. Hисх = 4, 75 + 0, 01 М Na. OH p. H = 4, 76 + 0, 01 М HCl p. H = 4, 74 p. H изменяется в пределах 0, 01 Таким образом, чем больше концентрация компонентов буферной смеси, тем больше сопротивляющее действие буферного раствора 39
![Влияние соотношения концентраций компонентов буферной смеси [HA] = C моль/л HA + Na. OH Влияние соотношения концентраций компонентов буферной смеси [HA] = C моль/л HA + Na. OH](https://present5.com/presentation/106263550_425153937/image-40.jpg) Влияние соотношения концентраций компонентов буферной смеси [HA] = C моль/л HA + Na. OH Na. A + H 2 O C - 0, 001 C = 0, 999 C Доб-но щелочи моль/л 0, 001 конц. к-ты [HA] конц. соли [A–] —— [HA] [A–] lg—— [HA] p. H 0, 999 C 0, 001 C 10– 3 b —— p. H p. K– 3 40
Влияние соотношения концентраций компонентов буферной смеси [HA] = C моль/л HA + Na. OH Na. A + H 2 O C - 0, 001 C = 0, 999 C Доб-но щелочи моль/л 0, 001 конц. к-ты [HA] конц. соли [A–] —— [HA] [A–] lg—— [HA] p. H 0, 999 C 0, 001 C 10– 3 b —— p. H p. K– 3 40
![Доб-но щелочи моль/л 0, 001 конц. к-ты [HA] конц. соли [A–] 0, 999 C Доб-но щелочи моль/л 0, 001 конц. к-ты [HA] конц. соли [A–] 0, 999 C](https://present5.com/presentation/106263550_425153937/image-41.jpg) Доб-но щелочи моль/л 0, 001 конц. к-ты [HA] конц. соли [A–] 0, 999 C 0, 001 C [A–] —— [HA] [A–] lg—— [HA] p. H 10– 3 p. K– 3 0, 01 0, 99 C 0, 01 C 10– 2 p. K– 2 0, 1 0, 9 C 0, 1 C 10– 1 p. K– 1 0, 5 C 1 0 p. K 0, 9 0, 1 C 0, 9 C 101 1 p. K+1 0, 99 0, 01 C 0, 99 C 102 2 p. K+2 0, 999 0, 001 C 103 3 p. K+3 0, 999 C b —— p. H 0, 009 C 0, 4 C 0, 09 C 0, 009 C 41
Доб-но щелочи моль/л 0, 001 конц. к-ты [HA] конц. соли [A–] 0, 999 C 0, 001 C [A–] —— [HA] [A–] lg—— [HA] p. H 10– 3 p. K– 3 0, 01 0, 99 C 0, 01 C 10– 2 p. K– 2 0, 1 0, 9 C 0, 1 C 10– 1 p. K– 1 0, 5 C 1 0 p. K 0, 9 0, 1 C 0, 9 C 101 1 p. K+1 0, 99 0, 01 C 0, 99 C 102 2 p. K+2 0, 999 0, 001 C 103 3 p. K+3 0, 999 C b —— p. H 0, 009 C 0, 4 C 0, 09 C 0, 009 C 41
![Доб-но щелочи моль/л 0, 001 0, 01 конц. к-ты [HA] конц. соли [A–] 0, Доб-но щелочи моль/л 0, 001 0, 01 конц. к-ты [HA] конц. соли [A–] 0,](https://present5.com/presentation/106263550_425153937/image-42.jpg) Доб-но щелочи моль/л 0, 001 0, 01 конц. к-ты [HA] конц. соли [A–] 0, 999 C 0, 001 C 0, 99 C 0, 01 C [A–] —— [HA] [A–] lg—— [HA] p. H 10– 3 p. K– 3 10– 2 p. K– 2 b —— p. H 0, 009 C b = |0, 999 C – 0, 99 C| = 0, 009 C b = |0, 001 C – 0, 01 C| = 0, 009 C p. H = |(p. K– 3) – (p. K– 2)| = 1 42
Доб-но щелочи моль/л 0, 001 0, 01 конц. к-ты [HA] конц. соли [A–] 0, 999 C 0, 001 C 0, 99 C 0, 01 C [A–] —— [HA] [A–] lg—— [HA] p. H 10– 3 p. K– 3 10– 2 p. K– 2 b —— p. H 0, 009 C b = |0, 999 C – 0, 99 C| = 0, 009 C b = |0, 001 C – 0, 01 C| = 0, 009 C p. H = |(p. K– 3) – (p. K– 2)| = 1 42
![Максимальная буферная емкость при [A–]=[HA] 43 Максимальная буферная емкость при [A–]=[HA] 43](https://present5.com/presentation/106263550_425153937/image-43.jpg) Максимальная буферная емкость при [A–]=[HA] 43
Максимальная буферная емкость при [A–]=[HA] 43
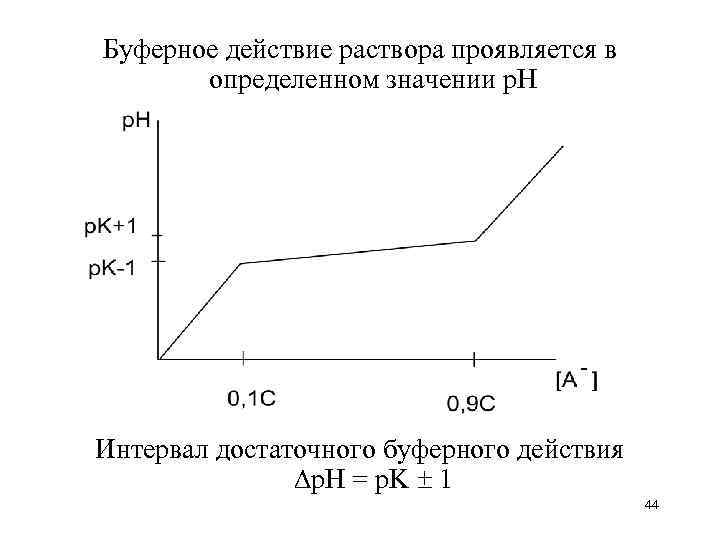 Буферное действие раствора проявляется в определенном значении р. Н Интервал достаточного буферного действия р. Н = p. K 1 44
Буферное действие раствора проявляется в определенном значении р. Н Интервал достаточного буферного действия р. Н = p. K 1 44
 р. К(CH 3 COOH) = 4, 75 р. К(KH 2 PO 4) = 7, 2 р. К(HCOOH) = 3, 75 p. H= 3, 75— 5, 75 p. H= 6, 2— 8, 2 p. H= 2, 75— 4, 75 Если необходимо поддерживать р. Н=5 p. H=7 45
р. К(CH 3 COOH) = 4, 75 р. К(KH 2 PO 4) = 7, 2 р. К(HCOOH) = 3, 75 p. H= 3, 75— 5, 75 p. H= 6, 2— 8, 2 p. H= 2, 75— 4, 75 Если необходимо поддерживать р. Н=5 p. H=7 45
 Вычислить буферную емкость раствора, состоящего из 1, 14 М раствора CH 3 COOH и 0, 205 М раствора CH 3 COONa, р. Н=4. Собщ·Kк-ты = 2, 3·[H+] —————— (Kк-ты + [H+])2 Собщ= Ссоли + Ск-ты = 1, 14 + 0, 205 = 1, 345 (М) Кк-ты = 1, 74· 10– 5 р. Н=4 [H+] = 10– 4 моль/л 46
Вычислить буферную емкость раствора, состоящего из 1, 14 М раствора CH 3 COOH и 0, 205 М раствора CH 3 COONa, р. Н=4. Собщ·Kк-ты = 2, 3·[H+] —————— (Kк-ты + [H+])2 Собщ= Ссоли + Ск-ты = 1, 14 + 0, 205 = 1, 345 (М) Кк-ты = 1, 74· 10– 5 р. Н=4 [H+] = 10– 4 моль/л 46
 1, 345 · 1, 74· 10– 5 = 2, 3· 10– 4 ——————— = 0, 39 (1, 74· 10– 5 + 10– 4)2 Это значит, что для изменения р. Н на 1 необходимо добавить 0, 39 М сильной кислоты или щелочи 47
1, 345 · 1, 74· 10– 5 = 2, 3· 10– 4 ——————— = 0, 39 (1, 74· 10– 5 + 10– 4)2 Это значит, что для изменения р. Н на 1 необходимо добавить 0, 39 М сильной кислоты или щелочи 47
 Буферный раствор, приготовленный из раствора аммиака и хлорида аммония, имеет р. Н=10. Вычислите буферную емкость этого раствора, если Собщ = 0, 336 М. р. Косн = 4, 75 р. Ксопр. к-ты = 14 – 4, 75 = 9, 25 Ксопр. к-ты = 10– 9, 25 р. Н = 10 [H+] = 10– 10 моль/л 48
Буферный раствор, приготовленный из раствора аммиака и хлорида аммония, имеет р. Н=10. Вычислите буферную емкость этого раствора, если Собщ = 0, 336 М. р. Косн = 4, 75 р. Ксопр. к-ты = 14 – 4, 75 = 9, 25 Ксопр. к-ты = 10– 9, 25 р. Н = 10 [H+] = 10– 10 моль/л 48
 Тогда 0, 336 · 10– 9, 25 = 2, 3· 10– 10 ——————— = 0, 66 (10– 9, 25 + 10– 10)2 49
Тогда 0, 336 · 10– 9, 25 = 2, 3· 10– 10 ——————— = 0, 66 (10– 9, 25 + 10– 10)2 49


