презентация Растворы СГТУ .ppt
- Количество слайдов: 48

Растворы «Вода стоит особняком в истории нашей планеты. Нет природного тела, которое могло бы сравниться с ней По влиянию на ход основных самых грандиозных процессов. » В. И. Вернадский.

Роль растворов в природе. ¾ земного шара занимает вода 97% воды приходится на океаны и моря 3% на озёра, реки, подземные воды животные организмы содержат до 70% плоды огурца, арбуза содержат 90% массы тела человека содержит 65% 2

n Гомогенные смеси веществ переменного состава называются растворами. n Компонент раствора, концентрация которого выше других компонентов, является растворителем. n Растворитель сохраняет свое фазовое состояние при образовании раствора. n Различают газовые, жидкие и твердые растворы. 3
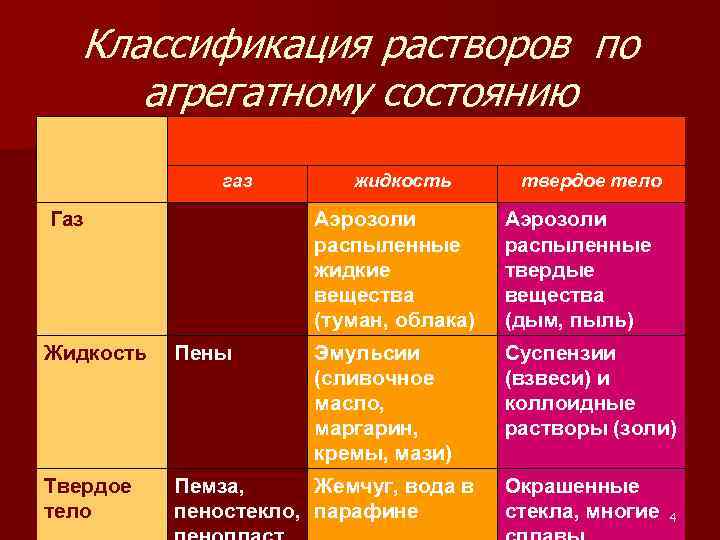
Классификация растворов по агрегатному состоянию газ Газ жидкость твердое тело Аэрозоли распыленные жидкие вещества (туман, облака) Аэрозоли распыленные твердые вещества (дым, пыль) Эмульсии (сливочное масло, маргарин, кремы, мази) Суспензии (взвеси) и коллоидные растворы (золи) Жидкость Пены Твердое тело Пемза, Жемчуг, вода в пеностекло, парафине Окрашенные стекла, многие 4

ИСТИННЫЕ РАСТВОРЫ n Растворы – это гомогенные (однофазные) системы переменного состава, состоящие из двух или более веществ (компонентов). 5

n Растворимость для различных веществ колеблется в значительных пределах и зависит от их природы, взаимодействия частиц растворенного вещества между собой и с молекулами растворителя, а также от внешних условий (давления, температуры и т. д. ) 6

КОНЦЕНТРАЦИИ РАСТВОРОВ К безразмерным концентрациям (долям) относятся следующие концентрации: 1. Массовая доля растворенного вещества W(B) выражается в долях единицы или в процентах: где m(B) и m(A) – масса растворенного вещества B 7 и масса растворителя A.

2. Объемная доля растворенного вещества σ(B) выражается в долях единицы или объемных процентах: n (доли) или % n где Vi – объем компонента раствора, V(B) – объем растворенного вещества B. Объемные проценты называют градусами. Иногда объемная концентрация выражается в тысячных долях (промилле, ‰) или в миллионных долях (млн– 1), ppm. 8

3. Мольная доля растворенного вещества χ(B) выражается соотношением: n Сумма мольных долей компонентов раствора равна единице. 9

К размерным концентрациям относятся следующие концентрации: Молярная концентрация 1. Молярная концентрация или молярность (См ) показывает число моль растворимого вещества в 1 л раствора (М) моль/л: 1 М раствор Н 2 SO 4 содержит 98 г/моль кислоты в 1 л раствора 10

2. Эквивалентная концентрация или нормальность (N) Эквивалентная концентрация или нормальность (N или Сн ) показывает количество эквивалентных масс растворенного вещества в 1 л раствора , моль/л: 1 н раствор Н 2 SO 4 содержит 49 г/моль кислоты в 1 л раствора 11

3. Титр (Т) n Титр (Т) показывает число грамм растворенного вещества в 1 мл или в 1 см 3 раствора 12

4. Моляльная концентрация или моляльность (Сm ) показывает число моль растворимого вещества в 1 кг или 1000 г раствора моль/кг: 13

Задача 1. Определить M, N, T и ω раствора, содержащего 18 г H 3 PO 4 в 300 г H 2 O (ρ Н 3 РО 4 =1, 031 г/см 3). Решение: 1)Найдем массовую долю растворенного вещества: 2) Найдем массу 1 л раствора (Н 3 РО 4): m =1000 · ρ = 1000 · 1, 031 = 1031 г 14

3) Нейдем массу растворенного вещества в 1 л раствора г 4) М (Н 3 РО 4) = 3 + 31 + 64 = 98 г/моль mэ(Н 3 РО 4) =32, 7 г/моль 5) Молярность: См = моль/л 15

6) Нормальность: моль/л n n 7) Титр: Т = г/мл 16

Задача 2: Какой объем 98% Н 2 SO 4 c ρ= 1, 84 г/см 3 потребуется для приготовления 2 л 0, 4 н раствора. 17

Гидраты и кристаллогидраты Установлено, что в водном растворе происходит образование гидратов (для неводных растворов – сольватов), которые являются сравнительно непрочными соединениями растворенных частиц и растворителя. n В зависимости от природы растворенного вещества, сольваты могут образовываться различными путями n 18

n 1) При растворении веществ с полным типом связи между молекул растворителя и ионами растворенного вещества возникают ион дипольное взаимодействие 19

n 2) Между ионами растворенного вещества и молекулами растворителя возможно и донорно акцепторное взаимодействие, если молекулы растворителя обладают неподеленными парами электронов (H 2 O, NH 3). Ионы растворенного вещества выступают в качестве акцепторов. Образуются комплексные соединения аквакомплексы – если растворитель Н 2 О, аммиакаты – если растворителем является NH 3 20

n 3) При растворении веществ с полярно ковалентным типом связи сольваты образуются за счет дипольного взаимодействия. 21

n n n Гидраты в большинстве случаев – нестойкие соединения, разлагающиеся при нагревании. При этом некоторые гидраты настолько прочны, что молекулы воды входят в состав его кристаллов. Такие вещества называют кристаллогидратами, а вода, содержащаяся в них, называется кристаллизационной. Пример: Cu. SO 4 · 5 H 2 O – медный купорос Na 2 SO 4 · 10 H 2 O – глауберова соль Ca. SO 4 · 2 H 2 O – гипс 22

Растворимость твердых веществ в жидкости Растворимость – количество растворимого вещества в граммах способное растворится при данной температуре в 100 г растворителя. Если растворяется: n > 10 г в 100 г Н 2 О – хорошо растворяется (Р), n < 1 г – малорастворимо (М), n < 0, 01 г нерастворимо (Н) n Процесс растворения сопровождается тепловым эффектом. 23

n Если энергия, которую надо затратить на разрушение кристаллической решетки твердого тела, больше энергии сольватации, то процесс растворения протекает с поглощением теплоты. (С повышением температуры растворимость усиливается. ), n если меньше энергии сольватации, то процесс растворения протекает с выделением теплоты. (С повышением температуры растворимость уменьшается. ) 24
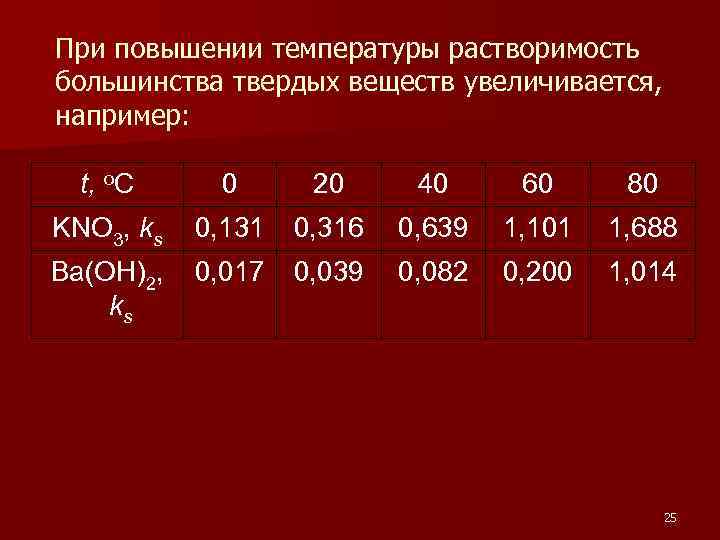
При повышении температуры растворимость большинства твердых веществ увеличивается, например: t, o. C 0 20 40 60 80 KNO 3, ks 0, 131 0, 316 0, 639 1, 101 1, 688 Ba(OH)2, ks 0, 017 0, 039 0, 082 0, 200 1, 014 25

Встречаются твердые вещества, растворимость которых уменьшается при повышении температуры: 0 10 20 30 40 60 80 t, o. C Li 2 CO 3, 0, 154 0, 143 0, 133 0, 125 0, 117 0, 101 0, 087 ks Li 2 SO 4, ks 0, 353 0, 350 0, 342 0, 335 0, 328 0, 319 0, 307 26

Т. к. объем системы при растворении меняется незначительно, то давление на этот процесс не оказывает существенного влияния. n Способность твердого вещества переходить в раствор не беспредельна. При введении в стакан с водой (Т = const) первые порции вещества полностью растворяются и образуется ненасыщенный раствор. n n 27

В таком растворе возможно растворение следующих порций до тех пор, пока вещество не перестанет переходить в раствор и часть его останется в виде осадка на дне стакана. Такой раствор называют насыщенным. n Между веществом в насыщенном растворе и веществом в осадке устанавливается состояние гетерогенного равновесия. Частицы растворенного вещества переходят через поверхность раздела из жидкой фазы (раствора) в твердую фазу (осадок) и обратно, поэтому состав насыщенного раствора остается постоянным при некоторой фиксированной температуре. n Состав насыщенного раствора может быть выражен любым известным способом (массовая доля, молярная концентрация и др. ). n коэффициент растворимости ks – отношение массы безводного растворенного вещества к массе воды: n ks = m(B) / m(воды) n 28

Растворимость жидкости в жидкости Может наблюдаться в 3 случаях: n 1. Неограниченная растворимость когда жидкости смешиваются в любых пропорциях (например: H 2 O + этанол) n 2. Ограниченная растворимость – когда жидкости смешиваются частично (например: диэтиловый эфир и H 2 O) n 3. Жидкости не смешиваются друг с другом (2 слоя). 29

Если в систему из двух несмешивающихся жидкостей внести третье вещество, способное раствориться в каждой из этих жидкостей, то вещество распределиться в каждой из этих жидкостей пропорционально своей растворимости. n Процесс называют экстракцией. n Переход экстрагируемого вещества из одного растворителя в другой происходит в результате разности концентраций и неодинаковой растворимости этого вещества в обоих растворите лях. Этот процесс происходит до тех пор, пока не наступит равновесие концентраций извлекаемого вещества в одном и другом растворителях. n 30

n Закон распределения: Вещество, способное растворятся в двух несмешивающихся растворителях, распределяется между ними так, что отношение его концентраций в этих растворителях при постоянной температуре остается постоянным независимо от общего количества растворенного вещества. n C 2 – концентрация во 2 жидкости n C 1 – концентрация в 1 жидкости n K – коэффициент распределения 31

Растворимость газов в жидкостях Растворение газов в жидкости (в частности в воде) идёт с выделением теплоты (∆H < 0) и с убылью энтропии (∆S > 0). n С повышением температуры растворимость газа уменьшается, а с увеличением давления – увеличивается. n Растворимость газов в жидкостях подчиняется закону Генри. n 32

закон Генри n при постоянной температуре давление летучего (газообразного) компонента PB прямо пропорционально его мольной доле χB: РВ = КН χB n где KH – константа Генри. Уравнение Генри соблюдается при не очень высоких давлениях и при отсутствии химического взаимодействия между газом и растворителем. 33
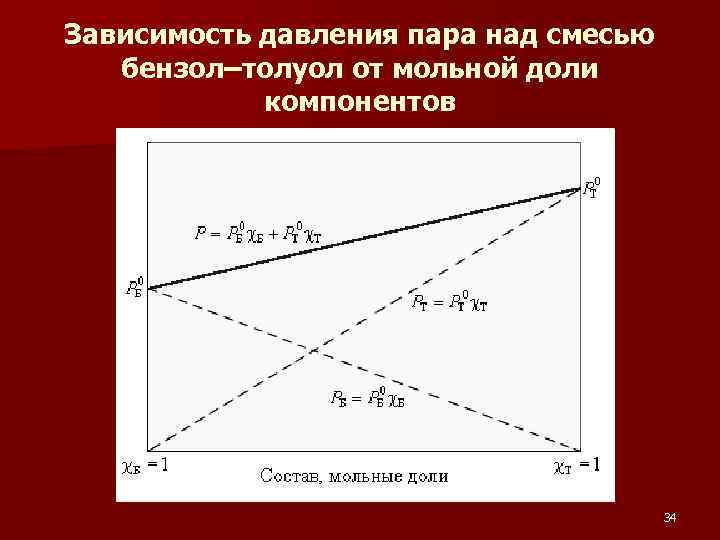
Зависимость давления пара над смесью бензол–толуол от мольной доли компонентов 34

ЗАКОНЫ РАУЛЯ n Если упругость пара растворенного вещества очень мала PB << PA, то его парциальным давлением можно пренебречь (нелетучий компонент), и тогда упругость пара над раствором будет зависеть только от парциального давления растворителя: РА = Р 0 А χА первый закон Рауля Относительное понижение парциального давления пара растворителя (Р 0 А) над раствором (РА) не зависит от природы растворённого вещества и равно его мольной доле (χА) в растворе. 35

n Отклонения от закона Рауля Растворы, компоненты которых существенно различаются по физическим и химическим свойствам, подчиняются закону Рауля лишь в области очень малых концентраций; при больших концентрациях наблюдаются отклонения от закона Рауля. n Растворы, для которых выполняется закон Рауля, называюся идеальными. n 36

n Идеальными при любых концентрациях являются растворы, компоненты которых очень близки по физическим и химическим свойствам (оптические изомеры, гомологи и т. п. ), и образование которых не сопровождается изменением объёма и выделением либо поглощением теплоты. n В этом случае силы межмолекулярного взаимодействия между однородными и разнородными частицами примерно одинаковы, и образование раствора обусловлено лишь энтропийным фактором. 37

n n n Второй закон Рауля Понижение температуры кристаллизации растворов Условием кристаллизации является равенство давления насыщенного пара растворителя над раствором давлению пара над твёрдым растворителем. Т. к. давление пара растворителя над раствором всегда ниже, чем над чистым растворителем, то это равенство всегда будет достигаться при температуре более низкой, чем температура замерзания растворителя. Так, океанская вода начинает замерзать при температуре около 2 °C. 38

Разность между температурой кристаллизации растворителя T°кр и температурой начала кристаллизации раствора Tкр. есть понижение температуры кристаллизации. n Понижение температуры кристаллизации бесконечно разбавленных растворов не зависит от природы растворённого вещества и прямо пропорционально моляльной концентрации (m) раствора. n 39

n Повышение температуры кипения растворов Жидкость кипит при той температуре, при которой общее давление насыщенного пара становится равным внешнему давлению. n Если растворённое вещество нелетуче (то есть давлением его насыщенных паров над раствором можно пренебречь), то общее давление насыщенного пара над раствором равно парциальному давлению паров растворителя. n В этом случае давление насыщенных паров над раствором при любой температуре будет меньше, чем над чистым растворителем, и равенство его внешнему давлению будет достигаться при более высокой температуре. 40

Таким образом, температура кипения раствора нелетучего вещества Tкип всегда выше, чем температура кипения чистого растворителя при том же давлении T°кип. n Повышение температуры кипения бесконечно разбавленных растворов нелетучих веществ не зависит от природы растворённого вещества и прямо пропорционально моляльной концентрации (m) раствора n 41

n n n n Коэффициенты пропорциональности: К криоскопическая const Е эбулиоскопическая const физический смысл понижения температуры кристаллизации и повышения температуры кипения раствора с концентрацией 1 моль/кг. Для воды К = 1. 86 K·кг/моль Е = 0. 52 K·кг/моль 42
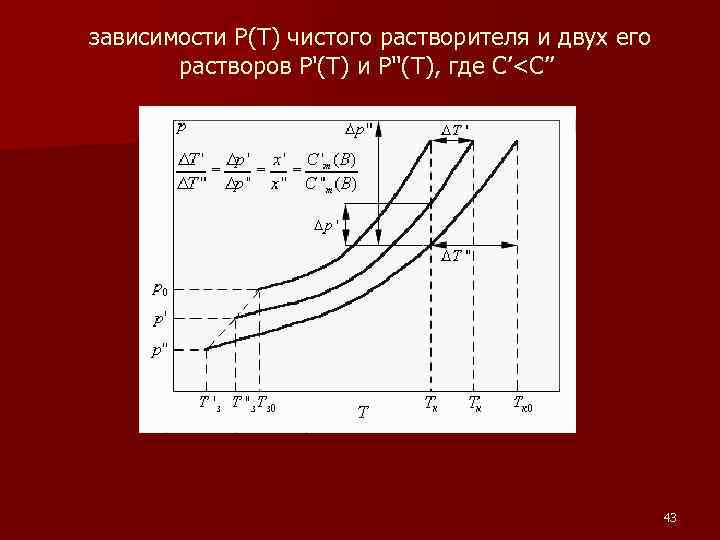
зависимости P(T) чистого растворителя и двух его растворов P'(T) и P''(T), где С’<C’’ 43

при увеличении концентрации раствора: n температуры кипения ΔTкип раствора повышается n температуры замерзания ΔTзам раствора понижается 44

ОСМОС Если создать систему из двух растворов, разделенных мембраной, через которую способны проходить только молекулы растворителя, то свойства такой системы будут определяться разностью концентраций растворителя по обе стороны мембраны. n Явление, связанное со способностью проходить через мембрану, в частности, только молекул растворителя, называется осмосом, а вызываемое им изменение давления по обе стороны мембраны – осмотическим давлением. n 45
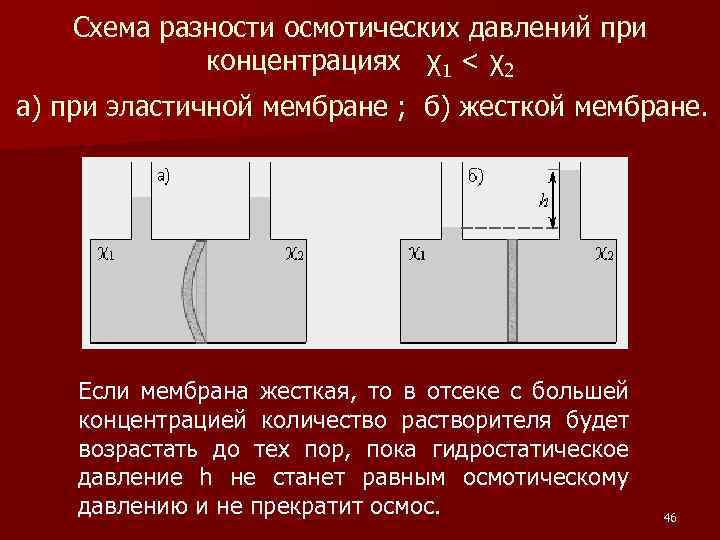
Схема разности осмотических давлений при концентрациях χ1 < χ2 а) при эластичной мембране ; б) жесткой мембране. Если мембрана жесткая, то в отсеке с большей концентрацией количество растворителя будет возрастать до тех пор, пока гидростатическое давление h не станет равным осмотическому давлению и не прекратит осмос. 46

зависимость Вант Гофф для идеального газа: n p. V = R. T n Поскольку объем (разбавление) обратно пропорционален концентрации, то закон Вант Гоффа можно записать в виде: n p =C. R. T 47

Так как объем одного моля газообразного вещества при нормальных условиях равен 22, 4 литра, то осмотическое давление раствора, содержащего 1 моль вещества, равно 22, 4 атм. (2, 27 МПа). Если растворы характеризуются одинаковыми осмотическими давлениями, то по Вант Гоффу, такие растворы называются изотоническими. 48
презентация Растворы СГТУ .ppt