Растворы ВМС. Лысов Валерий.125 гр.pptx
- Количество слайдов: 23
 Растворы ВМС
Растворы ВМС
 РАСТВОРЫ ВЫСОКОМОЛЕКУЛЯРНЫХ СОЕДИНЕНИЙ. Высокомолекулярными соединениями (В. М. С. ) называются вещества с молекулярной массой от нескольких тысяч до 1 миллиона и более. Молекулы представляют собой гигантские образования, состоящие из сотен отдельных атомов, связанных друг с другом силами главных валентностей.
РАСТВОРЫ ВЫСОКОМОЛЕКУЛЯРНЫХ СОЕДИНЕНИЙ. Высокомолекулярными соединениями (В. М. С. ) называются вещества с молекулярной массой от нескольких тысяч до 1 миллиона и более. Молекулы представляют собой гигантские образования, состоящие из сотен отдельных атомов, связанных друг с другом силами главных валентностей.
 СВОЙСТВА РАСТВОРОВ ВМС 1. Большой размер молекул 2. Низкое осмотическое давление 3. Малая диффузионная способность 4. Растворы ВМС не способны к диализу 5. Растворы ВМС могут изменяться под влиянием внешних факторов (добавление электролитов, изменение температуры и др. )
СВОЙСТВА РАСТВОРОВ ВМС 1. Большой размер молекул 2. Низкое осмотическое давление 3. Малая диффузионная способность 4. Растворы ВМС не способны к диализу 5. Растворы ВМС могут изменяться под влиянием внешних факторов (добавление электролитов, изменение температуры и др. )
 Форма макромалекул Глобулярная (сферическая) – компактные шаровидные образования: Фибриллярная (линейная, слаборазветвленная) – ассиметричные пачки молекул: гемоглобин гликоген пепсин трипсин панкреатин и др. желатин целлюлоза и ее производные коллаген полиакрилат натрия и др. Неограниченно набухающие: Ограниченно набухающие: процесс перехода от набухания к растворению происходит самопроизвольно процесс перехода от набухания к растворению происходит при определенных факторах (повышение температуры и др. )
Форма макромалекул Глобулярная (сферическая) – компактные шаровидные образования: Фибриллярная (линейная, слаборазветвленная) – ассиметричные пачки молекул: гемоглобин гликоген пепсин трипсин панкреатин и др. желатин целлюлоза и ее производные коллаген полиакрилат натрия и др. Неограниченно набухающие: Ограниченно набухающие: процесс перехода от набухания к растворению происходит самопроизвольно процесс перехода от набухания к растворению происходит при определенных факторах (повышение температуры и др. )
 Механизм набухания и растворения ВМС. • Растворе ния ВМС • Процесс растворе ния ВМС протекает самопроизвольно, но в течение длитель ного времени, и ему часто предшествует набухание полимера в растворителе. Полимеры, макромолекулы которых имеют симметричную форму, могут переходить в раствор, предвари тельно не набухая. Например, гемоглобин, печеночный гликоген при растворении почти не набухают, а растворы этих веществ не обладают высокой вязкостью даже при срав нительно больших концентрациях, в то время как вещества с более асимметрическими вытянутыми молекулами при рас творении очень сильно набухают (желатин, целлюлоза, нату ральный и синтетические каучуки).
Механизм набухания и растворения ВМС. • Растворе ния ВМС • Процесс растворе ния ВМС протекает самопроизвольно, но в течение длитель ного времени, и ему часто предшествует набухание полимера в растворителе. Полимеры, макромолекулы которых имеют симметричную форму, могут переходить в раствор, предвари тельно не набухая. Например, гемоглобин, печеночный гликоген при растворении почти не набухают, а растворы этих веществ не обладают высокой вязкостью даже при срав нительно больших концентрациях, в то время как вещества с более асимметрическими вытянутыми молекулами при рас творении очень сильно набухают (желатин, целлюлоза, нату ральный и синтетические каучуки).
 • Набухание ВМС • Набухание увеличение массы и объема полимера за счет проникновения молекул растворителя в пространственную структуру ВМС. Причина набухания большая раз ница в размерах молекул растворяемого вещества и раствори теля и, как следствие, большое различие в скоростях их диф фузии. При набухании вначале происходит практиче ски односторонняя диффузия молекул растворителя в про странственную сетку полимера, имеющая ту же природу, что и осмос растворителя в осмотическую ячейку через поры полупроницаемой мембраны. Механизм набухания сводится к проникновению молекул растворителя в ближайшие слои полимера и сольватации со ответствующих участков полимерной цепи. В результате мак ромолекулы «разрыхляются» , что облегчает дальнейшее про никновение молекул растворителя и увеличение массы и объ ема полимера.
• Набухание ВМС • Набухание увеличение массы и объема полимера за счет проникновения молекул растворителя в пространственную структуру ВМС. Причина набухания большая раз ница в размерах молекул растворяемого вещества и раствори теля и, как следствие, большое различие в скоростях их диф фузии. При набухании вначале происходит практиче ски односторонняя диффузия молекул растворителя в про странственную сетку полимера, имеющая ту же природу, что и осмос растворителя в осмотическую ячейку через поры полупроницаемой мембраны. Механизм набухания сводится к проникновению молекул растворителя в ближайшие слои полимера и сольватации со ответствующих участков полимерной цепи. В результате мак ромолекулы «разрыхляются» , что облегчает дальнейшее про никновение молекул растворителя и увеличение массы и объ ема полимера.
 • По свойству переходить в раствор ВМС разделяют на: • 1. Неограниченно набухающие; • 2. Ограниченно набухающие,
• По свойству переходить в раствор ВМС разделяют на: • 1. Неограниченно набухающие; • 2. Ограниченно набухающие,
 Если процесс перехода от набухания к растворению происходит самопроизвольно, то такие ВМС называются неограниченно набухающие. К ним относятся: некоторые камеди, слизи, белок, пепсин, трипсин, поливиниловый спирт, поливинилпирролидон и др. (т. е. молекулы со сферической формой). Если процесс перехода от набухания к растворению происходит только при определённых факторах (температура и т. д. ), то такие ВМС называются ограниченно набухающими. К ним относятся: желатин, крахмал и др. с линейной формой молекулы.
Если процесс перехода от набухания к растворению происходит самопроизвольно, то такие ВМС называются неограниченно набухающие. К ним относятся: некоторые камеди, слизи, белок, пепсин, трипсин, поливиниловый спирт, поливинилпирролидон и др. (т. е. молекулы со сферической формой). Если процесс перехода от набухания к растворению происходит только при определённых факторах (температура и т. д. ), то такие ВМС называются ограниченно набухающими. К ним относятся: желатин, крахмал и др. с линейной формой молекулы.
 Пример • Обычно процесс растворения состоит из 2 х стадий: набухания и растворения. При тепловом движении молекул между ними образуются щели, в которые легко проникает вода, т. к. молекулы воды более подвижные, происходит диффузия воды в ВМС, происходит стадия набухания. Молекулы воды ориентируются вокруг полярных групп ВМС – гидратируются, образуется мономолекулярный слой. ВМС набухает и увеличивается в размере в 10– 15 раз. Когда связь между молекулами ВМС будет ослаблена, то ВМС начинает диффундировать в раствор, при этом происходит растворение ВМС в воде и образуется истинный раствор.
Пример • Обычно процесс растворения состоит из 2 х стадий: набухания и растворения. При тепловом движении молекул между ними образуются щели, в которые легко проникает вода, т. к. молекулы воды более подвижные, происходит диффузия воды в ВМС, происходит стадия набухания. Молекулы воды ориентируются вокруг полярных групп ВМС – гидратируются, образуется мономолекулярный слой. ВМС набухает и увеличивается в размере в 10– 15 раз. Когда связь между молекулами ВМС будет ослаблена, то ВМС начинает диффундировать в раствор, при этом происходит растворение ВМС в воде и образуется истинный раствор.
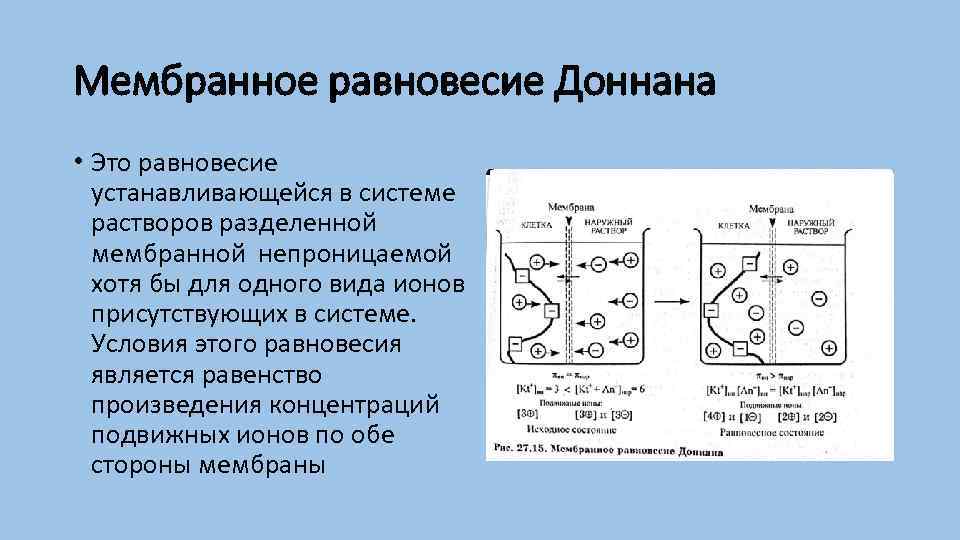 Мембранное равновесие Доннана • Это равновесие устанавливающейся в системе растворов разделенной мембранной непроницаемой хотя бы для одного вида ионов присутствующих в системе. Условия этого равновесия является равенство произведения концентраций подвижных ионов по обе стороны мембраны
Мембранное равновесие Доннана • Это равновесие устанавливающейся в системе растворов разделенной мембранной непроницаемой хотя бы для одного вида ионов присутствующих в системе. Условия этого равновесия является равенство произведения концентраций подвижных ионов по обе стороны мембраны
 ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ РАСТВОРОВ БИОПОЛИМЕРОВ • Растворы ВМС представляют собой истинные растворы, т. е. гомогенные, термодинамически устойчивые, не нуждающиеся в стабилизаторе, и образующиеся самопроизвольно системы. Однако растворы ВМС рассматривают в коллоидной химии, так как размеры их молекул приближаются, а в некоторых случаях даже превосходят размер коллоидных частиц. Кроме того, растворы ВМС в «плохих» растворителях содержат молекулы или агрегаты молекул с явно выраженной межфазной поверхностью. В концентрированных растворах ВМС обычно возникают достаточно большие ассоциаты молекул, которые можно рассматривать как вторую фазу. Наконец, растворы ВМС благодаря большим размерам их молекул обладают рядом свойств лиозолей: схожестью оптических свойств, малой скоростью диффузии, низким осмотическим давлением. Все это позволяет рассматривать многие проблемы одновременно и для коллоидных растворов, и для растворов ВМС. • В противоположность золям осмотическое давление растворов ВМС существенно и может быть измерено с достаточной точностью, что используется для определения их молекулярной массы. • С повышением концентрации ВМС их осмотическое давление перестает подчиняться закону Вант Гоффа (π = c. RT) и растет быстрее, причем экспериментально полученная кривая лежит выше теоретической прямой.
ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ РАСТВОРОВ БИОПОЛИМЕРОВ • Растворы ВМС представляют собой истинные растворы, т. е. гомогенные, термодинамически устойчивые, не нуждающиеся в стабилизаторе, и образующиеся самопроизвольно системы. Однако растворы ВМС рассматривают в коллоидной химии, так как размеры их молекул приближаются, а в некоторых случаях даже превосходят размер коллоидных частиц. Кроме того, растворы ВМС в «плохих» растворителях содержат молекулы или агрегаты молекул с явно выраженной межфазной поверхностью. В концентрированных растворах ВМС обычно возникают достаточно большие ассоциаты молекул, которые можно рассматривать как вторую фазу. Наконец, растворы ВМС благодаря большим размерам их молекул обладают рядом свойств лиозолей: схожестью оптических свойств, малой скоростью диффузии, низким осмотическим давлением. Все это позволяет рассматривать многие проблемы одновременно и для коллоидных растворов, и для растворов ВМС. • В противоположность золям осмотическое давление растворов ВМС существенно и может быть измерено с достаточной точностью, что используется для определения их молекулярной массы. • С повышением концентрации ВМС их осмотическое давление перестает подчиняться закону Вант Гоффа (π = c. RT) и растет быстрее, причем экспериментально полученная кривая лежит выше теоретической прямой.
 • Причиной отклонения от законов Вант Гоффа является гибкость цепей ВМС, которые ведут себя, как несколько коротких молекул. Для расчета осмотического давления растворов ВМС предложено уравнение Галлера: • где c концентрация раствора ВМС, г/л; М молярная масса, г/моль; b коээфициент, учитывающий гибкость и форму молекулы ВМС в растворе. • В сложных биологических системах суммарное осмотическое давление создается как низкомолекулярными электролитами и неэлектролитами, так и биополимерами. Составляющая суммарного осмотического давления, которая обусловлена наличием белков и других частиц коллоидного размера, называется онкотическим давлением. Доля онкотического давления относительно невелика: она составляет примерно 0, 5% от суммарного осмотического давления (≈3, 1 к. Па), однако отклонение этой величины от нормы приводит к серьезным нарушениям в функционировании организма.
• Причиной отклонения от законов Вант Гоффа является гибкость цепей ВМС, которые ведут себя, как несколько коротких молекул. Для расчета осмотического давления растворов ВМС предложено уравнение Галлера: • где c концентрация раствора ВМС, г/л; М молярная масса, г/моль; b коээфициент, учитывающий гибкость и форму молекулы ВМС в растворе. • В сложных биологических системах суммарное осмотическое давление создается как низкомолекулярными электролитами и неэлектролитами, так и биополимерами. Составляющая суммарного осмотического давления, которая обусловлена наличием белков и других частиц коллоидного размера, называется онкотическим давлением. Доля онкотического давления относительно невелика: она составляет примерно 0, 5% от суммарного осмотического давления (≈3, 1 к. Па), однако отклонение этой величины от нормы приводит к серьезным нарушениям в функционировании организма.
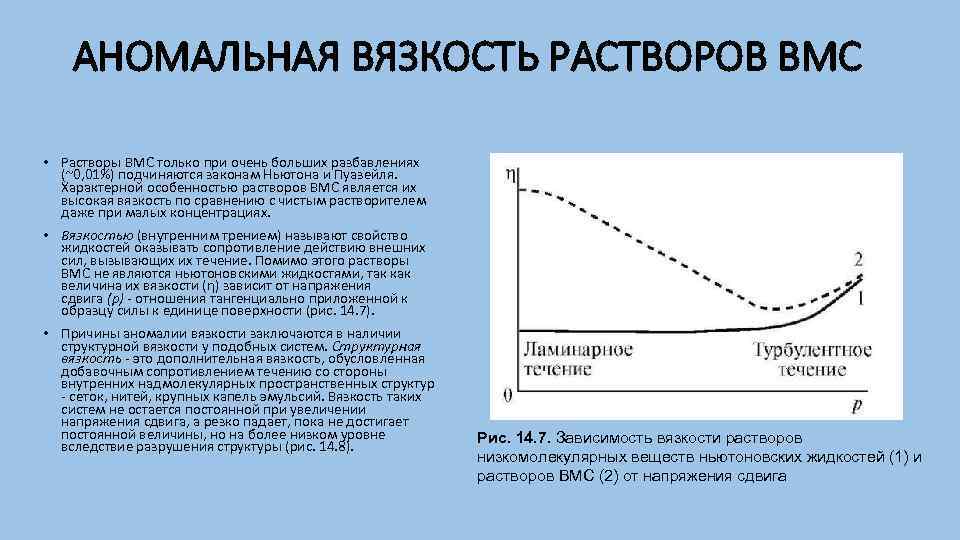 АНОМАЛЬНАЯ ВЯЗКОСТЬ РАСТВОРОВ ВМС • Растворы ВМС только при очень больших разбавлениях (~0, 01%) подчиняются законам Ньютона и Пуазейля. Характерной особенностью растворов ВМС является их высокая вязкость по сравнению с чистым растворителем даже при малых концентрациях. • Вязкостью (внутренним трением) называют свойство жидкостей оказывать сопротивление действию внешних сил, вызывающих их течение. Помимо этого растворы ВМС не являются ньютоновскими жидкостями, так как величина их вязкости (η) зависит от напряжения сдвига (р) отношения тангенциально приложенной к образцу силы к единице поверхности (рис. 14. 7). • Причины аномалии вязкости заключаются в наличии структурной вязкости у подобных систем. Структурная вязкость это дополнительная вязкость, обусловленная добавочным сопротивлением течению со стороны внутренних надмолекулярных пространственных структур сеток, нитей, крупных капель эмульсий. Вязкость таких систем не остается постоянной при увеличении напряжения сдвига, а резко падает, пока не достигает постоянной величины, но на более низком уровне вследствие разрушения структуры (рис. 14. 8). Рис. 14. 7. Зависимость вязкости растворов низкомолекулярных веществ ньютоновских жидкостей (1) и растворов ВМС (2) от напряжения сдвига
АНОМАЛЬНАЯ ВЯЗКОСТЬ РАСТВОРОВ ВМС • Растворы ВМС только при очень больших разбавлениях (~0, 01%) подчиняются законам Ньютона и Пуазейля. Характерной особенностью растворов ВМС является их высокая вязкость по сравнению с чистым растворителем даже при малых концентрациях. • Вязкостью (внутренним трением) называют свойство жидкостей оказывать сопротивление действию внешних сил, вызывающих их течение. Помимо этого растворы ВМС не являются ньютоновскими жидкостями, так как величина их вязкости (η) зависит от напряжения сдвига (р) отношения тангенциально приложенной к образцу силы к единице поверхности (рис. 14. 7). • Причины аномалии вязкости заключаются в наличии структурной вязкости у подобных систем. Структурная вязкость это дополнительная вязкость, обусловленная добавочным сопротивлением течению со стороны внутренних надмолекулярных пространственных структур сеток, нитей, крупных капель эмульсий. Вязкость таких систем не остается постоянной при увеличении напряжения сдвига, а резко падает, пока не достигает постоянной величины, но на более низком уровне вследствие разрушения структуры (рис. 14. 8). Рис. 14. 7. Зависимость вязкости растворов низкомолекулярных веществ ньютоновских жидкостей (1) и растворов ВМС (2) от напряжения сдвига
 • Особенно сильно это свойство проявляется у полимеров с длинными линейными молекулами, например у каучука. Растворы полимеров с той же молекулярной массой, но со сферической формой молекул имеют меньшую вязкость. Отсюда следует, что вязкость растворов полимеров возрастает пропорционально асимметрии их молекул. При одинаковой химической структуре вязкость возрастает с увеличением молекулярной массы. Она зависит также от концентрации полимера и межмолекулярных сил взаимодействия. • Рис. 14. 8. Изменение структуры растворов ВМС при увеличении напряжения сдвига
• Особенно сильно это свойство проявляется у полимеров с длинными линейными молекулами, например у каучука. Растворы полимеров с той же молекулярной массой, но со сферической формой молекул имеют меньшую вязкость. Отсюда следует, что вязкость растворов полимеров возрастает пропорционально асимметрии их молекул. При одинаковой химической структуре вязкость возрастает с увеличением молекулярной массы. Она зависит также от концентрации полимера и межмолекулярных сил взаимодействия. • Рис. 14. 8. Изменение структуры растворов ВМС при увеличении напряжения сдвига
 • Область постоянства вязкости аномально вязких жидкостей называютпсевдопластической областью. Дальнейшее повышение напряжения сдвига вызывает увеличение коэффициента вязкости, что связано с турбулентностью. • Экспериментальные данные показывают, что коллоидные аномально вязкие системы могут течь и при очень малых давлениях и при этом • вязкость остается постоянной, но очень высокой. Такое течение называют ползучестью. • Увеличение давления резко снижает вязкость ползучих систем, пока не наступает вторая область постоянства вязкости псевдопластическая. • Аномалии вязкости вызываются рядом причин. • 1. Структурообразование процесс агрегации частиц коллоидных растворов, суспензий, растворов ВМС и образования пространственных легкоразрушимых структур. • 2. Изменение ориентации в потоке частиц удлиненной формы и макромолекул при увеличении градиента скорости. • 3. Деформация клубков макромолекул полимера или капель эмульсий в потоке. • С повышением температуры вязкость структурированных систем резко уменьшается за счет разрушения структуры. При понижении температуры доля структурной вязкости значительно увеличивается.
• Область постоянства вязкости аномально вязких жидкостей называютпсевдопластической областью. Дальнейшее повышение напряжения сдвига вызывает увеличение коэффициента вязкости, что связано с турбулентностью. • Экспериментальные данные показывают, что коллоидные аномально вязкие системы могут течь и при очень малых давлениях и при этом • вязкость остается постоянной, но очень высокой. Такое течение называют ползучестью. • Увеличение давления резко снижает вязкость ползучих систем, пока не наступает вторая область постоянства вязкости псевдопластическая. • Аномалии вязкости вызываются рядом причин. • 1. Структурообразование процесс агрегации частиц коллоидных растворов, суспензий, растворов ВМС и образования пространственных легкоразрушимых структур. • 2. Изменение ориентации в потоке частиц удлиненной формы и макромолекул при увеличении градиента скорости. • 3. Деформация клубков макромолекул полимера или капель эмульсий в потоке. • С повышением температуры вязкость структурированных систем резко уменьшается за счет разрушения структуры. При понижении температуры доля структурной вязкости значительно увеличивается.
 Полиэлектролиты • Полиэлектролит — полимер, в состав молекул которого входят группы, способные к ионизации в растворе. Полиэлектролиты применяются в технике в качестве коагулянтов для очистки сточных вод, в качестве диспергаторов для снижения вязкости высококонцентрированных дисперсных систем на водной основе (суспензии и пасты в производствекерамики). Эффективность полиэлектролитов в этих приложениях объясняется адсорбцией полиионов на поверхность частиц с формированием двойного электрического слоя, эффективно снижающего трение между частицами. К полиэлектролитам относятся важнейшие биологические полимеры (биополимеры) — белки, нуклеиновые кислоты. Они играют важную роль в регулировании вязкости крови. Большое практическое значение имеют иониты.
Полиэлектролиты • Полиэлектролит — полимер, в состав молекул которого входят группы, способные к ионизации в растворе. Полиэлектролиты применяются в технике в качестве коагулянтов для очистки сточных вод, в качестве диспергаторов для снижения вязкости высококонцентрированных дисперсных систем на водной основе (суспензии и пасты в производствекерамики). Эффективность полиэлектролитов в этих приложениях объясняется адсорбцией полиионов на поверхность частиц с формированием двойного электрического слоя, эффективно снижающего трение между частицами. К полиэлектролитам относятся важнейшие биологические полимеры (биополимеры) — белки, нуклеиновые кислоты. Они играют важную роль в регулировании вязкости крови. Большое практическое значение имеют иониты.
 • Полиэлектролиты подразделяются на поликатионы (при диссоциации которых основная макромолекула приобретает положительный заряд), полианионы (заряд ионизированной полимерной молекулы отрицательный) и полиамфолиты(макромолекула содержит как положительные, так и отрицательные заряды). Как правило, полиамфолиты относятся кгетерополимерам. • Ион, отрывающийся от макромолекулы при диссоциации, называется противоионом или контрионом. В растворе обычно часть противоионов концентрируется вблизи одиночной макромолекулы полиэлектролита, а часть — свободные противоионы — уходит во внешний раствор.
• Полиэлектролиты подразделяются на поликатионы (при диссоциации которых основная макромолекула приобретает положительный заряд), полианионы (заряд ионизированной полимерной молекулы отрицательный) и полиамфолиты(макромолекула содержит как положительные, так и отрицательные заряды). Как правило, полиамфолиты относятся кгетерополимерам. • Ион, отрывающийся от макромолекулы при диссоциации, называется противоионом или контрионом. В растворе обычно часть противоионов концентрируется вблизи одиночной макромолекулы полиэлектролита, а часть — свободные противоионы — уходит во внешний раствор.
 Вязкость крови и других биологических жидкостей. • Осмотическое давление в жидкостях организма (кровь, лимфа, межклеточная жидкость, спинномозговая жидкость и др. ) выпол няет важную физиологическую функцию, влияющую на распределение в тканях организма воды, солей и различных питательных веществ. Осмотическое давление указанных биологических жидкостей зависит главным образом от растворенных в них низкомоле кулярных минеральных веществ, преимущественно хлористого натрия, но также от высокомолекулярных соединений, находящихся в коллоидном состоянии, главным образом белков. Несмотря на то, что в плазме крови содержится от 6 до 8% белков, коллоидо осмотическое давление составляет примерно 0, 5% (30— 40 см водного столба) от общего осмотического давления плазмы, причем около 80% онкотического давления обуслов лено наиболее низкодисперсными белками — альбуминами, а ос тальные 20% падают на другие белки плазмы. Существенным физиологическим моментом, связанным с важ нейшими процессами, происходящими в организме, является под держание состояния осмотического равновесия между кровью и тканевыми жидкостями, которое, будучи динамическим, обеспечи вает постоянный обмен жидкости, низкомолекулярных питатель ных веществ и конечных продуктов обмена.
Вязкость крови и других биологических жидкостей. • Осмотическое давление в жидкостях организма (кровь, лимфа, межклеточная жидкость, спинномозговая жидкость и др. ) выпол няет важную физиологическую функцию, влияющую на распределение в тканях организма воды, солей и различных питательных веществ. Осмотическое давление указанных биологических жидкостей зависит главным образом от растворенных в них низкомоле кулярных минеральных веществ, преимущественно хлористого натрия, но также от высокомолекулярных соединений, находящихся в коллоидном состоянии, главным образом белков. Несмотря на то, что в плазме крови содержится от 6 до 8% белков, коллоидо осмотическое давление составляет примерно 0, 5% (30— 40 см водного столба) от общего осмотического давления плазмы, причем около 80% онкотического давления обуслов лено наиболее низкодисперсными белками — альбуминами, а ос тальные 20% падают на другие белки плазмы. Существенным физиологическим моментом, связанным с важ нейшими процессами, происходящими в организме, является под держание состояния осмотического равновесия между кровью и тканевыми жидкостями, которое, будучи динамическим, обеспечи вает постоянный обмен жидкости, низкомолекулярных питатель ных веществ и конечных продуктов обмена.
 • Распределение воды и минеральных веществ между кровью и тканями и поддержание осмотического равнове сия обеспечивается в основном нормальной концентрацией белков в плазме крови, а кровяное давление компенсируется колло идно осмотическим давлением. Безбелковая часть плазмы в результате гидростатического давления проникает в межклеточное пространство ткани, а в ве нозной части капилляров проис ходит обратный ток жидкости в сторону пониженного гидростати ческого давления по сравнению с коллоидоосмотическим давлени ем крови. Аналогичные процессы имеют место и в почках при образовании мочи. При понижении содержания белка в крови, т. е. при гипопротеинемиях, вследствие голодания, нарушений деятельности пищеварительного тракта или потери белка с мочой при заболеваниях почек, возникает разница в онкотическом давлении в тканевых жидкостях и в крови. Вода уст ремляется в сторону более высо кого давления — в ткани; возни кают так называемые онкотические отеки подкожной клетчатки
• Распределение воды и минеральных веществ между кровью и тканями и поддержание осмотического равнове сия обеспечивается в основном нормальной концентрацией белков в плазме крови, а кровяное давление компенсируется колло идно осмотическим давлением. Безбелковая часть плазмы в результате гидростатического давления проникает в межклеточное пространство ткани, а в ве нозной части капилляров проис ходит обратный ток жидкости в сторону пониженного гидростати ческого давления по сравнению с коллоидоосмотическим давлени ем крови. Аналогичные процессы имеют место и в почках при образовании мочи. При понижении содержания белка в крови, т. е. при гипопротеинемиях, вследствие голодания, нарушений деятельности пищеварительного тракта или потери белка с мочой при заболеваниях почек, возникает разница в онкотическом давлении в тканевых жидкостях и в крови. Вода уст ремляется в сторону более высо кого давления — в ткани; возни кают так называемые онкотические отеки подкожной клетчатки
 Уравнение Штаудингера для вязкости растворов полимеров • По вязкости растворы высокомолекулярных соединений резко отличаются от растворов низкомолекулярных веществ и золей. При одной и той же весовой концентрации вязкость растворов полимеров значительно больше вязкости растворов низкомолекулярных веществ и лиофобных золей), и с увеличением концентрации она резко возрастает. • Такая высокая вязкость растворов полимеров объясняется наличием в системе макромолекул, которые увеличивают силу трения при передвижении одного слоя жидкости относительно другого. Причем с уменьшение гибкости макромолекул, с возрастанием их размеров и концентрации в растворе увеличение силы трения становится все более существенным. • • • Увеличение вязкости жидкости, связанное с присутствием в ней макромолекул полимера, принято характеризовать удельной вязкостью: • hуд. = • где ηр – вязкость раствора; • η 0 – вязкость чистого растворителя.
Уравнение Штаудингера для вязкости растворов полимеров • По вязкости растворы высокомолекулярных соединений резко отличаются от растворов низкомолекулярных веществ и золей. При одной и той же весовой концентрации вязкость растворов полимеров значительно больше вязкости растворов низкомолекулярных веществ и лиофобных золей), и с увеличением концентрации она резко возрастает. • Такая высокая вязкость растворов полимеров объясняется наличием в системе макромолекул, которые увеличивают силу трения при передвижении одного слоя жидкости относительно другого. Причем с уменьшение гибкости макромолекул, с возрастанием их размеров и концентрации в растворе увеличение силы трения становится все более существенным. • • • Увеличение вязкости жидкости, связанное с присутствием в ней макромолекул полимера, принято характеризовать удельной вязкостью: • hуд. = • где ηр – вязкость раствора; • η 0 – вязкость чистого растворителя.
 • Герман Штаудингер (1881 – 1965) получил образование в Галле (по ботанике) и Дармштадте и Мюнхене (по химии). С 1903 г. был ассистентом в Галле и Страсбурге, а с 1907 г. – профессор в Карлсруэ, где вел работы по органической химии. В 1912 г. он переехал в Цюрих, а в 1926 г. стал руководителем химической лаборатории в Фрейбурге, где в 1940 г. основал Институт высокомолекулярных соединений. Здесь были выполнены его важнейшие исследования в этой области. Г. Штаудингер основал новое направление – химию высокомолекулярных соединений на стыке органической и коллоидной химии. После 1930 г. эта новая область получила быстрое развитие как в части синтеза многих практически ценных высокополимеров, так и в отношении изучения особенностей их структуры. • Штаудингером установлена математическая зависимость удельной вязкости раствора полимера от его молярной массы: • ηуд. = KMC • где K – константа, характерная для полимеров данного класса; • С – концентрация полимера в растворе; М – молярная масса полимера. • • Уравнение Штаудингера можно использовать в таком виде для разбавленных растворов полимеров, макромолекулы которых линейны, не взаимодействуют друг с другом и имеют небольшую молярную массу (меньше 80000). • При увеличении длины макромолекулы и ее гибкости используется модифицированная форма уравнения Штаудингера: • [η] = KMα • где [η] – характеристическая вязкость раствора, определяемая как limηуд. /с; α – величина, учитывающая свертывание макромолекул, (т. е. гибкость их цепи). Она определяется опытным путем и принимает значения от 0, 5 (когда форма макромолекул близка к сферической до 1 (для жестких, вытянутых в виде палочки макромолекул). • •
• Герман Штаудингер (1881 – 1965) получил образование в Галле (по ботанике) и Дармштадте и Мюнхене (по химии). С 1903 г. был ассистентом в Галле и Страсбурге, а с 1907 г. – профессор в Карлсруэ, где вел работы по органической химии. В 1912 г. он переехал в Цюрих, а в 1926 г. стал руководителем химической лаборатории в Фрейбурге, где в 1940 г. основал Институт высокомолекулярных соединений. Здесь были выполнены его важнейшие исследования в этой области. Г. Штаудингер основал новое направление – химию высокомолекулярных соединений на стыке органической и коллоидной химии. После 1930 г. эта новая область получила быстрое развитие как в части синтеза многих практически ценных высокополимеров, так и в отношении изучения особенностей их структуры. • Штаудингером установлена математическая зависимость удельной вязкости раствора полимера от его молярной массы: • ηуд. = KMC • где K – константа, характерная для полимеров данного класса; • С – концентрация полимера в растворе; М – молярная масса полимера. • • Уравнение Штаудингера можно использовать в таком виде для разбавленных растворов полимеров, макромолекулы которых линейны, не взаимодействуют друг с другом и имеют небольшую молярную массу (меньше 80000). • При увеличении длины макромолекулы и ее гибкости используется модифицированная форма уравнения Штаудингера: • [η] = KMα • где [η] – характеристическая вязкость раствора, определяемая как limηуд. /с; α – величина, учитывающая свертывание макромолекул, (т. е. гибкость их цепи). Она определяется опытным путем и принимает значения от 0, 5 (когда форма макромолекул близка к сферической до 1 (для жестких, вытянутых в виде палочки макромолекул). • •
 Онкотическое давление плазмы и сыворотки крови • Онкотическое давление плазмы крови зависит в основном от концентрации белков, их размеров и гидрофильности (способности удерживать воду). Осмотическое давление водных растворов обусловлено солями. Онкотическое давление (Он. Д) имеет большое значение в распределении воды и растворенных в ней веществ между кровью и тканями. Он. Д крови составляет в среднем 7, 5 8, 0 атмосфер. • Осмотическое давление крови, лимфы и тканевой жидкости в норме поддерживается на постоянном уровне, хотя оно может незначительно изменяться, например при обильном поступлений в кровь воды или солей, но на непродолжительное время. Давление быстро выравнивается благодаря деятельности выделительных органов (почки, потовые железы), удаляющих избыток воды или солей. • При введении в кровь (внутривенно или внутриартериально) лекарственных веществ или солевых растворов, нужно обеспечивать одинаковое их осмотическое давление с осмотическим давлением крови. • Физиологические растворы все же не равноценны плазме крови, так как не содержат высокомолекулярных коллоидных веществ, которыми являются белки плазмы. Поэтому к солевому раствору с глюкозой прибавляют различные коллоиды, например водорастворимые высокомолекулярные полисахариды (декстран), или особым образом обработанные белковые препараты. Коллоидные вещества добавляют в количестве 7 8%. Такие растворы вводят человеку, например, после большой кровопотери. Однако наилучшей кровезамещающей жидкостью все же является плазма крови. [3, 112 c]
Онкотическое давление плазмы и сыворотки крови • Онкотическое давление плазмы крови зависит в основном от концентрации белков, их размеров и гидрофильности (способности удерживать воду). Осмотическое давление водных растворов обусловлено солями. Онкотическое давление (Он. Д) имеет большое значение в распределении воды и растворенных в ней веществ между кровью и тканями. Он. Д крови составляет в среднем 7, 5 8, 0 атмосфер. • Осмотическое давление крови, лимфы и тканевой жидкости в норме поддерживается на постоянном уровне, хотя оно может незначительно изменяться, например при обильном поступлений в кровь воды или солей, но на непродолжительное время. Давление быстро выравнивается благодаря деятельности выделительных органов (почки, потовые железы), удаляющих избыток воды или солей. • При введении в кровь (внутривенно или внутриартериально) лекарственных веществ или солевых растворов, нужно обеспечивать одинаковое их осмотическое давление с осмотическим давлением крови. • Физиологические растворы все же не равноценны плазме крови, так как не содержат высокомолекулярных коллоидных веществ, которыми являются белки плазмы. Поэтому к солевому раствору с глюкозой прибавляют различные коллоиды, например водорастворимые высокомолекулярные полисахариды (декстран), или особым образом обработанные белковые препараты. Коллоидные вещества добавляют в количестве 7 8%. Такие растворы вводят человеку, например, после большой кровопотери. Однако наилучшей кровезамещающей жидкостью все же является плазма крови. [3, 112 c]
 Использованный материал • Слесарев В. И. – Химия: Основы химии живого: Учебник для вузов. 3 е изд. , испр. – СПб: Химиздат. – 2007. – 784 с. • Ресурсы Интернет
Использованный материал • Слесарев В. И. – Химия: Основы химии живого: Учебник для вузов. 3 е изд. , испр. – СПб: Химиздат. – 2007. – 784 с. • Ресурсы Интернет


