 РАСТВОРЫ
РАСТВОРЫ
 Типы растворов Газ – газ Воздух: Н 2 О + О 2 + N 2 + H 2 O Раствор ы Жидкость – твердое Н 2 О + K 2 Cr 2 O 7 Жидкость – жидкость Н 2 О С 2 H 5 ОH Н 2 О – H 2 SO 4 Твердое – твердое Gex. Si 1 -x Жидкость – газ Н 2 О СО 2 Н 2 О – HCl
Типы растворов Газ – газ Воздух: Н 2 О + О 2 + N 2 + H 2 O Раствор ы Жидкость – твердое Н 2 О + K 2 Cr 2 O 7 Жидкость – жидкость Н 2 О С 2 H 5 ОH Н 2 О – H 2 SO 4 Твердое – твердое Gex. Si 1 -x Жидкость – газ Н 2 О СО 2 Н 2 О – HCl
 Hр = H ф. п. + H сольв. Sр = Sф. п. + Sсольв.
Hр = H ф. п. + H сольв. Sр = Sф. п. + Sсольв.
 Процесс растворения идет самопроизвольно G<0
Процесс растворения идет самопроизвольно G<0
 Насыщенный раствор – раствор, находящийся в равновесии с твердой фазой
Насыщенный раствор – раствор, находящийся в равновесии с твердой фазой
 Пересыщенный раствор представляет собой систему, находящуюся в кажущемся равновесии G>0
Пересыщенный раствор представляет собой систему, находящуюся в кажущемся равновесии G>0
 Влияние природы растворителя на растворимость • Правило Семенченко • Закон Генри Сi= Ki ·Pi
Влияние природы растворителя на растворимость • Правило Семенченко • Закон Генри Сi= Ki ·Pi
 Способы выражения концентрации раствора • Молярная доля, %
Способы выражения концентрации раствора • Молярная доля, %
 • Массовая доля, %:
• Массовая доля, %:
 • Объемная доля, %: где V – объема раствора, Vi – объем данного компонента.
• Объемная доля, %: где V – объема раствора, Vi – объем данного компонента.
 • Молярность, моль/л • Молярная концентрация эквивалента, нормальность, моль-экв/л
• Молярность, моль/л • Молярная концентрация эквивалента, нормальность, моль-экв/л
 • Моляльность, моль/кг • M- масса растворителя, г
• Моляльность, моль/кг • M- масса растворителя, г
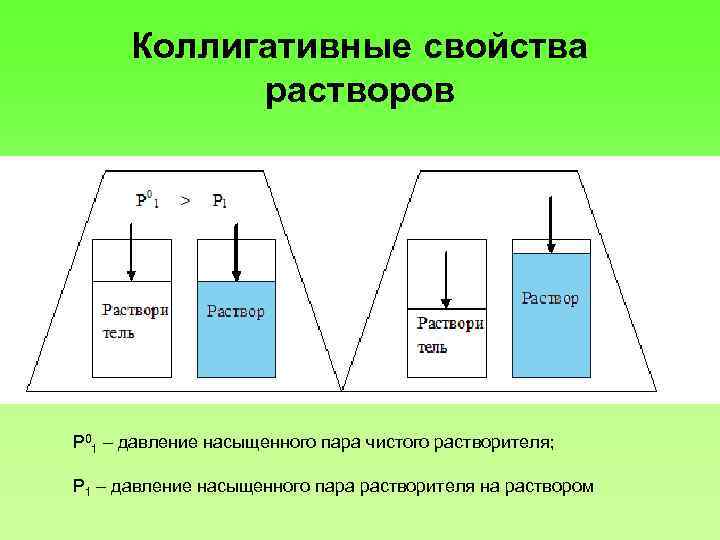 Коллигативные свойства растворов Ρ 01 – давление насыщенного пара чистого растворителя; Ρ 1 – давление насыщенного пара растворителя на раствором
Коллигативные свойства растворов Ρ 01 – давление насыщенного пара чистого растворителя; Ρ 1 – давление насыщенного пара растворителя на раствором
 Закон Рауля • Относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества в растворе
Закон Рауля • Относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества в растворе
 Р 1 2 Рв=1, 013 105 Па Р 01=f (T) Р 1=f (T) T 0 T 1 T Зависимость давления пара растворителя над чистым растворителем (Р 10) и над идеальным раствором (Р 1) от температуры
Р 1 2 Рв=1, 013 105 Па Р 01=f (T) Р 1=f (T) T 0 T 1 T Зависимость давления пара растворителя над чистым растворителем (Р 10) и над идеальным раствором (Р 1) от температуры
 Р 1 Р 01 ж=f(T) 2 Р 1=f (T) Р 0 тв=f (T) 3 T 10 T Зависимость давления пара растворителя над твердым (Р 10 тв) и жидким (Р 10 ж) растворителем и над раствором (Р 1) от температуры
Р 1 Р 01 ж=f(T) 2 Р 1=f (T) Р 0 тв=f (T) 3 T 10 T Зависимость давления пара растворителя над твердым (Р 10 тв) и жидким (Р 10 ж) растворителем и над раствором (Р 1) от температуры
 II Закон Рауля (следствия) Повышение температуры кипения и понижение температуры замерзания растворов пропорциональны числу частиц растворенного вещества и не зависят от его природы Tзам = К m Tкип = Е m
II Закон Рауля (следствия) Повышение температуры кипения и понижение температуры замерзания растворов пропорциональны числу частиц растворенного вещества и не зависят от его природы Tзам = К m Tкип = Е m
 Закон Вант-Гоффа (осмотического давления), 1887 г.
Закон Вант-Гоффа (осмотического давления), 1887 г.
 Росм = R·T·CМ где Росм– осмотическое давление раствора, КПа; С – его молярная концентрация, моль/л; R – универсальная газовая постоянная, 8, 314 Дж/моль. К; Т – абсолютная температура раствора.
Росм = R·T·CМ где Росм– осмотическое давление раствора, КПа; С – его молярная концентрация, моль/л; R – универсальная газовая постоянная, 8, 314 Дж/моль. К; Т – абсолютная температура раствора.