Lektsia_3_Rastvory_Svoystva_rastvorov_ne_elektr.pptx
- Количество слайдов: 68
 Растворы. Свойства растворов не электролитов и электролитов.
Растворы. Свойства растворов не электролитов и электролитов.
 Растворы – это макроскопически однородные смеси двух или большего числа веществ (компонентов), образующие термодинамически равновесные системы. Растворитель – это… Растворенное вещество -
Растворы – это макроскопически однородные смеси двух или большего числа веществ (компонентов), образующие термодинамически равновесные системы. Растворитель – это… Растворенное вещество -
 * Пример: Вода – это растворитель, если растворить твердое вещество (глюкозу) или газ (СО 2 ). - А если спирт и вода? - Если 3 % раствор спирта, то растворитель вода, если 90 % раствор спирта, то растворитель спирт, если 50 % раствор спирта, то есть право выбора растворителя. Самым распространенным растворителем на Земле является вода.
* Пример: Вода – это растворитель, если растворить твердое вещество (глюкозу) или газ (СО 2 ). - А если спирт и вода? - Если 3 % раствор спирта, то растворитель вода, если 90 % раствор спирта, то растворитель спирт, если 50 % раствор спирта, то есть право выбора растворителя. Самым распространенным растворителем на Земле является вода.
 *Содержание и распределение воды в организме человека ~ 60 % от общей массы тела человека составляет вода. (На 70 кг приходится 45 л воды). 70% всей воды организма внутриклеточная 30% внеклеточная Их состав сильно отличается :
*Содержание и распределение воды в организме человека ~ 60 % от общей массы тела человека составляет вода. (На 70 кг приходится 45 л воды). 70% всей воды организма внутриклеточная 30% внеклеточная Их состав сильно отличается :
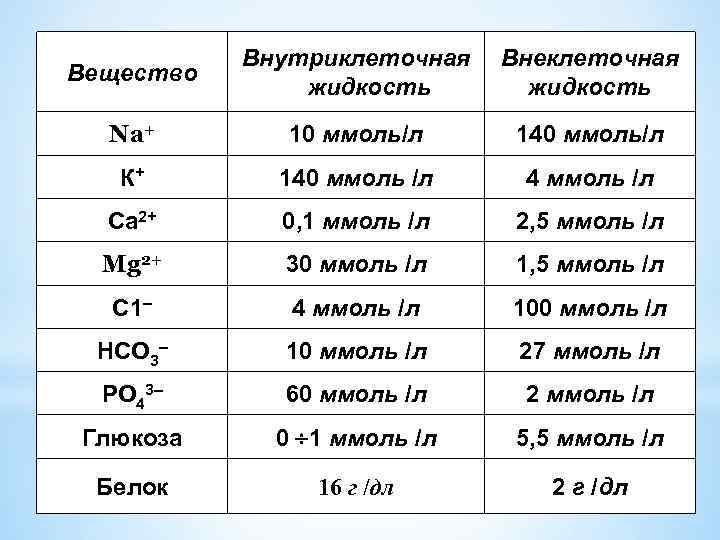 Вещество Внутриклеточная жидкость Внеклеточная жидкость Na+ 10 ммоль/л 140 ммоль/л К+ 140 ммоль /л 4 ммоль /л Са 2+ 0, 1 ммоль /л 2, 5 ммоль /л Mg 2+ 30 ммоль /л 1, 5 ммоль /л С 1– 4 ммоль /л 100 ммоль /л НСО 3– 10 ммоль /л 27 ммоль /л РO 43– 60 ммоль /л 2 ммоль /л Глюкоза 0 ¸ 1 ммоль /л 5, 5 ммоль /л Белок 16 г /дл 2 г /дл
Вещество Внутриклеточная жидкость Внеклеточная жидкость Na+ 10 ммоль/л 140 ммоль/л К+ 140 ммоль /л 4 ммоль /л Са 2+ 0, 1 ммоль /л 2, 5 ммоль /л Mg 2+ 30 ммоль /л 1, 5 ммоль /л С 1– 4 ммоль /л 100 ммоль /л НСО 3– 10 ммоль /л 27 ммоль /л РO 43– 60 ммоль /л 2 ммоль /л Глюкоза 0 ¸ 1 ммоль /л 5, 5 ммоль /л Белок 16 г /дл 2 г /дл
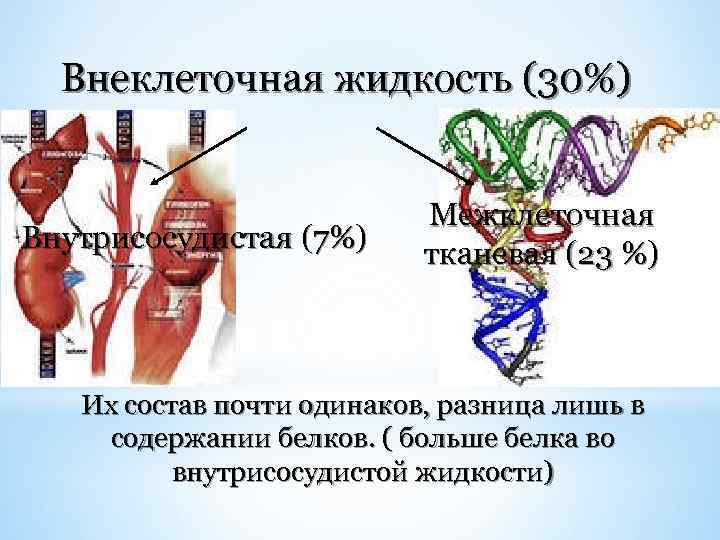 Внеклеточная жидкость (30%) Внутрисосудистая (7%) Межклеточная тканевая (23 %) Их состав почти одинаков, разница лишь в содержании белков. ( больше белка во внутрисосудистой жидкости)
Внеклеточная жидкость (30%) Внутрисосудистая (7%) Межклеточная тканевая (23 %) Их состав почти одинаков, разница лишь в содержании белков. ( больше белка во внутрисосудистой жидкости)
 *В биохимических процессах вода выступает как : 1. Растворитель 2. Реагент 3. Продукт реакции
*В биохимических процессах вода выступает как : 1. Растворитель 2. Реагент 3. Продукт реакции
 Вода- универсальный растворитель Существование межмолекулярных водородных связей определяет аномальные физические свойства воды: 1. Высокая теплоемкость -… 2. Высокая температура кипения 3. Большая теплота испарения 4. Высокое поверхностное натяжение 5. Низкая вязкость 6. Более высокая плотность в жидком состоянии, чем в твердом. 7. Высокая диэлектрическая проницаемость (ε = 80)
Вода- универсальный растворитель Существование межмолекулярных водородных связей определяет аномальные физические свойства воды: 1. Высокая теплоемкость -… 2. Высокая температура кипения 3. Большая теплота испарения 4. Высокое поверхностное натяжение 5. Низкая вязкость 6. Более высокая плотность в жидком состоянии, чем в твердом. 7. Высокая диэлектрическая проницаемость (ε = 80)
 Н 2 О – универсальный растворитель, наличие аномальных свойств ее играет важную физиологическую и биологическую роль. Биохимические процессы в организме протекают в водных растворах или при ее (воды) участии как реагента и продукта реакции.
Н 2 О – универсальный растворитель, наличие аномальных свойств ее играет важную физиологическую и биологическую роль. Биохимические процессы в организме протекают в водных растворах или при ее (воды) участии как реагента и продукта реакции.
 «Вода! У тебя нет ни вкуса, ни цвета, ни запаха, тебя не опишешь, тобой наслаждаешься, не понимая, что ты такое. Ты не просто необходима для жизни, ты и есть жизнь. » Антуан де Сент-Экзюпери
«Вода! У тебя нет ни вкуса, ни цвета, ни запаха, тебя не опишешь, тобой наслаждаешься, не понимая, что ты такое. Ты не просто необходима для жизни, ты и есть жизнь. » Антуан де Сент-Экзюпери
 Термодинамика процесса растворения Растворение – процесс самопроизвольный, поэтому ∆Gрастворения < 0. ∆ Gрастворения = ∆Н растворения –Т ∆Sрастворения
Термодинамика процесса растворения Растворение – процесс самопроизвольный, поэтому ∆Gрастворения < 0. ∆ Gрастворения = ∆Н растворения –Т ∆Sрастворения
 Энергетическая характеристика растворения 1. Рассмотрим растворение твердого вещества с ионной связью в воде. ∆Н растворения = ∆Н фаз. перехода + ∆Н гидратации > 0 < 0 Разрушение к. р. – эндотермический процесс Образование хим. связи –экзотермический процесс
Энергетическая характеристика растворения 1. Рассмотрим растворение твердого вещества с ионной связью в воде. ∆Н растворения = ∆Н фаз. перехода + ∆Н гидратации > 0 < 0 Разрушение к. р. – эндотермический процесс Образование хим. связи –экзотермический процесс
 1. Если |∆Н ф. п. |> |∆Н гидр. |, то ∆Н растворения > 0, эндо-процесс, раствор охлаждается (КNO 3, NH 4 NO 3) 2. Если |∆Н ф. п. |<|∆Н гидр. |, то ∆Н растворения < 0, экзо-процесс, раствор нагревается (Na. OH ) Т. о. при растворении тв. /ж. 0 < ∆ Н растворения < 0
1. Если |∆Н ф. п. |> |∆Н гидр. |, то ∆Н растворения > 0, эндо-процесс, раствор охлаждается (КNO 3, NH 4 NO 3) 2. Если |∆Н ф. п. |<|∆Н гидр. |, то ∆Н растворения < 0, экзо-процесс, раствор нагревается (Na. OH ) Т. о. при растворении тв. /ж. 0 < ∆ Н растворения < 0
 Энтропийная характеристика растворения ∆Sрастворения = ∆S фаз. перехода + ∆S гидратации >> 0 < 0, т. к. уменьшается число частиц в единице объёма Т. о. , |∆S ф. п. |> |∆S гидр. |, поэтому ∆Sрастворения тв. вещ-в > 0
Энтропийная характеристика растворения ∆Sрастворения = ∆S фаз. перехода + ∆S гидратации >> 0 < 0, т. к. уменьшается число частиц в единице объёма Т. о. , |∆S ф. п. |> |∆S гидр. |, поэтому ∆Sрастворения тв. вещ-в > 0
 2. Рассмотрим растворение газообразного вещества в воде. Обычно ∆Sрастворения газов < 0, ∆Gрастворения = ∆Н растворения – Т ∆Sрастворения ∆Нрастворения=∆G растворения + Т ∆Sрастворения ∆Gраств. < 0 и ∆Sраств. < 0 ; ∆Н растворения газов < 0
2. Рассмотрим растворение газообразного вещества в воде. Обычно ∆Sрастворения газов < 0, ∆Gрастворения = ∆Н растворения – Т ∆Sрастворения ∆Нрастворения=∆G растворения + Т ∆Sрастворения ∆Gраств. < 0 и ∆Sраств. < 0 ; ∆Н растворения газов < 0
 Реальные и идеальные растворы ∆Н р-ния = 0, ∆Gр-ния =– Т ∆Sр-ния >0
Реальные и идеальные растворы ∆Н р-ния = 0, ∆Gр-ния =– Т ∆Sр-ния >0
 * 1. осмотическое давление 2. понижение давления насыщенного пара растворителя над раствором по сравнению с давлением насыщенного пара растворителя над чистым растворителем. 3. повышение температуры кипения раствора по сравнению с температурой кипения чистого растворителя 4. понижение температуры замерзания раствора по сравнению с температурой замерзания чистого растворителя.
* 1. осмотическое давление 2. понижение давления насыщенного пара растворителя над раствором по сравнению с давлением насыщенного пара растворителя над чистым растворителем. 3. повышение температуры кипения раствора по сравнению с температурой кипения чистого растворителя 4. понижение температуры замерзания раствора по сравнению с температурой замерзания чистого растворителя.
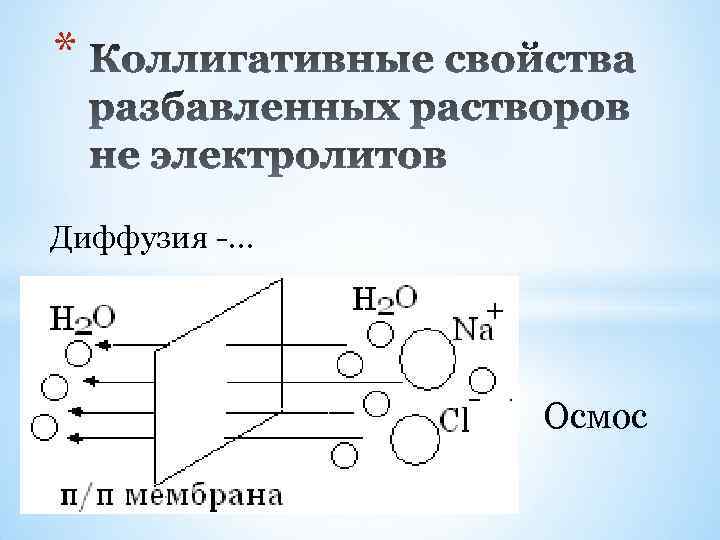 * Диффузия -… Осмос
* Диффузия -… Осмос
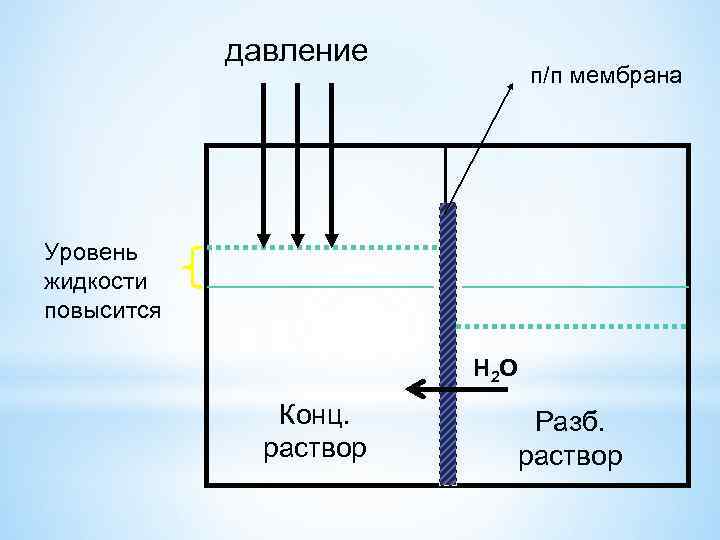 давление п/п мембрана Уровень жидкости повысится Н 2 О Конц. раствор Разб. раствор
давление п/п мембрана Уровень жидкости повысится Н 2 О Конц. раствор Разб. раствор
 В 1886 г. Вант-Гофф экспериментально установил, что Р осм. =СМRT – уравнение Вант-Гоффа. 1 м 3 = 1000 л; 1 Па =10 -3 к. Па СМ= моль/л, Росм. = к. Па.
В 1886 г. Вант-Гофф экспериментально установил, что Р осм. =СМRT – уравнение Вант-Гоффа. 1 м 3 = 1000 л; 1 Па =10 -3 к. Па СМ= моль/л, Росм. = к. Па.
 РVгаза= n. RT уравнение Менделеева-Клапейрона.
РVгаза= n. RT уравнение Менделеева-Клапейрона.
 Закон Вант-Гоффа: «Осмотическое давление раствора равно тому давлению, которое оказывало бы растворенное вещество, если бы оно, находясь в газообразном состоянии занимало бы объем равный объему раствора. » Пример: 1 моль/л раствор С 6 Н 12 О 6. Чему равно Росм? чем М, тем ↓ Р осм. (белки)
Закон Вант-Гоффа: «Осмотическое давление раствора равно тому давлению, которое оказывало бы растворенное вещество, если бы оно, находясь в газообразном состоянии занимало бы объем равный объему раствора. » Пример: 1 моль/л раствор С 6 Н 12 О 6. Чему равно Росм? чем М, тем ↓ Р осм. (белки)
 *Осмос и осмотические явления в биологических системах 1. распределение воды между внутриклеточной жидкостью и внеклеточной 2. распределение воды между сосудистым руслом и внесосудистым пространством. Осмолярность - … моль/л Осмоляльность - … моль/ кг (определяется криометрией) р-ля
*Осмос и осмотические явления в биологических системах 1. распределение воды между внутриклеточной жидкостью и внеклеточной 2. распределение воды между сосудистым руслом и внесосудистым пространством. Осмолярность - … моль/л Осмоляльность - … моль/ кг (определяется криометрией) р-ля
 Для плазмы крови осмоляльность = 292 ммоль/кг. Она обусловлена: 1. низкомолекулярными веществамиэлектролитами: соли Na+, K+, Mg 2+ , Ca 2+. 2. низкомолекулярными веществами не электролитами: глюкоза, мочевина. 3. ВМС – белки.
Для плазмы крови осмоляльность = 292 ммоль/кг. Она обусловлена: 1. низкомолекулярными веществамиэлектролитами: соли Na+, K+, Mg 2+ , Ca 2+. 2. низкомолекулярными веществами не электролитами: глюкоза, мочевина. 3. ВМС – белки.
 Форменные элементы крови на Росм. не влияют. Р осм. внутри и вне клетки одинаково, т. е. осмоляльность внутриклеточной жидкости равна осмоляльности плазмы крови ~ 292 ммоль /кг Н 2 О. Такое состояние – изоосмия.
Форменные элементы крови на Росм. не влияют. Р осм. внутри и вне клетки одинаково, т. е. осмоляльность внутриклеточной жидкости равна осмоляльности плазмы крови ~ 292 ммоль /кг Н 2 О. Такое состояние – изоосмия.
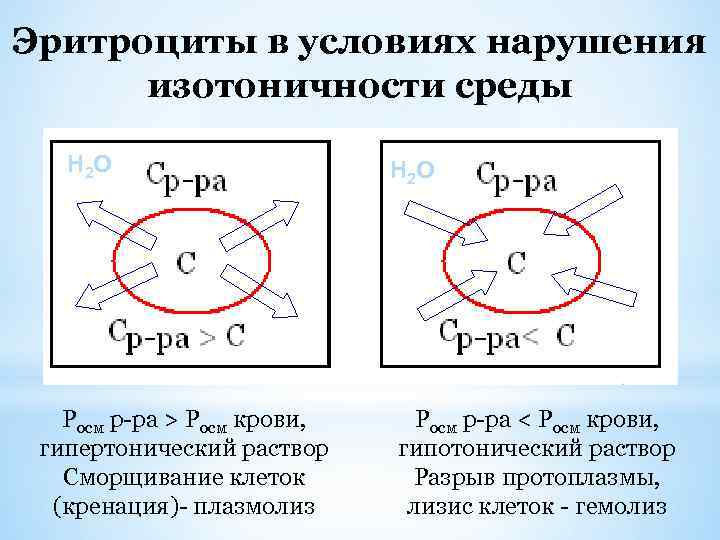 Эритроциты в условиях нарушения изотоничности среды Н 2 О Росм р-ра > Росм крови, гипертонический раствор Сморщивание клеток (кренация)- плазмолиз Н 2 О Росм р-ра < Росм крови, гипотонический раствор Разрыв протоплазмы, лизис клеток - гемолиз
Эритроциты в условиях нарушения изотоничности среды Н 2 О Росм р-ра > Росм крови, гипертонический раствор Сморщивание клеток (кренация)- плазмолиз Н 2 О Росм р-ра < Росм крови, гипотонический раствор Разрыв протоплазмы, лизис клеток - гемолиз
 Если раствор имеет Росм одинаковое с клеткой, то это изотонический раствор. При кровопотерях вводят растворы изотоничные плазме крови. Это 0, 85 -0, 9 % (0, 15 моль/л) Na. Cl ; 5% (0, 3 моль/л) С 6 Н 12 О 6 Физиологический раствор: 1. р-р Рингера- Локка - в 1 л: глюкоза 1, 0 г , Na. Cl 9, 0 г , КCl о, 2 г 1. солевой инфузин и др.
Если раствор имеет Росм одинаковое с клеткой, то это изотонический раствор. При кровопотерях вводят растворы изотоничные плазме крови. Это 0, 85 -0, 9 % (0, 15 моль/л) Na. Cl ; 5% (0, 3 моль/л) С 6 Н 12 О 6 Физиологический раствор: 1. р-р Рингера- Локка - в 1 л: глюкоза 1, 0 г , Na. Cl 9, 0 г , КCl о, 2 г 1. солевой инфузин и др.
 испарение
испарение
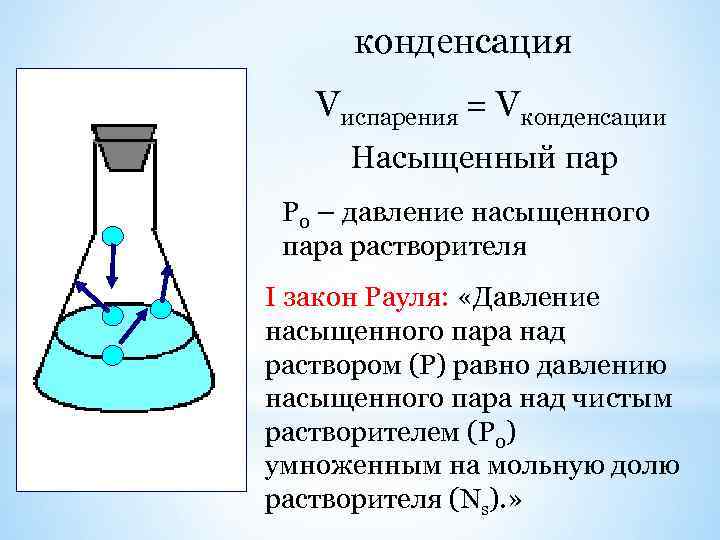 конденсация Vиспарения = Vконденсации Насыщенный пар Р 0 – давление насыщенного пара растворителя I закон Рауля: «Давление насыщенного пара над раствором (Р) равно давлению насыщенного пара над чистым растворителем (Р 0) умноженным на мольную долю растворителя (Ns). »
конденсация Vиспарения = Vконденсации Насыщенный пар Р 0 – давление насыщенного пара растворителя I закон Рауля: «Давление насыщенного пара над раствором (Р) равно давлению насыщенного пара над чистым растворителем (Р 0) умноженным на мольную долю растворителя (Ns). »
 Р = Р 0 Ns Р 0 – Р = Δ Р ; ΔР- абсолютное понижение давления насыщенного пара р-ля над р-ом относительное понижение давления нас. пара над раствором. NS + Ni= 1, P = P 0(1 - Ni) = P 0 - P 0 Ni; P 0 – P = P 0 Ni ; ΔР=Р 0 N i NS =1 - Ni
Р = Р 0 Ns Р 0 – Р = Δ Р ; ΔР- абсолютное понижение давления насыщенного пара р-ля над р-ом относительное понижение давления нас. пара над раствором. NS + Ni= 1, P = P 0(1 - Ni) = P 0 - P 0 Ni; P 0 – P = P 0 Ni ; ΔР=Р 0 N i NS =1 - Ni
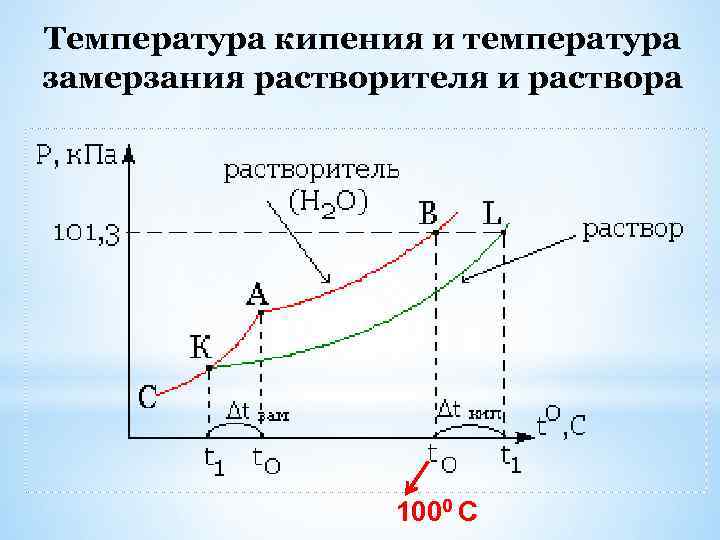 Температура кипения и температура замерзания растворителя и раствора 1000 С
Температура кипения и температура замерзания растворителя и раствора 1000 С
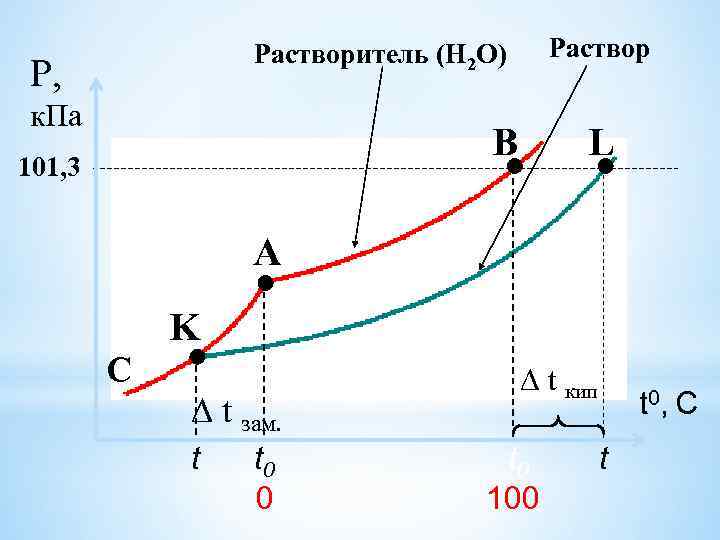 Растворитель (Н 2 О) Р, к. Па B 101, 3 L A C K ∆ t зам. t t 0 0 ∆ t кип t 0 100 t 0, С t
Растворитель (Н 2 О) Р, к. Па B 101, 3 L A C K ∆ t зам. t t 0 0 ∆ t кип t 0 100 t 0, С t
 II закон Рауля (1882) : «Повышение tкип. и понижение tзам. растворов пропорционально моляльности растворенного вещества. » tкип. =Е Сm , tзам. = K Сm Е- эбулиоскопическая постоянная, К- криоскопическая постоянная, Сm- моляльность раствора. Для Н 2 О: Е= 0, 53 кг град / моль, К=1, 86 кг град / моль.
II закон Рауля (1882) : «Повышение tкип. и понижение tзам. растворов пропорционально моляльности растворенного вещества. » tкип. =Е Сm , tзам. = K Сm Е- эбулиоскопическая постоянная, К- криоскопическая постоянная, Сm- моляльность раствора. Для Н 2 О: Е= 0, 53 кг град / моль, К=1, 86 кг град / моль.
 Криометрия, эбулиометрия
Криометрия, эбулиометрия
 Коллигативные свойства разбавленных растворов электролитов 1. Росм = См R T 2. P = P 0 N s 3. Ткип. =Е Сm 4. Тзам. =К Сm Только для р-ров неэлектролитов
Коллигативные свойства разбавленных растворов электролитов 1. Росм = См R T 2. P = P 0 N s 3. Ткип. =Е Сm 4. Тзам. =К Сm Только для р-ров неэлектролитов
 В 1887 г. Вант-Гофф ввел изотонический коэффициент – i (i>1) Росм = i См R T P = i P 0 Ns Ткип. = i Е Сm Тзам. = i К Сm i= (n-1) + 1
В 1887 г. Вант-Гофф ввел изотонический коэффициент – i (i>1) Росм = i См R T P = i P 0 Ns Ткип. = i Е Сm Тзам. = i К Сm i= (n-1) + 1
 Электролитами называются вещества, которые в растворе или в расплаве частично или полностью распадаются на ионы и проводят электрический ток за счет движения ионов.
Электролитами называются вещества, которые в растворе или в расплаве частично или полностью распадаются на ионы и проводят электрический ток за счет движения ионов.
 Сванте Аррениус В 1887 г. шведский учёный С. Аррениус для объяснения особенностей водных растворов веществ предложил теорию электролитической диссоциации.
Сванте Аррениус В 1887 г. шведский учёный С. Аррениус для объяснения особенностей водных растворов веществ предложил теорию электролитической диссоциации.
 1. Молекулы электролитов при растворении или расплавлении распадаются на ионы (+) и (-) заряженные. Процесс распада молекул электролитов на ионы называется электролитической диссоциацией или ионизацией.
1. Молекулы электролитов при растворении или расплавлении распадаются на ионы (+) и (-) заряженные. Процесс распада молекул электролитов на ионы называется электролитической диссоциацией или ионизацией.
 2. Ионы движутся хаотически, а при пропускании электролитического тока (+) заряженные частицы (Kat) двигаются к (-) заряженному электроду - катоду (Cu. OH+; Fe. OH²+; NH 4+), а (-) заряженные частицы(An) - к (+) заряженному электроду аноду (Cl-; SO 3²-; Cr 2 O 7²-; H 2 PO 4 -; HCO 3 -).
2. Ионы движутся хаотически, а при пропускании электролитического тока (+) заряженные частицы (Kat) двигаются к (-) заряженному электроду - катоду (Cu. OH+; Fe. OH²+; NH 4+), а (-) заряженные частицы(An) - к (+) заряженному электроду аноду (Cl-; SO 3²-; Cr 2 O 7²-; H 2 PO 4 -; HCO 3 -).
 3. Диссоциация - процесс обратимый. Наряду с ионизацией распадом молекул на ионы идет процесс ассоциации или молизации (соединение ионов) Na 2 SO 4 ↔ 2 Na+ + SO 4²- 4. Общая сумма зарядов (Kat) равна общей сумме зарядов (An) и противоположна по знаку.
3. Диссоциация - процесс обратимый. Наряду с ионизацией распадом молекул на ионы идет процесс ассоциации или молизации (соединение ионов) Na 2 SO 4 ↔ 2 Na+ + SO 4²- 4. Общая сумма зарядов (Kat) равна общей сумме зарядов (An) и противоположна по знаку.
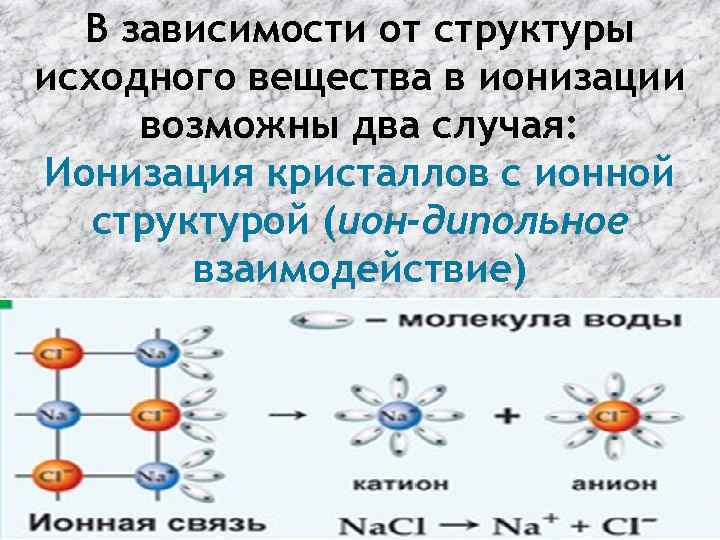 В зависимости от структуры исходного вещества в ионизации возможны два случая: Ионизация кристаллов с ионной структурой (ион-дипольное взаимодействие)
В зависимости от структуры исходного вещества в ионизации возможны два случая: Ионизация кристаллов с ионной структурой (ион-дипольное взаимодействие)
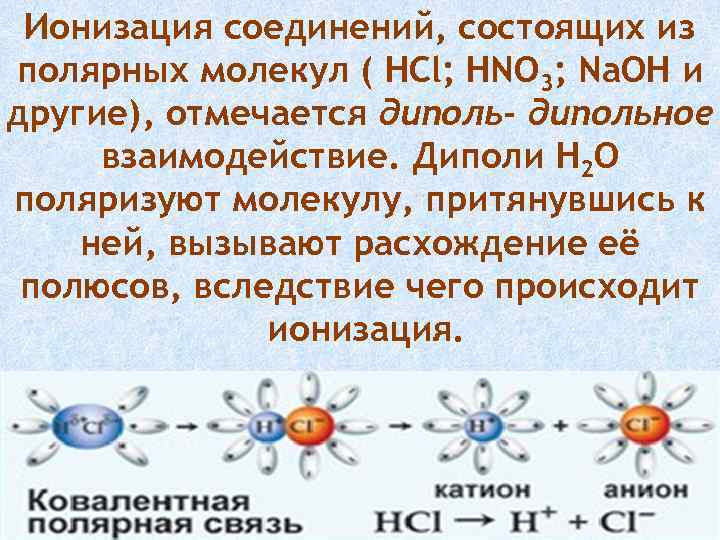 Ионизация соединений, состоящих из полярных молекул ( HCl; HNO 3; Na. OH и другие), отмечается диполь- дипольное взаимодействие. Диполи H 2 O поляризуют молекулу, притянувшись к ней, вызывают расхождение её полюсов, вследствие чего происходит ионизация.
Ионизация соединений, состоящих из полярных молекул ( HCl; HNO 3; Na. OH и другие), отмечается диполь- дипольное взаимодействие. Диполи H 2 O поляризуют молекулу, притянувшись к ней, вызывают расхождение её полюсов, вследствие чего происходит ионизация.
 Теория Аррениуса не учитывала влияние растворителя на процесс ионизации. Д. И. Менделеев и И. А. Каблуков дополнили теорию электролитической диссоциации: роль растворителя заключается не только в поляризации и разделении ионов противоположного знака, а также и в молизации, т. к. в результате диссоциации образуются не свободные ионы, а гидратированные (H 2 O) или сальватированные (с другим растворителем).
Теория Аррениуса не учитывала влияние растворителя на процесс ионизации. Д. И. Менделеев и И. А. Каблуков дополнили теорию электролитической диссоциации: роль растворителя заключается не только в поляризации и разделении ионов противоположного знака, а также и в молизации, т. к. в результате диссоциации образуются не свободные ионы, а гидратированные (H 2 O) или сальватированные (с другим растворителем).
 Образование гидратных (сальватных) оболочек способствует уменьшению электростатического взаимодействия ионов. Ослабление этого процесса происходит тем сильнее, чем больше величина диэлектрической проницаемости (ε) растворителя. Ионизация возможна в полярных растворителях (ε > 30): H 2 O-81; HCN-95; H 2 SO 4 -84. Малополярные растворители (ε=10 -30): пиридин-12, 5; этанол-25; не полярные растворители (ε<10): сероуглерод-2, 7; бензол-2, 3; гексан -1, 9 не обладают диссоциирующей способностью.
Образование гидратных (сальватных) оболочек способствует уменьшению электростатического взаимодействия ионов. Ослабление этого процесса происходит тем сильнее, чем больше величина диэлектрической проницаемости (ε) растворителя. Ионизация возможна в полярных растворителях (ε > 30): H 2 O-81; HCN-95; H 2 SO 4 -84. Малополярные растворители (ε=10 -30): пиридин-12, 5; этанол-25; не полярные растворители (ε<10): сероуглерод-2, 7; бензол-2, 3; гексан -1, 9 не обладают диссоциирующей способностью.

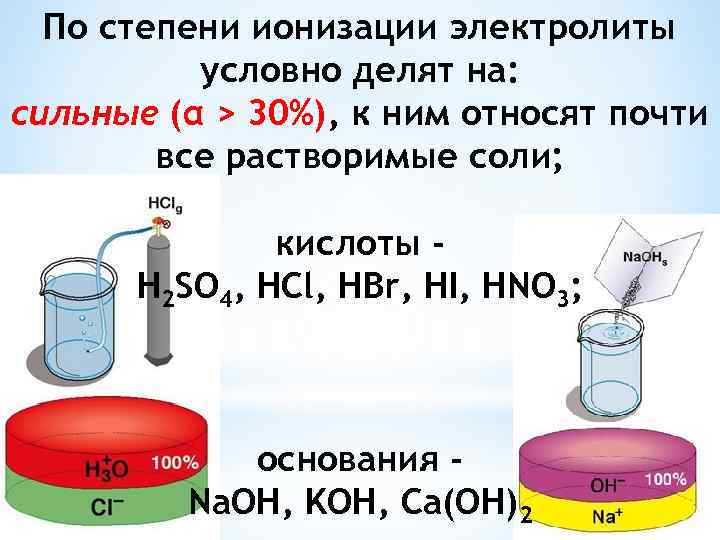 По степени ионизации электролиты условно делят на: сильные (α > 30%), к ним относят почти все растворимые соли; кислоты H 2 SO 4, HCl, HBr, HI, HNO 3; основания Na. OH, KOH, Ca(OH)2
По степени ионизации электролиты условно делят на: сильные (α > 30%), к ним относят почти все растворимые соли; кислоты H 2 SO 4, HCl, HBr, HI, HNO 3; основания Na. OH, KOH, Ca(OH)2
 cлабые (α < 3%), это большинство органических кислот, а также H 2 S, HCN, H 2 CO 3, H 2 SO 3, HCl. O, H 2 O, H 3 BO 3, Hg 2 Cl 2, Fe(SCN)3, Fe(OH)2, NH 4 OH, Pb(OH)2
cлабые (α < 3%), это большинство органических кислот, а также H 2 S, HCN, H 2 CO 3, H 2 SO 3, HCl. O, H 2 O, H 3 BO 3, Hg 2 Cl 2, Fe(SCN)3, Fe(OH)2, NH 4 OH, Pb(OH)2
 электролиты средней силы (α=3 -30%)
электролиты средней силы (α=3 -30%)

 На степень электролитической диссоциации влияют: ТЕМПЕРАТУРА: для эндотермических процессов (∆H > 0) увеличение t°C способствует > α; для экзотермических процессов (∆H < 0) уменьшение t°C способствует > α. КОНЦЕНТРАЦИЯ РАСТВОРА: при разбавлении растворов α значительно возрастает.
На степень электролитической диссоциации влияют: ТЕМПЕРАТУРА: для эндотермических процессов (∆H > 0) увеличение t°C способствует > α; для экзотермических процессов (∆H < 0) уменьшение t°C способствует > α. КОНЦЕНТРАЦИЯ РАСТВОРА: при разбавлении растворов α значительно возрастает.
 ДОБАВЛЕНИЕ ОДНОИМЕННОГО ИОНА: CH 3 COOH ↔ CH 3 OO¯ + H+ Например, введение сильного электролита CH 3 COONa ↔ CH 3 COO¯ + Na+ способствует увеличению концентрации CH 3 COO¯- иона, приводящему к сдвигу равновесия в лево, уменьшению α.
ДОБАВЛЕНИЕ ОДНОИМЕННОГО ИОНА: CH 3 COOH ↔ CH 3 OO¯ + H+ Например, введение сильного электролита CH 3 COONa ↔ CH 3 COO¯ + Na+ способствует увеличению концентрации CH 3 COO¯- иона, приводящему к сдвигу равновесия в лево, уменьшению α.


 Суммарное уравнение: H 2 CO 3 + 2 H 2 O ↔ 2 H 3 O+ + CO 32 Ксум = К 1·К 2 Распад электролита по каждой последующей ступени происходит в меньшей степени, чем по предыдущей К 1>К 2>К 3 (для трехосновной Н 3 РО 4). Зная константу ионизации электролита, можно рассчитать степень ионизации.
Суммарное уравнение: H 2 CO 3 + 2 H 2 O ↔ 2 H 3 O+ + CO 32 Ксум = К 1·К 2 Распад электролита по каждой последующей ступени происходит в меньшей степени, чем по предыдущей К 1>К 2>К 3 (для трехосновной Н 3 РО 4). Зная константу ионизации электролита, можно рассчитать степень ионизации.
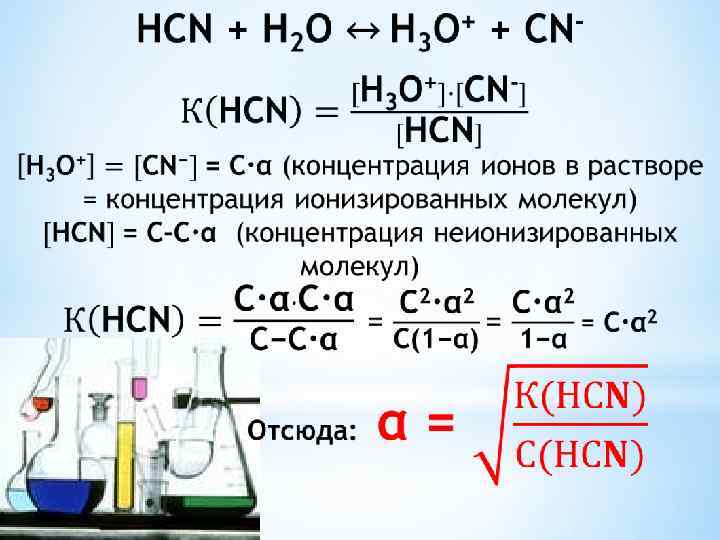
 Эта формула отражает закон Оствальда: степень диссоциации слабого электролита возрастает с разбавлением раствора. Сильные электролиты не подчиняются этому закону.
Эта формула отражает закон Оствальда: степень диссоциации слабого электролита возрастает с разбавлением раствора. Сильные электролиты не подчиняются этому закону.
 ТЕОРИЯ ВОДНЫХ РАСТВОРОВ СИЛЬНЫХ ЭЛЕКТРОЛИТОВ сформулирована в 1923 году Дебаем и Хюккелем: 1. Сильные электролиты в растворе полярных растворителей ионизированы практически нацело (α≈ 100%).
ТЕОРИЯ ВОДНЫХ РАСТВОРОВ СИЛЬНЫХ ЭЛЕКТРОЛИТОВ сформулирована в 1923 году Дебаем и Хюккелем: 1. Сильные электролиты в растворе полярных растворителей ионизированы практически нацело (α≈ 100%).
 2. В мало разбавленных растворах сильных электролитов среднее расстояние между ионами мало, а силы межионного взаимодействия велики. 3. В растворах сильных электролитов ионы не совсем свободны: движение их стеснено взаимным притяжением друг к другу.
2. В мало разбавленных растворах сильных электролитов среднее расстояние между ионами мало, а силы межионного взаимодействия велики. 3. В растворах сильных электролитов ионы не совсем свободны: движение их стеснено взаимным притяжением друг к другу.
 Каждый ион электролита окружен противоположно заряженными ионами, получившими название «ИОННОЙ АТМОСФЕРЫ» , которая тормозит движение ионов и влияет на степень ионизации. α является кажущейся, т. к. она не соответствует действительной степени распада электролита на ионы из-за образования ионной атмосферы , ионных пар (дуплетов), триплетов.
Каждый ион электролита окружен противоположно заряженными ионами, получившими название «ИОННОЙ АТМОСФЕРЫ» , которая тормозит движение ионов и влияет на степень ионизации. α является кажущейся, т. к. она не соответствует действительной степени распада электролита на ионы из-за образования ионной атмосферы , ионных пар (дуплетов), триплетов.
 Вследствие этого снижается эффективность ионов в таких явлениях, как перенос заряда (электрический ток) в растворах, понижение температуры замерзания, повышение температуры кипения, увеличение осмотического давления.
Вследствие этого снижается эффективность ионов в таких явлениях, как перенос заряда (электрический ток) в растворах, понижение температуры замерзания, повышение температуры кипения, увеличение осмотического давления.
 Таким образом, можно считать, что во всех процессах участвуют лишь «активные ионы» , т. е. ионы, не принимающие участия в данный момент в межионных взаимодействиях. Поэтому для оценки влияния ионной атмосферы пользуются активностью (а).
Таким образом, можно считать, что во всех процессах участвуют лишь «активные ионы» , т. е. ионы, не принимающие участия в данный момент в межионных взаимодействиях. Поэтому для оценки влияния ионной атмосферы пользуются активностью (а).
 Активность – эффективная концентрация электролита, в соответствии с которой он участвует в химических процессах. а(х) = f(х) ∙ C(x) (моль/л) f (x) – коэффициент активности, который показывает отклонение свойств реальных растворов от идеальных.
Активность – эффективная концентрация электролита, в соответствии с которой он участвует в химических процессах. а(х) = f(х) ∙ C(x) (моль/л) f (x) – коэффициент активности, который показывает отклонение свойств реальных растворов от идеальных.
 В идеальных растворах а = С, а в реальных С > a. Экспериментально (f) и (а) можно определить криометрическим, осмометрическим, электрохимическим методом, а также можно рассчитать.
В идеальных растворах а = С, а в реальных С > a. Экспериментально (f) и (а) можно определить криометрическим, осмометрическим, электрохимическим методом, а также можно рассчитать.

 Количественной характеристикой межионных электростатических взаимодействий является ионная сила раствора - величина измеряемая полу суммой произведений концентраций всех ионов в растворе на квадрат их заряда: µ=1/2[C(x 1 2(x )∙Z 1)+ C(x 2 2(x )∙Z 2)+…]
Количественной характеристикой межионных электростатических взаимодействий является ионная сила раствора - величина измеряемая полу суммой произведений концентраций всех ионов в растворе на квадрат их заряда: µ=1/2[C(x 1 2(x )∙Z 1)+ C(x 2 2(x )∙Z 2)+…]
 Таким образом, при большой концентрации раствора силы межионного взаимодействия увеличиваются, µ растет, что приводит к уменьшению а и f. У слабых электролитов отсутствует «ионная атмосфера» и межионные электростатические взаимодействия, поэтому они в расчет не берутся.
Таким образом, при большой концентрации раствора силы межионного взаимодействия увеличиваются, µ растет, что приводит к уменьшению а и f. У слабых электролитов отсутствует «ионная атмосфера» и межионные электростатические взаимодействия, поэтому они в расчет не берутся.



