 «Растворы»
«Растворы»
 • Раствором называют находящуюся в состоянии равновесия гомогенную систему переменного состава из двух или более веществ. • Вещества, составляющие раствор, называют компонентами раствора.
• Раствором называют находящуюся в состоянии равновесия гомогенную систему переменного состава из двух или более веществ. • Вещества, составляющие раствор, называют компонентами раствора.
 Агрегатные состояния растворов: Газообразные Твёрдые Жидкие
Агрегатные состояния растворов: Газообразные Твёрдые Жидкие
 Вода – важнейший растворитель • Состоит из 42 веществ. • Молекула воды состоит из двух атомов водорода и одного — кислорода, которые соединены между собой ковалентной связью. • Является хорошим сильнополярным растворителем.
Вода – важнейший растворитель • Состоит из 42 веществ. • Молекула воды состоит из двух атомов водорода и одного — кислорода, которые соединены между собой ковалентной связью. • Является хорошим сильнополярным растворителем.

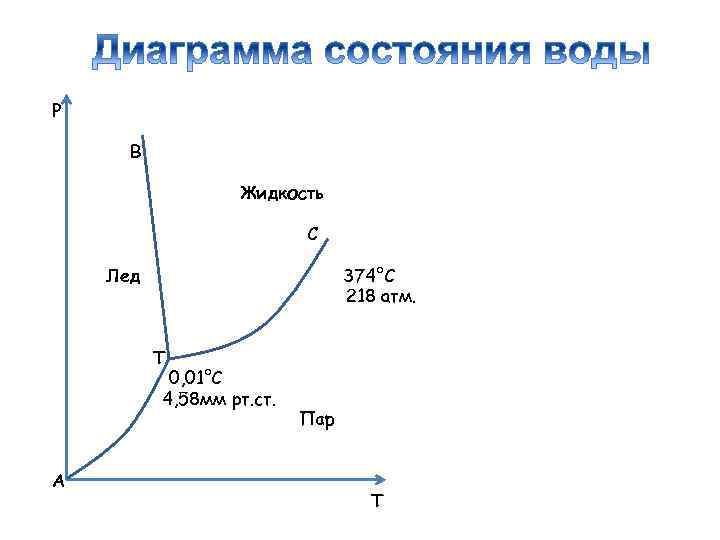 Р В Жидкость С Лед 374°С 218 атм. Т 0, 01°С 4, 58 мм рт. ст. А Пар Т
Р В Жидкость С Лед 374°С 218 атм. Т 0, 01°С 4, 58 мм рт. ст. А Пар Т
 Это те свойства, которые при данных условиях оказываются равными и независимыми от химической природы растворённого вещества; свойства растворов, которые зависят лишь от количества кинетических единиц и от их теплового движения.
Это те свойства, которые при данных условиях оказываются равными и независимыми от химической природы растворённого вещества; свойства растворов, которые зависят лишь от количества кинетических единиц и от их теплового движения.
 Закон Генри-Дальтона: Растворимость каждого из компонентов газовой смеси при постоянной температуре пропорциональна парциальному давлению компонента над жидкостью и не зависит от общего давления смеси и индивидуальности других компонентов. C=kp
Закон Генри-Дальтона: Растворимость каждого из компонентов газовой смеси при постоянной температуре пропорциональна парциальному давлению компонента над жидкостью и не зависит от общего давления смеси и индивидуальности других компонентов. C=kp

 Закон Рауля: Парциальное давление насыщенного пара компонента раствора прямо пропорционально его мольной доле в растворе, причём коэффициент пропорциональности равен давлению насыщенного пара над чистым компонентом.
Закон Рауля: Парциальное давление насыщенного пара компонента раствора прямо пропорционально его мольной доле в растворе, причём коэффициент пропорциональности равен давлению насыщенного пара над чистым компонентом.
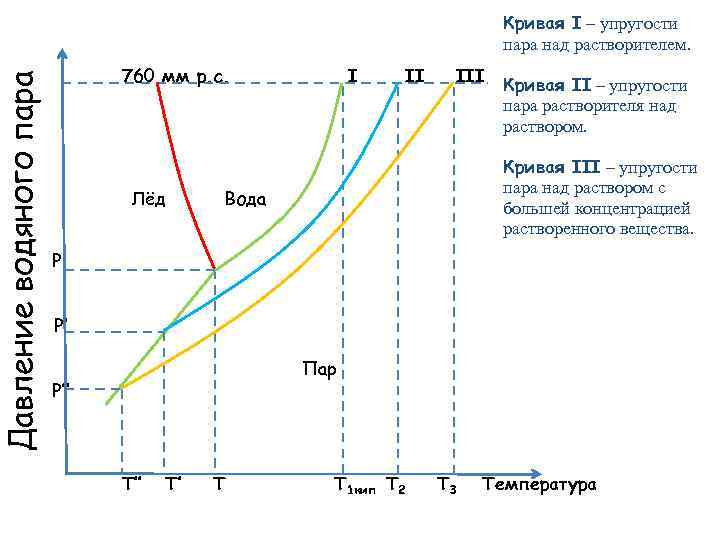 Давление водяного пара Кривая I – упругости пара над растворителем. 760 мм р. с. I II III Лёд Кривая II – упругости пара растворителя над раствором. Кривая III – упругости пара над раствором с большей концентрацией растворенного вещества. Вода P P′ Пар P″ T″ T′ T T 1 кип T 2 T 3 Температура
Давление водяного пара Кривая I – упругости пара над растворителем. 760 мм р. с. I II III Лёд Кривая II – упругости пара растворителя над раствором. Кривая III – упругости пара над раствором с большей концентрацией растворенного вещества. Вода P P′ Пар P″ T″ T′ T T 1 кип T 2 T 3 Температура
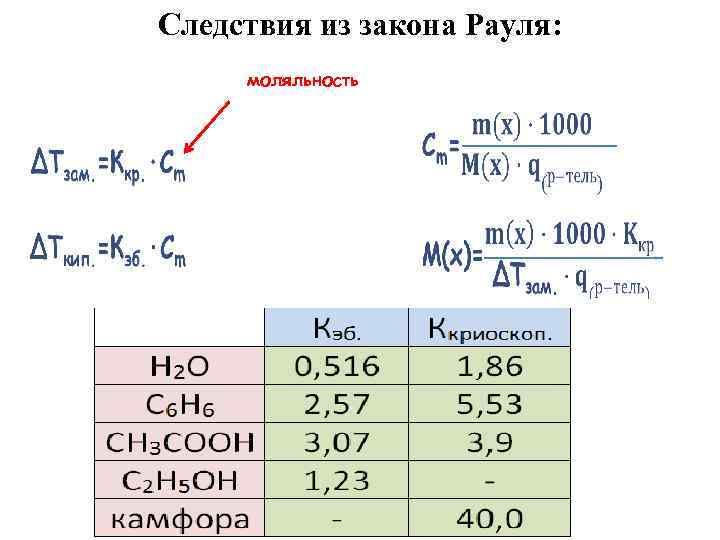 Следствия из закона Рауля: моляльность
Следствия из закона Рауля: моляльность
 Процесс односторонней диффузии через полупроницаемую перегородку. Pосм. =c. RT ; Уравнение Вант -Гоффа где с-молярная концентрация R- газовая постоянная T-температура
Процесс односторонней диффузии через полупроницаемую перегородку. Pосм. =c. RT ; Уравнение Вант -Гоффа где с-молярная концентрация R- газовая постоянная T-температура
 Разрушение эритроцитов крови с выделением в окружающую среду гемоглобина. С 1>С 2 С 1 H 2 O С 2
Разрушение эритроцитов крови с выделением в окружающую среду гемоглобина. С 1>С 2 С 1 H 2 O С 2
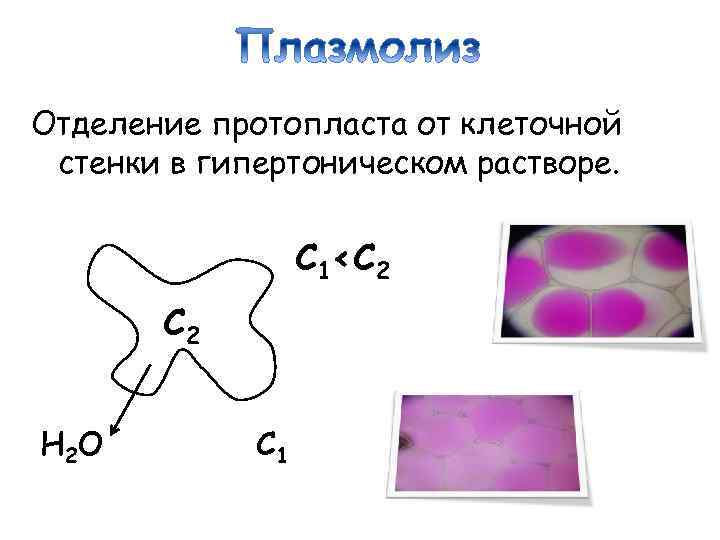 Отделение протопласта от клеточной стенки в гипертоническом растворе. С 1<С 2 H 2 O С 1
Отделение протопласта от клеточной стенки в гипертоническом растворе. С 1<С 2 H 2 O С 1
 Па атм
Па атм
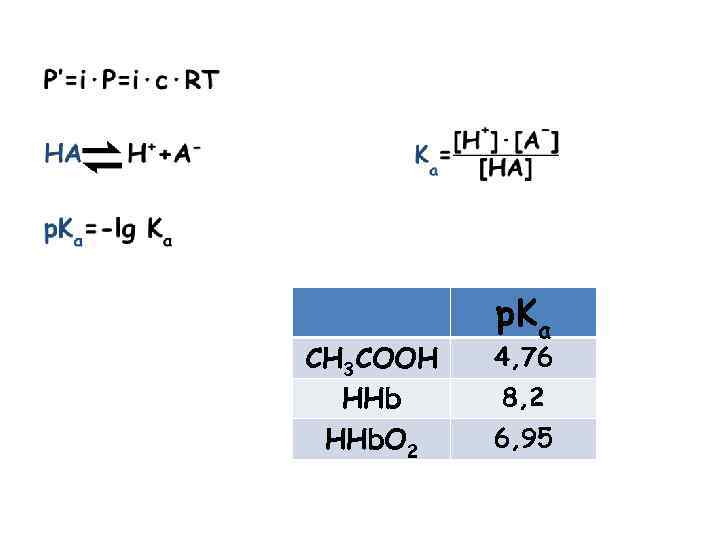 CH 3 COOH HHb. O 2 p. Ka 4, 76 8, 2 6, 95
CH 3 COOH HHb. O 2 p. Ka 4, 76 8, 2 6, 95
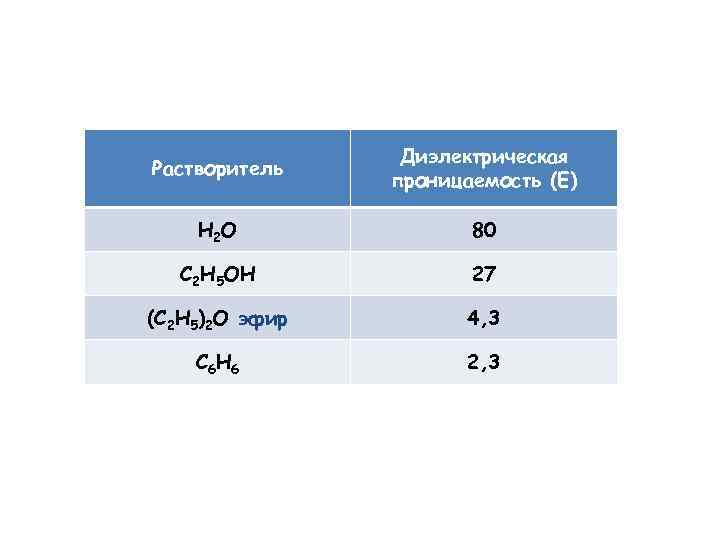 Растворитель Диэлектрическая проницаемость (E) H 2 O 80 C 2 H 5 OH 27 (C 2 H 5)2 O эфир 4, 3 C 6 H 6 2, 3
Растворитель Диэлектрическая проницаемость (E) H 2 O 80 C 2 H 5 OH 27 (C 2 H 5)2 O эфир 4, 3 C 6 H 6 2, 3
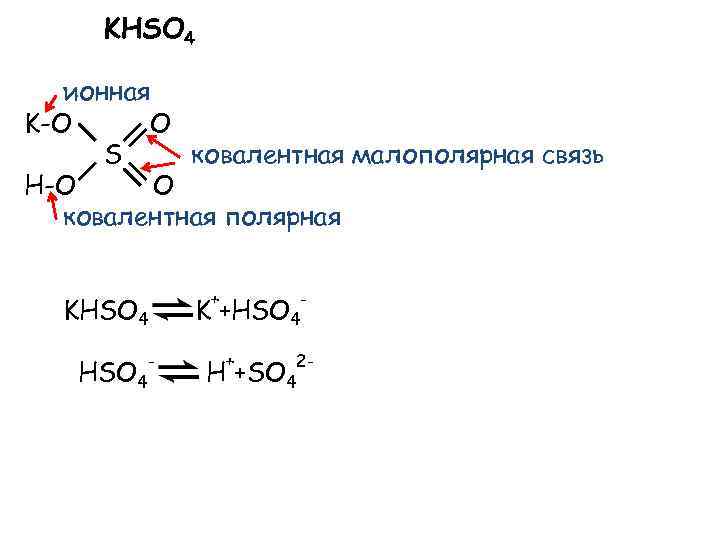 KHSO 4 ионная K-O O S ковалентная малополярная связь H-O O ковалентная полярная KHSO 4 - + K +HSO 4 + H +SO 4 - 2 -
KHSO 4 ионная K-O O S ковалентная малополярная связь H-O O ковалентная полярная KHSO 4 - + K +HSO 4 + H +SO 4 - 2 -
 Степень электролитической диссоциации
Степень электролитической диссоциации






 е
е
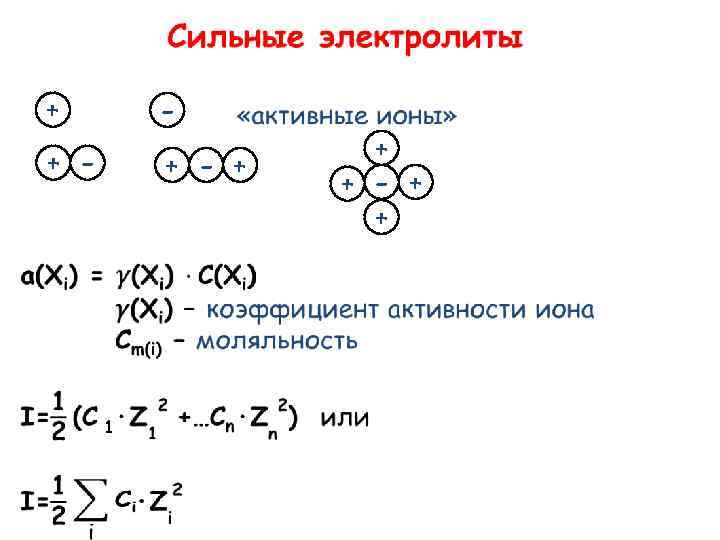 + - + - + 1 + + - + +
+ - + - + 1 + + - + +

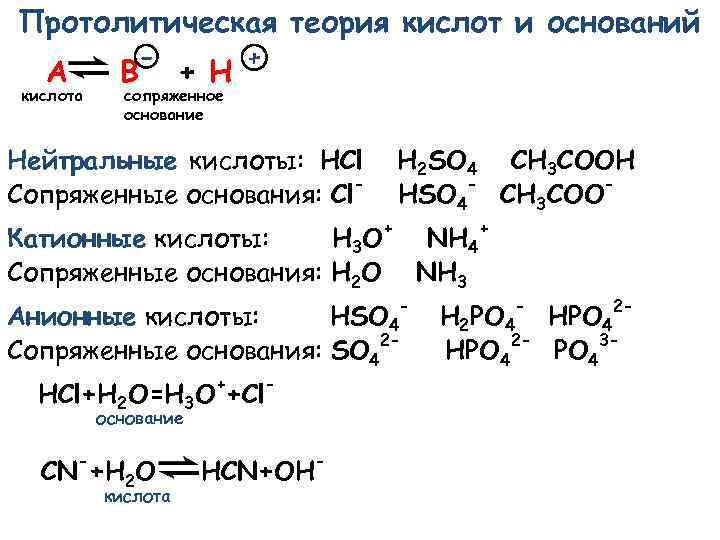 Протолитическая теория кислот и оснований - A кислота B + H + сопряженное основание Нейтральные кислоты: HCl Сопряженные основания: Cl- H 2 SO 4 CH 3 COOH HSO 4 - CH 3 COO- Катионные кислоты: H 3 O+ NH 4+ Сопряженные основания: H 2 O NH 3 - Анионные кислоты: HSO 4 Сопряженные основания: SO 42 HCl+H 2 O=H 3 O++Clоснование - CN +H 2 O кислота HCN+OH - - 2 - H 2 PO 4 HPO 42 - PO 43 -
Протолитическая теория кислот и оснований - A кислота B + H + сопряженное основание Нейтральные кислоты: HCl Сопряженные основания: Cl- H 2 SO 4 CH 3 COOH HSO 4 - CH 3 COO- Катионные кислоты: H 3 O+ NH 4+ Сопряженные основания: H 2 O NH 3 - Анионные кислоты: HSO 4 Сопряженные основания: SO 42 HCl+H 2 O=H 3 O++Clоснование - CN +H 2 O кислота HCN+OH - - 2 - H 2 PO 4 HPO 42 - PO 43 -
 Кислотой (Льюиса) называется всякая молекула или ион, способные присоединять электронную пару от другой молекулы или иона. Кислотой (Льюиса) называется акцептор электронной пары. Основанием (Льюиса) называется донор электронной пары, т. е. основанием считается всякая молекула или ион, способные обобществить имеющуюся у него электронную пару с какой - либо кислотой. BF 3 + : NH 3 к-та осн. → BF 3←: NH 3 Al 3+ + 6 H 2 O → [Al(H 2 O)6]3+ к-та осн. Ag+ + 2 CN- → [Ag(CN)2]-
Кислотой (Льюиса) называется всякая молекула или ион, способные присоединять электронную пару от другой молекулы или иона. Кислотой (Льюиса) называется акцептор электронной пары. Основанием (Льюиса) называется донор электронной пары, т. е. основанием считается всякая молекула или ион, способные обобществить имеющуюся у него электронную пару с какой - либо кислотой. BF 3 + : NH 3 к-та осн. → BF 3←: NH 3 Al 3+ + 6 H 2 O → [Al(H 2 O)6]3+ к-та осн. Ag+ + 2 CN- → [Ag(CN)2]-
 Определение Льюиса кислот и оснований применимо к значительно более широкому ряду соединений, чем по протолитической и электролитической теориям кислот и оснований.
Определение Льюиса кислот и оснований применимо к значительно более широкому ряду соединений, чем по протолитической и электролитической теориям кислот и оснований.
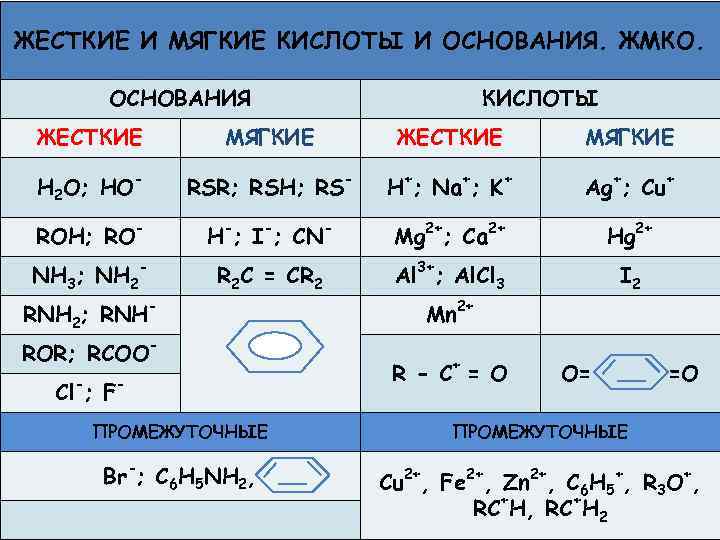 ЖЕСТКИЕ И МЯГКИЕ КИСЛОТЫ И ОСНОВАНИЯ. ЖМКО. ОСНОВАНИЯ КИСЛОТЫ ЖЕСТКИЕ МЯГКИЕ H 2 O; HO- RSR; RSH; RS- H+; Na+; K+ Ag+; Cu+ ROH; RO- H-; I-; CN- Mg 2+; Ca 2+ Hg 2+ NH 3; NH 2 - R 2 C = CR 2 Al 3+; Al. Cl 3 I 2 RNH 2; RNHROR; RCOO- Cl ; F - Mn 2+ R - C+ = O O= =O ПРОМЕЖУТОЧНЫЕ Br-; C 6 H 5 NH 2, Cu 2+, Fe 2+, Zn 2+, C 6 H 5+, R 3 O+, RC+H 2
ЖЕСТКИЕ И МЯГКИЕ КИСЛОТЫ И ОСНОВАНИЯ. ЖМКО. ОСНОВАНИЯ КИСЛОТЫ ЖЕСТКИЕ МЯГКИЕ H 2 O; HO- RSR; RSH; RS- H+; Na+; K+ Ag+; Cu+ ROH; RO- H-; I-; CN- Mg 2+; Ca 2+ Hg 2+ NH 3; NH 2 - R 2 C = CR 2 Al 3+; Al. Cl 3 I 2 RNH 2; RNHROR; RCOO- Cl ; F - Mn 2+ R - C+ = O O= =O ПРОМЕЖУТОЧНЫЕ Br-; C 6 H 5 NH 2, Cu 2+, Fe 2+, Zn 2+, C 6 H 5+, R 3 O+, RC+H 2

![[H+]=[OH-]=10 -7 моль/л; p. Н=7 нейтральная среда p. Н<7 [H+]>[OH-], [H+]>10 -7 моль/л; кислая [H+]=[OH-]=10 -7 моль/л; p. Н=7 нейтральная среда p. Н<7 [H+]>[OH-], [H+]>10 -7 моль/л; кислая](https://present5.com/presentation/328450171_437216909/image-35.jpg) [H+]=[OH-]=10 -7 моль/л; p. Н=7 нейтральная среда p. Н<7 [H+]>[OH-], [H+]>10 -7 моль/л; кислая среда p. Н>7 [H+]‹[OH-], [H+]‹ 10 -7 моль/л; щелочная среда р. Н + р. ОН = 14, р. Кw=14 – показатель константы автопротолиза
[H+]=[OH-]=10 -7 моль/л; p. Н=7 нейтральная среда p. Н<7 [H+]>[OH-], [H+]>10 -7 моль/л; кислая среда p. Н>7 [H+]‹[OH-], [H+]‹ 10 -7 моль/л; щелочная среда р. Н + р. ОН = 14, р. Кw=14 – показатель константы автопротолиза
 Произведение растворимости (Константа растворимости). растворимости
Произведение растворимости (Константа растворимости). растворимости

 Гидролиз солей Результат поляризационного взаимодействия ионов, на которые диссоциирует соль в растворе, и их гидратной оболочкой. Характер и степень гидролиза зависит от природы катионов и анионов. Kat. An+n. H 2 O z+ z- Kat (H 2 O)P+An (H 2 O)q
Гидролиз солей Результат поляризационного взаимодействия ионов, на которые диссоциирует соль в растворе, и их гидратной оболочкой. Характер и степень гидролиза зависит от природы катионов и анионов. Kat. An+n. H 2 O z+ z- Kat (H 2 O)P+An (H 2 O)q
 Гидролиз катионов Процесс обмена протона между гидратной оболочкой катиона и молекулами воды, находящимися в растворе. Гидролиз по катиону Al. Cl 3 Al 3++3 Cl. Al. Cl 3+HOH Al(OH)Cl 2+HCl Al(OH)Cl 2+HOH Al(OH)2 Cl+HCl Al(OH)2 Cl+HOH Al(OH)3+HCl Icт. IIIcт.
Гидролиз катионов Процесс обмена протона между гидратной оболочкой катиона и молекулами воды, находящимися в растворе. Гидролиз по катиону Al. Cl 3 Al 3++3 Cl. Al. Cl 3+HOH Al(OH)Cl 2+HCl Al(OH)Cl 2+HOH Al(OH)2 Cl+HCl Al(OH)2 Cl+HOH Al(OH)3+HCl Icт. IIIcт.
![[Al(H 2 O)6]3++HOH [Al(OH)(H 2 O)5]2++H+ [Al(H 2 O)5(OH)]2++HOH [Al(OH)2(H 2 O)4]++H+ [Al(OH)2(H 2 [Al(H 2 O)6]3++HOH [Al(OH)(H 2 O)5]2++H+ [Al(H 2 O)5(OH)]2++HOH [Al(OH)2(H 2 O)4]++H+ [Al(OH)2(H 2](https://present5.com/presentation/328450171_437216909/image-40.jpg) [Al(H 2 O)6]3++HOH [Al(OH)(H 2 O)5]2++H+ [Al(H 2 O)5(OH)]2++HOH [Al(OH)2(H 2 O)4]++H+ [Al(OH)2(H 2 O)4]++HOH [Al(OH)3(H 2 O)3]+H+ Al(OH)3 p. H<7 3+ 2+ + Al +HOH Al. OH +H Icт. Al. OH 2++HOH Al(OH)2++H+ IIcт. Al(OH)2++HOH Al(OH)3+H+ IIIcт.
[Al(H 2 O)6]3++HOH [Al(OH)(H 2 O)5]2++H+ [Al(H 2 O)5(OH)]2++HOH [Al(OH)2(H 2 O)4]++H+ [Al(OH)2(H 2 O)4]++HOH [Al(OH)3(H 2 O)3]+H+ Al(OH)3 p. H<7 3+ 2+ + Al +HOH Al. OH +H Icт. Al. OH 2++HOH Al(OH)2++H+ IIcт. Al(OH)2++HOH Al(OH)3+H+ IIIcт.
 Гидролиз соли по аниону Подобно катионам, анионы в водных растворах находятся в гидратированном состоянии. Анион Anсвязан с молекулами воды гидратной оболочки за счет водородных связей. I S 2 -+HOH HS-+OHNa 2 S+HOH Na. HS+Na. OH II HS-+HOH H 2 S+OHNa. HS+HOH H 2 S+Na. OH
Гидролиз соли по аниону Подобно катионам, анионы в водных растворах находятся в гидратированном состоянии. Анион Anсвязан с молекулами воды гидратной оболочки за счет водородных связей. I S 2 -+HOH HS-+OHNa 2 S+HOH Na. HS+Na. OH II HS-+HOH H 2 S+OHNa. HS+HOH H 2 S+Na. OH
 Гидролиз одновременно и по катиону и по аниону CH 3 COONH 4+HOH CH 3 COO-+NH 4++HOH CH 3 COOH+NH 4 OH Раствор нейтрален: K(CH 3 COOH)=1, 75· 10 -5 K(NH 4 OH)=1, 8· 10 -5 NH 4 CN+HOH NH 4 OH+HCN Раствор слабощелочной: K(NH 4 OH)>K(HCN) 7, 2· 10 -10
Гидролиз одновременно и по катиону и по аниону CH 3 COONH 4+HOH CH 3 COO-+NH 4++HOH CH 3 COOH+NH 4 OH Раствор нейтрален: K(CH 3 COOH)=1, 75· 10 -5 K(NH 4 OH)=1, 8· 10 -5 NH 4 CN+HOH NH 4 OH+HCN Раствор слабощелочной: K(NH 4 OH)>K(HCN) 7, 2· 10 -10
 Необратимый гидролиз 2 Al. Cl 3+3 Na 2 S+6 H 2 O→ 2 Al(OH)3↓+3 H 2 S↑ 6 Na. Cl Al 2 S 3+6 H 2 O→ 2 Al(OH)3+3 H 2 S↑ Карбонаты, сульфиды хрома, железа, алюминия
Необратимый гидролиз 2 Al. Cl 3+3 Na 2 S+6 H 2 O→ 2 Al(OH)3↓+3 H 2 S↑ 6 Na. Cl Al 2 S 3+6 H 2 O→ 2 Al(OH)3+3 H 2 S↑ Карбонаты, сульфиды хрома, железа, алюминия
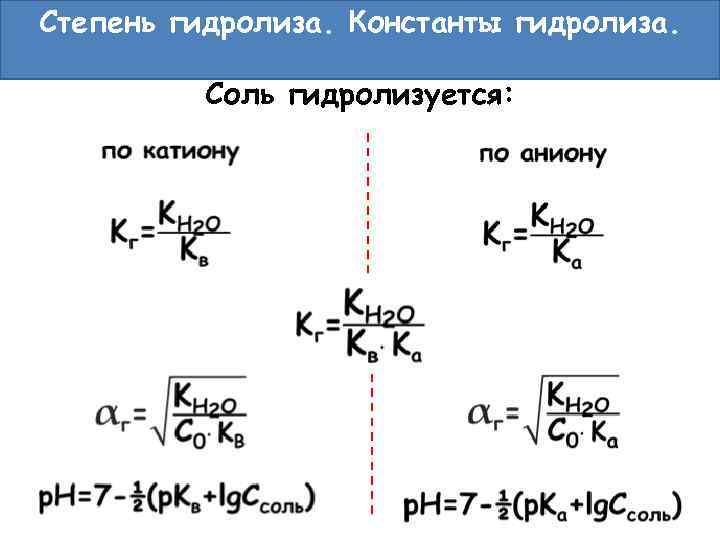 Степень гидролиза. Константы гидролиза. Соль гидролизуется:
Степень гидролиза. Константы гидролиза. Соль гидролизуется:
 Значение растворов в жизнедеятельности организмов: • Биожидкости участвуют в транспорте питательных веществ (жиров, аминокислот, кислорода). • В жидких средах организма поддерживается постоянство кислотности, концентрации солей и органических веществ.
Значение растворов в жизнедеятельности организмов: • Биожидкости участвуют в транспорте питательных веществ (жиров, аминокислот, кислорода). • В жидких средах организма поддерживается постоянство кислотности, концентрации солей и органических веществ.


