Лек.8. Растворы.pptx
- Количество слайдов: 93
Растворы Общие свойства растворов
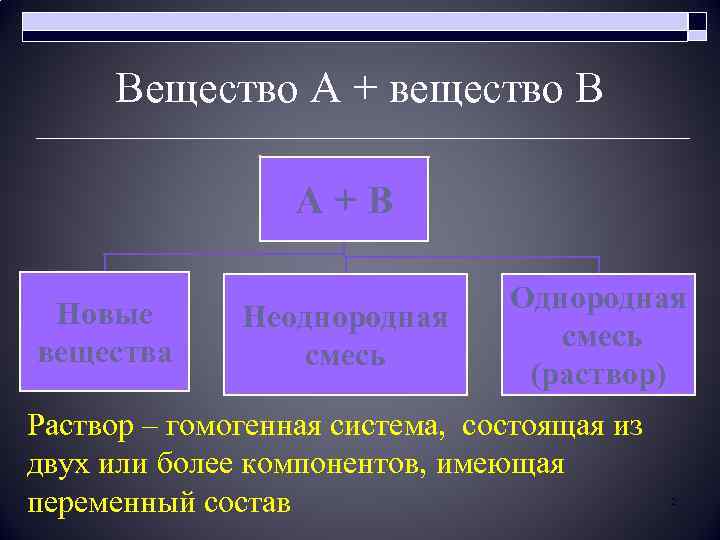
Вещество А + вещество В А + В Новые вещества Неоднородная смесь Однородная смесь (раствор) Раствор – гомогенная система, состоящая из двух или более компонентов, имеющая переменный состав 2

Дисперсными называют гетерогенные системы , в которых одно вещество в виде очень мелких частиц равномерно распределено в объеме другого • Вещество, которое в меньшем количестве и распределено в массе другого - дисперсная фаза • Вещество в объеме которого распределена дисперсная фаза, называется дисперсионной средой

Классификация по отсутствию или наличию взаимодействия между частицами в дисперсной фазе 1) свободнодисперсные системы - частицы дисперсной фазы не связаны между собой и могут свободно перемещаться по дисперсионной среде (суспензии, эмульсии, золи и др. ); 2) связнодисперсные системы - частицы дисперсной фазы закреплены в определенных точках пространства и не могут свободно перемещаться по дисперсионной среде (твердые пены, студни, твердые растворы).

Классификация по степени взаимодействия дисперсной фазы и дисперсионной среды 1) лиофильные (гидрофильные) растворы – системы, в которых частицы фазы взаимодействуют со средой (растворы мыл, некоторых белков, полисахариды, латекс). 2) лиофобные (гидрофобные) растворы – системы, в которых частицы фазы и среды не взаимодействуют (коллоидные растворы, эмульсии масел в воде).

Смеси веществ o o o Смеси Грубодисперсные системы (взвеси) Тонкодисперсные системы (коллоидные системы) Истинные растворы o Размеры частиц более 100 нм o 1 – 100 нм o менее 1 нм 6

По агрегатному состоянию фазы и среды o Дисперсионная среда – газообразная Дисперсная фаза: n n n o Дисперсионная среда – жидкая Дисперсная фаза: n n n o твердая – пыль, дым, порошок жидкая – смог, облако, туман газообразная – воздух, природный газ твердая – суспензия, паста жидкая – эмульсия газообразная – пена, газированная вода Дисперсионная среда – твердая Дисперсная фаза: n n n твердая – горные породы, цветные стекла, композиты жидкая – твердые эмульсии газообразная – твердые пены 7

Теория Думанского и Пескова • • Коллоидный раствор состоит из мицелл (твердая или дисперсная фаза) и интермицеллярной жидкости, которая содержит растворенные в ней электролиты и неэлектролиты (дисперсионная среда). Мицелла – это электрически нейтральная структурная единица коллоидного раствора.

Строение структурной единицы лиофобных коллоидов – мицеллы – может быть показано лишь схематически, поскольку мицелла не имеет определенного состава. Пример: строение коллоидной мицеллы на примере гидрозоля иодида серебра: Ag. NO 3 + KI Ag. I + KNO 3

Возможны два варианта: - реакция проводится в избытке KI, осадок будет адсорбировать ионы I-, приобретая ( -) заряд; - реакция проводится в избытке Ag. NO 3, осадок адсорбирует ионы Ag+, приобретая (+) заряд. Ионы, сообщающие заряд, называются потенциалопределяющими, а сам заряженный кристалл – ядром мицеллы.

Заряженное ядро притягивает из раствора ионы с противоположным зарядом – противоионы. Часть противоионов адсорбируется на поверхности ядра, образуя адсорбционный слой противоионов.

Ядро вместе с адсорбированными на нем противоионами называют коллоидной частицей или гранулой. Остальные противоионы, число которых определяется, исходя из правила электронейтральности мицеллы, составляют диффузный слой противоионов. 12


Мицелла золя Ag. I, полученного в избытке KI (потенциалопределяющие ионы – анионы I–, противоионы – ионы К+): {[Ag. I]m · n. I– · (n-x)K+}x– · x K+ Мицелла золя Ag. I, получении в избытке Ag. NO 3 (потенциалопределяющие ионы – катионы Ag+, противоионы – ионы NO 3+): {[Ag. I]m · n. Ag+ · (n-x)NO 3–}x+ · x NO 3–
![Схема мицеллы • {[Ag. I]m · n. I– · (n-x)K+}x– · x K+ ПОИ Схема мицеллы • {[Ag. I]m · n. I– · (n-x)K+}x– · x K+ ПОИ](https://present5.com/presentation/-76516864_340769011/image-15.jpg)
Схема мицеллы • {[Ag. I]m · n. I– · (n-x)K+}x– · x K+ ПОИ ПИ • ядро АС коллоидная частица (гранула) • мицелла ДС

Эффект Фарадея-Тиндаля (1857): - образование светового конуса при прохождении луча света через коллоидный раствор.


Истинные растворы 18

o o o Агрегатное состояние: газообразные, жидкие, твердые растворы Состав раствора: растворитель + растворенное вещество Параметры раствора: температура, давление, содержание растворенного вещества 19

Количественный состав раствора o o o o Массовая доля Молярная концентрация (молярность) Молярная концентрация эквивалента Коэффициент растворимости Мольная доля Массовая концентрация Моляльная концентрация (моляльность) 20

Растворы Идеальные n ΔV = 0; ΔQ = 0 o Реальные n ΔV ≠ 0 1 л H 2 O + 1 л C 2 H 5 OH → 1, 93 л раствора n ΔQ ≠ 0 o Qрастворение = – Qразрыв связей + Qобразование связей 21

Растворы o Ненасыщенные n o Вт → Вр Насыщенные n o Концентрация вещества меньше его растворимости Растворимость вещества – его концентрация в насыщенном растворе Вт Вр; истинное равновесие Пересыщенные n Вр; метастабильное равновесие Концентрация вещества больше его растворимости 22

Гетерогенные ионные равновесия М+ + А– МА(т) М+ + А– o Для малорастворимых сильных электролитов: o Kс = [M+][A–] = ПР(МА) (произведение растворимости) o В общем виде: Мх. Ау(т) х Ма+ + у Аb– ПР = [Ma+]x [Ab–]y ПР = const при T = const ПР = f (T) 23
![Растворимость (L), моль/л Мх. Ау(т) х Ма+ + у Аb– [Ma+] = x L; Растворимость (L), моль/л Мх. Ау(т) х Ма+ + у Аb– [Ma+] = x L;](https://present5.com/presentation/-76516864_340769011/image-24.jpg)
Растворимость (L), моль/л Мх. Ау(т) х Ма+ + у Аb– [Ma+] = x L; [Ab–] = y L ПР(Мх. Ау) = (x L)x (y L)y = xx yy Lx+y 24

Задача Рассчитать растворимость сульфата серебра, если ПР(Ag 2 SO 4) = 1, 2. 10– 5 o Ag 2 SO 4(т) 2 Ag+ + SO 42– L 2 L L o ПР = [Ag+ ]2 [SO 42–] = (2 L)2 L = 4 L 3 25
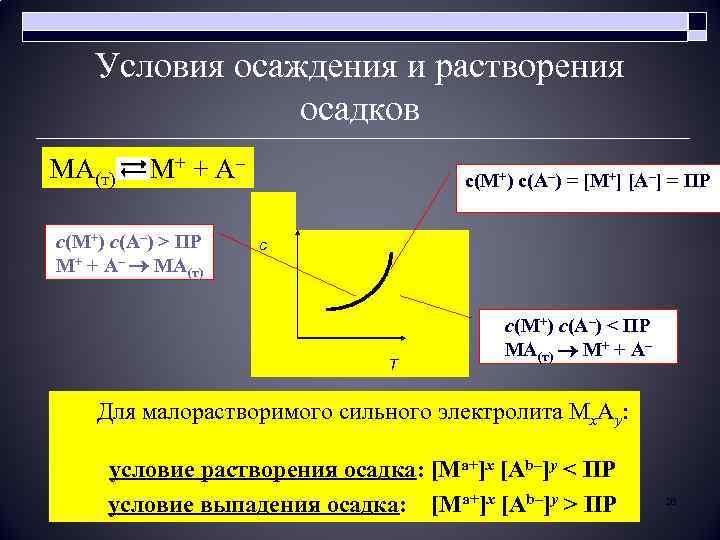
Условия осаждения и растворения осадков МА(т) М+ + А– с(М+) с(А–) > ПР М+ + А– МА(т) с(М+) с(А–) = [M+] [А–] = ПР с Т с(М+) с(А–) < ПР МА(т) М+ + А– Для малорастворимого сильного электролита Мх. Ay условие растворения осадка: [Ma+]x [Ab–]y < ПР условие выпадения осадка: [Ma+]x [Ab–]y > ПР 26

Введение одноименного иона Мх. Ау(т) х Ма+ + у Аb– Увеличение C (Ма+) или C (Аb–) Сдвиг равновесия в сторону образования осадка 27

Удаление одноименного иона Мх. Ау(т) х Ма+ + у Аb– Уменьшение C (Ма+) или C (Аb–) Сдвиг равновесия в сторону растворения осадка 28

Удаление одноименного иона o o o Связывание в виде менее растворимого вещества (осадок Ag. Cl осадок Ag. I) Связывание в виде комплексного иона (осадок Pb. SO 4 [Pb(OH)4]2–) Перевод в другую форму (осадок Ba. Cr. O 4 Cr 2 O 72–) 29

Переосаждение PO 43– Ag 2 SO 4(т) Ag 3 PO 4(т) SO 42– 3 Ag 2 SO 4(т) + 2 PO 43– 2 Ag 3 PO 4(т) + 3 SO 42– (1) KС = [SO 42–]3 / [ PO 43–]2 Ag 2 SO 4(т) 2 Ag+ + SO 42– (2) ПР 1 = [Ag+]2[SO 42–] Ag 3 PO 4(т) 3 Ag+ + PO 43– (3) ПР 2 = [Ag+]3[PO 43–] (1) = 3(2) – 2(3) KС = (ПР 1)3 / (ПР 2)2 ~ (10– 5)3/(10– 18)2 > 1

В каком минимальном объеме воды можно растворить 1 г гипса? o Условие задачи Уравнение фазового равновесия V(H 2 O) = ? m(Ca. SO 4. 2 H 2 O) = 1 г Са 2+ + SО 42– Ca. SO 4(т) ПР(Ca. SO 4) = 4. 10– 5 M(Ca. SO 4. 2 H 2 O) = 172 г/моль ПР(Ca. SO 4) = [Ca 2+] [SO 42–] = C 2 V(H 2 O) = n / C = m / ( M C ) = m / (M ПР) ~ 0, 920 л 31

Коллигативные свойства растворов o o Некоторые физические свойства разбавленных растворов зависят от числа растворенных частиц в растворе, а не от их химического состава. Так как эти свойства обусловлены коллективным влиянием растворенных частиц, их принято называть коллигативными - от латинского colligatus, что означает собирать. 32

Коллигативные свойства растворов o К ним относят: - понижения давления пара над раствором; - повышение температуры кипения растворов; - понижение температуры замерзания растворов; - осмотическое давление. 33

а) понижение давления пара, над раствором. o В результате испарения над жидкостью образуется пар. o Эндотермический - процесс испарения протекает обратимо, одновременно с экзотермическим процессом конденсации. 34

o При определенных условиях устанавливается равновесие (ΔG = 0). {H 2 O} ↔ (H 2 O) вода пар o Пар, находящийся в равновесии с жидкостью называется насыщенным. 35

o o Жидкость закипает, когда давление ее пара становится равным атмосферному. При растворении в жидкости какого-либо нелетучего вещества давление пара растворителя над полученным раствором всегда меньше давления пара чистого растворителя. 36
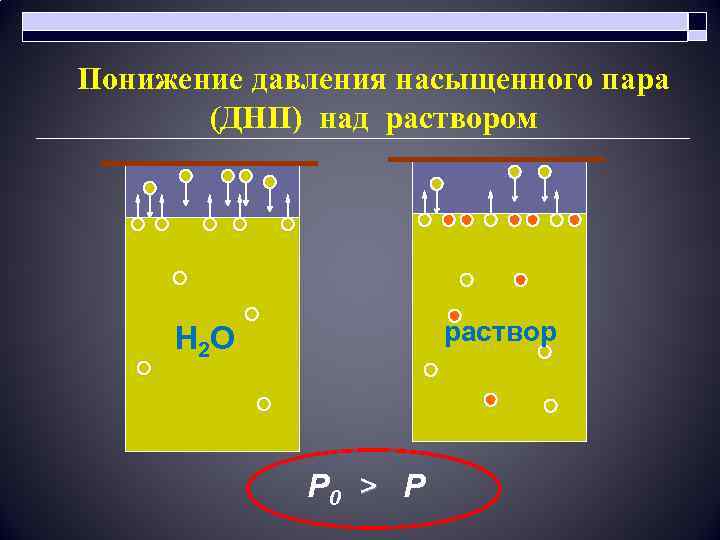
Понижение давления насыщенного пара (ДНП) над раствором раствор Н 2 О Р 0 > Р

Применительно к разбавленным растворам французский химик Рауль сформулировал 2 закона. o 1 -й закон Рауля: - относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества. o 38

P 1 - давление насыщенного пара над растворителем, Р - давление насыщенного пара над раствором, n 1 - число моль растворителя, n 2 - число моль растворенного вещества, 39

Δ Р = Р 1 - Р - абсолютное понижение давления пара o o - относительное понижение давления. Из закона Рауля следует, что понижения давления пара разбавленного раствора не зависит от природы растворенного вещества, а зависит только от концентрации раствора. 40

o б) повышение температуры кипения и понижение температуры замерзания. В прямой зависимости от давления насыщенного пара раствора нелетучего вещества находится температура кипения раствора. 41

o Температурой кипения жидкости является температура, при которой давление ее паров становится равным внешнему давлению (при 101 к. Па температура кипения воды =100°С, бензола = 80°С). 42

o Понижение давления пара растворителя в результате растворения в нем вещества означает необходимость повышения температуры раствора для восстановления нарушенного равновесия жидкость - пар, чтобы довести давление насыщенного пара до первоначального. 43

o o Температура замерзания раствора ниже температуры замерзания растворителя, что также связано с понижением давления пара над раствором. Температура замерзания (отвердевания, кристаллизации) - это температура, при которой давление пара над жидкостью становится равным давлению пара над твердой фазой. 44

o o 2 -й закон Рауля: понижение температуры замерзания или повышение температуры кипения растворов прямо пропорционально их моляльной концентрации. Математические выражения:

o o К (криоскопическая константа) и Е (эбуллиоскопическая константа) являются характеристиками данного растворителя и показывают понижение температуры замерзания или повышение температуры кипения, вызываемое растворением 1 моль вещества в 1 кг этого растворителя. Величины табличные для каждого растворителя. 46

Константы зависят от природы растворителя. При C = 1 моль/кг К = ΔТзам Е = ΔТкип КН 2 О = 1, 86 кг·К/моль ЕН 2 О = 0, 52 кг·К/моль Чем больше концентрация растворенного вещества, тем выше Ткип и ниже Тзам раствора.

Повышение ΔТкип и понижение ΔТзам разбавленных растворов неэлектролитов прямо пропорционально моляльной концентрации раствора. ΔТкип = Е·Сm ΔТзам = К·Сm ΔТзам = Тзам. р-ля – Тзам. р-ра ΔТкип = Ткип. р-ра – Ткип. р-ля

Криометрия –метод определения молярной массы вещества (М) по температуре замерзания: К · m вещ-ва М вещ-ва = —————— (г/моль) ΔТзам·m раст-ля (кг)

o Математические зависимости для коллигативных свойств для разбавленных растворов электролитов включает изотонический коэффициент (i): i = 1 - (1 - n) (ур-ие Вант-Гоффа) ΔТ = i k C (сл. из з-на Рауля)

o o o где - степень электролитической диссоциации электролита n - число ионов, на которые распадается каждая молекула электролита k - коэффициент. 51

Изотонический коэффициент показывает, во сколько раз наблюдаемые на опыте параметры растворов кислот, оснований и солей больше тех же самых величин, вычисленных на основании уравнений Вант. Гоффа и Рауля.
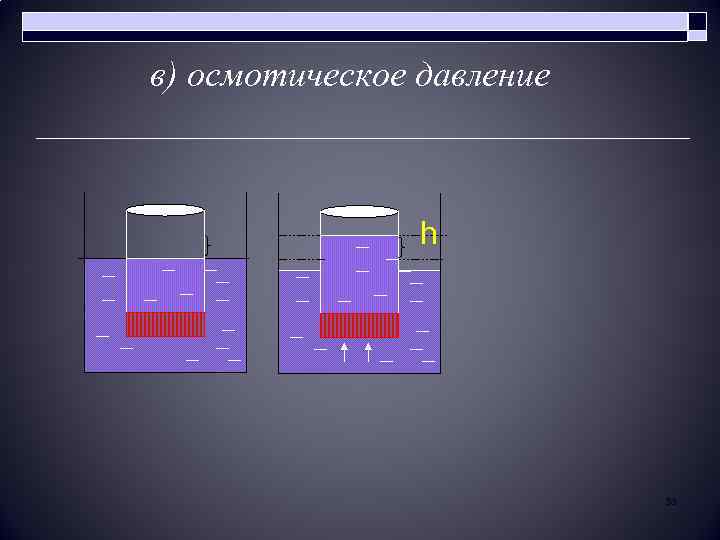
в) осмотическое давление h 53

o o В большой сосуд с чистым растворителем опущен сосуд с раствором, нижняя половина которого представляет собой полупроницаемую мембрану, пропускающую только молекулы растворителя. Через некоторое время наблюдается значительное повышение уровня жидкости в маленьком сосуде.

o Осмос - самопроизвольная диффузия растворителя через полупроницаемую мембрану в раствор. o Давление, которое нужно приложить к раствору, чтобы прекратить осмос, называется - осмотическим давлением (Росм).

o Уравнение Вант – Гоффа Росм = См • R • Т где: См - молярная концентрация растворенного вещества, R - универсальная газовая постоянная, Т - абсолютная температура. 56

o На практике Pосм определяют по ΔТзам раствора (C(x) ≈ Cm): R * T * ΔТз Pосм = Кз 57

o Растворы с осмотическим давлением равным осмотическому давлению раствора взятому за стандарт, называются изотоническими, растворы с более высоким Росм. , чем в стандарте – гипертоническими, с меньшим Росм – гипотоническими. 58

Протолитическая теория кислот и оснований 1923 г. Йоханес Брёнстед Томас Лаури

Протолитическая теория o Кислотные или основные свойства частиц обусловлены их способностью отдавать или присоединять катион водорода (протон Н+) Н+ Н+ NH 4+ + S 2– NH 3 + HS– Кт Ос Кт Пары "сопряженная кислота / сопряженное основание": NH 4+/NH 3 и HS–/ S 2– 60
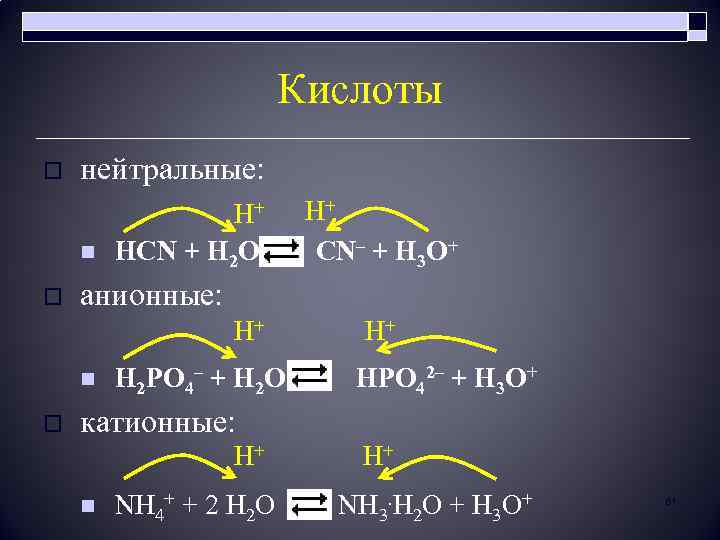
Кислоты o нейтральные: n o H+ H+ HCN + H 2 O CN– + H 3 O+ анионные: H+ n o H+ H 2 PO 4– + H 2 O HPO 42– + H 3 O+ катионные: H+ n H+ NH 4+ + 2 H 2 O NH 3. H 2 O + H 3 O+ 61

Основания o нейтральные: H+ n o NH 3. H 2 O + H 2 O NH 4+ + OH– + H 2 O анионные: H+ n o H+ H+ CN– + H 2 O HCN + OH– катионные: H+ n H+ N 2 H 5+ + H 2 O N 2 H 62+ + OH– 62
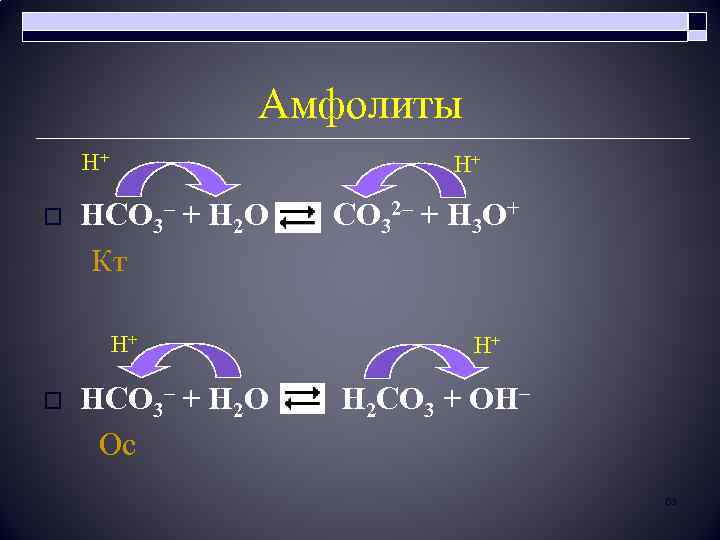
Амфолиты Н+ Н+ HCO 3– + H 2 O CO 32– + H 3 O+ Кт o Н+ Н+ HCO 3– + H 2 O H 2 CO 3 + OH– Ос o 63

Ионное произведение воды H+ H+ H 2 O H 3 O+ + OH– При стандартной температуре 298 К (25 С): o KB (Kw) = [H 3 O+] [OH–] = 1. 10– 14 В чистой воде при 25 С [H 3 O+] = [OH–] = KB = 10– 7 моль/л o 64
![Водородный показатель (р. Н) o o р. Н = –lg[H 3 O+] = 10–р. Водородный показатель (р. Н) o o р. Н = –lg[H 3 O+] = 10–р.](https://present5.com/presentation/-76516864_340769011/image-65.jpg)
Водородный показатель (р. Н) o o р. Н = –lg[H 3 O+] = 10–р. Н Гидроксидный показатель (р. ОН) o p. OH = –lg[OH–] o [OH–] = 10–р. ОН o р. Н + р. ОН = –lg. KB = 14 65

Водородный показатель (р. Н) o В чистой воде при 25 С n n o Если [H 3 O+] > 1. 10– 7, то р. Н < 7 n o р. Н = р. ОН = 7 Среда нейтральная Среда кислотная Если [OH–] > 1. 10– 7, то р. ОН < 7 и p. H > 7 n Среда щелочная 66
![Шкала р. Н o При [H 3 O+] = 0, 1 моль/л (например, в Шкала р. Н o При [H 3 O+] = 0, 1 моль/л (например, в](https://present5.com/presentation/-76516864_340769011/image-67.jpg)
Шкала р. Н o При [H 3 O+] = 0, 1 моль/л (например, в 0, 1 М растворе HCl) p. H = 1 (нижний предел? ). o При [OH–] = 0, 1 моль/л (например, в 0, 1 М растворе KOH) р. Н = 13 (верхний предел? ). 67

Константа кислотности H+ H+ HA + H 2 O A– + H 3 O+ 68

o o o Сопряженная пара СН 3 СООН / СН 3 СОО– Al 3+. H 2 O / Al. OH 2+ H 2 S / HS– B(OH)3. H 2 O / [B(OH)4]– KК 1, 7. 10– 5 9, 6. 10– 6 1, 1. 10– 7 5, 8. 10– 10 Сила кислоты Слабые кислоты СН 3 СООН + Н 2 О СН 3 СОО– + H 3 O+ Al 3+. H 2 O + H 2 O Al. OH 2+ + H 3 O+ H 2 S + H 2 O HS– + H 3 O+ B(OH)3. H 2 O + H 2 O [B(OH)4]– + H 3 O+ 69

Сильные кислоты H+ o o HA + H 2 O = A– + H 3 O+ Бескилородные кислоты: HCl, HBr, HI Кислородсодержащие кислоты состава Нх. ЭОу (если у – х 2). Протолиз сильных кислот необратим. Анионы сильных кислот являются непротолитами и не участвуют в реакциях протолиза. 70
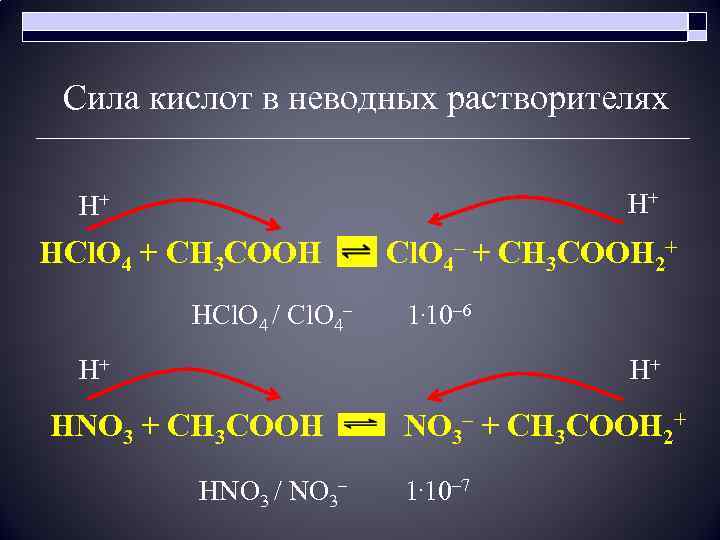
Сила кислот в неводных растворителях H+ H+ HCl. O 4 + CH 3 COOH Cl. O 4– + CH 3 COOH 2+ HCl. O 4 / Cl. O 4– 1. 10– 6 H+ H+ HNO 3 + CH 3 COOH NO 3– + CH 3 COOH 2+ HNO 3 / NO 3– 1. 10– 7

Константа основности H+ H+ A– + H 2 O HA + ОН– 72

Слабые основания Уравнение реакции протолиза H+ NH 3·H 2 O + H 2 O NH 4+ + OH– + H 2 O H+ NH 4+/ NH 3·H 2 O H+ SO 32– + H 2 O HSO 3– + OH– H+ KО HSO 3– / SO 32– H+ HSO 3– + H 2 O SO 2∙H 2 O + OH– SO 2∙H 2 O / HSO 3– Сила основания H+ Сопряженная пара 1, 8 · 10– 5 1, 6. 10– 7 6, 0. 10– 13 73

Сильные основания o Анионы: n n n o амид-ион NH 2– метилат-ион CH 3 O– и другие алкоголят-ионы гидроксид-ион ОН– Соединения, дающие эти ионы при диссоциации n n n MOH, где М – щелочной элемент или Tl(I) M(OH)2, где М – Ba, Ra и др. Катионы – непротолиты! 74

Малорастворимые гидроксиды Ni(OH)2(т) Ni 2+ + 2 OHСлабое основание? Сильное основание? ПР = [Ni 2+][OH—]2 75
![Связь Kк и Ko для пары НА/А– [H 3 O+] [A–] [HA] [OH–] KК Связь Kк и Ko для пары НА/А– [H 3 O+] [A–] [HA] [OH–] KК](https://present5.com/presentation/-76516864_340769011/image-76.jpg)
Связь Kк и Ko для пары НА/А– [H 3 O+] [A–] [HA] [OH–] KК KO = –––––––––– = [H 3 O+] [OH–] = KB [HA] [A–] KO = KB / KК 76

Степень протолиза ( ) – отношение числа частиц, подвергшихся протолизу, к исходному числу частиц Для реакции протолиза слабой кислоты: H+ H+ HA + H 2 O A– + H 3 O+ ([H 3 O+] = [A–] при отсутствии в растворе других протолитов) 77

Закон разбавления Оствальда При << 1 ( < 0, 05): 78

Учет автопротолиза воды H+ H+ HA + H 2 O A– + H 3 O+ H+ H+ H 2 O OH– + H 3 O+ 79
![Учет автопротолиза воды Kк. C 0 – Kк[A–] = [A–][H 3 O+] 80 Учет автопротолиза воды Kк. C 0 – Kк[A–] = [A–][H 3 O+] 80](https://present5.com/presentation/-76516864_340769011/image-80.jpg)
Учет автопротолиза воды Kк. C 0 – Kк[A–] = [A–][H 3 O+] 80
![Учет автопротолиза воды При бесконечном разбавлении: C 0 → 0; [H 3 O+] → Учет автопротолиза воды При бесконечном разбавлении: C 0 → 0; [H 3 O+] →](https://present5.com/presentation/-76516864_340769011/image-81.jpg)
Учет автопротолиза воды При бесконечном разбавлении: C 0 → 0; [H 3 O+] → 10– 7 моль/л o при Kк ≥ 10– 5 α → 1 при Kк = 10– 7 α → 0, 5 81

Определите р. Н в 0, 001 М растворе серной кислоты. 2 H+ H 2 SO 4 + 2 H 2 O = SO 42 + 2 H 3 O+ C 0(H 2 SO 4) = 0, 001 моль л p. H = –lg [H 3 O+] = – lg(2 c 0) = – lg (2. 10– 3) = 2, 7 82

Определите р. Н в 0, 002 М растворе хлорноватистой кислоты при 25 °C. H+ H+ HCl. O + H 2 O Cl. O– + Н 3 O+; Kк = 2, 82. 10– 8 [Cl. O–] = [H 3 O+]; [HCl. O] = C 0

Определите p. H в 0, 002 М растворе аммиака при 25 °С H+ H+ NH 3·H 2 O + H 2 O NH 4+ + OH– + H 2 O o o o KK = 5, 75. 10– 10 KB = 1. 10– 14 [NH 4+] = [OH–]; [NH 3. H 2 O] = C 0

Обратимый гидролиз солей 1. Диссоциация 2. Протолиз

Гидролиз солей o KCl = K+ + Cl– непротолиты Нет гидролиза, нейтральная среда, р. Н 7 NH 4 NO 3 = NH 4+ + NO 3– Кт непротолит o H+ H+ NH 4+ + 2 H 2 O NH 3. H 2 O + H 3 O+ Гидролиз по катиону, кислотная среда, p. H < 7 86

Гидролиз солей o Zn. SO 4 = Zn 2+ + SO 42– H+ H+ Zn 2+. H 2 O + H 2 O Zn. OH+ + H 3 O+ Гидролиз по катиону, кислотная среда, р. Н < 7 o KNO 2 = K+ + NO 2– H+ H+ NO 2– + H 2 O HNO 2 + OH– Гидролиз по аниону, щелочная среда, p. H > 7 87
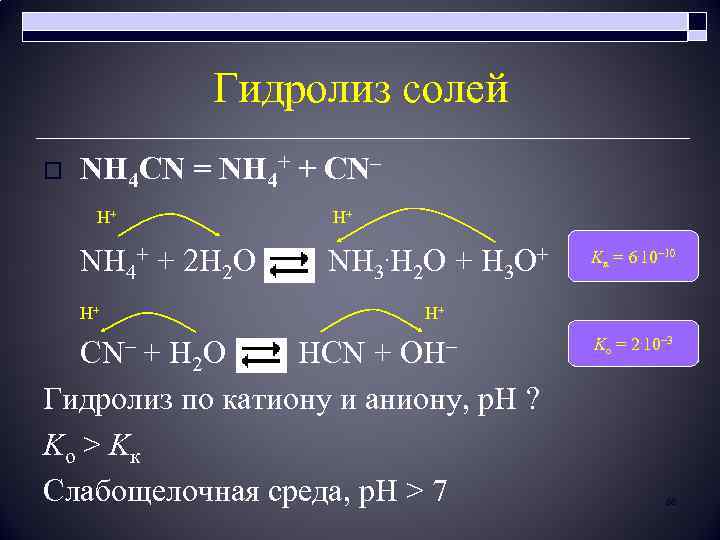
Гидролиз солей o NH 4 CN = NH 4+ + CN– H+ H+ NH 4+ + 2 H 2 O NH 3. H 2 O + H 3 O+ H+ CN– + H Kк = 6. 10– 10 H+ O HCN + OH– 2 Гидролиз по катиону и аниону, р. Н ? Ko > Kк Слабощелочная среда, p. H > 7 Ko = 2. 10– 3 88
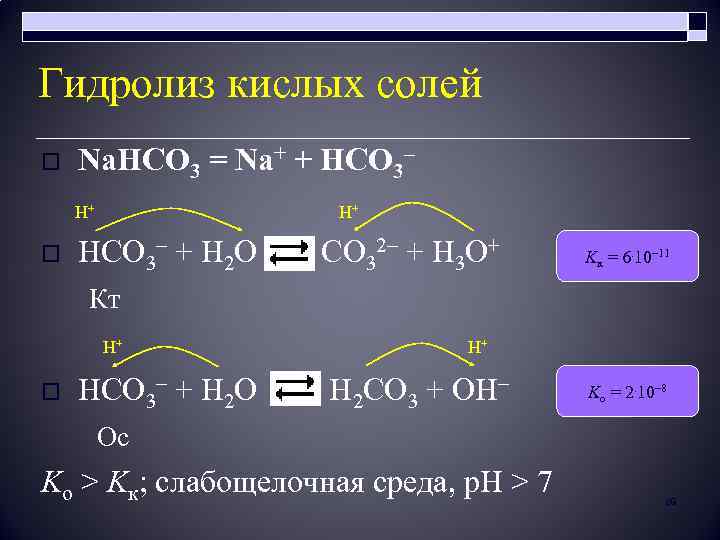
Гидролиз кислых солей o Na. HCO 3 = Na+ + HCO 3– H+ H+ HCO 3– + H 2 O CO 32– + H 3 O+ Кт o H+ H+ HCO 3– + H 2 O H 2 CO 3 + OH– Ос Ko > Kк; слабощелочная среда, p. H > 7 o Kк = 6. 10– 11 Ko = 2. 10– 8 89

Необратимый гидролиз o Al 2 S 3(т) + 6 H 2 O = 2 Al(OH)3↓ + 3 H 2 S↑ o Совместный гидролиз: n 2 Al 3+ +3 S 2– + 6 H 2 O = 2 Al(OH)3↓ + 3 H 2 S↑ 90

Определите р. Н 0, 1 М раствора хлорида железа(III). o Fe. Cl 3 = Fe 3+ + 3 Cl– H+ H+ Fe 3+. H 2 O + H 2 O Fe. OH 2+ + H 3 O+ [H 3 O+] [Fe. OH 2+] [H 3 O+]2 Kк = ––––––– = ––––– (если считать [Fe 3+] = C 0) [Fe 3+] C 0 _____ p. H = – lg[H 3 O+] = –lg Kк C 0 = – lg 7. 10– 3. 10– 1 = 1, 6 91

Определите р. Н раствора, содержащего 0, 001 моль/л уксусной кислоты и 0, 1 моль/л ацетата натрия. p. H = – lg[H 3 O+] = – lg x = –lg(Kк C 0 /C 1) = = – lg 1, 8 10– 5 10– 3/10– 1 = 6, 7 При разбавлении раствора р. Н не меняется! Буферный раствор 92

Кислотно-основные индикаторы Индикатор Метиловый оранжевый Цвет сопряженной кислоты Интервал p. H Цвет сопряженного основания красный 3, 1– 4, 4 оранжевожёлтый красный 5, 0– 8, 0 синий Бромтимоловый синий жёлтый 6, 0– 7, 6 синий Фенолфталеин бесцветный 8, 2– 10, 0 малиновокрасный Лакмус 93
Лек.8. Растворы.pptx