Phys_Chem_Biol_4_2013.pptx
- Количество слайдов: 45
 Растворы электролитов Пропускание тока через раствор электролита сопровождается разложением растворенного вещества и выделением его составляющих (или их продуктов) на электродах. Т. о. движение заряда в таком растворе сопровождается движением атомов или групп атомов – частей растворенного вещества. Выделение происходит на обоих электродах, в эквивалентных количествах. Законы Фарадея 1 2 Ag H Cu Zn A. м. (г) 108 1 64 65 k (мг/к) 1. 118 0. 01 0. 32 0. 34 1/F=1. 037 10 -5 г/к, F=96500 к Если пропустить 1 F электричества, то выделяется m=(A. м. )/n вещества Элементарный электрический заряд: наименьшее количество электричества, существующее в природе (Гельмгольц) 1
Растворы электролитов Пропускание тока через раствор электролита сопровождается разложением растворенного вещества и выделением его составляющих (или их продуктов) на электродах. Т. о. движение заряда в таком растворе сопровождается движением атомов или групп атомов – частей растворенного вещества. Выделение происходит на обоих электродах, в эквивалентных количествах. Законы Фарадея 1 2 Ag H Cu Zn A. м. (г) 108 1 64 65 k (мг/к) 1. 118 0. 01 0. 32 0. 34 1/F=1. 037 10 -5 г/к, F=96500 к Если пропустить 1 F электричества, то выделяется m=(A. м. )/n вещества Элементарный электрический заряд: наименьшее количество электричества, существующее в природе (Гельмгольц) 1
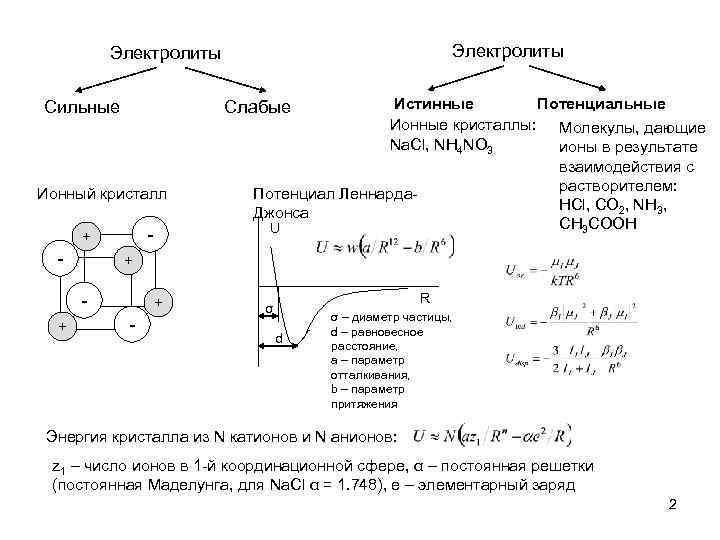 Электролиты Сильные Ионный кристалл - + + Истинные Потенциальные Ионные кристаллы: Молекулы, дающие Na. Cl, NH 4 NO 3 ионы в результате взаимодействия с растворителем: Потенциал Леннарда. HCl, CO 2, NH 3, Джонса CH 3 COOH U Слабые + - R σ d σ – диаметр частицы, d – равновесное расстояние, a – параметр отталкивания, b – параметр притяжения Энергия кристалла из N катионов и N анионов: z 1 – число ионов в 1 -й координационной сфере, α – постоянная решетки (постоянная Маделунга, для Na. Cl α = 1. 748), e – элементарный заряд 2
Электролиты Сильные Ионный кристалл - + + Истинные Потенциальные Ионные кристаллы: Молекулы, дающие Na. Cl, NH 4 NO 3 ионы в результате взаимодействия с растворителем: Потенциал Леннарда. HCl, CO 2, NH 3, Джонса CH 3 COOH U Слабые + - R σ d σ – диаметр частицы, d – равновесное расстояние, a – параметр отталкивания, b – параметр притяжения Энергия кристалла из N катионов и N анионов: z 1 – число ионов в 1 -й координационной сфере, α – постоянная решетки (постоянная Маделунга, для Na. Cl α = 1. 748), e – элементарный заряд 2
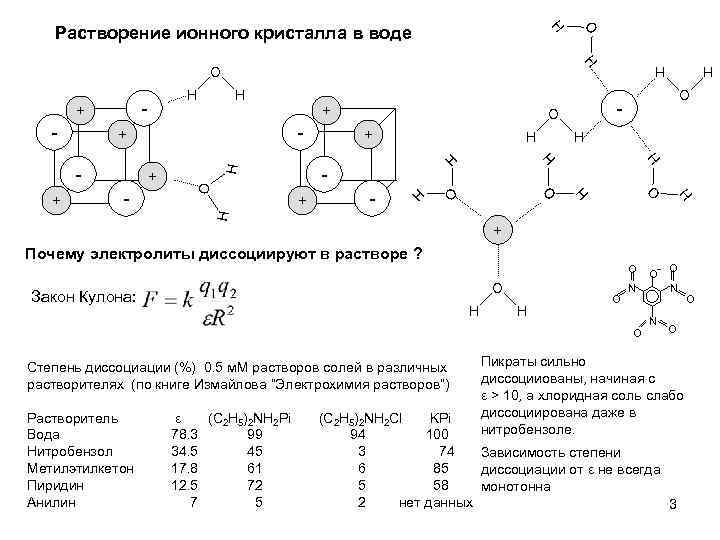 - + H H O - H H + O - H + + O - H H + O + Почему электролиты диссоциируют в растворе ? O O Закон Кулона: H H O Степень диссоциации (%) 0. 5 м. М растворов солей в различных растворителях (по книге Измайлова “Электрохимия растворов”) ε (C 2 H 5)2 NH 2 Pi 78. 3 99 34. 5 45 17. 8 61 12. 5 72 7 5 O- N O Растворитель Вода Нитробензол Метилэтилкетон Пиридин Анилин H + O H H H + - H H H O - O H Растворение ионного кристалла в воде O N N O Пикраты сильно диссоцииованы, начиная с ε > 10, а хлоридная соль слабо диссоциирована даже в нитробензоле. (C 2 H 5)2 NH 2 Cl KPi 94 100 3 74 Зависимость степени 6 85 диссоциации от ε не всегда 5 58 монотонна 2 нет данных 3 O
- + H H O - H H + O - H + + O - H H + O + Почему электролиты диссоциируют в растворе ? O O Закон Кулона: H H O Степень диссоциации (%) 0. 5 м. М растворов солей в различных растворителях (по книге Измайлова “Электрохимия растворов”) ε (C 2 H 5)2 NH 2 Pi 78. 3 99 34. 5 45 17. 8 61 12. 5 72 7 5 O- N O Растворитель Вода Нитробензол Метилэтилкетон Пиридин Анилин H + O H H H + - H H H O - O H Растворение ионного кристалла в воде O N N O Пикраты сильно диссоцииованы, начиная с ε > 10, а хлоридная соль слабо диссоциирована даже в нитробензоле. (C 2 H 5)2 NH 2 Cl KPi 94 100 3 74 Зависимость степени 6 85 диссоциации от ε не всегда 5 58 монотонна 2 нет данных 3 O
 Вывод законов Фарадея из представлений о ионах 2 1 1+2 Масса выделившегося вещества ? – массе одной частицы, умноженной на число частиц: Масса одной частицы: Итак, Произведение силы тока на время – это величина перенесенного заряда, т. е. произведение элементарного заряда, заряда (валентности) иона и числа перенесенных частиц: → Получим объединенный закон Фарадея: 4
Вывод законов Фарадея из представлений о ионах 2 1 1+2 Масса выделившегося вещества ? – массе одной частицы, умноженной на число частиц: Масса одной частицы: Итак, Произведение силы тока на время – это величина перенесенного заряда, т. е. произведение элементарного заряда, заряда (валентности) иона и числа перенесенных частиц: → Получим объединенный закон Фарадея: 4
 Гидратация и сольватация ионов в растворах электролитов Растворение электролитов, как правило, экзотермический процесс, тогда как получение ионов в газовой фазе требует очень больших затрат энергии. Отсюда – представления о гидратации и сольватации: образованием каких-то связей между ионами и молекулами растворителя, что и делает этот процесс энергетически выгодным Пример: Cu. Cl 2 cr Cu 2+, aq + 2 Cl-, aq ΔH= -50 к. Дж/моль Cu. Cl 2 cr Cu 2+, gas + 2 Cl-, gas ΔH= +1986 к. Дж/моль Гидратация катионов – взаимодействие с неподеленными электронными парами кислорода в молекуле воды. Катионы s и p элементов – ион-дипольное взаимодействие, катионы переходных металлов – донорно-акцепторная связь за счет перехода электронов атома кислорода на вакантные связывающие орбитали катионов металлов. Гидратация анионов – за счет образования водородных связей с частичным переходом электронной плотности с аниона на молекулу воды. Сольватация: катионы взаимодействуют с донорными функциональными группами или атомами растворителей, а анионы – с акцепторными. Соответственно, основные (по Льюису) растворители склонны сольватировать катионы, а кислотные – анионы. 5
Гидратация и сольватация ионов в растворах электролитов Растворение электролитов, как правило, экзотермический процесс, тогда как получение ионов в газовой фазе требует очень больших затрат энергии. Отсюда – представления о гидратации и сольватации: образованием каких-то связей между ионами и молекулами растворителя, что и делает этот процесс энергетически выгодным Пример: Cu. Cl 2 cr Cu 2+, aq + 2 Cl-, aq ΔH= -50 к. Дж/моль Cu. Cl 2 cr Cu 2+, gas + 2 Cl-, gas ΔH= +1986 к. Дж/моль Гидратация катионов – взаимодействие с неподеленными электронными парами кислорода в молекуле воды. Катионы s и p элементов – ион-дипольное взаимодействие, катионы переходных металлов – донорно-акцепторная связь за счет перехода электронов атома кислорода на вакантные связывающие орбитали катионов металлов. Гидратация анионов – за счет образования водородных связей с частичным переходом электронной плотности с аниона на молекулу воды. Сольватация: катионы взаимодействуют с донорными функциональными группами или атомами растворителей, а анионы – с акцепторными. Соответственно, основные (по Льюису) растворители склонны сольватировать катионы, а кислотные – анионы. 5
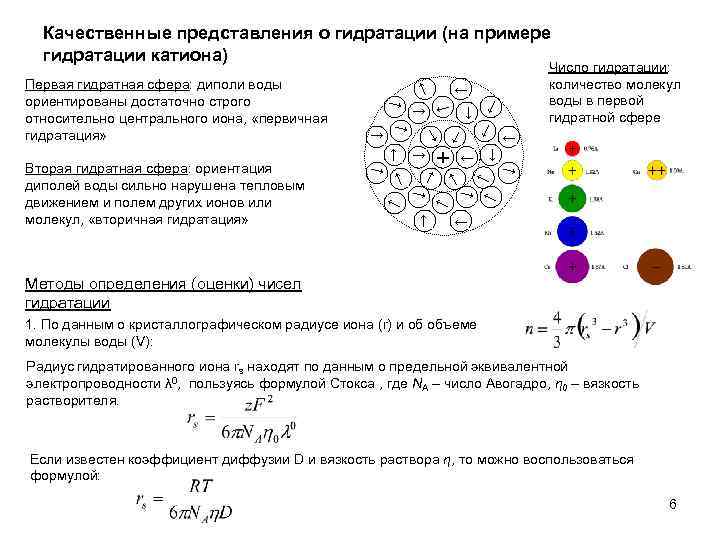 Качественные представления о гидратации (на примере гидратации катиона) ← ← ← + ← ← ← ← ← ← Вторая гидратная сфера: ориентация диполей воды сильно нарушена тепловым движением и полем других ионов или молекул, «вторичная гидратация» ← ← Первая гидратная сфера: диполи воды ориентированы достаточно строго относительно центрального иона, «первичная гидратация» Число гидратации: количество молекул воды в первой гидратной сфере ← Методы определения (оценки) чисел гидратации 1. По данным о кристаллографическом радиусе иона (r) и об объеме молекулы воды (V): Радиус гидратированного иона rs находят по данным о предельной эквивалентной электропроводности λ 0, пользуясь формулой Стокса , где NA – число Авогадро, η 0 – вязкость растворителя. Если известен коэффициент диффузии D и вязкость раствора η, то можно воспользоваться формулой: 6
Качественные представления о гидратации (на примере гидратации катиона) ← ← ← + ← ← ← ← ← ← Вторая гидратная сфера: ориентация диполей воды сильно нарушена тепловым движением и полем других ионов или молекул, «вторичная гидратация» ← ← Первая гидратная сфера: диполи воды ориентированы достаточно строго относительно центрального иона, «первичная гидратация» Число гидратации: количество молекул воды в первой гидратной сфере ← Методы определения (оценки) чисел гидратации 1. По данным о кристаллографическом радиусе иона (r) и об объеме молекулы воды (V): Радиус гидратированного иона rs находят по данным о предельной эквивалентной электропроводности λ 0, пользуясь формулой Стокса , где NA – число Авогадро, η 0 – вязкость растворителя. Если известен коэффициент диффузии D и вязкость раствора η, то можно воспользоваться формулой: 6
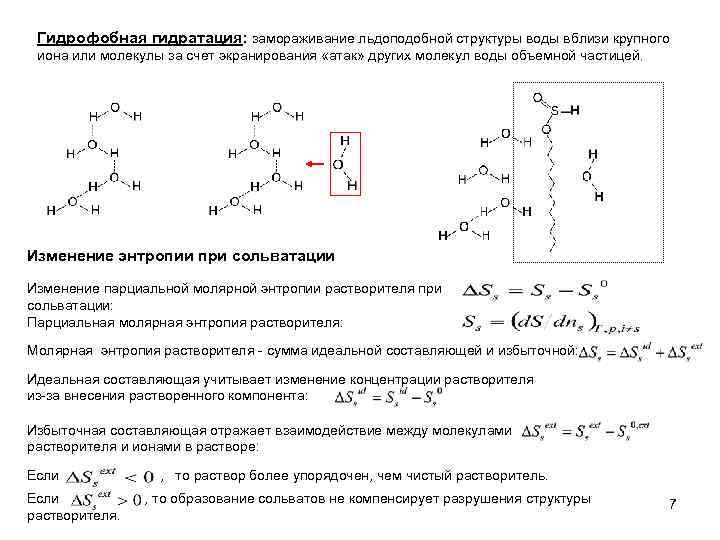 Гидрофобная гидратация: замораживание льдоподобной структуры воды вблизи крупного иона или молекулы за счет экранирования «атак» других молекул воды объемной частицей. Изменение энтропии при сольватации Изменение парциальной молярной энтропии растворителя при сольватации: Парциальная молярная энтропия растворителя: Молярная энтропия растворителя - сумма идеальной составляющей и избыточной: Идеальная составляющая учитывает изменение концентрации растворителя из-за внесения растворенного компонента: Избыточная составляющая отражает взаимодействие между молекулами растворителя и ионами в растворе: Если растворителя. , то раствор более упорядочен, чем чистый растворитель. , то образование сольватов не компенсирует разрушения структуры 7
Гидрофобная гидратация: замораживание льдоподобной структуры воды вблизи крупного иона или молекулы за счет экранирования «атак» других молекул воды объемной частицей. Изменение энтропии при сольватации Изменение парциальной молярной энтропии растворителя при сольватации: Парциальная молярная энтропия растворителя: Молярная энтропия растворителя - сумма идеальной составляющей и избыточной: Идеальная составляющая учитывает изменение концентрации растворителя из-за внесения растворенного компонента: Избыточная составляющая отражает взаимодействие между молекулами растворителя и ионами в растворе: Если растворителя. , то раствор более упорядочен, чем чистый растворитель. , то образование сольватов не компенсирует разрушения структуры 7
 Оценка ионных составляющих свободной энергии и энтальпии сольватации В конденсированных системах при комнатной температуре различие между значениями ΔG и ΔH невелико. Поэтому Строго разделить ΔG и ΔH сольватации электролита на ионные составляющие невозможно. Предполагают, что эти величины одинаковы у гидратов одинаковых радиусов. К этому условию приближается Cs. I ΔHs, Cs. I = -560. 4 к. Дж/моль, принимая ΔHs, Cs = ΔHs, I , для каждого из ионов получим 280. 2 к. Дж/моль. Далее, для солей Cs. X считаем ΔHs, X = ΔHs, Cs. X – ΔHs, Cs , а для иодидов MI ΔHs, M = ΔHs, Cs. I – ΔHs, I. Так получают шкалу ионных энтальпий и свободных энергий гидратации для всех солей цезия и всех иодидов, а затем – вообще для любых электролитов. Слабости этого подхода: 1. Сравнительно произвольный, хотя и логичный выбор «пилотного» электролита – Cs. I; 2. Допущение, что термодинамические функции гидратации пилотных ионов не зависят от природы другого иона в электролите, т. е. гидратация Cs+ одна и та же в растворах всех солей цезия, а гидратация I- - во растворах всех иодидов. Для каких растворов справедливо допущение 2? 8
Оценка ионных составляющих свободной энергии и энтальпии сольватации В конденсированных системах при комнатной температуре различие между значениями ΔG и ΔH невелико. Поэтому Строго разделить ΔG и ΔH сольватации электролита на ионные составляющие невозможно. Предполагают, что эти величины одинаковы у гидратов одинаковых радиусов. К этому условию приближается Cs. I ΔHs, Cs. I = -560. 4 к. Дж/моль, принимая ΔHs, Cs = ΔHs, I , для каждого из ионов получим 280. 2 к. Дж/моль. Далее, для солей Cs. X считаем ΔHs, X = ΔHs, Cs. X – ΔHs, Cs , а для иодидов MI ΔHs, M = ΔHs, Cs. I – ΔHs, I. Так получают шкалу ионных энтальпий и свободных энергий гидратации для всех солей цезия и всех иодидов, а затем – вообще для любых электролитов. Слабости этого подхода: 1. Сравнительно произвольный, хотя и логичный выбор «пилотного» электролита – Cs. I; 2. Допущение, что термодинамические функции гидратации пилотных ионов не зависят от природы другого иона в электролите, т. е. гидратация Cs+ одна и та же в растворах всех солей цезия, а гидратация I- - во растворах всех иодидов. Для каких растворов справедливо допущение 2? 8
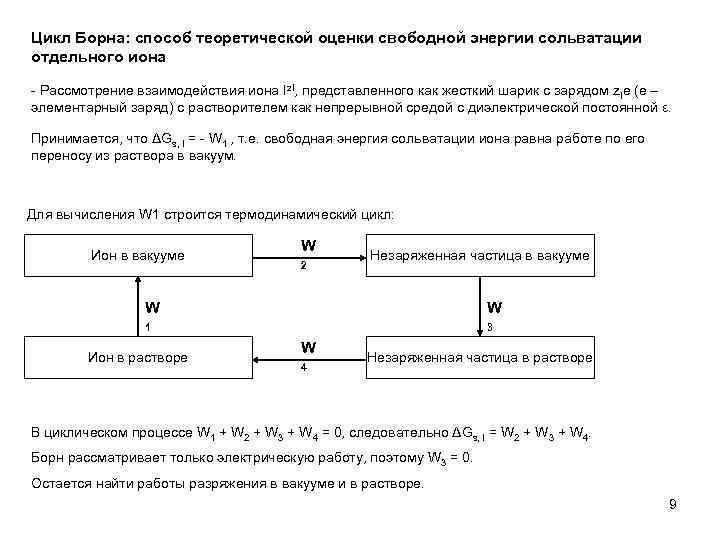 Цикл Борна: способ теоретической оценки свободной энергии сольватации отдельного иона - Рассмотрение взаимодействия иона Iz. I, представленного как жесткий шарик с зарядом z. Ie (e – элементарный заряд) с растворителем как непрерывной средой с диэлектрической постоянной ε. Принимается, что ΔGs, I = - W 1 , т. е. свободная энергия сольватации иона равна работе по его переносу из раствора в вакуум. Для вычисления W 1 строится термодинамический цикл: Ион в вакууме W 2 Незаряженная частица в вакууме W W 1 3 Ион в растворе W 4 Незаряженная частица в растворе В циклическом процессе W 1 + W 2 + W 3 + W 4 = 0, следовательно ΔGs, I = W 2 + W 3 + W 4. Борн рассматривает только электрическую работу, поэтому W 3 = 0. Остается найти работы разряжения в вакууме и в растворе. 9
Цикл Борна: способ теоретической оценки свободной энергии сольватации отдельного иона - Рассмотрение взаимодействия иона Iz. I, представленного как жесткий шарик с зарядом z. Ie (e – элементарный заряд) с растворителем как непрерывной средой с диэлектрической постоянной ε. Принимается, что ΔGs, I = - W 1 , т. е. свободная энергия сольватации иона равна работе по его переносу из раствора в вакуум. Для вычисления W 1 строится термодинамический цикл: Ион в вакууме W 2 Незаряженная частица в вакууме W W 1 3 Ион в растворе W 4 Незаряженная частица в растворе В циклическом процессе W 1 + W 2 + W 3 + W 4 = 0, следовательно ΔGs, I = W 2 + W 3 + W 4. Борн рассматривает только электрическую работу, поэтому W 3 = 0. Остается найти работы разряжения в вакууме и в растворе. 9
 Цикл Борна- продолжение Работа разряжения 1 моля ионов в вакууме определяется электростатическим потенциалом ΦR , зарядом на поверхности иона q и диэлектрической постоянной среды (вакуума) – ε 0: Работа разряжения 1 моля ионов в среде растворителя - аналогично: Комбинируя, получим Уравнение Борна для свободной энергии сольватации: Дифференцируя по температуре, получим выражение для энтропии сольватации: Пользуясь уравнением Гиббса-Гельмгольца, получим для энтальпии сольватации Уравнение Борна-Бьеррума: 10
Цикл Борна- продолжение Работа разряжения 1 моля ионов в вакууме определяется электростатическим потенциалом ΦR , зарядом на поверхности иона q и диэлектрической постоянной среды (вакуума) – ε 0: Работа разряжения 1 моля ионов в среде растворителя - аналогично: Комбинируя, получим Уравнение Борна для свободной энергии сольватации: Дифференцируя по температуре, получим выражение для энтропии сольватации: Пользуясь уравнением Гиббса-Гельмгольца, получим для энтальпии сольватации Уравнение Борна-Бьеррума: 10
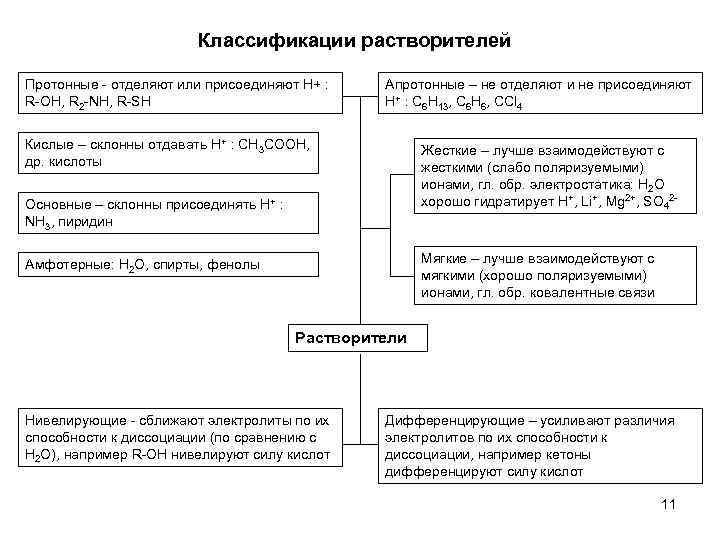 Классификации растворителей Протонные - отделяют или присоединяют H+ : R-OH, R 2 -NH, R-SH Апротонные – не отделяют и не присоединяют H+ : C 6 H 13, C 6 H 6, CCl 4 Кислые – склонны отдавать H+ : CH 3 COOH, др. кислоты Жесткие – лучше взаимодействуют с жесткими (слабо поляризуемыми) ионами, гл. обр. электростатика: H 2 O хорошо гидратирует H+, Li+, Mg 2+, SO 42 - Основные – склонны присоединять H+ : NH 3, пиридин Мягкие – лучше взаимодействуют с мягкими (хорошо поляризуемыми) ионами, гл. обр. ковалентные связи Амфотерные: H 2 O, спирты, фенолы Растворители Нивелирующие - сближают электролиты по их способности к диссоциации (по сравнению с H 2 O), например R-OH нивелируют силу кислот Дифференцирующие – усиливают различия электролитов по их способности к диссоциации, например кетоны дифференцируют силу кислот 11
Классификации растворителей Протонные - отделяют или присоединяют H+ : R-OH, R 2 -NH, R-SH Апротонные – не отделяют и не присоединяют H+ : C 6 H 13, C 6 H 6, CCl 4 Кислые – склонны отдавать H+ : CH 3 COOH, др. кислоты Жесткие – лучше взаимодействуют с жесткими (слабо поляризуемыми) ионами, гл. обр. электростатика: H 2 O хорошо гидратирует H+, Li+, Mg 2+, SO 42 - Основные – склонны присоединять H+ : NH 3, пиридин Мягкие – лучше взаимодействуют с мягкими (хорошо поляризуемыми) ионами, гл. обр. ковалентные связи Амфотерные: H 2 O, спирты, фенолы Растворители Нивелирующие - сближают электролиты по их способности к диссоциации (по сравнению с H 2 O), например R-OH нивелируют силу кислот Дифференцирующие – усиливают различия электролитов по их способности к диссоциации, например кетоны дифференцируют силу кислот 11
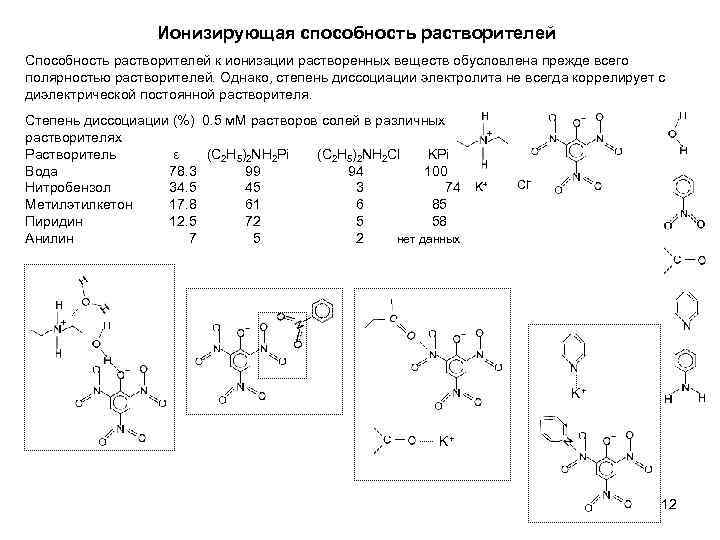 Ионизирующая способность растворителей Способность растворителей к ионизации растворенных веществ обусловлена прежде всего полярностью растворителей. Однако, степень диссоциации электролита не всегда коррелирует с диэлектрической постоянной растворителя. Степень диссоциации (%) 0. 5 м. М растворов солей в различных растворителях Растворитель ε (C 2 H 5)2 NH 2 Pi (C 2 H 5)2 NH 2 Cl KPi Вода 78. 3 99 94 100 Нитробензол 34. 5 45 3 74 Метилэтилкетон 17. 8 61 6 85 Пиридин 12. 5 72 5 58 Анилин 7 5 2 нет данных K+ Cl- K+ K+ 12
Ионизирующая способность растворителей Способность растворителей к ионизации растворенных веществ обусловлена прежде всего полярностью растворителей. Однако, степень диссоциации электролита не всегда коррелирует с диэлектрической постоянной растворителя. Степень диссоциации (%) 0. 5 м. М растворов солей в различных растворителях Растворитель ε (C 2 H 5)2 NH 2 Pi (C 2 H 5)2 NH 2 Cl KPi Вода 78. 3 99 94 100 Нитробензол 34. 5 45 3 74 Метилэтилкетон 17. 8 61 6 85 Пиридин 12. 5 72 5 58 Анилин 7 5 2 нет данных K+ Cl- K+ K+ 12
 Активность и концентрация компонента Формальное соотношение активности и концентрации: Концентрация – величина, пропорциональная количеству вещества в единице массы или объема, в этом смысле – относительна, но абсолютна в том смысле, что не является разностной. Концентрация имеет размерность. Активность – величина, связанная со свободной энергией и заданная как функция химического потенциала: Поэтому численное значение активности зависит от выбора стандартного состояния. Активность – безразмерная величина, размерность коэффициента активности обратна размерности концентрации: 13
Активность и концентрация компонента Формальное соотношение активности и концентрации: Концентрация – величина, пропорциональная количеству вещества в единице массы или объема, в этом смысле – относительна, но абсолютна в том смысле, что не является разностной. Концентрация имеет размерность. Активность – величина, связанная со свободной энергией и заданная как функция химического потенциала: Поэтому численное значение активности зависит от выбора стандартного состояния. Активность – безразмерная величина, размерность коэффициента активности обратна размерности концентрации: 13
 Особенности термодинамики ионных систем Полные потенциалы – потенциалы, которые включают все виды работы, совершаемой при перемещении массы компонента из одной части системы в другую Примеры: Гравитационно-химический потенциал. Пусть масса i-го компонента dni перемещается вдоль вертикальной оси (т. е. вдоль градиента поля тяготения) на расстояние (h”–h’). Изменение свободной энергии Гиббса составит d. G=(μi”- μi’)dni + Mig(h”-h’)dni. πi = μi + Migh (химическая + механическая работа) Mi – масса, соответствующая dni, g –ускорение свободного падения. Равновесие устанавливается при d. G=0, т. е. πi’= πi” или μi’+Migh’= μi”+Migh” Электрохимический потенциал. Пусть dni ионов сорта i преодолевает скачок электрического потенциала (ψ”- ψ’). Изменение свободной энергии Гиббса составит d. G = (μi”- μi’)dni + zi. F(ψ”- ψ’)dni. μ = μi+zi. Fψ (химическая и электрическая работа) I Равновесие устанавливается при d. G=0, т. е. или , т. е. 14
Особенности термодинамики ионных систем Полные потенциалы – потенциалы, которые включают все виды работы, совершаемой при перемещении массы компонента из одной части системы в другую Примеры: Гравитационно-химический потенциал. Пусть масса i-го компонента dni перемещается вдоль вертикальной оси (т. е. вдоль градиента поля тяготения) на расстояние (h”–h’). Изменение свободной энергии Гиббса составит d. G=(μi”- μi’)dni + Mig(h”-h’)dni. πi = μi + Migh (химическая + механическая работа) Mi – масса, соответствующая dni, g –ускорение свободного падения. Равновесие устанавливается при d. G=0, т. е. πi’= πi” или μi’+Migh’= μi”+Migh” Электрохимический потенциал. Пусть dni ионов сорта i преодолевает скачок электрического потенциала (ψ”- ψ’). Изменение свободной энергии Гиббса составит d. G = (μi”- μi’)dni + zi. F(ψ”- ψ’)dni. μ = μi+zi. Fψ (химическая и электрическая работа) I Равновесие устанавливается при d. G=0, т. е. или , т. е. 14
 Активность электролита, средние и ионные активности Пусть электролит диссоциирует по схеме: Раствор: растворитель S и растворенный электролита E. Запишем для них уравнение Гиббса-Дюгема: или С другой стороны, раствор состоит из растворителя и ионов. Для раствора в 1000 г растворителя можем записать: или Моляльные концентрации ионов: Следовательно, т. е. или Стандартное состояние: Для электролита стандартное состояние выбираем так, чтобы Const=1: Отсюда связь активности электролита, средней активности и активностей ионов: Коэффициент активности электролита и ионные коэффициенты активности 15
Активность электролита, средние и ионные активности Пусть электролит диссоциирует по схеме: Раствор: растворитель S и растворенный электролита E. Запишем для них уравнение Гиббса-Дюгема: или С другой стороны, раствор состоит из растворителя и ионов. Для раствора в 1000 г растворителя можем записать: или Моляльные концентрации ионов: Следовательно, т. е. или Стандартное состояние: Для электролита стандартное состояние выбираем так, чтобы Const=1: Отсюда связь активности электролита, средней активности и активностей ионов: Коэффициент активности электролита и ионные коэффициенты активности 15
 Методы экспериментального определения коэффициентов активности 1. Методы, использующие данные о химическом потенциале растворителя (например -давлении пара) - основаны на уравнении Гиббса-Дюгема 1. 1. Давление пара растворителя над раствором пропорционально активности растворителя: 1. 2. Изопиестический метод: два раствора нелетучих компонентов приводят в равновесие по растворителю, затем определяют составы обоих растворов. 1. 3. Криоскопический и эбуллиоскопический методы: по изменению температуры замерзания или кипения в сравнении с чистым растворителем 16
Методы экспериментального определения коэффициентов активности 1. Методы, использующие данные о химическом потенциале растворителя (например -давлении пара) - основаны на уравнении Гиббса-Дюгема 1. 1. Давление пара растворителя над раствором пропорционально активности растворителя: 1. 2. Изопиестический метод: два раствора нелетучих компонентов приводят в равновесие по растворителю, затем определяют составы обоих растворов. 1. 3. Криоскопический и эбуллиоскопический методы: по изменению температуры замерзания или кипения в сравнении с чистым растворителем 16
 2. “Прямые” методы 2. 1. Экстракционный метод: μi(1) = μi(2) – приводят в равновесие растворы в двух несмешивающихся растворителях. Находят коэффициент распределения ki = Ci(1)/Ci(2) при разных значений концентраций. Экстраполируя на предельное разбавление, находят ki 0 – термодинамический коэффициент распределения, ki 0 = ai(1)/ai(2) ki ki 0 Зная и активности компонента в одном из растворителей, можно теперь найти их для другого растворителя. 0 Ci(2) 2. 2. Метод э. д. с. : определяем активность электролита IX в растворе, путем измерения разности потенциалов 2 -х электродов, обратимых, соответственно, к ионам I+ и X- Проблема: все экспериментальные методы дают активность компонента (электролита как целого). Строгих методов измерения активности ионов не существует. Приближение Мак-Иннеса: Приближение Гуггенгейма: концентрации растворов одинаковы 17
2. “Прямые” методы 2. 1. Экстракционный метод: μi(1) = μi(2) – приводят в равновесие растворы в двух несмешивающихся растворителях. Находят коэффициент распределения ki = Ci(1)/Ci(2) при разных значений концентраций. Экстраполируя на предельное разбавление, находят ki 0 – термодинамический коэффициент распределения, ki 0 = ai(1)/ai(2) ki ki 0 Зная и активности компонента в одном из растворителей, можно теперь найти их для другого растворителя. 0 Ci(2) 2. 2. Метод э. д. с. : определяем активность электролита IX в растворе, путем измерения разности потенциалов 2 -х электродов, обратимых, соответственно, к ионам I+ и X- Проблема: все экспериментальные методы дают активность компонента (электролита как целого). Строгих методов измерения активности ионов не существует. Приближение Мак-Иннеса: Приближение Гуггенгейма: концентрации растворов одинаковы 17
 Теория сильных электролитов Сильный электролит: вещество, которое полностью диссоциирует при любой его концентрации в растворе Экспериментальные факты в пользу существования сильных электролитов 1. По данным рентгеноструктурного анализа кристаллическая решетка сильного электролита построена из ионов. Если молекулы отсутствуют в кристалле, то тем менее вероятно их появление в растворе, где силы притяжения между ионами уменьшаются в силу высокой диэлектрической проницаемости среды 2. Коэффициенты экстинкции растворов сильных электролитов не зависят от концентрации 3. Молярные теплоты нейтрализации сильных кислот и оснований не зависят от концентрации Термодинамика описывает свойства физико-химических систем с помощью параметров состояния и функций состояния. Некоторые из них можно измерить непосредственно, другие – выразить через измеримые величины изменения в ходе какого-либо процесса. Термодинамика не дает возможности описать эти величины с помощью модельных представлений. В частности, получить теоретически связь между коэффициентами активности и составом раствора можно только из внетермодинамических представлений. 18
Теория сильных электролитов Сильный электролит: вещество, которое полностью диссоциирует при любой его концентрации в растворе Экспериментальные факты в пользу существования сильных электролитов 1. По данным рентгеноструктурного анализа кристаллическая решетка сильного электролита построена из ионов. Если молекулы отсутствуют в кристалле, то тем менее вероятно их появление в растворе, где силы притяжения между ионами уменьшаются в силу высокой диэлектрической проницаемости среды 2. Коэффициенты экстинкции растворов сильных электролитов не зависят от концентрации 3. Молярные теплоты нейтрализации сильных кислот и оснований не зависят от концентрации Термодинамика описывает свойства физико-химических систем с помощью параметров состояния и функций состояния. Некоторые из них можно измерить непосредственно, другие – выразить через измеримые величины изменения в ходе какого-либо процесса. Термодинамика не дает возможности описать эти величины с помощью модельных представлений. В частности, получить теоретически связь между коэффициентами активности и составом раствора можно только из внетермодинамических представлений. 18
 Задача: найти способ теоретического расчета электролитных (и ионных !) коэффициентов активности Если нас интересует активность, обратимся к величине химического потенциала. Разность химических потенциалов компонента в интересующем нас состоянии и в стандартном состоянии разобьем на “идеальную” часть и “поправку” Перейдем к соответствующим выражениям для свободной энергии Гиббса: Итак, надо найти выражение для величины ΔGcorr Теория Дебая-Хюккеля Исходные положения: 1. Неидеальность вызвана межчастичными взаимодействиями: ориентационным, индукционным, дисперсионным, а также кулоновским межионным взаимодействием 2. Все перечисленные взаимодействия, кроме кулоновского, заметны на расстояниях в пределах 1 нм, на расстояниях 10 нм и более кулоновское взаимодействие – единственное. (1 моль/л – 1 нм, 10 -3 моль/л -10 нм) Таким образом, мы можем ограничиться рассмотрением только кулоновских взаимодействий, но должны быть готовы к тому, что теория не будет работать при концентрациях свыше 10 -3 моль/л 19
Задача: найти способ теоретического расчета электролитных (и ионных !) коэффициентов активности Если нас интересует активность, обратимся к величине химического потенциала. Разность химических потенциалов компонента в интересующем нас состоянии и в стандартном состоянии разобьем на “идеальную” часть и “поправку” Перейдем к соответствующим выражениям для свободной энергии Гиббса: Итак, надо найти выражение для величины ΔGcorr Теория Дебая-Хюккеля Исходные положения: 1. Неидеальность вызвана межчастичными взаимодействиями: ориентационным, индукционным, дисперсионным, а также кулоновским межионным взаимодействием 2. Все перечисленные взаимодействия, кроме кулоновского, заметны на расстояниях в пределах 1 нм, на расстояниях 10 нм и более кулоновское взаимодействие – единственное. (1 моль/л – 1 нм, 10 -3 моль/л -10 нм) Таким образом, мы можем ограничиться рассмотрением только кулоновских взаимодействий, но должны быть готовы к тому, что теория не будет работать при концентрациях свыше 10 -3 моль/л 19
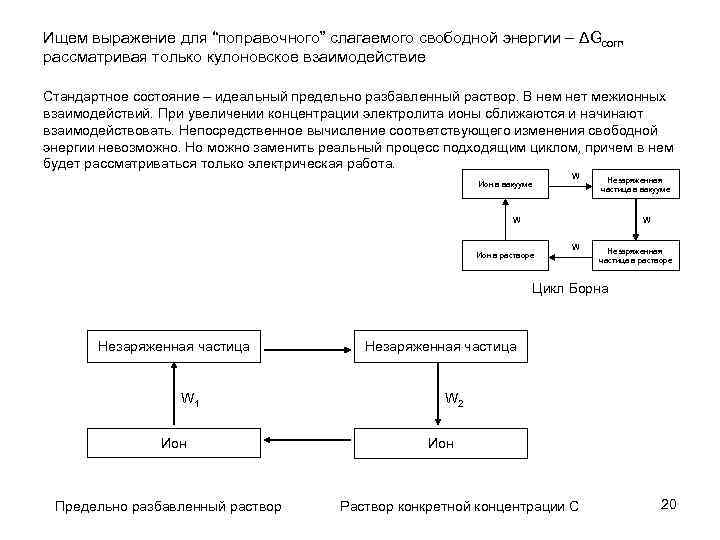 Ищем выражение для “поправочного” слагаемого свободной энергии – ΔGcorr, рассматривая только кулоновское взаимодействие Стандартное состояние – идеальный предельно разбавленный раствор. В нем нет межионных взаимодействий. При увеличении концентрации электролита ионы сближаются и начинают взаимодействовать. Непосредственное вычисление соответствующего изменения свободной энергии невозможно. Но можно заменить реальный процесс подходящим циклом, причем в нем будет рассматриваться только электрическая работа. W Ион в вакууме Незаряженная частица в вакууме W W Ион в растворе W Незаряженная частица в растворе Цикл Борна Незаряженная частица W 1 Ион Предельно разбавленный раствор Незаряженная частица W 2 Ион Раствор конкретной концентрации C 20
Ищем выражение для “поправочного” слагаемого свободной энергии – ΔGcorr, рассматривая только кулоновское взаимодействие Стандартное состояние – идеальный предельно разбавленный раствор. В нем нет межионных взаимодействий. При увеличении концентрации электролита ионы сближаются и начинают взаимодействовать. Непосредственное вычисление соответствующего изменения свободной энергии невозможно. Но можно заменить реальный процесс подходящим циклом, причем в нем будет рассматриваться только электрическая работа. W Ион в вакууме Незаряженная частица в вакууме W W Ион в растворе W Незаряженная частица в растворе Цикл Борна Незаряженная частица W 1 Ион Предельно разбавленный раствор Незаряженная частица W 2 Ион Раствор конкретной концентрации C 20
 Работа разряжения иона сорта i в предельно разбавленном растворе Разряжение – изменение заряда иона от его истинной величины zie до 0, т. е. текущее (по ходу процесса) значение заряда q меняется от zie до 0 Для каждого значения q по ходу процесса разряжения справедливо выражение электрического потенциала ψii, создаваемого самим ионом на расстоянии r: Электрическая работа, связанная с изменением заряда на величину dq равна Нас интересует именно работа разряжения данного иона, поэтому за расстояние r мы берем радиус иона: r 0. Тогда работа изменения заряда от zie до 0 равна 21
Работа разряжения иона сорта i в предельно разбавленном растворе Разряжение – изменение заряда иона от его истинной величины zie до 0, т. е. текущее (по ходу процесса) значение заряда q меняется от zie до 0 Для каждого значения q по ходу процесса разряжения справедливо выражение электрического потенциала ψii, создаваемого самим ионом на расстоянии r: Электрическая работа, связанная с изменением заряда на величину dq равна Нас интересует именно работа разряжения данного иона, поэтому за расстояние r мы берем радиус иона: r 0. Тогда работа изменения заряда от zie до 0 равна 21
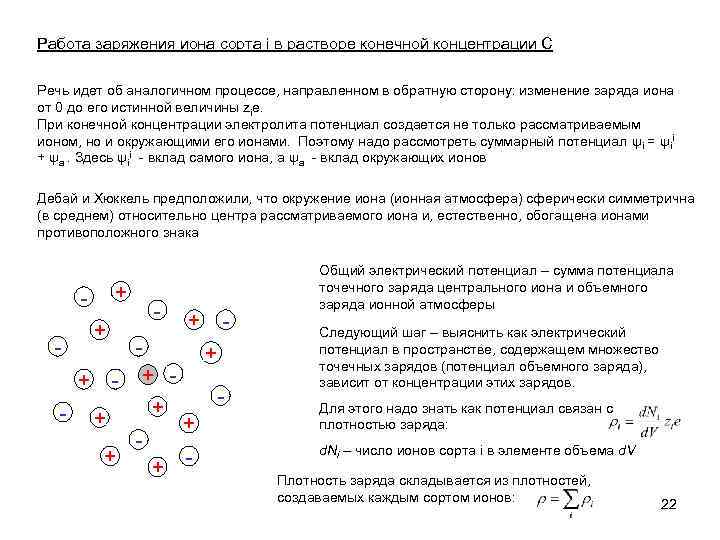 Работа заряжения иона сорта i в растворе конечной концентрации C Речь идет об аналогичном процессе, направленном в обратную сторону: изменение заряда иона от 0 до его истинной величины zie. При конечной концентрации электролита потенциал создается не только рассматриваемым ионом, но и окружающими его ионами. Поэтому надо рассмотреть суммарный потенциал ψi = ψii + ψa. Здесь ψii - вклад самого иона, а ψa - вклад окружающих ионов Дебай и Хюккель предположили, что окружение иона (ионная атмосфера) сферически симметрична (в среднем) относительно центра рассматриваемого иона и, естественно, обогащена ионами противоположного знака + + - - + + - Общий электрический потенциал – сумма потенциала точечного заряда центрального иона и объемного заряда ионной атмосферы Следующий шаг – выяснить как электрический потенциал в пространстве, содержащем множество точечных зарядов (потенциал объемного заряда), зависит от концентрации этих зарядов. Для этого надо знать как потенциал связан с плотностью заряда: d. Ni – число ионов сорта i в элементе объема d. V Плотность заряда складывается из плотностей, создаваемых каждым сортом ионов: 22
Работа заряжения иона сорта i в растворе конечной концентрации C Речь идет об аналогичном процессе, направленном в обратную сторону: изменение заряда иона от 0 до его истинной величины zie. При конечной концентрации электролита потенциал создается не только рассматриваемым ионом, но и окружающими его ионами. Поэтому надо рассмотреть суммарный потенциал ψi = ψii + ψa. Здесь ψii - вклад самого иона, а ψa - вклад окружающих ионов Дебай и Хюккель предположили, что окружение иона (ионная атмосфера) сферически симметрична (в среднем) относительно центра рассматриваемого иона и, естественно, обогащена ионами противоположного знака + + - - + + - Общий электрический потенциал – сумма потенциала точечного заряда центрального иона и объемного заряда ионной атмосферы Следующий шаг – выяснить как электрический потенциал в пространстве, содержащем множество точечных зарядов (потенциал объемного заряда), зависит от концентрации этих зарядов. Для этого надо знать как потенциал связан с плотностью заряда: d. Ni – число ионов сорта i в элементе объема d. V Плотность заряда складывается из плотностей, создаваемых каждым сортом ионов: 22
 Связь потенциала объемного заряда с плотностью этого заряда (т. е. с распределением точечных зарядов в объеме) Уравнение Пуассона описывает потенциал любого поля, убывающего по закону 1/r 2 в трехмерном пространстве, при условии гладкой функции распределения частиц, создающих поле Уравнение Пуассона: - + + ++ - + + - - Усреднение по времени делает уравнение Пуассона применимым к реальной ситуации В качестве среднего по времени распределения в теории Дебая -Хюккеля используется распределение Больцмана (барометрическая формула) + Учтем, что и Получим “Основное” уравнение теории Дебая-Хюккеля: Разложим экспоненту в ряд и, считая 2 -мя первыми членами. Получим: , ограничимся только Последнее равенство - в силу электронейтральности: e -x = 1 - x + x 2 x 3 - +. . . 2! 3! 23
Связь потенциала объемного заряда с плотностью этого заряда (т. е. с распределением точечных зарядов в объеме) Уравнение Пуассона описывает потенциал любого поля, убывающего по закону 1/r 2 в трехмерном пространстве, при условии гладкой функции распределения частиц, создающих поле Уравнение Пуассона: - + + ++ - + + - - Усреднение по времени делает уравнение Пуассона применимым к реальной ситуации В качестве среднего по времени распределения в теории Дебая -Хюккеля используется распределение Больцмана (барометрическая формула) + Учтем, что и Получим “Основное” уравнение теории Дебая-Хюккеля: Разложим экспоненту в ряд и, считая 2 -мя первыми членами. Получим: , ограничимся только Последнее равенство - в силу электронейтральности: e -x = 1 - x + x 2 x 3 - +. . . 2! 3! 23
 Вернемся к уравнению Пуассона, причем оператор Лапласа запишем в полярных координатах, т. к. считаем систему ион + ионная атмосфера центральносимметричной: Т. е. Общее решение имеет вид: α и β – константы интегрирования. Ищем их из граничных условий На бесконечном расстоянии от иона (r → ∞ ) нет поля. Т. е. при r → ∞ д. б. ψ → 0. Первое слагаемое при r → ∞ обращается в 0 при любых α. Чтобы вся сумма обратилась в 0 требуется β=0. Таким образом, Для определения константы α разложим и эту экспоненту в ряд, ограничиваясь 2 -мя первыми членами: Поскольку , то при предельном разбавлении эта величина (χ) обращается в 0. Соответственно, в предельно разбавленном растворе . Отсюда 24
Вернемся к уравнению Пуассона, причем оператор Лапласа запишем в полярных координатах, т. к. считаем систему ион + ионная атмосфера центральносимметричной: Т. е. Общее решение имеет вид: α и β – константы интегрирования. Ищем их из граничных условий На бесконечном расстоянии от иона (r → ∞ ) нет поля. Т. е. при r → ∞ д. б. ψ → 0. Первое слагаемое при r → ∞ обращается в 0 при любых α. Чтобы вся сумма обратилась в 0 требуется β=0. Таким образом, Для определения константы α разложим и эту экспоненту в ряд, ограничиваясь 2 -мя первыми членами: Поскольку , то при предельном разбавлении эта величина (χ) обращается в 0. Соответственно, в предельно разбавленном растворе . Отсюда 24
 Таким образом, результирующий потенциал в системе ион – ионная атмосфера может быть записан как Здесь Ионную атмосферу можно заменить зарядом, равным по величине заряду центрального иона, противоположным ему по знаку и равномерно распределенным по сфере радиуса r. D = χ-1. Величина r. D - эффективный радиус ионной атмосферы или Дебаевский радиус. Для плоского случая (двойной электрический слой) аналог этой величины – Дебаевская длина: эффективная толщина диффузной части двойного электрического слоя (теория Гуи-Чапмена). Дебаевский радиус: Для 1: 1 электролита в воде при 25 о. С r. D=2 C-1/2 A, при 0. 01 M – r. D=20 A. Теперь получим работу возвращения заряда на ион в растворе конечной концентрации Здесь r 0 т. к. речь о заряжении иона радиусом r 0 25
Таким образом, результирующий потенциал в системе ион – ионная атмосфера может быть записан как Здесь Ионную атмосферу можно заменить зарядом, равным по величине заряду центрального иона, противоположным ему по знаку и равномерно распределенным по сфере радиуса r. D = χ-1. Величина r. D - эффективный радиус ионной атмосферы или Дебаевский радиус. Для плоского случая (двойной электрический слой) аналог этой величины – Дебаевская длина: эффективная толщина диффузной части двойного электрического слоя (теория Гуи-Чапмена). Дебаевский радиус: Для 1: 1 электролита в воде при 25 о. С r. D=2 C-1/2 A, при 0. 01 M – r. D=20 A. Теперь получим работу возвращения заряда на ион в растворе конечной концентрации Здесь r 0 т. к. речь о заряжении иона радиусом r 0 25
 Для полной электрической работы, связанной с перемещением иона сорта i из предельно разбавленного раствора в раствор конечной концентрации (т. е. работы создания ионной атмосферы): Для всех ионов электролита, присутствующих в объеме V, общая электрическая работа составит Теперь вернемся к исходной идее: поправка на неидеальнность должна отражать только электростатическое взаимодействие, тогда Введем обозначение . В водных р-рах при 25 0 С А~0. 509 Мы получили предельный закон (первое приближение) теории Дебая-Хюккеля: 26
Для полной электрической работы, связанной с перемещением иона сорта i из предельно разбавленного раствора в раствор конечной концентрации (т. е. работы создания ионной атмосферы): Для всех ионов электролита, присутствующих в объеме V, общая электрическая работа составит Теперь вернемся к исходной идее: поправка на неидеальнность должна отражать только электростатическое взаимодействие, тогда Введем обозначение . В водных р-рах при 25 0 С А~0. 509 Мы получили предельный закон (первое приближение) теории Дебая-Хюккеля: 26
 Более точные выражения теории Дебая-Хюккеля Поправка Хюккеля: учет объема самих ионов Интегрирование по всему объему раствора разумно проводить только тогда, когда объем, занимаемый ионами пренебрежимо мал по сравнению с общим объемом, т. е. только для разбавленных растворов (в пределах 0. 001 М). В более концентрированных надо иметь в виду, что ионы могут занять заметную долю объема. С другой стороны, расстояние между центрами ионов не может быть меньше, чем сумма их радиусов. Отсюда - второе приближение теории Дебая-Хюккеля: Исключаем объем центрального иона, т. е. интегрируем не от 0, а от r=a. Величина a – эффективный радиус иона (радиус Киеланда). Тогда константа интегрирования В результате получим , . В водных растворах при 25 0 С B~0. 329 Значения параметра a подбирают эмпирически! Уравнение Дэвис (3 -е приближение теории Дебая-Хюккеля): учет локального изменения диэлектрической постоянной вблизи иона (работает до 0. 1 М растворов, в т. ч. Ca. Cl 2): 27
Более точные выражения теории Дебая-Хюккеля Поправка Хюккеля: учет объема самих ионов Интегрирование по всему объему раствора разумно проводить только тогда, когда объем, занимаемый ионами пренебрежимо мал по сравнению с общим объемом, т. е. только для разбавленных растворов (в пределах 0. 001 М). В более концентрированных надо иметь в виду, что ионы могут занять заметную долю объема. С другой стороны, расстояние между центрами ионов не может быть меньше, чем сумма их радиусов. Отсюда - второе приближение теории Дебая-Хюккеля: Исключаем объем центрального иона, т. е. интегрируем не от 0, а от r=a. Величина a – эффективный радиус иона (радиус Киеланда). Тогда константа интегрирования В результате получим , . В водных растворах при 25 0 С B~0. 329 Значения параметра a подбирают эмпирически! Уравнение Дэвис (3 -е приближение теории Дебая-Хюккеля): учет локального изменения диэлектрической постоянной вблизи иона (работает до 0. 1 М растворов, в т. ч. Ca. Cl 2): 27
 Более современные теории Теория Робинсона-Стокса – учет расхода растворителя на сольватацию ионов Здесь φs – осмотический коэффициент растворителя, h – число гидратации, ν – количество ионов данного вида в одной молекуле электролита, ns – число молей растворителя в 1 -молярном растворе электролита Теория Питцера: ионы представлены как жесткие сферы, а не как точечные заряды. Т. е. не просто учтен их объем, а учтено отталкивание на близких расстояниях Параметры C и D эмпирические 28
Более современные теории Теория Робинсона-Стокса – учет расхода растворителя на сольватацию ионов Здесь φs – осмотический коэффициент растворителя, h – число гидратации, ν – количество ионов данного вида в одной молекуле электролита, ns – число молей растворителя в 1 -молярном растворе электролита Теория Питцера: ионы представлены как жесткие сферы, а не как точечные заряды. Т. е. не просто учтен их объем, а учтено отталкивание на близких расстояниях Параметры C и D эмпирические 28
 Перенос электрического заряда в растворах электролитов Способы (виды) переноса: конвекция, диффузия, (электро)миграция Конвекция: перенос объема раствора, например – из-за перемешивания Диффузия: перенос электролита в объеме раствора под действием градиента химического потенциала Электромиграция: перенос электролита в объеме раствора под суммарным действием градиентов химического потенциала и внешнего электрического поля Сопротивление Электропроводность Удельная электропроводность: электропроводность объема материала (твердого или жидкого), заключенного в кубике с ребром 1 см, помещенном между двумя электродами большой площади Удельная электропроводность 1 см Вещество Серебро Алюминий Уголь Na. Cl (750 0 C) H 2 SO 4 30% KCl 1 M H 2 O κ (Ом-1 см-1) 6. 2· 105 3. 6· 105 2· 105 3. 4 0. 74 9. 8· 10 -2 5. 5· 10 -8 29
Перенос электрического заряда в растворах электролитов Способы (виды) переноса: конвекция, диффузия, (электро)миграция Конвекция: перенос объема раствора, например – из-за перемешивания Диффузия: перенос электролита в объеме раствора под действием градиента химического потенциала Электромиграция: перенос электролита в объеме раствора под суммарным действием градиентов химического потенциала и внешнего электрического поля Сопротивление Электропроводность Удельная электропроводность: электропроводность объема материала (твердого или жидкого), заключенного в кубике с ребром 1 см, помещенном между двумя электродами большой площади Удельная электропроводность 1 см Вещество Серебро Алюминий Уголь Na. Cl (750 0 C) H 2 SO 4 30% KCl 1 M H 2 O κ (Ом-1 см-1) 6. 2· 105 3. 6· 105 2· 105 3. 4 0. 74 9. 8· 10 -2 5. 5· 10 -8 29
 Основное понятие, применяемое при описании процессов переноса вещества, теплоты, электрического заряда, и т. д. – плотность потока. Вектор! Плотность потока частиц сорта i: число частиц этого сорта, пересекающих площадку единичной площади, расположенную перпендикулярно направлению движения частиц, за 1 единицу времени Ji – поток частиц сорта i, двигающихся со скоростью Vi относительно системы отсчета, которая движется со скоростью Vref Кристаллы: система отсчета – кристаллическая решетка Растворы: разные системы отсчета Характеристическая система Гитторфа: Vref – средняя скорость движения частиц растворителя Поток в системе Гитторфа Характеристическая система Фика: Vr = W – средняя скорость движения всего объема раствора, в котором происходит перенос. Удобство системы Фика: если нет конвекции, т. е. раствор покоится относительно наблюдателя, то Vref = W = 0 Ci – концентрация, vi – парциальный молярный объем частиц сорта i Поток в системе Фика 30
Основное понятие, применяемое при описании процессов переноса вещества, теплоты, электрического заряда, и т. д. – плотность потока. Вектор! Плотность потока частиц сорта i: число частиц этого сорта, пересекающих площадку единичной площади, расположенную перпендикулярно направлению движения частиц, за 1 единицу времени Ji – поток частиц сорта i, двигающихся со скоростью Vi относительно системы отсчета, которая движется со скоростью Vref Кристаллы: система отсчета – кристаллическая решетка Растворы: разные системы отсчета Характеристическая система Гитторфа: Vref – средняя скорость движения частиц растворителя Поток в системе Гитторфа Характеристическая система Фика: Vr = W – средняя скорость движения всего объема раствора, в котором происходит перенос. Удобство системы Фика: если нет конвекции, т. е. раствор покоится относительно наблюдателя, то Vref = W = 0 Ci – концентрация, vi – парциальный молярный объем частиц сорта i Поток в системе Фика 30
 Речь идет о движении только вдоль оси x, символ вектора в дальнейшем не применяем + Катод Анод x Плотность электрического тока: Плотность электрического тока не зависит от выбора характеристической системы отсчета! Число переноса ионов сорта i В разбавленных растворах числа переноса по Гитторфу и по Фику совпадают, но в концентрированных могут заметно различаться В любой системе отсчета 31
Речь идет о движении только вдоль оси x, символ вектора в дальнейшем не применяем + Катод Анод x Плотность электрического тока: Плотность электрического тока не зависит от выбора характеристической системы отсчета! Число переноса ионов сорта i В разбавленных растворах числа переноса по Гитторфу и по Фику совпадают, но в концентрированных могут заметно различаться В любой системе отсчета 31
 Подвижность иона Пусть система однородна (нет градиентов) даже по оси x. Тогда никакого направленного переноса не будет, только хаотичное тепловое движение частиц x Наложим внешнее электрическое поле с напряженностью На частицы действует постоянная ускоряющая сила напряженности электрического поля, и тормозящая сила трения , пропорциональная , пропорциональная скорости движения частицы относительно тормозящей среды в текущий момент времени t. В некий момент времени t = τ достигнутая частицей скорость порождает такую тормозящую силу, которая компенсирует действие ускоряющей: Начиная с этого момента t = τ частица движется с постоянной скоростью Vi – Vsolv = Vi, τ – Vsolv = ui - электрическая подвижность иона IZi Тогда для парциальной плотности тока и общей плотности тока получим и 32
Подвижность иона Пусть система однородна (нет градиентов) даже по оси x. Тогда никакого направленного переноса не будет, только хаотичное тепловое движение частиц x Наложим внешнее электрическое поле с напряженностью На частицы действует постоянная ускоряющая сила напряженности электрического поля, и тормозящая сила трения , пропорциональная , пропорциональная скорости движения частицы относительно тормозящей среды в текущий момент времени t. В некий момент времени t = τ достигнутая частицей скорость порождает такую тормозящую силу, которая компенсирует действие ускоряющей: Начиная с этого момента t = τ частица движется с постоянной скоростью Vi – Vsolv = Vi, τ – Vsolv = ui - электрическая подвижность иона IZi Тогда для парциальной плотности тока и общей плотности тока получим и 32
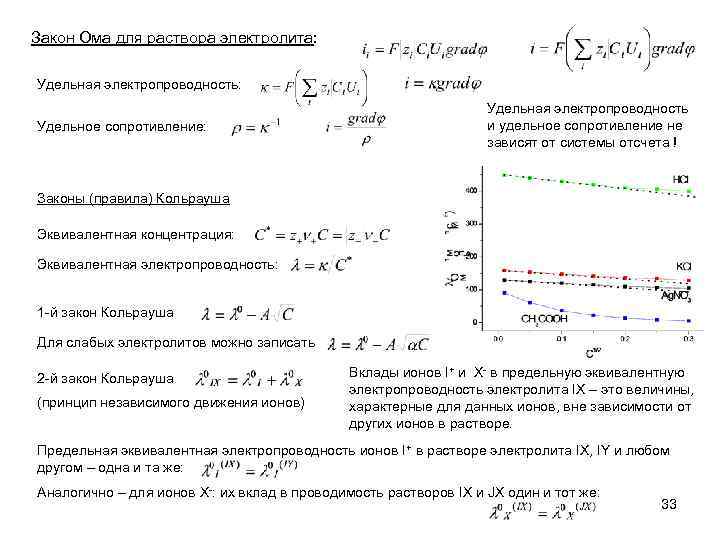 Закон Ома для раствора электролита: Удельная электропроводность: Удельное сопротивление: Удельная электропроводность и удельное сопротивление не зависят от системы отсчета ! Законы (правила) Кольрауша Эквивалентная концентрация: Эквивалентная электропроводность: 1 -й закон Кольрауша Для слабых электролитов можно записать 2 -й закон Кольрауша (принцип независимого движения ионов) Вклады ионов I+ и X- в предельную эквивалентную электропроводность электролита IX – это величины, характерные для данных ионов, вне зависимости от других ионов в растворе. Предельная эквивалентная электропроводность ионов I+ в растворе электролита IX, IY и любом другом – одна и та же: Аналогично – для ионов X-: их вклад в проводимость растворов IX и JX один и тот же: 33
Закон Ома для раствора электролита: Удельная электропроводность: Удельное сопротивление: Удельная электропроводность и удельное сопротивление не зависят от системы отсчета ! Законы (правила) Кольрауша Эквивалентная концентрация: Эквивалентная электропроводность: 1 -й закон Кольрауша Для слабых электролитов можно записать 2 -й закон Кольрауша (принцип независимого движения ионов) Вклады ионов I+ и X- в предельную эквивалентную электропроводность электролита IX – это величины, характерные для данных ионов, вне зависимости от других ионов в растворе. Предельная эквивалентная электропроводность ионов I+ в растворе электролита IX, IY и любом другом – одна и та же: Аналогично – для ионов X-: их вклад в проводимость растворов IX и JX один и тот же: 33
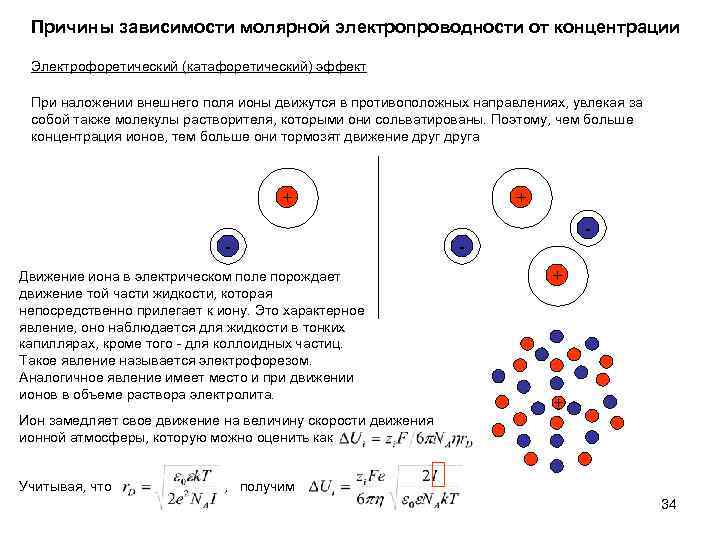 Причины зависимости молярной электропроводности от концентрации Электрофоретический (катафоретический) эффект При наложении внешнего поля ионы движутся в противоположных направлениях, увлекая за собой также молекулы растворителя, которыми они сольватированы. Поэтому, чем больше концентрация ионов, тем больше они тормозят движение друга + Движение иона в электрическом поле порождает движение той части жидкости, которая непосредственно прилегает к иону. Это характерное явление, оно наблюдается для жидкости в тонких капиллярах, кроме того - для коллоидных частиц. Такое явление называется электрофорезом. Аналогичное явление имеет место и при движении ионов в объеме раствора электролита. Ион замедляет свое движение на величину скорости движения ионной атмосферы, которую можно оценить как Учитывая, что + - + + , получим 34
Причины зависимости молярной электропроводности от концентрации Электрофоретический (катафоретический) эффект При наложении внешнего поля ионы движутся в противоположных направлениях, увлекая за собой также молекулы растворителя, которыми они сольватированы. Поэтому, чем больше концентрация ионов, тем больше они тормозят движение друга + Движение иона в электрическом поле порождает движение той части жидкости, которая непосредственно прилегает к иону. Это характерное явление, оно наблюдается для жидкости в тонких капиллярах, кроме того - для коллоидных частиц. Такое явление называется электрофорезом. Аналогичное явление имеет место и при движении ионов в объеме раствора электролита. Ион замедляет свое движение на величину скорости движения ионной атмосферы, которую можно оценить как Учитывая, что + - + + , получим 34
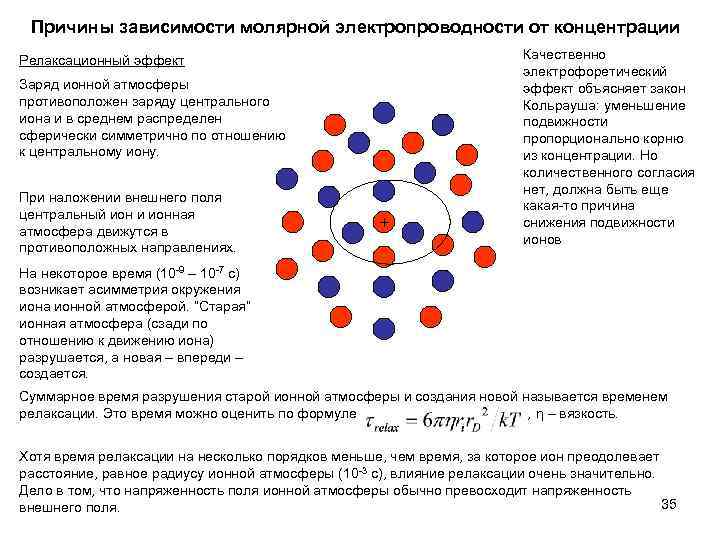 Причины зависимости молярной электропроводности от концентрации Релаксационный эффект Заряд ионной атмосферы противоположен заряду центрального иона и в среднем распределен сферически симметрично по отношению к центральному иону. При наложении внешнего поля центральный ион и ионная атмосфера движутся в противоположных направлениях. + Качественно электрофоретический эффект объясняет закон Кольрауша: уменьшение подвижности пропорционально корню из концентрации. Но количественного согласия нет, должна быть еще какая-то причина снижения подвижности ионов На некоторое время (10 -9 – 10 -7 с) возникает асимметрия окружения иона ионной атмосферой. “Старая” ионная атмосфера (сзади по отношению к движению иона) разрушается, а новая – впереди – создается. Суммарное время разрушения старой ионной атмосферы и создания новой называется временем релаксации. Это время можно оценить по формуле , η – вязкость. Хотя время релаксации на несколько порядков меньше, чем время, за которое ион преодолевает расстояние, равное радиусу ионной атмосферы (10 -3 с), влияние релаксации очень значительно. Дело в том, что напряженность поля ионной атмосферы обычно превосходит напряженность 35 внешнего поля.
Причины зависимости молярной электропроводности от концентрации Релаксационный эффект Заряд ионной атмосферы противоположен заряду центрального иона и в среднем распределен сферически симметрично по отношению к центральному иону. При наложении внешнего поля центральный ион и ионная атмосфера движутся в противоположных направлениях. + Качественно электрофоретический эффект объясняет закон Кольрауша: уменьшение подвижности пропорционально корню из концентрации. Но количественного согласия нет, должна быть еще какая-то причина снижения подвижности ионов На некоторое время (10 -9 – 10 -7 с) возникает асимметрия окружения иона ионной атмосферой. “Старая” ионная атмосфера (сзади по отношению к движению иона) разрушается, а новая – впереди – создается. Суммарное время разрушения старой ионной атмосферы и создания новой называется временем релаксации. Это время можно оценить по формуле , η – вязкость. Хотя время релаксации на несколько порядков меньше, чем время, за которое ион преодолевает расстояние, равное радиусу ионной атмосферы (10 -3 с), влияние релаксации очень значительно. Дело в том, что напряженность поля ионной атмосферы обычно превосходит напряженность 35 внешнего поля.
 Теория электропроводности Онзагера Теория Онзагера учитывает межионные электростатические взаимодействия примерно также, как они учтены в теории Дебая-Хюккеля, а потоки всех частиц описываются с помощью уравнений гидродинамики. Учитывается, что в результате электрофоретического эффекта подвижность иона уменьшается (по сравнению с величиной в предельно разбавленном растворе) Кроме того, на внешнее поле Eex накладывается релаксационное поле ΔE: В сильно разбавленном растворе одного электролита IX: где , В результате Онзагер получил для эквивалентной электропроводности выражение: Если и , то получим закон Кольрауша: 36
Теория электропроводности Онзагера Теория Онзагера учитывает межионные электростатические взаимодействия примерно также, как они учтены в теории Дебая-Хюккеля, а потоки всех частиц описываются с помощью уравнений гидродинамики. Учитывается, что в результате электрофоретического эффекта подвижность иона уменьшается (по сравнению с величиной в предельно разбавленном растворе) Кроме того, на внешнее поле Eex накладывается релаксационное поле ΔE: В сильно разбавленном растворе одного электролита IX: где , В результате Онзагер получил для эквивалентной электропроводности выражение: Если и , то получим закон Кольрауша: 36
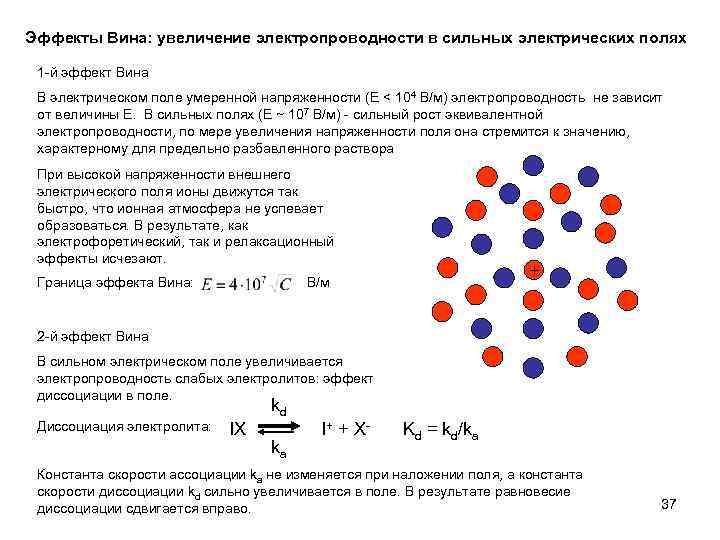 Эффекты Вина: увеличение электропроводности в сильных электрических полях 1 -й эффект Вина В электрическом поле умеренной напряженности (E < 104 В/м) электропроводность не зависит от величины E. В сильных полях (E ~ 107 В/м) - сильный рост эквивалентной электропроводности, по мере увеличения напряженности поля она стремится к значению, характерному для предельно разбавленного раствора При высокой напряженности внешнего электрического поля ионы движутся так быстро, что ионная атмосфера не успевает образоваться. В результате, как электрофоретический, так и релаксационный эффекты исчезают. Граница эффекта Вина: + В/м 2 -й эффект Вина В сильном электрическом поле увеличивается электропроводность слабых электролитов: эффект диссоциации в поле. kd Диссоциация электролита: IX ka I + + X- Kd = kd/ka Константа скорости ассоциации ka не изменяется при наложении поля, а константа скорости диссоциации kd сильно увеличивается в поле. В результате равновесие диссоциации сдвигается вправо. 37
Эффекты Вина: увеличение электропроводности в сильных электрических полях 1 -й эффект Вина В электрическом поле умеренной напряженности (E < 104 В/м) электропроводность не зависит от величины E. В сильных полях (E ~ 107 В/м) - сильный рост эквивалентной электропроводности, по мере увеличения напряженности поля она стремится к значению, характерному для предельно разбавленного раствора При высокой напряженности внешнего электрического поля ионы движутся так быстро, что ионная атмосфера не успевает образоваться. В результате, как электрофоретический, так и релаксационный эффекты исчезают. Граница эффекта Вина: + В/м 2 -й эффект Вина В сильном электрическом поле увеличивается электропроводность слабых электролитов: эффект диссоциации в поле. kd Диссоциация электролита: IX ka I + + X- Kd = kd/ka Константа скорости ассоциации ka не изменяется при наложении поля, а константа скорости диссоциации kd сильно увеличивается в поле. В результате равновесие диссоциации сдвигается вправо. 37
 Эффект Дебая-Фалькенгагена: увеличение электропроводности в переменном электрическом поле Исходя из идеи ионной атмосферы, Дебай и Фалькенгаген предсказали, что эффект асимметрии (релаксационный эффект) должен исчезнуть, если вместо постоянного электрического поля приложить переменное поле высокой частоты. + Действительно, при частотах порядка 1 МГц, когда период колебаний поля соизмерим со временем релаксации наблюдается заметное увеличение электропроводности Даже малые (и периодические) колебания ионов вызывают колебания их сольватных оболочек. Поэтому электрофоретический эффект сохраняется также и в переменном электрическом поле В переменном поле исчезает только релаксационный эффект, а электрофоретический остается, поэтому эквивалентная электропроводность в переменном поле не достигает значений, характерных для предельно разбавленных растворов 38
Эффект Дебая-Фалькенгагена: увеличение электропроводности в переменном электрическом поле Исходя из идеи ионной атмосферы, Дебай и Фалькенгаген предсказали, что эффект асимметрии (релаксационный эффект) должен исчезнуть, если вместо постоянного электрического поля приложить переменное поле высокой частоты. + Действительно, при частотах порядка 1 МГц, когда период колебаний поля соизмерим со временем релаксации наблюдается заметное увеличение электропроводности Даже малые (и периодические) колебания ионов вызывают колебания их сольватных оболочек. Поэтому электрофоретический эффект сохраняется также и в переменном электрическом поле В переменном поле исчезает только релаксационный эффект, а электрофоретический остается, поэтому эквивалентная электропроводность в переменном поле не достигает значений, характерных для предельно разбавленных растворов 38
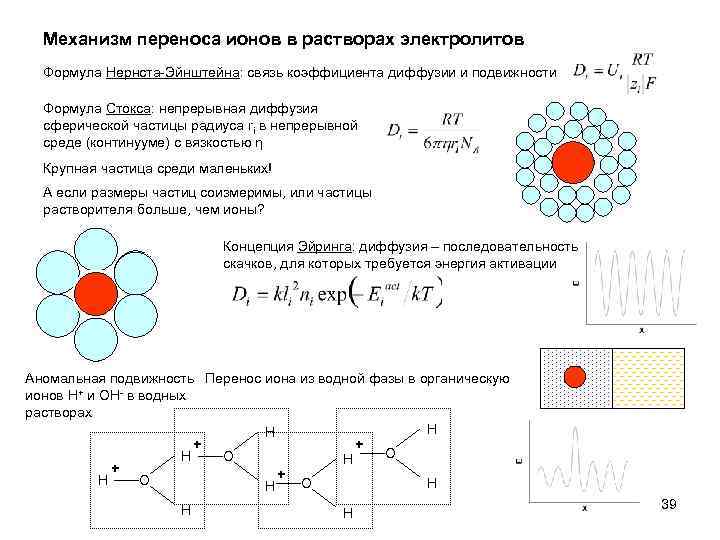 Механизм переноса ионов в растворах электролитов Формула Нернста-Эйнштейна: связь коэффициента диффузии и подвижности Формула Стокса: непрерывная диффузия сферической частицы радиуса ri в непрерывной среде (континууме) с вязкостью η Крупная частица среди маленьких! А если размеры частиц соизмеримы, или частицы растворителя больше, чем ионы? Концепция Эйринга: диффузия – последовательность скачков, для которых требуется энергия активации Аномальная подвижность Перенос иона из водной фазы в органическую ионов H+ и OH- в водных растворах H H + + O H + + H O O H H 39
Механизм переноса ионов в растворах электролитов Формула Нернста-Эйнштейна: связь коэффициента диффузии и подвижности Формула Стокса: непрерывная диффузия сферической частицы радиуса ri в непрерывной среде (континууме) с вязкостью η Крупная частица среди маленьких! А если размеры частиц соизмеримы, или частицы растворителя больше, чем ионы? Концепция Эйринга: диффузия – последовательность скачков, для которых требуется энергия активации Аномальная подвижность Перенос иона из водной фазы в органическую ионов H+ и OH- в водных растворах H H + + O H + + H O O H H 39
 Правило Вальдена-Писаржевского Формула Стокса Водные растворы уксусной кислоты: t, 0 C 0 25 60 100 150 λ 0 CH 3 COOη 0. 366 0. 368 0. 369 В отношении постоянства произведения Diη при разных температурах (в одном растворителе) правило Вальдена-Писаржевского выполняется очень хорошо. В отношении разных растворителей – выполняется редко, хотя при отсутствии данных о коэффициентах диффузии или о вязкости этим правилом пользуются для приблизительных оценок. Электропроводность неводных растворов Как правило, электропроводность неводных растворов значительно ниже, чем водных. Одна из причин низкой проводимости неводных растворов – вязкость растворителей. Но главная – низкая полярность и, соответственно – низкая степень диссоциации. Предельные подвижности ионов в различных растворителях 25 0 С H 2 O Met. OH Et. OH OAc Ph. NO 3 H+ 349. 8 143 59. 5 88. 0 23 Na+ 50. 1 45. 2 18. 7 80. 0 17. 2 K+ 73. 5 52. 4 22. 0 82. 0 19. 2 Cl 76. 4 52. 9 24. 3 111. 0 17. 3 OH 197. 6 53. 0 22. 5 - Cl. O 467. 3 70. 9 33. 8 117. 0 19. 9 Высокая подвижность ионов водорода сохраняется в спиртах: H+ + R-OH → R-OH-H+, а высокая подвижность гидроксила – только в воде, что подтверждает эстафетный механизм подвижности H+ и OH-. Соотношение подвижностей ионов сильно меняется от одного растворителя к 40 другому.
Правило Вальдена-Писаржевского Формула Стокса Водные растворы уксусной кислоты: t, 0 C 0 25 60 100 150 λ 0 CH 3 COOη 0. 366 0. 368 0. 369 В отношении постоянства произведения Diη при разных температурах (в одном растворителе) правило Вальдена-Писаржевского выполняется очень хорошо. В отношении разных растворителей – выполняется редко, хотя при отсутствии данных о коэффициентах диффузии или о вязкости этим правилом пользуются для приблизительных оценок. Электропроводность неводных растворов Как правило, электропроводность неводных растворов значительно ниже, чем водных. Одна из причин низкой проводимости неводных растворов – вязкость растворителей. Но главная – низкая полярность и, соответственно – низкая степень диссоциации. Предельные подвижности ионов в различных растворителях 25 0 С H 2 O Met. OH Et. OH OAc Ph. NO 3 H+ 349. 8 143 59. 5 88. 0 23 Na+ 50. 1 45. 2 18. 7 80. 0 17. 2 K+ 73. 5 52. 4 22. 0 82. 0 19. 2 Cl 76. 4 52. 9 24. 3 111. 0 17. 3 OH 197. 6 53. 0 22. 5 - Cl. O 467. 3 70. 9 33. 8 117. 0 19. 9 Высокая подвижность ионов водорода сохраняется в спиртах: H+ + R-OH → R-OH-H+, а высокая подвижность гидроксила – только в воде, что подтверждает эстафетный механизм подвижности H+ и OH-. Соотношение подвижностей ионов сильно меняется от одного растворителя к 40 другому.
 Почему правило Вальдена-Писаржевского не выполняется в смысле постоянства Diη при переходе от одного растворителя к другому? В разных растворителях ионы сольватированы по-разному. Если измерить коэффициент диффузии и вязкость, то можно вычислить Стоксовский радиус иона: Соотношение между Стоксовским ri и кристаллографическим ri, C радиусами ri, C (A) ri/ri, C 2. 04 3. 47 1. 70 N(C 2 H 5)4+ 2. 81 4. 00 1. 42 N(C 3 H 7)4+ 3. 92 4. 52 1. 15 N(C 4 H 6)4+ 4. 71 4. 94 1. 05 N(C 5 H 11)4+ 5. 25 5. 29 1. 01 N(CH 3)4+ Для крупных, слабосольватированных ионов характерно совпадение Стоксовских и кристаллографических радиусов. Для них и правило Вальдена-Писаржевского выполняется как для температурной зависимости, так и для перехода от одного растворителя к другому. Различие между Стоксовским и кристаллографическим радиусами позволяет оценить число молекул растворителя в сольватной оболочке иона Аномальная электропроводность: экстремумы на зависимости λ от концентрации Пример: растворы Ag. NO 3 В крепких растворах диссоциация димеров: [Ag. NO 3]2 → Ag(NO 3)2 - + Ag+ При умеренных концентрациях димеров нет, а сам Ag. NO 3 диссоциирован слабо: проводимость снижается При разбавлении увеличивается диссоциация Ag. NO 3 → Ag+ + NO 341
Почему правило Вальдена-Писаржевского не выполняется в смысле постоянства Diη при переходе от одного растворителя к другому? В разных растворителях ионы сольватированы по-разному. Если измерить коэффициент диффузии и вязкость, то можно вычислить Стоксовский радиус иона: Соотношение между Стоксовским ri и кристаллографическим ri, C радиусами ri, C (A) ri/ri, C 2. 04 3. 47 1. 70 N(C 2 H 5)4+ 2. 81 4. 00 1. 42 N(C 3 H 7)4+ 3. 92 4. 52 1. 15 N(C 4 H 6)4+ 4. 71 4. 94 1. 05 N(C 5 H 11)4+ 5. 25 5. 29 1. 01 N(CH 3)4+ Для крупных, слабосольватированных ионов характерно совпадение Стоксовских и кристаллографических радиусов. Для них и правило Вальдена-Писаржевского выполняется как для температурной зависимости, так и для перехода от одного растворителя к другому. Различие между Стоксовским и кристаллографическим радиусами позволяет оценить число молекул растворителя в сольватной оболочке иона Аномальная электропроводность: экстремумы на зависимости λ от концентрации Пример: растворы Ag. NO 3 В крепких растворах диссоциация димеров: [Ag. NO 3]2 → Ag(NO 3)2 - + Ag+ При умеренных концентрациях димеров нет, а сам Ag. NO 3 диссоциирован слабо: проводимость снижается При разбавлении увеличивается диссоциация Ag. NO 3 → Ag+ + NO 341
 Кислотность водных и неводных растворов Шкала p. H для водных растворов Ag│Ag. Cl, буфер, KCl (m) │H 2, Pt Буфер Фталатный Фосфатный Боратный Д-Х 4. 002 6. 858 9. 177 γ± 4. 011 6. 873 9. 180 Используют ГЯ без жидкостного соединения, чтобы избежать трудностей с диффузионным потенциалом Измеряют э. д. с. при разных значениях m. Cl и экстраполируют на m. Cl = 0 (γCl = 1). По ходу построения, γCl вычисляют по теории Дебая. Хюккеля или принимают γCl = γ±KCl Построить шкалу p. H водных растворов удается только путем внесения внетермодинамических допущений. Но результаты внесения различных допущений оказываются очень близкими друг к другу Шкала p. H для неводных растворов (? ) 1 aq 1 1 org aq 2 2 aq 2 org Построить единую согласованную шкалу p. H для разных растворителей не удается ! 42
Кислотность водных и неводных растворов Шкала p. H для водных растворов Ag│Ag. Cl, буфер, KCl (m) │H 2, Pt Буфер Фталатный Фосфатный Боратный Д-Х 4. 002 6. 858 9. 177 γ± 4. 011 6. 873 9. 180 Используют ГЯ без жидкостного соединения, чтобы избежать трудностей с диффузионным потенциалом Измеряют э. д. с. при разных значениях m. Cl и экстраполируют на m. Cl = 0 (γCl = 1). По ходу построения, γCl вычисляют по теории Дебая. Хюккеля или принимают γCl = γ±KCl Построить шкалу p. H водных растворов удается только путем внесения внетермодинамических допущений. Но результаты внесения различных допущений оказываются очень близкими друг к другу Шкала p. H для неводных растворов (? ) 1 aq 1 1 org aq 2 2 aq 2 org Построить единую согласованную шкалу p. H для разных растворителей не удается ! 42
 Функции кислотности Аррениус: кислота (HA) – вещество, которое в водном растворе отщепляет ион водорода основание (BOH) –вещество, которое в водном растворе отщепляет ион гидроксила HA ↔ H+ + ABOH ↔ B+ + OHБренстед: кислота (A, BH) – это вещество, способное отщеплять протон, основание (B) – это вещество, способное присоединять протон Az. A ↔ H+ + Bz. A-1 + H+ ↔ Az. A HCl ↔ H+ + Cl. NH 3 + H+ ↔ NH 4+ Важно: необходимы 2 протолитические системы, например A 1 + B 2 ↔ B 1 + A 2 Льюис: кислота (A) – это вещество, способное быть акцептором электронов, основание (B) – это вещество, способное быть донором электронов. Сам ион H+ - кислота Льюиса, реакции – это вытеснение одного основания другим: AB 1 + B 2 ↔ AB 2 + B 1 По Льюису для реакции необходимы 2 основания. Гаммет: для сопоставления кислотности растворов в разных растворителях можно использовать цветные индикаторы (B, BH), концентрации которых малы, поэтому внесение индикатора не влияет на кислотность раствора. Функция кислотности Гаммета (нитроанилины, B, BH+) Считается, что γB/γBH = Const для всех индикаторов во всех растворителях. Для этого химическая структура индикаторов д. б. близкой, а концентрации - маленькими Для индикаторов типа CH ↔ C- + H+ Для индикаторов типа DH 2+ ↔ D+ + H+ 43
Функции кислотности Аррениус: кислота (HA) – вещество, которое в водном растворе отщепляет ион водорода основание (BOH) –вещество, которое в водном растворе отщепляет ион гидроксила HA ↔ H+ + ABOH ↔ B+ + OHБренстед: кислота (A, BH) – это вещество, способное отщеплять протон, основание (B) – это вещество, способное присоединять протон Az. A ↔ H+ + Bz. A-1 + H+ ↔ Az. A HCl ↔ H+ + Cl. NH 3 + H+ ↔ NH 4+ Важно: необходимы 2 протолитические системы, например A 1 + B 2 ↔ B 1 + A 2 Льюис: кислота (A) – это вещество, способное быть акцептором электронов, основание (B) – это вещество, способное быть донором электронов. Сам ион H+ - кислота Льюиса, реакции – это вытеснение одного основания другим: AB 1 + B 2 ↔ AB 2 + B 1 По Льюису для реакции необходимы 2 основания. Гаммет: для сопоставления кислотности растворов в разных растворителях можно использовать цветные индикаторы (B, BH), концентрации которых малы, поэтому внесение индикатора не влияет на кислотность раствора. Функция кислотности Гаммета (нитроанилины, B, BH+) Считается, что γB/γBH = Const для всех индикаторов во всех растворителях. Для этого химическая структура индикаторов д. б. близкой, а концентрации - маленькими Для индикаторов типа CH ↔ C- + H+ Для индикаторов типа DH 2+ ↔ D+ + H+ 43
 Расплавы солей В расплавах в значительной мере сохраняется квазикристаллический порядок чередования ионов различных знаков – как в кристаллической решетке. Но в силу высокой температуры ионы в расплавах имеют высокую кинетическую энергию. Поэтому можно предполагать высокую степень диссоциации в расплавах. Вместе с тем, электропроводность их не так велика, как можно было бы ожидать при такой концентрации зарядов в единице объема и высокой степени диссоциации. Электропроводность расплавов обусловлена дефектами структуры, которых намного больше, чем в твердых солях. Сложные закономерности чисел переноса Удельная электропроводность Вещество Серебро Na. Cl (750 0 C) Li. F (905 0 C) Al. Cl 3 (200 0 C) H 2 SO 4 30% KCl 1 M H 2 O KCl – Mg. Cl 2 (1: 1) κ (Ом-1 см-1) 6. 2· 105 3. 4 20. 3 5. 6· 10 -8 0. 74 9. 8· 10 -2 5. 5· 10 -8 t. K = 0. 7, t. Mg = 0. 14, t. Cl = 0. 16 KCl – Mg. Cl 2 (2: 1) t. K = 0. 8, t. Mg = 0. 0, t. Cl = 0. 20 Расплавные источники тока Анод: металлический Li, Ca (!) Катод: Ca. Cr. O 4, Cu. O, Fe 2 O 3, WO 3 V ~ 3 В, i ~ 103 A/м 2 (!) Li. Cl - KCl 10 – 15 лет хранения в холодном виде 44
Расплавы солей В расплавах в значительной мере сохраняется квазикристаллический порядок чередования ионов различных знаков – как в кристаллической решетке. Но в силу высокой температуры ионы в расплавах имеют высокую кинетическую энергию. Поэтому можно предполагать высокую степень диссоциации в расплавах. Вместе с тем, электропроводность их не так велика, как можно было бы ожидать при такой концентрации зарядов в единице объема и высокой степени диссоциации. Электропроводность расплавов обусловлена дефектами структуры, которых намного больше, чем в твердых солях. Сложные закономерности чисел переноса Удельная электропроводность Вещество Серебро Na. Cl (750 0 C) Li. F (905 0 C) Al. Cl 3 (200 0 C) H 2 SO 4 30% KCl 1 M H 2 O KCl – Mg. Cl 2 (1: 1) κ (Ом-1 см-1) 6. 2· 105 3. 4 20. 3 5. 6· 10 -8 0. 74 9. 8· 10 -2 5. 5· 10 -8 t. K = 0. 7, t. Mg = 0. 14, t. Cl = 0. 16 KCl – Mg. Cl 2 (2: 1) t. K = 0. 8, t. Mg = 0. 0, t. Cl = 0. 20 Расплавные источники тока Анод: металлический Li, Ca (!) Катод: Ca. Cr. O 4, Cu. O, Fe 2 O 3, WO 3 V ~ 3 В, i ~ 103 A/м 2 (!) Li. Cl - KCl 10 – 15 лет хранения в холодном виде 44
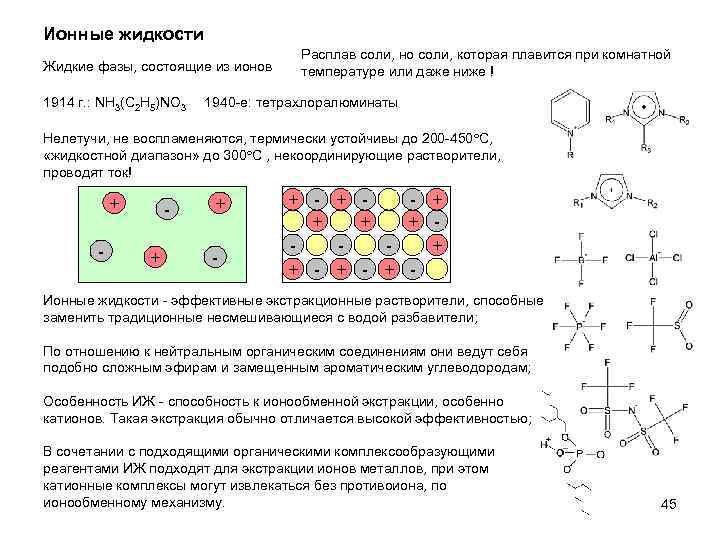 Ионные жидкости Жидкие фазы, состоящие из ионов 1914 г. : NH 3(C 2 H 5)NO 3 Расплав соли, но соли, которая плавится при комнатной температуре или даже ниже ! 1940 -e: тетрахлоралюминаты Нелетучи, не воспламеняются, термически устойчивы до 200 -450 С, «жидкостной диапазон» до 300 С , некоординирующие растворители, проводят ток! + - + - + + + + - + - Ионные жидкости - эффективные экстракционные растворители, способные заменить традиционные несмешивающиеся с водой разбавители; По отношению к нейтральным органическим соединениям они ведут себя подобно сложным эфирам и замещенным ароматическим углеводородам; Особенность ИЖ - способность к ионообменной экстракции, особенно катионов. Такая экстракция обычно отличается высокой эффективностью; В сочетании с подходящими органическими комплексообразующими реагентами ИЖ подходят для экстракции ионов металлов, при этом катионные комплексы могут извлекаться без противоиона, по ионообменному механизму. 45
Ионные жидкости Жидкие фазы, состоящие из ионов 1914 г. : NH 3(C 2 H 5)NO 3 Расплав соли, но соли, которая плавится при комнатной температуре или даже ниже ! 1940 -e: тетрахлоралюминаты Нелетучи, не воспламеняются, термически устойчивы до 200 -450 С, «жидкостной диапазон» до 300 С , некоординирующие растворители, проводят ток! + - + - + + + + - + - Ионные жидкости - эффективные экстракционные растворители, способные заменить традиционные несмешивающиеся с водой разбавители; По отношению к нейтральным органическим соединениям они ведут себя подобно сложным эфирам и замещенным ароматическим углеводородам; Особенность ИЖ - способность к ионообменной экстракции, особенно катионов. Такая экстракция обычно отличается высокой эффективностью; В сочетании с подходящими органическими комплексообразующими реагентами ИЖ подходят для экстракции ионов металлов, при этом катионные комплексы могут извлекаться без противоиона, по ионообменному механизму. 45


