8 Растворы электролит.ppt
- Количество слайдов: 26
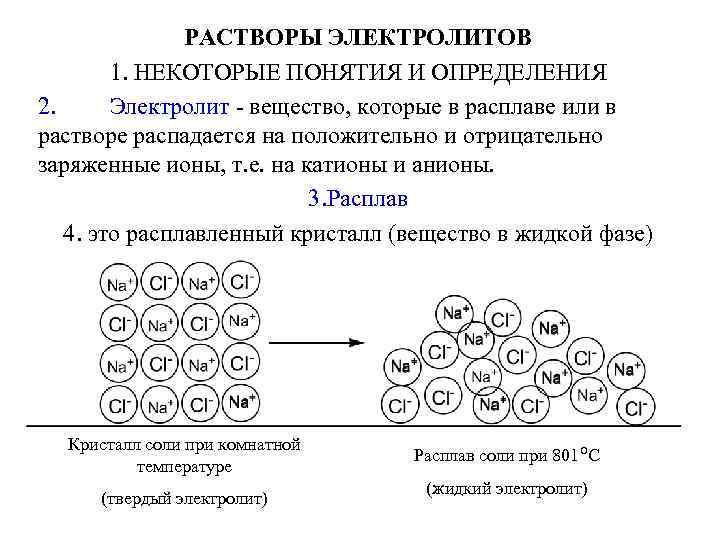 РАСТВОРЫ ЭЛЕКТРОЛИТОВ 1. НЕКОТОРЫЕ ПОНЯТИЯ И ОПРЕДЕЛЕНИЯ 2. Электролит - вещество, которые в расплаве или в растворе распадается на положительно и отрицательно заряженные ионы, т. е. на катионы и анионы. 3. Расплав 4. это расплавленный кристалл (вещество в жидкой фазе) Кристалл соли при комнатной температуре (твердый электролит) Расплав соли при 801 о С (жидкий электролит)
РАСТВОРЫ ЭЛЕКТРОЛИТОВ 1. НЕКОТОРЫЕ ПОНЯТИЯ И ОПРЕДЕЛЕНИЯ 2. Электролит - вещество, которые в расплаве или в растворе распадается на положительно и отрицательно заряженные ионы, т. е. на катионы и анионы. 3. Расплав 4. это расплавленный кристалл (вещество в жидкой фазе) Кристалл соли при комнатной температуре (твердый электролит) Расплав соли при 801 о С (жидкий электролит)
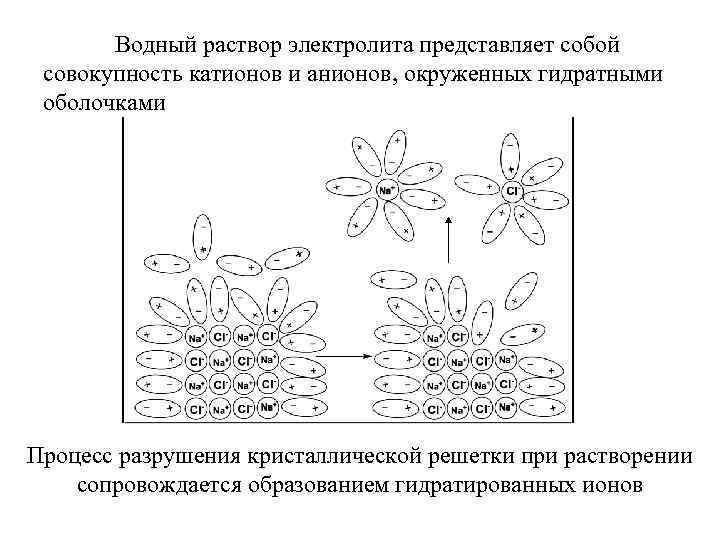 Водный раствор электролита представляет собой совокупность катионов и анионов, окруженных гидратными оболочками Процесс разрушения кристаллической решетки при растворении сопровождается образованием гидратированных ионов
Водный раствор электролита представляет собой совокупность катионов и анионов, окруженных гидратными оболочками Процесс разрушения кристаллической решетки при растворении сопровождается образованием гидратированных ионов
 2. СИЛЬНЫЕ ЭЛЕКТРОЛИТЫ Сильные электролиты полностью распадаются на ионы при растворении в воде. К сильным электролитам относятся: 1) соли: Na. Cl, КCl, Ca. Cl 2, Mg. Cl 2, Ca. SO 4 и др. , 2) основания щелочных и щелочноземельных металлов: Na. OH, Ca(OH)2 и др. , 3) кислоты, такие, как серная H 2 SO 4, азотная HNO 3, соляная HCl 3. ПРИМЕРЫ ПОЛНОЙ ДИССОЦИАЦИИ СИЛЬНЫХ ЭЛЕКТРОЛИТОВ + Na. Cl (кр. ) + H 2 O(ж) Na (р-р) + Cl (р-р) + Na. OH (кр. ) + Н 2 О(ж) Na (р-р) + OH (р-р) H 2 SO 4 (ж) + Н 2 О (ж) Н +(р-р) + НSO 4 (р-р)
2. СИЛЬНЫЕ ЭЛЕКТРОЛИТЫ Сильные электролиты полностью распадаются на ионы при растворении в воде. К сильным электролитам относятся: 1) соли: Na. Cl, КCl, Ca. Cl 2, Mg. Cl 2, Ca. SO 4 и др. , 2) основания щелочных и щелочноземельных металлов: Na. OH, Ca(OH)2 и др. , 3) кислоты, такие, как серная H 2 SO 4, азотная HNO 3, соляная HCl 3. ПРИМЕРЫ ПОЛНОЙ ДИССОЦИАЦИИ СИЛЬНЫХ ЭЛЕКТРОЛИТОВ + Na. Cl (кр. ) + H 2 O(ж) Na (р-р) + Cl (р-р) + Na. OH (кр. ) + Н 2 О(ж) Na (р-р) + OH (р-р) H 2 SO 4 (ж) + Н 2 О (ж) Н +(р-р) + НSO 4 (р-р)
 4. СЛАБЫЕ ЭЛЕКТРОЛИТЫ Слабые электролиты лишь частично диссоциируют на ионы при растворении в воде. К слабым электролитам относятся: 1) вода Н 2 О 2) некоторые неорганические кислоты, например, синильная кислота HCN, сероводород H 2 S, угольная кислота Н 2 СО 3 (в свободном виде она не существует и выделить её из водного раствора нельзя, она распадается на воду и углекислый газ) 3) многие основания металлов кроме щелочных и щелочноземельных металлов, например, Al(OH)3 4) аммиачная вода, NH 3(р-р) или NH 4 OH 5) органические кислоты, например, СН 3 СООН
4. СЛАБЫЕ ЭЛЕКТРОЛИТЫ Слабые электролиты лишь частично диссоциируют на ионы при растворении в воде. К слабым электролитам относятся: 1) вода Н 2 О 2) некоторые неорганические кислоты, например, синильная кислота HCN, сероводород H 2 S, угольная кислота Н 2 СО 3 (в свободном виде она не существует и выделить её из водного раствора нельзя, она распадается на воду и углекислый газ) 3) многие основания металлов кроме щелочных и щелочноземельных металлов, например, Al(OH)3 4) аммиачная вода, NH 3(р-р) или NH 4 OH 5) органические кислоты, например, СН 3 СООН
 5. ПРИМЕРЫ ДИССОЦИАЦИИ СЛАБЫХ ЭЛЕКТРОЛИТОВ Электролитическая диссоциация воды + Н 2 О ⇄ Н 3 О + НО Н 2 О ⇄ Н+ + НО - Концентрация недиссоциированной воды постоянная величина: 1 л воды содержит
5. ПРИМЕРЫ ДИССОЦИАЦИИ СЛАБЫХ ЭЛЕКТРОЛИТОВ Электролитическая диссоциация воды + Н 2 О ⇄ Н 3 О + НО Н 2 О ⇄ Н+ + НО - Концентрация недиссоциированной воды постоянная величина: 1 л воды содержит
 6. ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ р. Н 0 1 2 3 4 5 кислая среда 6 7 8 Нейтральная среда 9 10 11 12 13 14 щелочная среда [моль/л]
6. ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ р. Н 0 1 2 3 4 5 кислая среда 6 7 8 Нейтральная среда 9 10 11 12 13 14 щелочная среда [моль/л]
 7. ЗНАЧЕНИЯ р. Н НЕКОТОРЫХ ЖИДКОСТЕЙ Раствор соляной кислоты (HCl) 1 моль/л р. Н 0. 0 Чистый желудочный сок человека 0. 9 – 1. 1 Лимонный сок 2. 3 Речная вода 5. 6 Грудное молоко 6. 6 – 6. 9 Сыворотка крови человека 7. 4 Морская вода 7. 8 – 8. 3 Раствор щелочи (КОН) 1 моль/л 14. 0
7. ЗНАЧЕНИЯ р. Н НЕКОТОРЫХ ЖИДКОСТЕЙ Раствор соляной кислоты (HCl) 1 моль/л р. Н 0. 0 Чистый желудочный сок человека 0. 9 – 1. 1 Лимонный сок 2. 3 Речная вода 5. 6 Грудное молоко 6. 6 – 6. 9 Сыворотка крови человека 7. 4 Морская вода 7. 8 – 8. 3 Раствор щелочи (КОН) 1 моль/л 14. 0
 8. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ СЛАБЫХ КИСЛОТ Основность кислоты определяется числом ионов водорода, которые образуются при диссоциации кислоты Диссоциация одноосновной кислоты: НСN ⇄ Диссоциация двухосновной кислоты: К – константа равновесия ⇄ К 1 К 2 К 1 > K 2 ⇄ + Диссоциация трехосновной кислоты: H 3 PO 4 ⇄ + H 2 PO 4 - K 1 H 2 PO 4 ⇄ + HPO 42 - K 2 2 HPO 4 ⇄ + PO 4 3 - K 3 K 1 > K 2 > K 3
8. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ СЛАБЫХ КИСЛОТ Основность кислоты определяется числом ионов водорода, которые образуются при диссоциации кислоты Диссоциация одноосновной кислоты: НСN ⇄ Диссоциация двухосновной кислоты: К – константа равновесия ⇄ К 1 К 2 К 1 > K 2 ⇄ + Диссоциация трехосновной кислоты: H 3 PO 4 ⇄ + H 2 PO 4 - K 1 H 2 PO 4 ⇄ + HPO 42 - K 2 2 HPO 4 ⇄ + PO 4 3 - K 3 K 1 > K 2 > K 3
 9. РЕАКЦИИ ЭЛЕКТРОЛИТОВ 1) Реакции нейтрализации (образование воды): HCl(р-р) + KOH(р-р) KCl(р-р) + H 2 O(ж) 2) Реакции осаждения (образование нерастворимой соли): Ca. Cl 2(р-р) + Na 2 SO 4(р-р) Na. Cl(р-р) + Ca. SO 4 (т) 3) Окислительно-восстановительные реакции с участием металлов: Zn(т) + Cu. SO 4(р-р) Zn. SO 4(р-р) + Cu(т) Реакция окисления (атом цинка отдает электроны): 2+ Zn(т) Zn (р-р) + 2 e. Реакция восстановления (ион меди принимает электроны): Cu - Cu + 2+ 2 e
9. РЕАКЦИИ ЭЛЕКТРОЛИТОВ 1) Реакции нейтрализации (образование воды): HCl(р-р) + KOH(р-р) KCl(р-р) + H 2 O(ж) 2) Реакции осаждения (образование нерастворимой соли): Ca. Cl 2(р-р) + Na 2 SO 4(р-р) Na. Cl(р-р) + Ca. SO 4 (т) 3) Окислительно-восстановительные реакции с участием металлов: Zn(т) + Cu. SO 4(р-р) Zn. SO 4(р-р) + Cu(т) Реакция окисления (атом цинка отдает электроны): 2+ Zn(т) Zn (р-р) + 2 e. Реакция восстановления (ион меди принимает электроны): Cu - Cu + 2+ 2 e
 Реакции гидролиза Соли – сильные электролиты. При растворении в воде они образуют гидратированные катионы и анионы. Если катион или анион при взаимодействии с водой образует слабый электролит, то раствор становится либо щелочной либо кислой средой. Взаимодействие ионов солей с водой, изменяющее р. Н среды с электронейтральной на кислую или щелочную называется гидролизом. 10. ДВА ПРИМЕРА РЕАКЦИЙ ГИДРОЛИЗА СОЛЕЙ а) реакция воды с анионом слабой кислоты CH 3 COONa(р-р) + H 2 O(ж) ⇄ CH 3 COOH(р-р) + Na. OH(р-р) + CH 3 COO -+ Na++ H 2 O ⇄ CH 3 COOH + Na + OH CH 3 COO-+ H 2 O ⇄ CH 3 COOH + OH - (среда щелочная)
Реакции гидролиза Соли – сильные электролиты. При растворении в воде они образуют гидратированные катионы и анионы. Если катион или анион при взаимодействии с водой образует слабый электролит, то раствор становится либо щелочной либо кислой средой. Взаимодействие ионов солей с водой, изменяющее р. Н среды с электронейтральной на кислую или щелочную называется гидролизом. 10. ДВА ПРИМЕРА РЕАКЦИЙ ГИДРОЛИЗА СОЛЕЙ а) реакция воды с анионом слабой кислоты CH 3 COONa(р-р) + H 2 O(ж) ⇄ CH 3 COOH(р-р) + Na. OH(р-р) + CH 3 COO -+ Na++ H 2 O ⇄ CH 3 COOH + Na + OH CH 3 COO-+ H 2 O ⇄ CH 3 COOH + OH - (среда щелочная)
 б) реакция воды с катионом слабого основания + Al. Cl 3 + H 2 O ⇄ Al(OH)Cl 2 + H + Cl 3+ Al + 3 Cl - + H 2 O ⇄ Al(OH)Cl 2 + H ++ Cl Al 3++ 2 Cl - + H 2 O ⇄ Al(OH)Cl 2 + H + (среда кислая) 11. ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ И ЭЛЕКТРОЛИЗЕРЫ Для того, чтобы энергию химической реакции превратить в электрическую и наоборот электрическую энергию использовать для осуществления химической реакции превращения веществ ученые создали специальные устройства. В них отсутствует непосредственный контакт реагирующих веществ. Такими устройствами являются: а) гальванические элементы б) электролизеры
б) реакция воды с катионом слабого основания + Al. Cl 3 + H 2 O ⇄ Al(OH)Cl 2 + H + Cl 3+ Al + 3 Cl - + H 2 O ⇄ Al(OH)Cl 2 + H ++ Cl Al 3++ 2 Cl - + H 2 O ⇄ Al(OH)Cl 2 + H + (среда кислая) 11. ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ И ЭЛЕКТРОЛИЗЕРЫ Для того, чтобы энергию химической реакции превратить в электрическую и наоборот электрическую энергию использовать для осуществления химической реакции превращения веществ ученые создали специальные устройства. В них отсутствует непосредственный контакт реагирующих веществ. Такими устройствами являются: а) гальванические элементы б) электролизеры
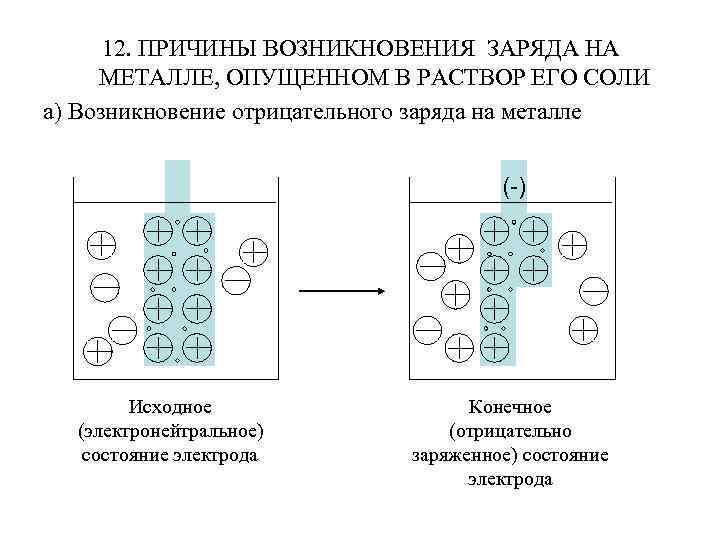 12. ПРИЧИНЫ ВОЗНИКНОВЕНИЯ ЗАРЯДА НА МЕТАЛЛЕ, ОПУЩЕННОМ В РАСТВОР ЕГО СОЛИ а) Возникновение отрицательного заряда на металле (-) Исходное (электронейтральное) состояние электрода Конечное (отрицательно заряженное) состояние электрода
12. ПРИЧИНЫ ВОЗНИКНОВЕНИЯ ЗАРЯДА НА МЕТАЛЛЕ, ОПУЩЕННОМ В РАСТВОР ЕГО СОЛИ а) Возникновение отрицательного заряда на металле (-) Исходное (электронейтральное) состояние электрода Конечное (отрицательно заряженное) состояние электрода
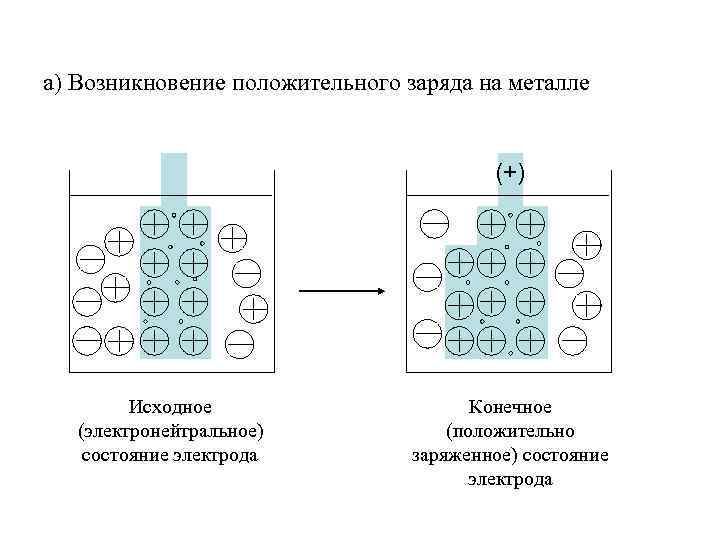 а) Возникновение положительного заряда на металле (+) Исходное (электронейтральное) состояние электрода Конечное (положительно заряженное) состояние электрода
а) Возникновение положительного заряда на металле (+) Исходное (электронейтральное) состояние электрода Конечное (положительно заряженное) состояние электрода
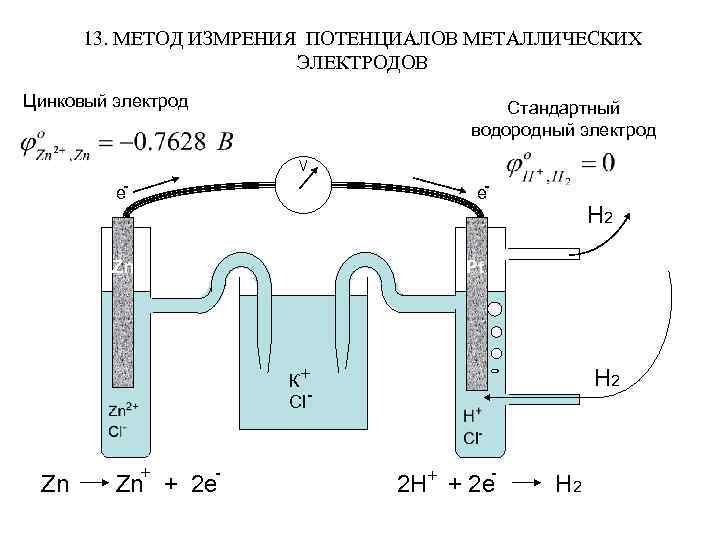 13. МЕТОД ИЗМРЕНИЯ ПОТЕНЦИАЛОВ МЕТАЛЛИЧЕСКИХ ЭЛЕКТРОДОВ Цинковый электрод Стандартный водородный электрод e- e- Zn Н 2 Pt К+ Cl - Zn + 2 e Н 2 - 2 H+ + 2 e H 2
13. МЕТОД ИЗМРЕНИЯ ПОТЕНЦИАЛОВ МЕТАЛЛИЧЕСКИХ ЭЛЕКТРОДОВ Цинковый электрод Стандартный водородный электрод e- e- Zn Н 2 Pt К+ Cl - Zn + 2 e Н 2 - 2 H+ + 2 e H 2
 14. СТАНДАРТНЫЕ ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ МЕТАЛЛОВ И НЕМЕТАЛЛОВ В ВОДНОМ РАСТВОРЕ Электродная реакция
14. СТАНДАРТНЫЕ ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ МЕТАЛЛОВ И НЕМЕТАЛЛОВ В ВОДНОМ РАСТВОРЕ Электродная реакция
 15. ВЫЧИСЛЕНИЕ ЭЛЕКТРОДНОГОПОТЕНЦИАЛА УРАВНЕНИЕ НЕРНСТА Для любого металлического электрода, электродный потенциал вычисляется по уравнению Нернста: где, - стандартный электродный потенциал при концентрации электролита 1 моль/л; - электродный потенциал при концентрации электролита, отличающейся от 1 моль/л; R – газовая постоянная; Т – температура [К]; z – число электронов, участвующее в электродном процессе; F – единица количества электричества [Фарадей]. Из уравнения Нернста следует: электродный потенциал зависит а) от температуры, при которой находится электрод с электролитом, б) от концентрации ионов металла в разбавленном растворе, в) от природы металла (его свойства отдавать электроны).
15. ВЫЧИСЛЕНИЕ ЭЛЕКТРОДНОГОПОТЕНЦИАЛА УРАВНЕНИЕ НЕРНСТА Для любого металлического электрода, электродный потенциал вычисляется по уравнению Нернста: где, - стандартный электродный потенциал при концентрации электролита 1 моль/л; - электродный потенциал при концентрации электролита, отличающейся от 1 моль/л; R – газовая постоянная; Т – температура [К]; z – число электронов, участвующее в электродном процессе; F – единица количества электричества [Фарадей]. Из уравнения Нернста следует: электродный потенциал зависит а) от температуры, при которой находится электрод с электролитом, б) от концентрации ионов металла в разбавленном растворе, в) от природы металла (его свойства отдавать электроны).
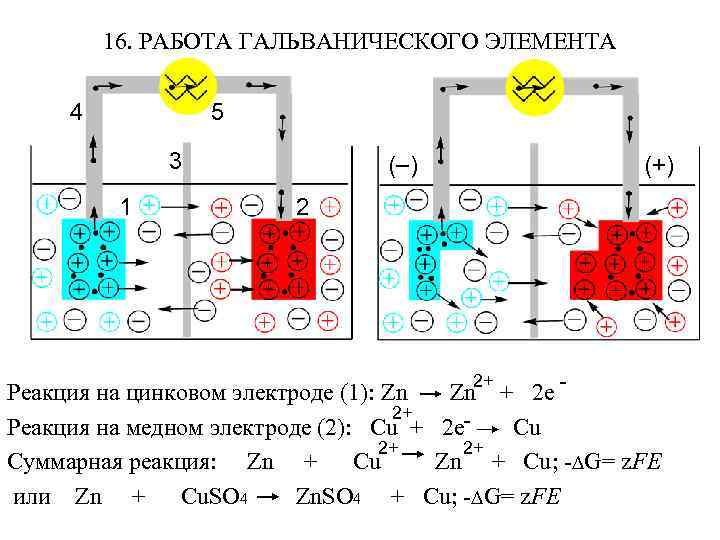 16. РАБОТА ГАЛЬВАНИЧЕСКОГО ЭЛЕМЕНТА 4 5 3 1 ( ) (+) 2 Реакция на цинковом электроде (1): Zn Zn + 2 e 2+ Реакция на медном электроде (2): Cu + 2 e. Cu 2+ 2+ Суммарная реакция: Zn + Cu; - G= z. FE или Zn + Cu. SO 4 Zn. SO 4 + Cu; - G= z. FE 2+
16. РАБОТА ГАЛЬВАНИЧЕСКОГО ЭЛЕМЕНТА 4 5 3 1 ( ) (+) 2 Реакция на цинковом электроде (1): Zn Zn + 2 e 2+ Реакция на медном электроде (2): Cu + 2 e. Cu 2+ 2+ Суммарная реакция: Zn + Cu; - G= z. FE или Zn + Cu. SO 4 Zn. SO 4 + Cu; - G= z. FE 2+
 17. ВЫЧИСЛЕНИЕ ЭЛЕКТРОДВИЖУЩЕЙ СИЛЫ (э. д. с. , Е ) ГАЛЬВАНИЧЕСКОГО ЭЛЕМЕНТА 1. Сокращенно обозначим гальванический элемент, записывая отрицательный электрод слева: (-)Zn|Zn. SO 4||Cu. SO 4|Cu(+) 2. Знаки (+) и (-) указывают, что на отрицательном электроде (аноде) происходит окисление металла, а на положительном электроде (катоде) восстановление иона до металла. 2+ Реакция на аноде: Zn Zn + 2 e- (окисление металла) 2+ Реакция на катоде: Cu + 2 e Cu (восстановление до металла) 3. Вычитают из потенциала положительного электрода потенциал более отрицательного электрода: = = 0. 337 – (-0. 763) = 1. 10 В
17. ВЫЧИСЛЕНИЕ ЭЛЕКТРОДВИЖУЩЕЙ СИЛЫ (э. д. с. , Е ) ГАЛЬВАНИЧЕСКОГО ЭЛЕМЕНТА 1. Сокращенно обозначим гальванический элемент, записывая отрицательный электрод слева: (-)Zn|Zn. SO 4||Cu. SO 4|Cu(+) 2. Знаки (+) и (-) указывают, что на отрицательном электроде (аноде) происходит окисление металла, а на положительном электроде (катоде) восстановление иона до металла. 2+ Реакция на аноде: Zn Zn + 2 e- (окисление металла) 2+ Реакция на катоде: Cu + 2 e Cu (восстановление до металла) 3. Вычитают из потенциала положительного электрода потенциал более отрицательного электрода: = = 0. 337 – (-0. 763) = 1. 10 В
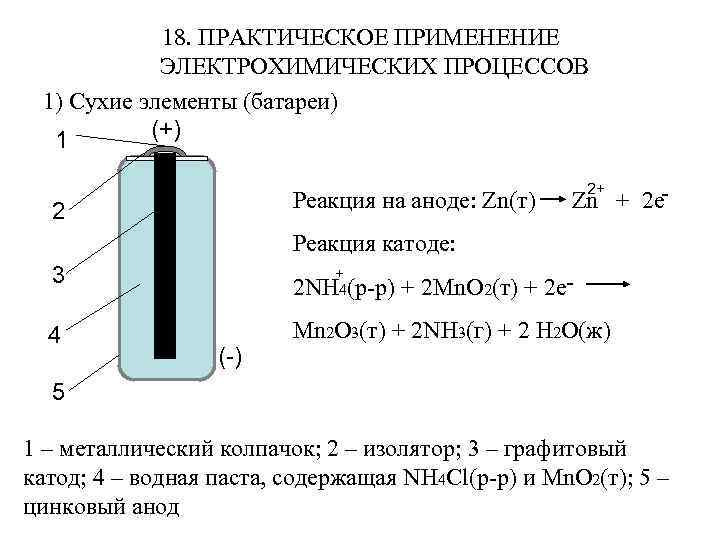 18. ПРАКТИЧЕСКОЕ ПРИМЕНЕНИЕ ЭЛЕКТРОХИМИЧЕСКИХ ПРОЦЕССОВ 1) Сухие элементы (батареи) (+) 1 Реакция на аноде: Zn(т) 2 2+ Zn + 2 e- Реакция катоде: 3 + 2 NH 4(р-р) 4 Mn 2 O 3(т) + 2 NH 3(г) + 2 H 2 O(ж) (-) + 2 Mn. O 2(т) + 2 e- 5 1 – металлический колпачок; 2 – изолятор; 3 – графитовый катод; 4 – водная паста, содержащая NH 4 Cl(р-р) и Mn. O 2(т); 5 – цинковый анод
18. ПРАКТИЧЕСКОЕ ПРИМЕНЕНИЕ ЭЛЕКТРОХИМИЧЕСКИХ ПРОЦЕССОВ 1) Сухие элементы (батареи) (+) 1 Реакция на аноде: Zn(т) 2 2+ Zn + 2 e- Реакция катоде: 3 + 2 NH 4(р-р) 4 Mn 2 O 3(т) + 2 NH 3(г) + 2 H 2 O(ж) (-) + 2 Mn. O 2(т) + 2 e- 5 1 – металлический колпачок; 2 – изолятор; 3 – графитовый катод; 4 – водная паста, содержащая NH 4 Cl(р-р) и Mn. O 2(т); 5 – цинковый анод
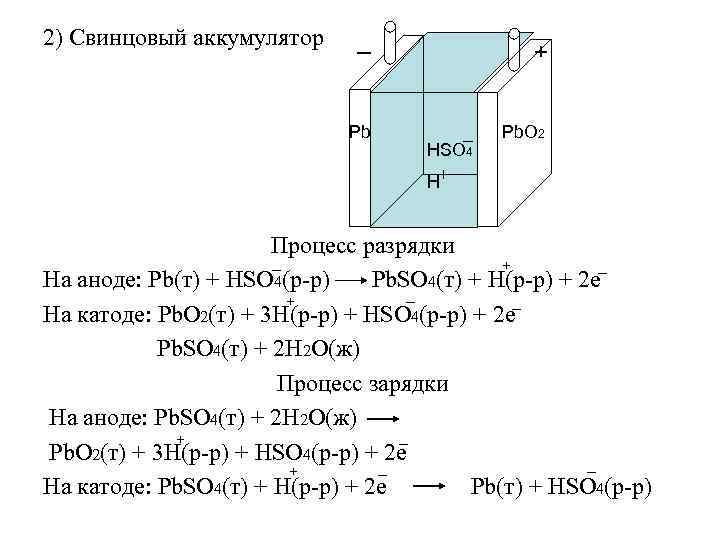 2) Свинцовый аккумулятор _ Pb + _ HSO 4 H+ Pb. O 2 Процесс разрядки _ + _ На аноде: Pb(т) + HSO 4(р-р) Pb. SO 4(т) + H(р-р) + 2 е _ + _ На катоде: Pb. O 2(т) + 3 H(р-р) + HSO 4(р-р) + 2 е Pb. SO 4(т) + 2 Н 2 О(ж) Процесс зарядки На аноде: Pb. SO 4(т) + 2 Н 2 О(ж) _ + Pb. O 2(т) + 3 H(р-р) + HSO 4(р-р) + 2 е _ _ + На катоде: Pb. SO 4(т) + H(р-р) + 2 е Pb(т) + HSO 4(р-р)
2) Свинцовый аккумулятор _ Pb + _ HSO 4 H+ Pb. O 2 Процесс разрядки _ + _ На аноде: Pb(т) + HSO 4(р-р) Pb. SO 4(т) + H(р-р) + 2 е _ + _ На катоде: Pb. O 2(т) + 3 H(р-р) + HSO 4(р-р) + 2 е Pb. SO 4(т) + 2 Н 2 О(ж) Процесс зарядки На аноде: Pb. SO 4(т) + 2 Н 2 О(ж) _ + Pb. O 2(т) + 3 H(р-р) + HSO 4(р-р) + 2 е _ _ + На катоде: Pb. SO 4(т) + H(р-р) + 2 е Pb(т) + HSO 4(р-р)
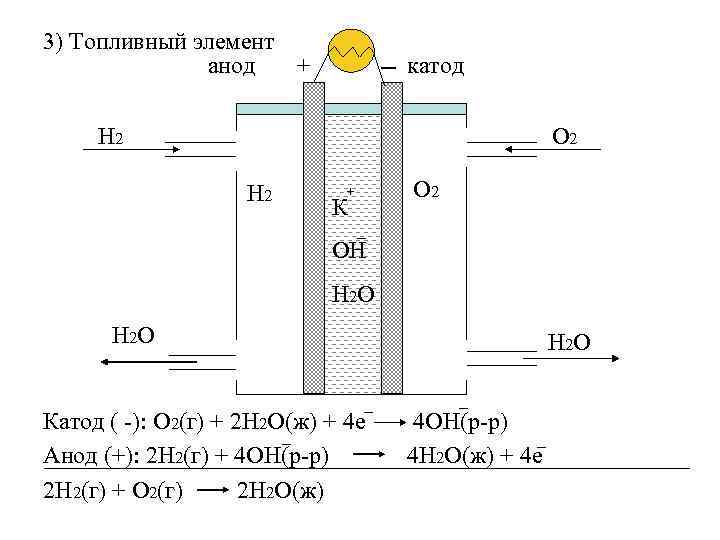 3) Топливный элемент анод + катод Н 2 О 2 + К _ ОН Н 2 О _ Катод ( -): О 2(г) + 2 Н 2 О(ж) + 4 е _ Анод (+): 2 Н 2(г) + 4 ОН(р-р) 2 Н 2(г) + О 2(г) 2 Н 2 О(ж) _ 4 ОН(р-р) _ 4 Н 2 О(ж) + 4 е
3) Топливный элемент анод + катод Н 2 О 2 + К _ ОН Н 2 О _ Катод ( -): О 2(г) + 2 Н 2 О(ж) + 4 е _ Анод (+): 2 Н 2(г) + 4 ОН(р-р) 2 Н 2(г) + О 2(г) 2 Н 2 О(ж) _ 4 ОН(р-р) _ 4 Н 2 О(ж) + 4 е
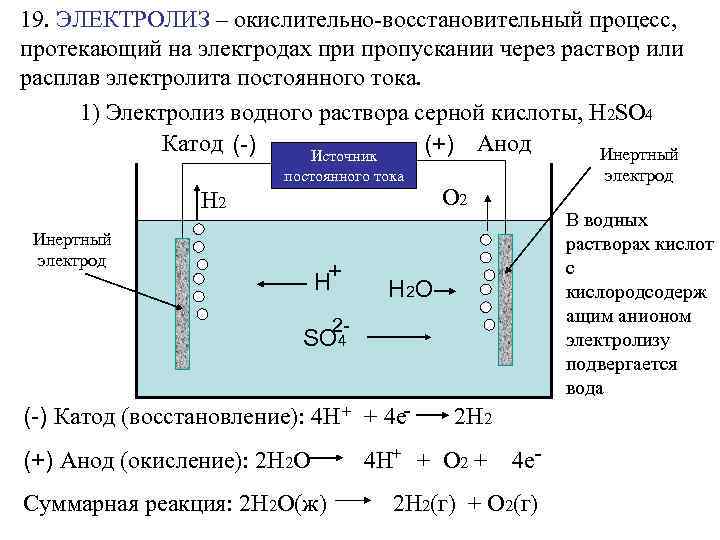 19. ЭЛЕКТРОЛИЗ – окислительно-восстановительный процесс, протекающий на электродах при пропускании через раствор или расплав электролита постоянного тока. 1) Электролиз водного раствора серной кислоты, Н 2 SO 4 Катод (-) (+) Анод Инертный Источник постоянного тока Н 2 Инертный электрод Н+ электрод О 2 В водных растворах кислот с кислородсодерж ащим анионом электролизу подвергается вода H 2 O 2 - SO 4 (-) Катод (восстановление): 4 Н + + 4 е(+) Анод (окисление): 2 Н 2 О Суммарная реакция: 2 Н 2 О(ж) 2 Н 2 4 Н+ + О 2 + 4 е- 2 Н 2(г) + О 2(г)
19. ЭЛЕКТРОЛИЗ – окислительно-восстановительный процесс, протекающий на электродах при пропускании через раствор или расплав электролита постоянного тока. 1) Электролиз водного раствора серной кислоты, Н 2 SO 4 Катод (-) (+) Анод Инертный Источник постоянного тока Н 2 Инертный электрод Н+ электрод О 2 В водных растворах кислот с кислородсодерж ащим анионом электролизу подвергается вода H 2 O 2 - SO 4 (-) Катод (восстановление): 4 Н + + 4 е(+) Анод (окисление): 2 Н 2 О Суммарная реакция: 2 Н 2 О(ж) 2 Н 2 4 Н+ + О 2 + 4 е- 2 Н 2(г) + О 2(г)
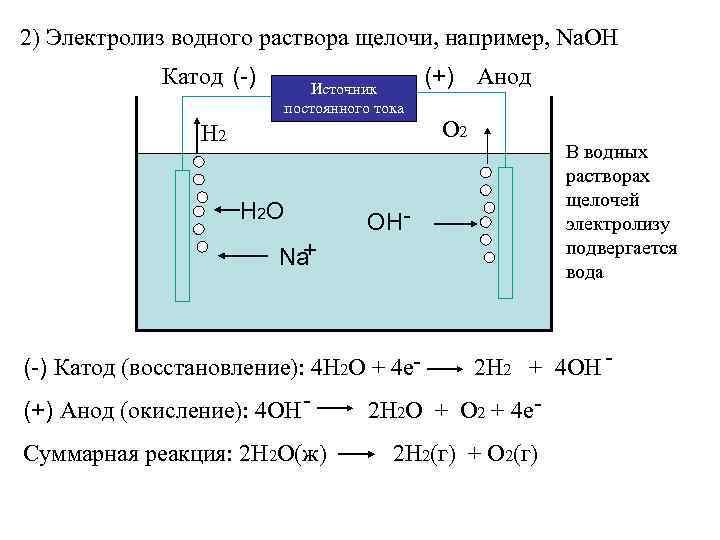 2) Электролиз водного раствора щелочи, например, Na. OH Катод (-) Источник постоянного тока Н 2 H 2 O (+) Анод О 2 OН- + Na В водных растворах щелочей электролизу подвергается вода (-) Катод (восстановление): 4 Н 2 О + 4 е 2 Н 2 + 4 ОН (+) Анод (окисление): 4 ОН 2 Н 2 О + О 2 + 4 е. Суммарная реакция: 2 Н 2 О(ж) 2 Н 2(г) + О 2(г)
2) Электролиз водного раствора щелочи, например, Na. OH Катод (-) Источник постоянного тока Н 2 H 2 O (+) Анод О 2 OН- + Na В водных растворах щелочей электролизу подвергается вода (-) Катод (восстановление): 4 Н 2 О + 4 е 2 Н 2 + 4 ОН (+) Анод (окисление): 4 ОН 2 Н 2 О + О 2 + 4 е. Суммарная реакция: 2 Н 2 О(ж) 2 Н 2(г) + О 2(г)
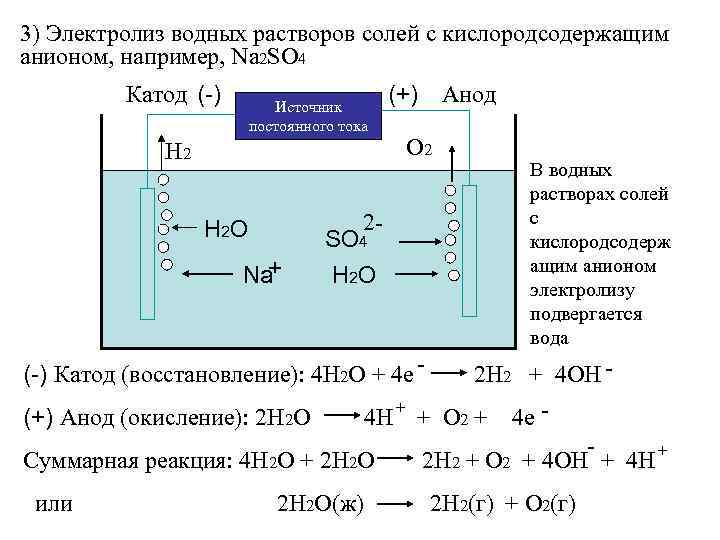 3) Электролиз водных растворов солей с кислородсодержащим анионом, например, Na 2 SO 4 Катод (-) Источник постоянного тока (+) Анод Н 2 О 2 2 - H 2 O + Na SO 4 H 2 O В водных растворах солей с кислородсодерж ащим анионом электролизу подвергается вода (-) Катод (восстановление): 4 Н 2 О + 4 е (+) Анод (окисление): 2 Н 2 О 4 Н + Суммарная реакция: 4 Н 2 О + 2 Н 2 О или 2 Н 2 О(ж) 2 Н 2 + 4 ОН + О 2 + 4 е + 2 Н 2 + О 2 + 4 ОН + 4 Н 2 Н 2(г) + О 2(г)
3) Электролиз водных растворов солей с кислородсодержащим анионом, например, Na 2 SO 4 Катод (-) Источник постоянного тока (+) Анод Н 2 О 2 2 - H 2 O + Na SO 4 H 2 O В водных растворах солей с кислородсодерж ащим анионом электролизу подвергается вода (-) Катод (восстановление): 4 Н 2 О + 4 е (+) Анод (окисление): 2 Н 2 О 4 Н + Суммарная реакция: 4 Н 2 О + 2 Н 2 О или 2 Н 2 О(ж) 2 Н 2 + 4 ОН + О 2 + 4 е + 2 Н 2 + О 2 + 4 ОН + 4 Н 2 Н 2(г) + О 2(г)
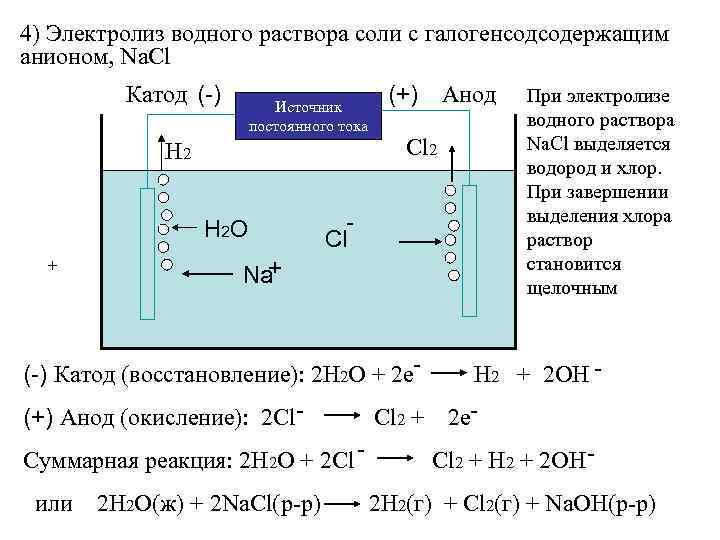 4) Электролиз водного раствора соли с галогенсодсодержащим анионом, Na. Cl Катод (-) Источник постоянного тока Н 2 H 2 O + (+) Анод Сl 2 Сl + Na (-) Катод (восстановление): 2 Н 2 О + 2 е(+) Анод (окисление): 2 Cl. Cl 2 + Суммарная реакция: 2 Н 2 О + 2 Cl или 2 Н 2 О(ж) + 2 Na. Cl(р-р) При электролизе водного раствора Na. Cl выделяется водород и хлор. При завершении выделения хлора раствор становится щелочным Н 2 + 2 ОН 2 е. Cl 2 + Н 2 + 2 ОН - 2 Н 2(г) + Cl 2(г) + Na. OH(р-р)
4) Электролиз водного раствора соли с галогенсодсодержащим анионом, Na. Cl Катод (-) Источник постоянного тока Н 2 H 2 O + (+) Анод Сl 2 Сl + Na (-) Катод (восстановление): 2 Н 2 О + 2 е(+) Анод (окисление): 2 Cl. Cl 2 + Суммарная реакция: 2 Н 2 О + 2 Cl или 2 Н 2 О(ж) + 2 Na. Cl(р-р) При электролизе водного раствора Na. Cl выделяется водород и хлор. При завершении выделения хлора раствор становится щелочным Н 2 + 2 ОН 2 е. Cl 2 + Н 2 + 2 ОН - 2 Н 2(г) + Cl 2(г) + Na. OH(р-р)
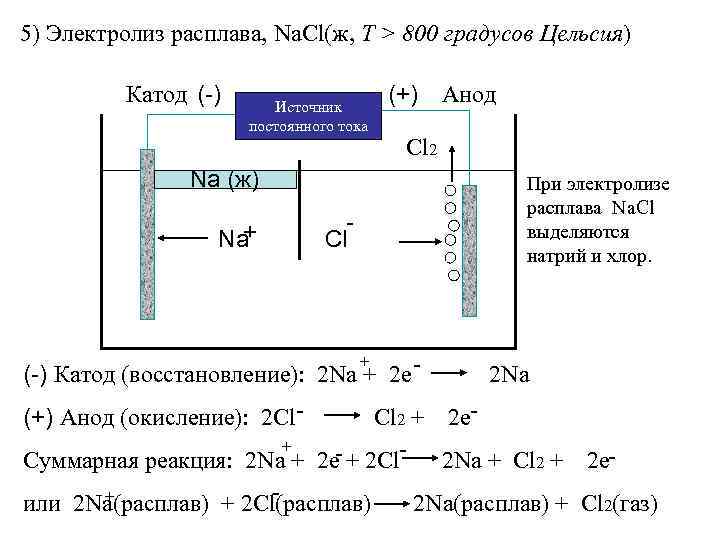 5) Электролиз расплава, Na. Cl(ж, Т > 800 градусов Цельсия) Катод (-) Источник постоянного тока Na (ж) + Na (+) Анод Сl 2 При электролизе расплава Na. Cl выделяются натрий и хлор. Сl (-) Катод (восстановление): 2 Na + 2 е 2 Na (+) Анод (окисление): 2 Cl. Cl 2 + 2 е+ Суммарная реакция: 2 Na + 2 е- + 2 Cl- 2 Na + Cl 2 + 2 е+ или 2 Na(расплав) + 2 Cl(расплав) 2 Na(расплав) + Cl 2(газ) +
5) Электролиз расплава, Na. Cl(ж, Т > 800 градусов Цельсия) Катод (-) Источник постоянного тока Na (ж) + Na (+) Анод Сl 2 При электролизе расплава Na. Cl выделяются натрий и хлор. Сl (-) Катод (восстановление): 2 Na + 2 е 2 Na (+) Анод (окисление): 2 Cl. Cl 2 + 2 е+ Суммарная реакция: 2 Na + 2 е- + 2 Cl- 2 Na + Cl 2 + 2 е+ или 2 Na(расплав) + 2 Cl(расплав) 2 Na(расплав) + Cl 2(газ) +


