Лекция 1. Растворы..pptx
- Количество слайдов: 17
 Растворы Дисперсные системы – системы состоящие из двух или более фаз. Одна из фаз образует непрерывную дисперсную среду (ДС), в которой распределена дисперсная фаза (ДФ) в виде микроскопических гомогенных частей В зависимости от размера частиц ДФ подразделяются Молекулярно-ионные ≤ 10 -8 см Коллоидно-дисперсные Грубодисперсные 10 -5 – 10 -7 см > 10 -5 см Системы с частицами ДФ > 10 -8 см – гетерогенны, имеют большую удельную поверхность раздела Классификация дисперсных систем по агрегатному состоянию ДФ и ДС (ДФ/ДС) т/г т/ж т/т ж/г ж/ж ж/т г/г г/ж г/т Раствор – гомогенная (однофазная) дисперсная система (переменного состава), из двух или более компонентов Растворитель – вещество, которое при образовании раствора не меняет свое агрегатное состояние, или содержится в большем количестве.
Растворы Дисперсные системы – системы состоящие из двух или более фаз. Одна из фаз образует непрерывную дисперсную среду (ДС), в которой распределена дисперсная фаза (ДФ) в виде микроскопических гомогенных частей В зависимости от размера частиц ДФ подразделяются Молекулярно-ионные ≤ 10 -8 см Коллоидно-дисперсные Грубодисперсные 10 -5 – 10 -7 см > 10 -5 см Системы с частицами ДФ > 10 -8 см – гетерогенны, имеют большую удельную поверхность раздела Классификация дисперсных систем по агрегатному состоянию ДФ и ДС (ДФ/ДС) т/г т/ж т/т ж/г ж/ж ж/т г/г г/ж г/т Раствор – гомогенная (однофазная) дисперсная система (переменного состава), из двух или более компонентов Растворитель – вещество, которое при образовании раствора не меняет свое агрегатное состояние, или содержится в большем количестве.
 При образовании растворов одновременно происходят два процесса - распределение растворяемого вещества в объёме растворителя (физический процесс) - образование из частиц растворяемого вещества и молекул растворителя соединений переменного состава – сольватов (химический процесс) Способы выражения состава раствора массовая Доля объемная молярная Молярная концентрация вещества Молярная концентрация эквивалентов вещества Массовая концентрация вещества Моляльность Все эти величины – интенсивные (не зависят от количества раствора)
При образовании растворов одновременно происходят два процесса - распределение растворяемого вещества в объёме растворителя (физический процесс) - образование из частиц растворяемого вещества и молекул растворителя соединений переменного состава – сольватов (химический процесс) Способы выражения состава раствора массовая Доля объемная молярная Молярная концентрация вещества Молярная концентрация эквивалентов вещества Массовая концентрация вещества Моляльность Все эти величины – интенсивные (не зависят от количества раствора)
 Растворимость веществ Процесс образования раствора самопроизвольный. раствор r 1 r 2 r 1 – скорость перехода частиц вещества в раствор r 2 – скорость перехода частиц вещества из раствора обратно Динамическое равновесие при r 1=r 2 вещество насыщенный раствор Концентрацию насыщенного раствора называют растворимостью вещества при данной температуре (mв-ва/100 mр-ля – коэффициент растворимости) На процесс растворения многих веществ оказывает большое влияние полярность молекул растворителя, которая определяется диэлектрической постоянной ε Растворители с высокой ε хорошо растворяют вещества, имеющие полярные молекулы
Растворимость веществ Процесс образования раствора самопроизвольный. раствор r 1 r 2 r 1 – скорость перехода частиц вещества в раствор r 2 – скорость перехода частиц вещества из раствора обратно Динамическое равновесие при r 1=r 2 вещество насыщенный раствор Концентрацию насыщенного раствора называют растворимостью вещества при данной температуре (mв-ва/100 mр-ля – коэффициент растворимости) На процесс растворения многих веществ оказывает большое влияние полярность молекул растворителя, которая определяется диэлектрической постоянной ε Растворители с высокой ε хорошо растворяют вещества, имеющие полярные молекулы
 Растворимость веществ Процесс образования раствора самопроизвольный. раствор r 1 r 2 r 1 – скорость перехода частиц вещества в раствор r 2 – скорость перехода частиц вещества из раствора обратно Динамическое равновесие при r 1=r 2 вещество насыщенный раствор Концентрацию насыщенного раствора называют растворимостью вещества при данной температуре (mв-ва/100 mр-ля – коэффициент растворимости) На процесс растворения многих веществ оказывает большое влияние полярность молекул растворителя, которая определяется диэлектрической постоянной ε Растворители с высокой ε хорошо растворяют вещества, имеющие полярные молекулы
Растворимость веществ Процесс образования раствора самопроизвольный. раствор r 1 r 2 r 1 – скорость перехода частиц вещества в раствор r 2 – скорость перехода частиц вещества из раствора обратно Динамическое равновесие при r 1=r 2 вещество насыщенный раствор Концентрацию насыщенного раствора называют растворимостью вещества при данной температуре (mв-ва/100 mр-ля – коэффициент растворимости) На процесс растворения многих веществ оказывает большое влияние полярность молекул растворителя, которая определяется диэлектрической постоянной ε Растворители с высокой ε хорошо растворяют вещества, имеющие полярные молекулы
 Растворимость газов в жидкостях Закон Генри – растворимость газа при Т=const прямо пропорционально давлению газа над раствором К – const, зависит от природы жидкости и газа Закон строго применим для описания разбавленных растворов газов при невысоких давлениях Газы, вступающие в химическую реакцию с растворителем, закону не подчиняются (NH 3, SO 2, HCl с водой) С повышением Т растворимость, как правило, падает Растворимость жидкостей в жидкостях Неограниченная растворимость – при смешивании образуют однородный раствор (вода – этанол, бензол - толуол) Ограниченная растворимость – растворяются друг в друге, но взаимная растворимость их достигает предела (эфир – вода, фенол – вода, анилин – вода) Образуется два слоя, находящиеся в фазовом равновесии: верхний слой – насыщенный раствор воды в эфире нижний слой – насыщенный раствор эфира в воде Система вода – эфир При нагревании взаимная растворимость, как правило, растет достигая при Ткр полной взаимной растворимости Ткр – критическая температура растворения
Растворимость газов в жидкостях Закон Генри – растворимость газа при Т=const прямо пропорционально давлению газа над раствором К – const, зависит от природы жидкости и газа Закон строго применим для описания разбавленных растворов газов при невысоких давлениях Газы, вступающие в химическую реакцию с растворителем, закону не подчиняются (NH 3, SO 2, HCl с водой) С повышением Т растворимость, как правило, падает Растворимость жидкостей в жидкостях Неограниченная растворимость – при смешивании образуют однородный раствор (вода – этанол, бензол - толуол) Ограниченная растворимость – растворяются друг в друге, но взаимная растворимость их достигает предела (эфир – вода, фенол – вода, анилин – вода) Образуется два слоя, находящиеся в фазовом равновесии: верхний слой – насыщенный раствор воды в эфире нижний слой – насыщенный раствор эфира в воде Система вода – эфир При нагревании взаимная растворимость, как правило, растет достигая при Ткр полной взаимной растворимости Ткр – критическая температура растворения
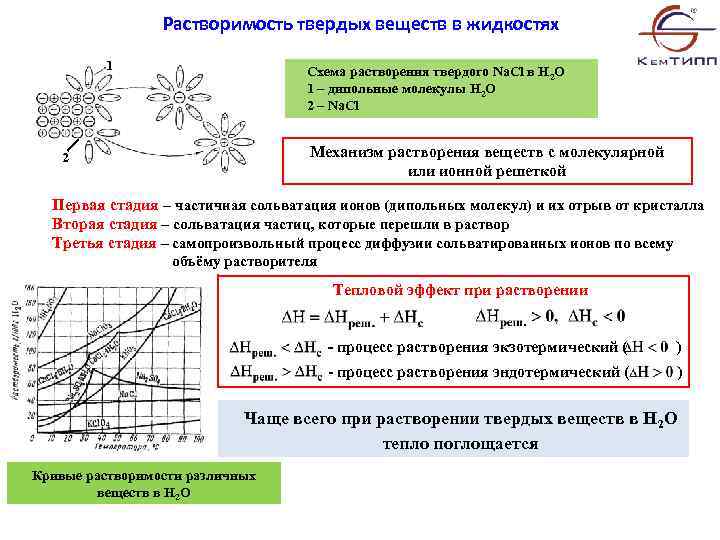 Растворимость твердых веществ в жидкостях 1 Схема растворения твердого Na. Cl в H 2 O 1 – дипольные молекулы H 2 O 2 – Na. Cl Механизм растворения веществ с молекулярной или ионной решеткой 2 Первая стадия – частичная сольватация ионов (дипольных молекул) и их отрыв от кристалла Вторая стадия – сольватация частиц, которые перешли в раствор Третья стадия – самопроизвольный процесс диффузии сольватированных ионов по всему объёму растворителя Тепловой эффект при растворении - процесс растворения экзотермический ( ) - процесс растворения эндотермический ( ) Чаще всего при растворении твердых веществ в H 2 O тепло поглощается Кривые растворимости различных веществ в H 2 O
Растворимость твердых веществ в жидкостях 1 Схема растворения твердого Na. Cl в H 2 O 1 – дипольные молекулы H 2 O 2 – Na. Cl Механизм растворения веществ с молекулярной или ионной решеткой 2 Первая стадия – частичная сольватация ионов (дипольных молекул) и их отрыв от кристалла Вторая стадия – сольватация частиц, которые перешли в раствор Третья стадия – самопроизвольный процесс диффузии сольватированных ионов по всему объёму растворителя Тепловой эффект при растворении - процесс растворения экзотермический ( ) - процесс растворения эндотермический ( ) Чаще всего при растворении твердых веществ в H 2 O тепло поглощается Кривые растворимости различных веществ в H 2 O
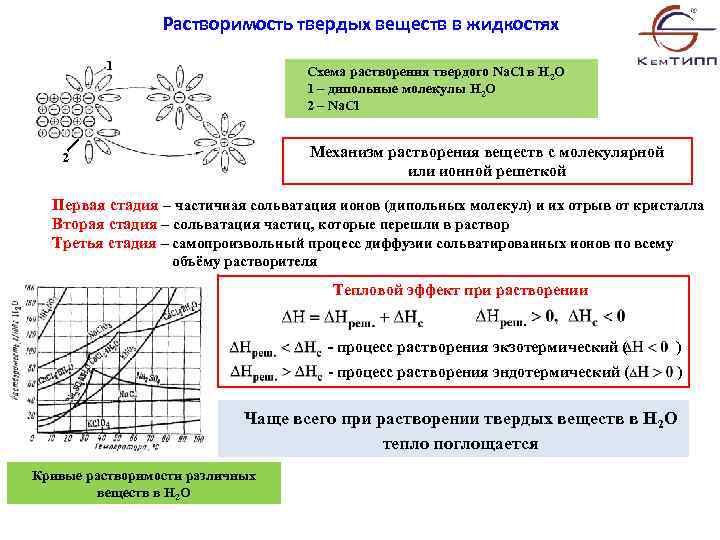 Растворимость твердых веществ в жидкостях 1 Схема растворения твердого Na. Cl в H 2 O 1 – дипольные молекулы H 2 O 2 – Na. Cl Механизм растворения веществ с молекулярной или ионной решеткой 2 Первая стадия – частичная сольватация ионов (дипольных молекул) и их отрыв от кристалла Вторая стадия – сольватация частиц, которые перешли в раствор Третья стадия – самопроизвольный процесс диффузии сольватированных ионов по всему объёму растворителя Тепловой эффект при растворении - процесс растворения экзотермический ( ) - процесс растворения эндотермический ( ) Чаще всего при растворении твердых веществ в H 2 O тепло поглощается Кривые растворимости различных веществ в H 2 O
Растворимость твердых веществ в жидкостях 1 Схема растворения твердого Na. Cl в H 2 O 1 – дипольные молекулы H 2 O 2 – Na. Cl Механизм растворения веществ с молекулярной или ионной решеткой 2 Первая стадия – частичная сольватация ионов (дипольных молекул) и их отрыв от кристалла Вторая стадия – сольватация частиц, которые перешли в раствор Третья стадия – самопроизвольный процесс диффузии сольватированных ионов по всему объёму растворителя Тепловой эффект при растворении - процесс растворения экзотермический ( ) - процесс растворения эндотермический ( ) Чаще всего при растворении твердых веществ в H 2 O тепло поглощается Кривые растворимости различных веществ в H 2 O
 Взаимодействия в растворе Между частицами растворителя – Eр-р Между частицами растворителя и вещества – Eр-в Между частицами растворенного вещества – Eв-в Растворы, в которых взаимодействием частиц растворенного вещества Eв-в можно пренебречь называются предельно разбавленными растворами Свойства описываются простыми закономерностями Считают: С < 10 -4 моль/дм 3 – предельно разбавленный раствор С = 10 -4 – 10 -2 моль/дм 3 – разбавленный раствор 10 -2 < C < 1 моль/дм 3 – концентрированный раствор Растворы, у которых эти закономерности сохраняются при любых концентрациях называются идеальными При образовании таких растворов ΔН, ΔV = 0, ΔS>0; Eр-р= Eр-в= Eр-р Пример: Смеси изомеров, смеси изотопов одного элемента, раствор образованный бензолом и толуолом Смеси веществ, частицы которых близки по размерам и химической природе
Взаимодействия в растворе Между частицами растворителя – Eр-р Между частицами растворителя и вещества – Eр-в Между частицами растворенного вещества – Eв-в Растворы, в которых взаимодействием частиц растворенного вещества Eв-в можно пренебречь называются предельно разбавленными растворами Свойства описываются простыми закономерностями Считают: С < 10 -4 моль/дм 3 – предельно разбавленный раствор С = 10 -4 – 10 -2 моль/дм 3 – разбавленный раствор 10 -2 < C < 1 моль/дм 3 – концентрированный раствор Растворы, у которых эти закономерности сохраняются при любых концентрациях называются идеальными При образовании таких растворов ΔН, ΔV = 0, ΔS>0; Eр-р= Eр-в= Eр-р Пример: Смеси изомеров, смеси изотопов одного элемента, раствор образованный бензолом и толуолом Смеси веществ, частицы которых близки по размерам и химической природе
 Растворы электролитов Теория электролитической диссоциации • Создана С. Аррениусом и В. Оствальдом (физическая теория растворов, 1887 г. ) - Электролиты при растворении распадаются (диссоциируют) на свободные ионы. - Диссоциация электролитов неполная. Ионы и молекулы находятся в динамическом равновесии. - Наличие ионов в растворе определяет его электропроводность. Дополнены И. Каблуковым и В. Кистяковским (химическая теория растворов, 1891 г. ) При растворении электролита происходит его химическое взаимодействие с водой, в результате которого электролит диссоциирует на ионы (сольватирование) Степень электролитической диссоциации α – доля продиссоциировавших молекул (α < 1) С↓ α↑; С↑ α↓ где К – число ионов, образующихся при диссоциации
Растворы электролитов Теория электролитической диссоциации • Создана С. Аррениусом и В. Оствальдом (физическая теория растворов, 1887 г. ) - Электролиты при растворении распадаются (диссоциируют) на свободные ионы. - Диссоциация электролитов неполная. Ионы и молекулы находятся в динамическом равновесии. - Наличие ионов в растворе определяет его электропроводность. Дополнены И. Каблуковым и В. Кистяковским (химическая теория растворов, 1891 г. ) При растворении электролита происходит его химическое взаимодействие с водой, в результате которого электролит диссоциирует на ионы (сольватирование) Степень электролитической диссоциации α – доля продиссоциировавших молекул (α < 1) С↓ α↑; С↑ α↓ где К – число ионов, образующихся при диссоциации
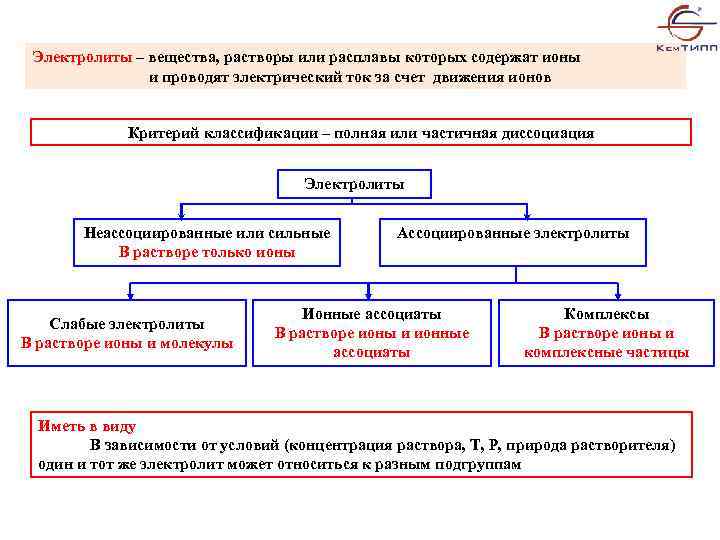 Электролиты – вещества, растворы или расплавы которых содержат ионы и проводят электрический ток за счет движения ионов Критерий классификации – полная или частичная диссоциация Электролиты Неассоциированные или сильные В растворе только ионы Слабые электролиты В растворе ионы и молекулы Ассоциированные электролиты Ионные ассоциаты В растворе ионы и ионные ассоциаты Комплексы В растворе ионы и комплексные частицы Иметь в виду В зависимости от условий (концентрация раствора, Т, Р, природа растворителя) один и тот же электролит может относиться к разным подгруппам
Электролиты – вещества, растворы или расплавы которых содержат ионы и проводят электрический ток за счет движения ионов Критерий классификации – полная или частичная диссоциация Электролиты Неассоциированные или сильные В растворе только ионы Слабые электролиты В растворе ионы и молекулы Ассоциированные электролиты Ионные ассоциаты В растворе ионы и ионные ассоциаты Комплексы В растворе ионы и комплексные частицы Иметь в виду В зависимости от условий (концентрация раствора, Т, Р, природа растворителя) один и тот же электролит может относиться к разным подгруппам
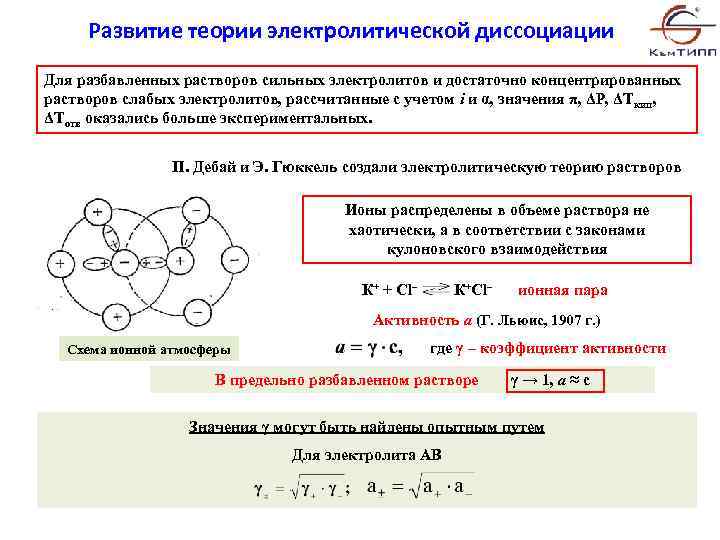 Развитие теории электролитической диссоциации Для разбавленных растворов сильных электролитов и достаточно концентрированных растворов слабых электролитов, рассчитанные с учетом i и α, значения π, ΔР, ΔТкип, ΔТотв оказались больше экспериментальных. П. Дебай и Э. Гюккель создали электролитическую теорию растворов Ионы распределены в объеме раствора не хаотически, а в соответствии с законами кулоновского взаимодействия К+ + Cl– К+Cl– ионная пара Активность а (Г. Льюис, 1907 г. ) Схема ионной атмосферы где γ – коэффициент активности В предельно разбавленном растворе γ → 1, а ≈ с Значения γ могут быть найдены опытным путем Для электролита АВ
Развитие теории электролитической диссоциации Для разбавленных растворов сильных электролитов и достаточно концентрированных растворов слабых электролитов, рассчитанные с учетом i и α, значения π, ΔР, ΔТкип, ΔТотв оказались больше экспериментальных. П. Дебай и Э. Гюккель создали электролитическую теорию растворов Ионы распределены в объеме раствора не хаотически, а в соответствии с законами кулоновского взаимодействия К+ + Cl– К+Cl– ионная пара Активность а (Г. Льюис, 1907 г. ) Схема ионной атмосферы где γ – коэффициент активности В предельно разбавленном растворе γ → 1, а ≈ с Значения γ могут быть найдены опытным путем Для электролита АВ
 Расчет γ ± по формуле Дебая и Гюккеля где А – const, зависящая от ε растворителя и Т Для водных растворов при 25 0 С Ионная сила раствора I Мера интенсивности электрического поля, создаваемого ионами в растворе I равна полусумме произведений концентраций (С) каждого из присутствующих в растворе ионов на квадрат их заряда (Z) Пример раствор Na. Cl, С = 10 -3 моль/дм 3 I(Na. Cl) = 10 -3 моль/дм 3
Расчет γ ± по формуле Дебая и Гюккеля где А – const, зависящая от ε растворителя и Т Для водных растворов при 25 0 С Ионная сила раствора I Мера интенсивности электрического поля, создаваемого ионами в растворе I равна полусумме произведений концентраций (С) каждого из присутствующих в растворе ионов на квадрат их заряда (Z) Пример раствор Na. Cl, С = 10 -3 моль/дм 3 I(Na. Cl) = 10 -3 моль/дм 3
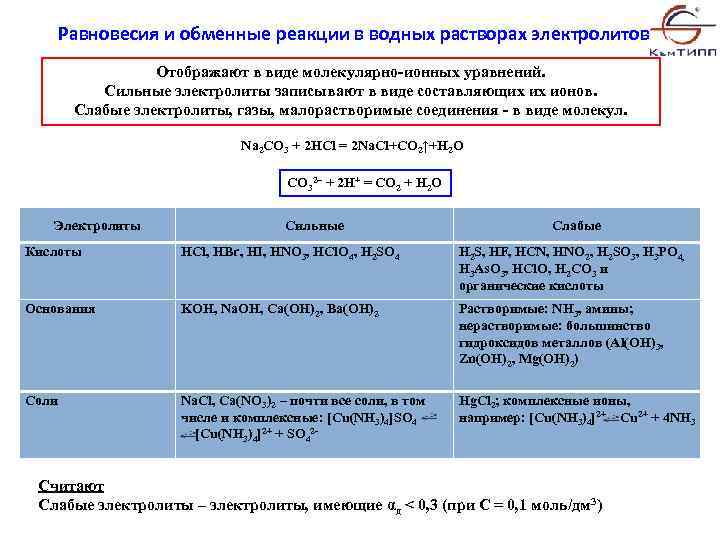 Равновесия и обменные реакции в водных растворах электролитов Отображают в виде молекулярно-ионных уравнений. Сильные электролиты записывают в виде составляющих их ионов. Слабые электролиты, газы, малорастворимые соединения - в виде молекул. Na 2 CO 3 + 2 HCl = 2 Na. Cl+CO 2↑+H 2 O CO 32– + 2 H+ = CO 2 + H 2 O Электролиты Сильные Слабые Кислоты HCl, HBr, HI, HNO 3, HCl. O 4, H 2 SO 4 H 2 S, HF, HCN, HNO 2, H 2 SO 3, H 3 PO 4, H 3 As. O 3, HCl. O, H 2 CO 3 и органические кислоты Основания KOH, Na. OH, Ca(OH)2, Ba(OH)2 Растворимые: NH 3, амины; нерастворимые: большинство гидроксидов металлов (Al(OH)3, Zn(OH)2, Mg(OH)2) Соли Na. Cl, Ca(NO 3)2 – почти все соли, в том числе и комплексные: [Cu(NH 3)4]SO 4 [Cu(NH 3)4]2+ + SO 42 - Hg. Cl 2; комплексные ионы, например: [Cu(NH 3)4]2+ Cu 2+ + 4 NH 3 Считают Слабые электролиты – электролиты, имеющие αд < 0, 3 (при С = 0, 1 моль/дм 3)
Равновесия и обменные реакции в водных растворах электролитов Отображают в виде молекулярно-ионных уравнений. Сильные электролиты записывают в виде составляющих их ионов. Слабые электролиты, газы, малорастворимые соединения - в виде молекул. Na 2 CO 3 + 2 HCl = 2 Na. Cl+CO 2↑+H 2 O CO 32– + 2 H+ = CO 2 + H 2 O Электролиты Сильные Слабые Кислоты HCl, HBr, HI, HNO 3, HCl. O 4, H 2 SO 4 H 2 S, HF, HCN, HNO 2, H 2 SO 3, H 3 PO 4, H 3 As. O 3, HCl. O, H 2 CO 3 и органические кислоты Основания KOH, Na. OH, Ca(OH)2, Ba(OH)2 Растворимые: NH 3, амины; нерастворимые: большинство гидроксидов металлов (Al(OH)3, Zn(OH)2, Mg(OH)2) Соли Na. Cl, Ca(NO 3)2 – почти все соли, в том числе и комплексные: [Cu(NH 3)4]SO 4 [Cu(NH 3)4]2+ + SO 42 - Hg. Cl 2; комплексные ионы, например: [Cu(NH 3)4]2+ Cu 2+ + 4 NH 3 Считают Слабые электролиты – электролиты, имеющие αд < 0, 3 (при С = 0, 1 моль/дм 3)
 Условия смещения ионных равновесий 1. Ионная реакция будет обратимой, если среди исходных и образующихся веществ есть малодиссоциирующие, малорастворимые или газообразные 2. Равновесие в обратимой реакции смещается в направлении наиболее полного связывания ионов (их наименьшей концентрации в растворе) Ba. Cl 2 + H 2 SO 4 Ba. SO 4↓ + 2 HCl Ba 2+ + SO 42– Ba. SO 4↓ Na 2 S + 2 HCl Na. Cl+H 2 S↑ S 2– + 2 H+ H 2 S↑ KCN + H 2 O HCN + KOH CN– + H 2 O HCN + OH– Zn. Cl 2 + 4 NH 3 [Zn(NH 3)4]Cl 2 Zn 2+ + 4 NH 3 [Zn(NH 3)4]2+ Zn. Cl 2+H 2 SO 4 = Zn. SO 4 + 2 HCl Реакция не идет.
Условия смещения ионных равновесий 1. Ионная реакция будет обратимой, если среди исходных и образующихся веществ есть малодиссоциирующие, малорастворимые или газообразные 2. Равновесие в обратимой реакции смещается в направлении наиболее полного связывания ионов (их наименьшей концентрации в растворе) Ba. Cl 2 + H 2 SO 4 Ba. SO 4↓ + 2 HCl Ba 2+ + SO 42– Ba. SO 4↓ Na 2 S + 2 HCl Na. Cl+H 2 S↑ S 2– + 2 H+ H 2 S↑ KCN + H 2 O HCN + KOH CN– + H 2 O HCN + OH– Zn. Cl 2 + 4 NH 3 [Zn(NH 3)4]Cl 2 Zn 2+ + 4 NH 3 [Zn(NH 3)4]2+ Zn. Cl 2+H 2 SO 4 = Zn. SO 4 + 2 HCl Реакция не идет.
 Равновесия в растворах слабых электролитов Равновесие между непродиссоциировшими молекулами и сольватированными ионами HCN + (n + m)H 2 O CN– ∙ n. H 2 O + H+ ∙ m. H 2 O HCN CN– + H+ Константы диссоциации слабых электролитов при 25 0 С табулированы При равновесии [H+] = [CN–] = Cα [HСN] = C-Cα = C(1 -α) Закон разбавления. В. Оствальд, 1888 г. α << 1, Кд ≈ Сα 2, Многоосновные кислоты и многокислотные основания диссоциируют ступенчато H 3 PO 4 H 2 PO 4– + H+, = 1, 1 ∙ 10– 2; H 2 PO 4– HPO 42– + H+ , = 2, 1 ∙ 10– 7; HPO 42– PO 43– + H+, = 3, 6 ∙ 10– 13 H+ + HZn. O 2– Zn(OH)2 [Zn. OH]1+ + OH–
Равновесия в растворах слабых электролитов Равновесие между непродиссоциировшими молекулами и сольватированными ионами HCN + (n + m)H 2 O CN– ∙ n. H 2 O + H+ ∙ m. H 2 O HCN CN– + H+ Константы диссоциации слабых электролитов при 25 0 С табулированы При равновесии [H+] = [CN–] = Cα [HСN] = C-Cα = C(1 -α) Закон разбавления. В. Оствальд, 1888 г. α << 1, Кд ≈ Сα 2, Многоосновные кислоты и многокислотные основания диссоциируют ступенчато H 3 PO 4 H 2 PO 4– + H+, = 1, 1 ∙ 10– 2; H 2 PO 4– HPO 42– + H+ , = 2, 1 ∙ 10– 7; HPO 42– PO 43– + H+, = 3, 6 ∙ 10– 13 H+ + HZn. O 2– Zn(OH)2 [Zn. OH]1+ + OH–
 Равновесия в растворах слабых электролитов Равновесие между непродиссоциировшими молекулами и сольватированными ионами HCN + (n + m)H 2 O CN– ∙ n. H 2 O + H+ ∙ m. H 2 O HCN CN– + H+ Константы диссоциации слабых электролитов при 25 0 С табулированы При равновесии [H+] = [CN–] = Cα [HСN] = C-Cα = C(1 -α) Закон разбавления. В. Оствальд, 1888 г. α << 1, Кд ≈ Сα 2, Многоосновные кислоты и многокислотные основания диссоциируют ступенчато H 3 PO 4 H 2 PO 4– + H+, = 1, 1 ∙ 10– 2; H 2 PO 4– HPO 42– + H+ , = 2, 1 ∙ 10– 7; HPO 42– PO 43– + H+, = 3, 6 ∙ 10– 13 H+ + HZn. O 2– Zn(OH)2 [Zn. OH]1+ + OH–
Равновесия в растворах слабых электролитов Равновесие между непродиссоциировшими молекулами и сольватированными ионами HCN + (n + m)H 2 O CN– ∙ n. H 2 O + H+ ∙ m. H 2 O HCN CN– + H+ Константы диссоциации слабых электролитов при 25 0 С табулированы При равновесии [H+] = [CN–] = Cα [HСN] = C-Cα = C(1 -α) Закон разбавления. В. Оствальд, 1888 г. α << 1, Кд ≈ Сα 2, Многоосновные кислоты и многокислотные основания диссоциируют ступенчато H 3 PO 4 H 2 PO 4– + H+, = 1, 1 ∙ 10– 2; H 2 PO 4– HPO 42– + H+ , = 2, 1 ∙ 10– 7; HPO 42– PO 43– + H+, = 3, 6 ∙ 10– 13 H+ + HZn. O 2– Zn(OH)2 [Zn. OH]1+ + OH–
 Диссоциация вода. Водородный показатель Протон не существует в растворе в свободном виде 8 H 2 O H 9 O 4+(H+ ∙ 4 H 2 O) + H 7 O 4– (OH– ∙ 3 H 2 O) Процесс диссоциации Н 2 О в упрощенном виде + + ОН– или 2 Н О Н О+ + ОН–, Δ Н ≈ 60 к. Дж. Н 2 О Н 2 3 r Степень диссоциации Н 2 О очень мала – 1, 7 ∙ 10– 9 при 25 0 С, а = С Кд=1, 8 ∙ 10– 16 Ионное произведение воды при 25 0 С Водородный показатель р. Н p. H + p. OH = 14 t = 25 0 С Чистая вода Нейтральный раствор Кислый раствор Щелочной раствор [H+] = [OH–] = 10– 7 p. H = 7 [H+]↑> 10– 7, [OH–]↓<10– 7 [H+]↓< 10– 7, [OH–]↑>10– 7 p. H < 7 p. H > 7 [H 2 O] = 55, 5 моль/дм 3
Диссоциация вода. Водородный показатель Протон не существует в растворе в свободном виде 8 H 2 O H 9 O 4+(H+ ∙ 4 H 2 O) + H 7 O 4– (OH– ∙ 3 H 2 O) Процесс диссоциации Н 2 О в упрощенном виде + + ОН– или 2 Н О Н О+ + ОН–, Δ Н ≈ 60 к. Дж. Н 2 О Н 2 3 r Степень диссоциации Н 2 О очень мала – 1, 7 ∙ 10– 9 при 25 0 С, а = С Кд=1, 8 ∙ 10– 16 Ионное произведение воды при 25 0 С Водородный показатель р. Н p. H + p. OH = 14 t = 25 0 С Чистая вода Нейтральный раствор Кислый раствор Щелочной раствор [H+] = [OH–] = 10– 7 p. H = 7 [H+]↑> 10– 7, [OH–]↓<10– 7 [H+]↓< 10– 7, [OH–]↑>10– 7 p. H < 7 p. H > 7 [H 2 O] = 55, 5 моль/дм 3


