Растворы.ppt
- Количество слайдов: 18
 растворы делятся на истинные - (однородные гомогенные системы с размером частиц на уровне 10 -10 – 10 -9 м) и коллоидные -(неоднородные гетерогенные системы с размером частиц 10 -9 — 10 -6 м). Истинным раствором называется термодинамически устойчивая гомогенная система переменного состава, состоящая из двух и более компонентов, между которыми существуют достаточно сильные взаимодействия.
растворы делятся на истинные - (однородные гомогенные системы с размером частиц на уровне 10 -10 – 10 -9 м) и коллоидные -(неоднородные гетерогенные системы с размером частиц 10 -9 — 10 -6 м). Истинным раствором называется термодинамически устойчивая гомогенная система переменного состава, состоящая из двух и более компонентов, между которыми существуют достаточно сильные взаимодействия.
 • Уникальные свойства воды – • -----высокая теплоемкость (75, 3 Дж/моль • К) и • -----большая теплота испарения (40, 8 к. Дж/моль) обеспечивают термостатирование нашего организма. • -----высокая диэлектрическая проницаемость воды (е = 78, 5) • способствует растворению и диссоциации на ионы, что обуславливает: • высокие скорости протекания биохимических реакций, • быструю миграцию ионов через биологические мембраны • практически мгновенную передачу нервных импульсов.
• Уникальные свойства воды – • -----высокая теплоемкость (75, 3 Дж/моль • К) и • -----большая теплота испарения (40, 8 к. Дж/моль) обеспечивают термостатирование нашего организма. • -----высокая диэлектрическая проницаемость воды (е = 78, 5) • способствует растворению и диссоциации на ионы, что обуславливает: • высокие скорости протекания биохимических реакций, • быструю миграцию ионов через биологические мембраны • практически мгновенную передачу нервных импульсов.
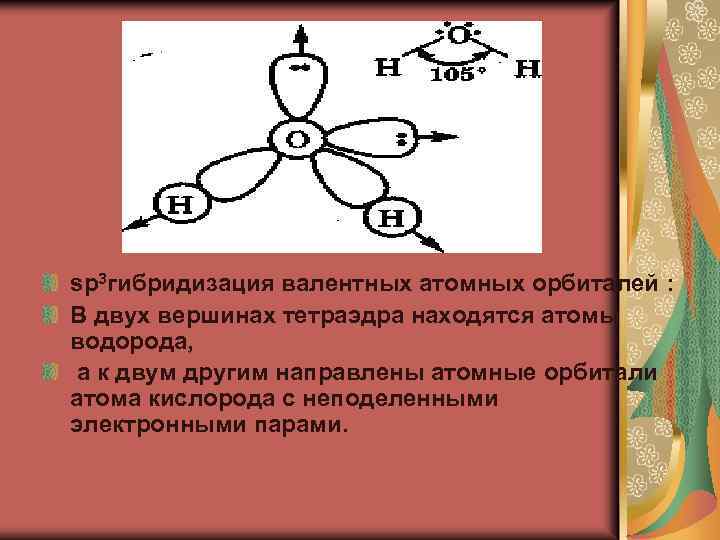 sp 3 гибридизация валентных атомных орбиталей : В двух вершинах тетраэдра находятся атомы водорода, а к двум другим направлены атомные орбитали атома кислорода с неподеленными электронными парами.
sp 3 гибридизация валентных атомных орбиталей : В двух вершинах тетраэдра находятся атомы водорода, а к двум другим направлены атомные орбитали атома кислорода с неподеленными электронными парами.
![• Наше тело [по массе] • на 70% состоит из воды; минимальная потеря • Наше тело [по массе] • на 70% состоит из воды; минимальная потеря](https://present5.com/presentation/20034858_30261080/image-4.jpg) • Наше тело [по массе] • на 70% состоит из воды; минимальная потеря воды за сутки 1700 мл, • причём 50% воды выделяется из организма почками, • 5% — кишечником, • 13% — лёгкими, остальная вода выделяется кожей.
• Наше тело [по массе] • на 70% состоит из воды; минимальная потеря воды за сутки 1700 мл, • причём 50% воды выделяется из организма почками, • 5% — кишечником, • 13% — лёгкими, остальная вода выделяется кожей.
 n n n За всю жизнь человек выпивает около 25 тонн воды; вода поступает с продуктами, часть воды образуется при обмене веществ как конечный продукт. При окислении 100 г жира образуется 107 мл, 100 г углеводов — 55 мл воды 100 г белка — 41 мл воды.
n n n За всю жизнь человек выпивает около 25 тонн воды; вода поступает с продуктами, часть воды образуется при обмене веществ как конечный продукт. При окислении 100 г жира образуется 107 мл, 100 г углеводов — 55 мл воды 100 г белка — 41 мл воды.
 Роль воды – • 1. составная часть всех клеток и тканей организма. • 2. средой, в которой протекают все химические превращения. • 3. Вода — источник минеральных солей, поступающих в организм. • 4. Транспортировка элементов питания и продуктов обмена происходит по водным магистралям. • 5. Вода — не только индифферентный растворитель, но и активный участник многих реакций обмена [например, реакций гидролиза]. • 6. Механическая роль — вода облегчает скольжение трущихся поверхностей [суставов, связок, мышц и т. д. ]. • 7. Испарение воды кожей — мощный фактор терморегуляции организма. • 8. С водой связаны осмотические явления. • 9. Только в водной среде сохраняется коллоидное состояние протоплазмы.
Роль воды – • 1. составная часть всех клеток и тканей организма. • 2. средой, в которой протекают все химические превращения. • 3. Вода — источник минеральных солей, поступающих в организм. • 4. Транспортировка элементов питания и продуктов обмена происходит по водным магистралям. • 5. Вода — не только индифферентный растворитель, но и активный участник многих реакций обмена [например, реакций гидролиза]. • 6. Механическая роль — вода облегчает скольжение трущихся поверхностей [суставов, связок, мышц и т. д. ]. • 7. Испарение воды кожей — мощный фактор терморегуляции организма. • 8. С водой связаны осмотические явления. • 9. Только в водной среде сохраняется коллоидное состояние протоплазмы.
![o В организме различают две формы воды: внутриклеточную и внеклеточную. Общая вода [70%] Внутриклеточная o В организме различают две формы воды: внутриклеточную и внеклеточную. Общая вода [70%] Внутриклеточная](https://present5.com/presentation/20034858_30261080/image-7.jpg) o В организме различают две формы воды: внутриклеточную и внеклеточную. Общая вода [70%] Внутриклеточная [50%] Интерстициальная [15%] o o Внеклеточная [20%] Внутрисосудистая [5%] Внутриклеточная вода —связанную воду протоплазмы, воду притяжения на поверхности коллоидных мицелл и воду капиллярности (в ней растворены электролиты) Внутриклеточная вода связана с К+ и РО 43 -, а для внеклеточная –Na+ , Cl-, HCO 3 Интерстициальная жидкость окружает непосредственно клетки. Внутрисосудистая жидкость — плазма крови, ликвор, лимфа (содержит белок)
o В организме различают две формы воды: внутриклеточную и внеклеточную. Общая вода [70%] Внутриклеточная [50%] Интерстициальная [15%] o o Внеклеточная [20%] Внутрисосудистая [5%] Внутриклеточная вода —связанную воду протоплазмы, воду притяжения на поверхности коллоидных мицелл и воду капиллярности (в ней растворены электролиты) Внутриклеточная вода связана с К+ и РО 43 -, а для внеклеточная –Na+ , Cl-, HCO 3 Интерстициальная жидкость окружает непосредственно клетки. Внутрисосудистая жидкость — плазма крови, ликвор, лимфа (содержит белок)
 o Обмен воды в организме тесно связан с солевым o o o o обменом. Соли: 1. Входят в состав структурных элементов клеток и тканей. 2. Активируют ряд ферментных систем. 3. Поддерживают осмотическое давление. 4. Играют роль в образовании буферных систем организма. 5. Участвуют в процессе свёртывания крови. 6. Участвуют в передаче нервного возбуждения. 7. Участвуют в поддержании структуры органоидов клетки и т. д.
o Обмен воды в организме тесно связан с солевым o o o o обменом. Соли: 1. Входят в состав структурных элементов клеток и тканей. 2. Активируют ряд ферментных систем. 3. Поддерживают осмотическое давление. 4. Играют роль в образовании буферных систем организма. 5. Участвуют в процессе свёртывания крови. 6. Участвуют в передаче нервного возбуждения. 7. Участвуют в поддержании структуры органоидов клетки и т. д.
 В зависимости от сродства к воде функциональные группы подразделяют на гидрофильные и гидрофобные К гидрофильным относятся ионы и полярные группы: гидроксильная —ОН, амино —NH 2, карбоксильная —СООН, нитро —NO 2, К гидрофобным относятся неполярные группы: углеводородные радикалы предельных (—Cn. H 2 n+2)> непредельных (— Cn. H 2 n) и ароматических (—С 6 Н 5) соединений. Дифильные молекулы принято изображать в виде "головастика" О—— • , у которого головка соответствует полярному, а хвост — гидрофобному фрагменту молекулы. По наличию или отсутствию электролитической диссоциации растворы разделяются на: Электролиты, Неэлектролиты (сахароза, глюкоза, мочевина Амфолиты- диссоцирующие на ионы и по
В зависимости от сродства к воде функциональные группы подразделяют на гидрофильные и гидрофобные К гидрофильным относятся ионы и полярные группы: гидроксильная —ОН, амино —NH 2, карбоксильная —СООН, нитро —NO 2, К гидрофобным относятся неполярные группы: углеводородные радикалы предельных (—Cn. H 2 n+2)> непредельных (— Cn. H 2 n) и ароматических (—С 6 Н 5) соединений. Дифильные молекулы принято изображать в виде "головастика" О—— • , у которого головка соответствует полярному, а хвост — гидрофобному фрагменту молекулы. По наличию или отсутствию электролитической диссоциации растворы разделяются на: Электролиты, Неэлектролиты (сахароза, глюкоза, мочевина Амфолиты- диссоцирующие на ионы и по
 o Процесс растворения – сложный , наблюдаются физические явления (например, диффузия) и химические(образованием связей между растворяемым в-ом и растворителем, процесс этот называется сольватацией (гидратацией). o Доказательством хим. взаимодействия явл-ся o тепловые эффекты ( КОН –выделяется, Na. Cl поглощается) o изменение цвета -( Cu. SO 4 -с белого на голубой).
o Процесс растворения – сложный , наблюдаются физические явления (например, диффузия) и химические(образованием связей между растворяемым в-ом и растворителем, процесс этот называется сольватацией (гидратацией). o Доказательством хим. взаимодействия явл-ся o тепловые эффекты ( КОН –выделяется, Na. Cl поглощается) o изменение цвета -( Cu. SO 4 -с белого на голубой).
 o Свойства растворов: o 1. гомогенность- нет границ раздела фаз o 2. Переменность состава o 3. Термический эффект растворения o Q р-ра = Qкристал. +Q гидратации o Qкристал тратится на разрушение структуры вещества o Q гидратации выделяется за счет сольватации
o Свойства растворов: o 1. гомогенность- нет границ раздела фаз o 2. Переменность состава o 3. Термический эффект растворения o Q р-ра = Qкристал. +Q гидратации o Qкристал тратится на разрушение структуры вещества o Q гидратации выделяется за счет сольватации
 Растворимость газов: Х(г) ↔Хр +Q, закон Генри (1803 г. ) количество газа, растворенного в определенном объеме жидкости, пряморпопорционально давлению газа С(Х)= Кг(Х)Р(Х), Закон Генри справедлив лишь для разбавленных растворов при невысоких давлениях при условии отсутствия взаимодействия между растворителем и раствором з-н Дальтона Растворимость каждого из компонентов газовой смеси при постоянной температуре пропорциональна парциальному давлению компонента над жидкостью и не зависит от от общего давления смеси и других компонентов Рi=Робщ Х(Хi), где Х(Хi)- МОЛЬНАЯ ДОЛЯ I – компонента
Растворимость газов: Х(г) ↔Хр +Q, закон Генри (1803 г. ) количество газа, растворенного в определенном объеме жидкости, пряморпопорционально давлению газа С(Х)= Кг(Х)Р(Х), Закон Генри справедлив лишь для разбавленных растворов при невысоких давлениях при условии отсутствия взаимодействия между растворителем и раствором з-н Дальтона Растворимость каждого из компонентов газовой смеси при постоянной температуре пропорциональна парциальному давлению компонента над жидкостью и не зависит от от общего давления смеси и других компонентов Рi=Робщ Х(Хi), где Х(Хi)- МОЛЬНАЯ ДОЛЯ I – компонента
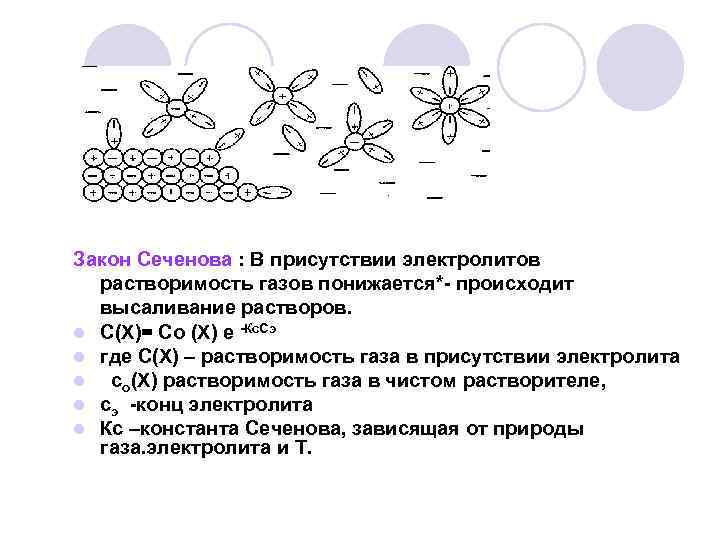 Закон Сеченова : В присутствии электролитов растворимость газов понижается*- происходит высаливание растворов. l С(Х)= Со (Х) е -Кс. Сэ l где С(Х) – растворимость газа в присутствии электролита l со(Х) растворимость газа в чистом растворителе, l сэ -конц электролита l Кс –константа Сеченова, зависящая от природы газа. электролита и Т.
Закон Сеченова : В присутствии электролитов растворимость газов понижается*- происходит высаливание растворов. l С(Х)= Со (Х) е -Кс. Сэ l где С(Х) – растворимость газа в присутствии электролита l со(Х) растворимость газа в чистом растворителе, l сэ -конц электролита l Кс –константа Сеченова, зависящая от природы газа. электролита и Т.
 Применение законов Генри и Дальтона Кессоннная болезнь- газы, закупоривают мелкие сосуды. Для лечения барокамеры – при повышенном давлении увеличивается концентрация кислорода в крови –залечивание гангрен , сосудистая реабилитация после инсультов.
Применение законов Генри и Дальтона Кессоннная болезнь- газы, закупоривают мелкие сосуды. Для лечения барокамеры – при повышенном давлении увеличивается концентрация кислорода в крови –залечивание гангрен , сосудистая реабилитация после инсультов.
 Растворимость жидкости в жидкости Ø Ø Ø Неограниченная –(C 2 H 5 OH в H 2 O Ограниченная –(фенол в H 2 O) Полная нерастворимость (бензол в H 2 O) Растворимость зависит: - от природы в-ва и р-ля (полярные в полярных…. ) -от температуры: Ø Ø Ø T
Растворимость жидкости в жидкости Ø Ø Ø Неограниченная –(C 2 H 5 OH в H 2 O Ограниченная –(фенол в H 2 O) Полная нерастворимость (бензол в H 2 O) Растворимость зависит: - от природы в-ва и р-ля (полярные в полярных…. ) -от температуры: Ø Ø Ø T
 Раст-ть твердых в-в в жидкости u Коэффициент растворимостимасса вещества, которая насыщает 1000 г растворителя u Факторы, влияющие на растворимость: u Природа вещества и р-ля u Температура повышает эндотерм. процесс и понижает экзотерм.
Раст-ть твердых в-в в жидкости u Коэффициент растворимостимасса вещества, которая насыщает 1000 г растворителя u Факторы, влияющие на растворимость: u Природа вещества и р-ля u Температура повышает эндотерм. процесс и понижает экзотерм.
 Закон Нернста –Шилова: Коэффициент распределения в-ва в 2 -х несмешивающихся жидкостях есть величина постоянная при данной температуре u С I 2 в CCl 4/ С I 2 в H 2 O= К распред. =85 u Экстракция в-ва – это извлечение 1 из компонентов р-ра с помощью растворителя, который несмешивается с р-ром u
Закон Нернста –Шилова: Коэффициент распределения в-ва в 2 -х несмешивающихся жидкостях есть величина постоянная при данной температуре u С I 2 в CCl 4/ С I 2 в H 2 O= К распред. =85 u Экстракция в-ва – это извлечение 1 из компонентов р-ра с помощью растворителя, который несмешивается с р-ром u
 u u u . Равновесие между раствором и осадком малорастворимого сильного электролита. Са 3(РО 4)2 ↓↔ 3 Са 2+ + 2 PO 4 3 -. Применяя закон действующих масс для данного равновесного состояния, выразим константу растворимости КS (произведение растворимости (ПР)): ПР = [Са 2+ ] 3[PO 4 3 - ]2 / [Са 3(РО 4)2 ] = const, и ПР(Са 3(РО 4)2)= [Са 2+ ] 3[PO 4 3 - ]2. Чем меньше ПР, тем ниже растворимость электролита. Условия образования осадка: стехиометрическое произведение концентраций ионов сильного электролита должно быть больше ПР: [Са 2+ ] 3[PO 4 3 - ]2 > ПР. Условия растворения осадка: осадок малорастворимого сильного электролита растворится, когда стехиометрическое произведение концентраций ионов сильного электролита меньше ПР: [Са 2+ ] 3[PO 4 3 - ]2 < ПР. Последовательность осаждения ионов: если к раствору, содержащему смесь ионов, осаждаемых одним и тем же реагентом, добавить этот реагент, то образование осадков идет поочередно, начиная с электролита, имеющего наименьшее ПР.
u u u . Равновесие между раствором и осадком малорастворимого сильного электролита. Са 3(РО 4)2 ↓↔ 3 Са 2+ + 2 PO 4 3 -. Применяя закон действующих масс для данного равновесного состояния, выразим константу растворимости КS (произведение растворимости (ПР)): ПР = [Са 2+ ] 3[PO 4 3 - ]2 / [Са 3(РО 4)2 ] = const, и ПР(Са 3(РО 4)2)= [Са 2+ ] 3[PO 4 3 - ]2. Чем меньше ПР, тем ниже растворимость электролита. Условия образования осадка: стехиометрическое произведение концентраций ионов сильного электролита должно быть больше ПР: [Са 2+ ] 3[PO 4 3 - ]2 > ПР. Условия растворения осадка: осадок малорастворимого сильного электролита растворится, когда стехиометрическое произведение концентраций ионов сильного электролита меньше ПР: [Са 2+ ] 3[PO 4 3 - ]2 < ПР. Последовательность осаждения ионов: если к раствору, содержащему смесь ионов, осаждаемых одним и тем же реагентом, добавить этот реагент, то образование осадков идет поочередно, начиная с электролита, имеющего наименьшее ПР.


