Растворители и эффекты среды в химии.ppt
- Количество слайдов: 31
 Растворители и эффекты среды в химии.
Растворители и эффекты среды в химии.
 Краткая история вопроса § 1. Греческие философы, алхимики, Парацельс (1493 – 1541): Поиск универсального растворителя – “menstrum universale”; § 2. Гельмонт (1577 – 1644): «…. удалось получить алкагест, который храниться в сосуде» ; § 3. Бертло (1862 г. ) впервые отмечено влияние растворителя на скорость этерификации уксусной кислоты; § 4. Меншуткин Н. А. 1890 г. «Реакцию нельзя отделять от среды, в которой она протекает…»
Краткая история вопроса § 1. Греческие философы, алхимики, Парацельс (1493 – 1541): Поиск универсального растворителя – “menstrum universale”; § 2. Гельмонт (1577 – 1644): «…. удалось получить алкагест, который храниться в сосуде» ; § 3. Бертло (1862 г. ) впервые отмечено влияние растворителя на скорость этерификации уксусной кислоты; § 4. Меншуткин Н. А. 1890 г. «Реакцию нельзя отделять от среды, в которой она протекает…»
 Литература: 1. Э. Амис, Влияние растворителя на скорость и 2. 3. 4. 5. 6. 7. механизм х. реакций, 1968 г. С. Энтелис, Р. Тигер, Кинетика реакций в жидкой фазе, Наука, 1973. Смирнова Н. Н. Теории растворов. Наука, 1980. В. П. Белоусов, М. Ю. Панов, Термодинамика водных растворов неэлектролитов, Химия, 1983. Р. Шмидт, В. Н. Сапунов, Неформальная кинетика, Мир, 1985 г. Фиалков Ю. Я. Растворитель как средство управления хим. Процессом, Химия, 1990 г. Кристиан Райхардт: Растворители и эффекты среды в органической химии, Мир, 1992, 764 с.
Литература: 1. Э. Амис, Влияние растворителя на скорость и 2. 3. 4. 5. 6. 7. механизм х. реакций, 1968 г. С. Энтелис, Р. Тигер, Кинетика реакций в жидкой фазе, Наука, 1973. Смирнова Н. Н. Теории растворов. Наука, 1980. В. П. Белоусов, М. Ю. Панов, Термодинамика водных растворов неэлектролитов, Химия, 1983. Р. Шмидт, В. Н. Сапунов, Неформальная кинетика, Мир, 1985 г. Фиалков Ю. Я. Растворитель как средство управления хим. Процессом, Химия, 1990 г. Кристиан Райхардт: Растворители и эффекты среды в органической химии, Мир, 1992, 764 с.
 Основные понятия § Раствор – гомогенная жидкая фаза из нескольких веществ, где растворитель присутствует в большем количестве и не вступает в хим. Взаимодействие. § Раствор – дискретная фаза с локальной упорядоченной структурой, в которой вещества не распределены равномерно.
Основные понятия § Раствор – гомогенная жидкая фаза из нескольких веществ, где растворитель присутствует в большем количестве и не вступает в хим. Взаимодействие. § Раствор – дискретная фаза с локальной упорядоченной структурой, в которой вещества не распределены равномерно.
 Структура жидкой воды
Структура жидкой воды
 Взаимодействия между веществом и растворителем 1. 1955 г. Ziegler K. Господство идеи об инертности среды. Правило разбавления. Конкурентность поликонденсации и циклизации: § Wpc = k[Mo]2; Wcycl = k. Mo
Взаимодействия между веществом и растворителем 1. 1955 г. Ziegler K. Господство идеи об инертности среды. Правило разбавления. Конкурентность поликонденсации и циклизации: § Wpc = k[Mo]2; Wcycl = k. Mo
 § 2. Представления о взаимодействии вещества с § § § § растворителем привели к правилу: «Подобное растворяется в подобном» Правило справедливо на 50%: Me. OH+С 6 Н 6 растворимость Вода+ДМФА растворимость Полистирол + CHCl 3 растворимость ПВС в этаноле не растворим (н. р. ) Полиакрилонитрил в акрилонитриле н. р. Ацетилцеллюлоза в этилацетате – н. р. Вода в Et 2 O 15 мг/л; Et 2 O в воде – 60 мг/л;
§ 2. Представления о взаимодействии вещества с § § § § растворителем привели к правилу: «Подобное растворяется в подобном» Правило справедливо на 50%: Me. OH+С 6 Н 6 растворимость Вода+ДМФА растворимость Полистирол + CHCl 3 растворимость ПВС в этаноле не растворим (н. р. ) Полиакрилонитрил в акрилонитриле н. р. Ацетилцеллюлоза в этилацетате – н. р. Вода в Et 2 O 15 мг/л; Et 2 O в воде – 60 мг/л;
 § Растворение (сольватация образование вокруг каждой нахо дящейся в растворе молекулы или иона оболочки из более или менее прочно связанных молекул растворителя.
§ Растворение (сольватация образование вокруг каждой нахо дящейся в растворе молекулы или иона оболочки из более или менее прочно связанных молекул растворителя.
 § Движущие силы процесса растворения (сольватации) § В общем случае для растворения молекулы вещества в растворителе необходимо: § 1. образование полости для размещения молекулы § 2. ориентация молекулы § 3. взаимодействие на больших расстояниях (неспецифические взаим я) § 4. взаимодействие на близких расстояниях (специфическое)
§ Движущие силы процесса растворения (сольватации) § В общем случае для растворения молекулы вещества в растворителе необходимо: § 1. образование полости для размещения молекулы § 2. ориентация молекулы § 3. взаимодействие на больших расстояниях (неспецифические взаим я) § 4. взаимодействие на близких расстояниях (специфическое)
 § Таким образом, растворение вещества требует преодоление сил сцепления между: § 1. молекулами вещества § 2. молекулами растворителя § 3. размещение молекулы в полостях (пустотах) § Образование взаимодействия растворитель вещество должно компенсировать энергию на преодоление сил сцепления.
§ Таким образом, растворение вещества требует преодоление сил сцепления между: § 1. молекулами вещества § 2. молекулами растворителя § 3. размещение молекулы в полостях (пустотах) § Образование взаимодействия растворитель вещество должно компенсировать энергию на преодоление сил сцепления.
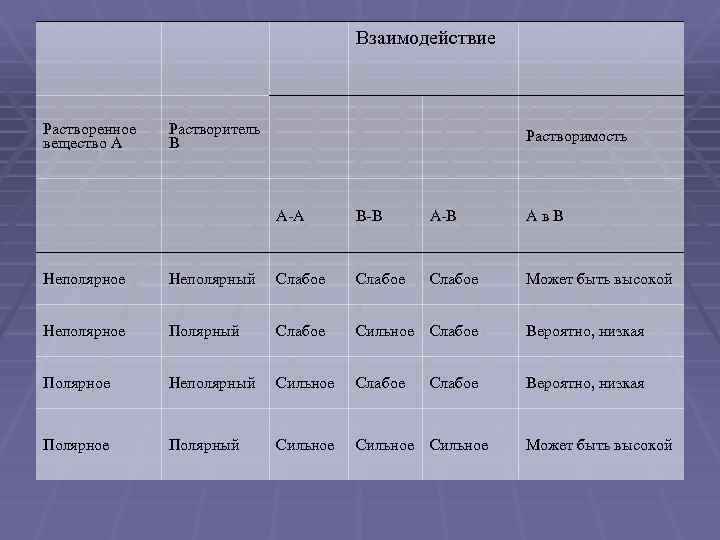 Взаимодействие Растворенное вещество А Растворитель В Растворимость А А В В Ав. В Слабое Может быть высокой Неполярное Неполярный Слабое Неполярное Полярный Слабое Сильное Слабое Вероятно, низкая Полярное Неполярный Сильное Слабое Вероятно, низкая Полярное Полярный Сильное Слабое Может быть высокой
Взаимодействие Растворенное вещество А Растворитель В Растворимость А А В В Ав. В Слабое Может быть высокой Неполярное Неполярный Слабое Неполярное Полярный Слабое Сильное Слабое Вероятно, низкая Полярное Неполярный Сильное Слабое Вероятно, низкая Полярное Полярный Сильное Слабое Может быть высокой
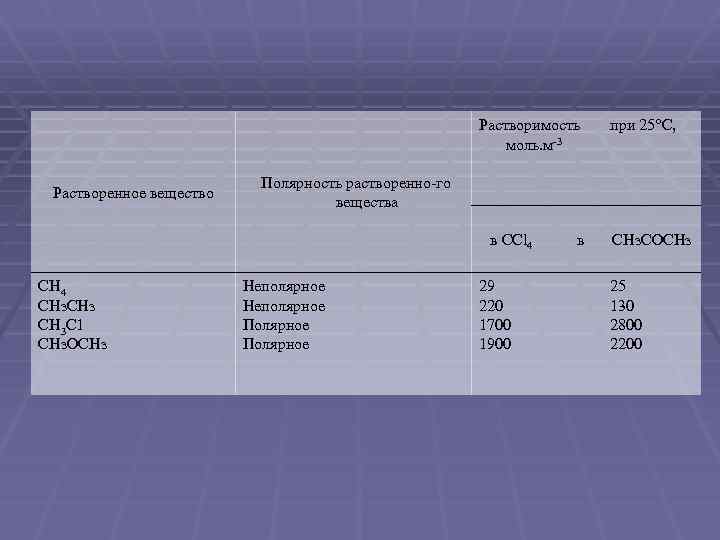 Растворимость моль. м 3 Растворенное вещество Полярность растворенно го вещества в CCl 4 CH 4 СНз СН 3 С 1 СНз. ОСНз при 25°С, Неполярное Полярное 29 220 1700 1900 в СНз. СОСНз 25 130 2800 2200
Растворимость моль. м 3 Растворенное вещество Полярность растворенно го вещества в CCl 4 CH 4 СНз СН 3 С 1 СНз. ОСНз при 25°С, Неполярное Полярное 29 220 1700 1900 в СНз. СОСНз 25 130 2800 2200
 Параметр Гильдебранда Характеризует работу затраченную на отделение молекул друг от друга (т. е. на нарушение всех видов взаимодействия)
Параметр Гильдебранда Характеризует работу затраченную на отделение молекул друг от друга (т. е. на нарушение всех видов взаимодействия)
 Растворитель М П 1/ Растворитель 2 МП 1 /2 а Вода 47, Уксусная 9 кислота 20, 7 Формамид 39, 1, 4 Диоксан 3 20, 5 N Метилформам ид 32, Дисульфид 9 углерода 20, 4 Этандиол 1, 2 29, Циклогексано 9 н 20, 3 Метанол 29, Ацетон 6 20, 2 Тетр агидротиофенд иоксид 1, 1 27, 1, 2 4 Дихлорэтан 20, 0 Этанол 26, Хлорбензол 0 19, 4 N. N Диметилформа мид 24, Хлороформ 8 19, 0
Растворитель М П 1/ Растворитель 2 МП 1 /2 а Вода 47, Уксусная 9 кислота 20, 7 Формамид 39, 1, 4 Диоксан 3 20, 5 N Метилформам ид 32, Дисульфид 9 углерода 20, 4 Этандиол 1, 2 29, Циклогексано 9 н 20, 3 Метанол 29, Ацетон 6 20, 2 Тетр агидротиофенд иоксид 1, 1 27, 1, 2 4 Дихлорэтан 20, 0 Этанол 26, Хлорбензол 0 19, 4 N. N Диметилформа мид 24, Хлороформ 8 19, 0
 Типы межмолекулярных взаимодействий 1. Неспецифические взаимодействия: а) ориентационные б) индукционные в) дисперсионные 2. Специфические взаимодействия: а) водородные связи б) комплексы с переносом заряда в) донорно акцепторные взаимодействия
Типы межмолекулярных взаимодействий 1. Неспецифические взаимодействия: а) ориентационные б) индукционные в) дисперсионные 2. Специфические взаимодействия: а) водородные связи б) комплексы с переносом заряда в) донорно акцепторные взаимодействия
 Неспецифические взаимодействия Тип ММВЗ Характеристика Энергия Примечание 1. Ион дипольное Большая роль в сольватации ионов. 2. Диполь дипольное Важен учет в БАР: ДМСО, ДМФА и т. п. 3. Диполь (ион) индуц. Диполь 4. Мгновенный диполь – индуц. диполь Характерны для любых молекул
Неспецифические взаимодействия Тип ММВЗ Характеристика Энергия Примечание 1. Ион дипольное Большая роль в сольватации ионов. 2. Диполь дипольное Важен учет в БАР: ДМСО, ДМФА и т. п. 3. Диполь (ион) индуц. Диполь 4. Мгновенный диполь – индуц. диполь Характерны для любых молекул
 Специфические взаимодействия § 1. Водородная связь R X H + : Y R = R X H…: Y R X и Y: C, N, P, O, S, Hal, система § Примеры наиболее важных типов групп: OH, SH, NH, C(O)OH, C(O)NH
Специфические взаимодействия § 1. Водородная связь R X H + : Y R = R X H…: Y R X и Y: C, N, P, O, S, Hal, система § Примеры наиболее важных типов групп: OH, SH, NH, C(O)OH, C(O)NH
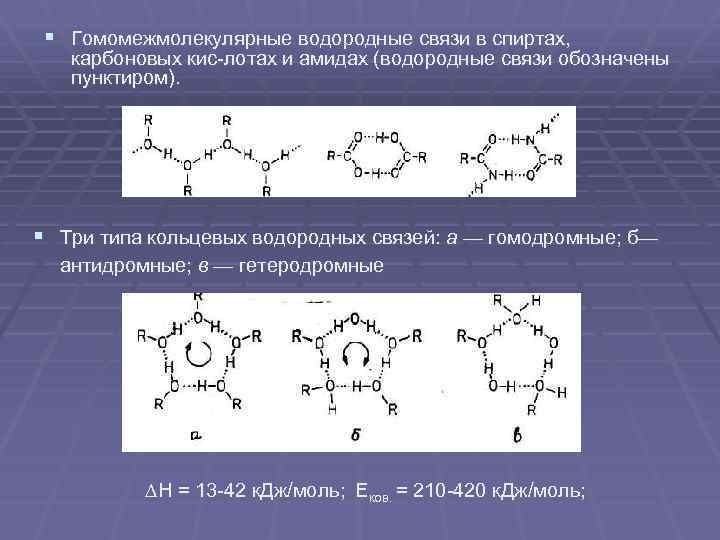 § Гомомежмолекулярные водородные связи в спиртах, карбоновых кис лотах и амидах (водородные связи обозначены пунктиром). § Три типа кольцевых водородных связей: а — гомодромные; б— антидромные; в — гетеродромные H = 13 42 к. Дж/моль; Еков. = 210 420 к. Дж/моль;
§ Гомомежмолекулярные водородные связи в спиртах, карбоновых кис лотах и амидах (водородные связи обозначены пунктиром). § Три типа кольцевых водородных связей: а — гомодромные; б— антидромные; в — гетеродромные H = 13 42 к. Дж/моль; Еков. = 210 420 к. Дж/моль;
 Донорно акцепторные взаимодействия § ДЭП/АЭП § Необходимым условием взаимодействия является наличие в молекуле ДЭП занятой МО с высокой энергией и вакантной МО АЭП с низкой энергией. § 9 видов взаимодействия: n § D+A = [D…A D+…A ] § Перенос электрона тем легче, чем < потенциал ионизации D и чем > сродство к электрону A. § Прочные комплексы Н = 42 188 к. Дж/моль
Донорно акцепторные взаимодействия § ДЭП/АЭП § Необходимым условием взаимодействия является наличие в молекуле ДЭП занятой МО с высокой энергией и вакантной МО АЭП с низкой энергией. § 9 видов взаимодействия: n § D+A = [D…A D+…A ] § Перенос электрона тем легче, чем < потенциал ионизации D и чем > сродство к электрону A. § Прочные комплексы Н = 42 188 к. Дж/моль
 Физические процессы в растворе § 1. Сольвофобное взаимодействие § 2. Сольватация § 3. Солюбилизация (мицелярная сольватация) § 4. Ионизация § 5. Диссоциация
Физические процессы в растворе § 1. Сольвофобное взаимодействие § 2. Сольватация § 3. Солюбилизация (мицелярная сольватация) § 4. Ионизация § 5. Диссоциация
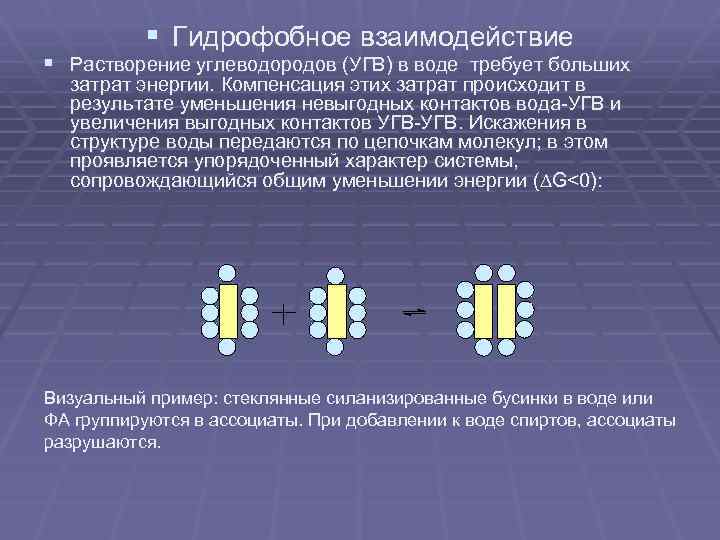 § Гидрофобное взаимодействие § Растворение углеводородов (УГВ) в воде требует больших затрат энергии. Компенсация этих затрат происходит в результате уменьшения невыгодных контактов вода УГВ и увеличения выгодных контактов УГВ. Искажения в структуре воды передаются по цепочкам молекул; в этом проявляется упорядоченный характер системы, сопровождающийся общим уменьшении энергии ( G<0): Визуальный пример: стеклянные силанизированные бусинки в воде или ФА группируются в ассоциаты. При добавлении к воде спиртов, ассоциаты разрушаются.
§ Гидрофобное взаимодействие § Растворение углеводородов (УГВ) в воде требует больших затрат энергии. Компенсация этих затрат происходит в результате уменьшения невыгодных контактов вода УГВ и увеличения выгодных контактов УГВ. Искажения в структуре воды передаются по цепочкам молекул; в этом проявляется упорядоченный характер системы, сопровождающийся общим уменьшении энергии ( G<0): Визуальный пример: стеклянные силанизированные бусинки в воде или ФА группируются в ассоциаты. При добавлении к воде спиртов, ассоциаты разрушаются.
 Гидрофобное взаимодействие § Определяет: § 1. способность к мицеллообразованию, § § § солюбилизации; 2. изменения конформации молекул в водных растворах (например, белковых молекул); 3. специф. взаимодействие ферментов с субстратами; 4. самосборку надмолекулярных структур; 5. работу биомембран; 6. свойства суспензий, латексов, флотационных сред.
Гидрофобное взаимодействие § Определяет: § 1. способность к мицеллообразованию, § § § солюбилизации; 2. изменения конформации молекул в водных растворах (например, белковых молекул); 3. специф. взаимодействие ферментов с субстратами; 4. самосборку надмолекулярных структур; 5. работу биомембран; 6. свойства суспензий, латексов, флотационных сред.
 Сольватация § Gсольв. = Gрастворения Gреш § § Если Gсольв. > Gреш экзотермичный процесс § Если Gсольв. < Gреш эндотермичный процесс
Сольватация § Gсольв. = Gрастворения Gреш § § Если Gсольв. > Gреш экзотермичный процесс § Если Gсольв. < Gреш эндотермичный процесс
 Gсольв. § – изменение энергии Гиббса при переходе § § молекулы (иона) из газовой фазы в растворитель. Gсольв. обусловлена: 1. затратами на образование пустот; 2. затратами на переориентацию молекул растворителя; 3. затратами на изотропное (неспецифическое) взаимодействие 4. затратами на анизотропное (специфическое) взаимодействие
Gсольв. § – изменение энергии Гиббса при переходе § § молекулы (иона) из газовой фазы в растворитель. Gсольв. обусловлена: 1. затратами на образование пустот; 2. затратами на переориентацию молекул растворителя; 3. затратами на изотропное (неспецифическое) взаимодействие 4. затратами на анизотропное (специфическое) взаимодействие
 Стехиометрия сольватных комплексов: § Описывается координационным числом (число молекул растворителя в первой координационной сфере, 4 9, чаще 6). § Различают вторичную координационную менее упорядоченную сферу. § Время жизни сольватной оболочки: § 10 10 11 с
Стехиометрия сольватных комплексов: § Описывается координационным числом (число молекул растворителя в первой координационной сфере, 4 9, чаще 6). § Различают вторичную координационную менее упорядоченную сферу. § Время жизни сольватной оболочки: § 10 10 11 с
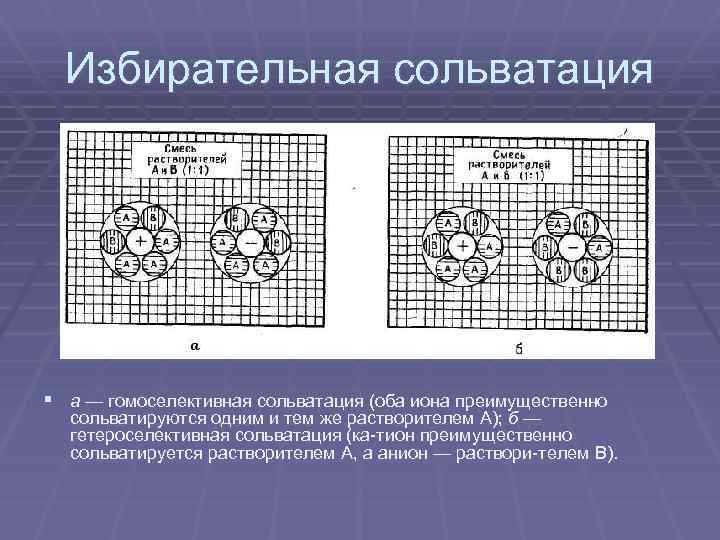 Избирательная сольватация § а — гомоселективная сольватация (оба иона преимущественно сольватируются одним и тем же растворителем А); б — гетероселективная сольватация (ка тион преимущественно сольватируется растворителем А, а анион — раствори телем В).
Избирательная сольватация § а — гомоселективная сольватация (оба иона преимущественно сольватируются одним и тем же растворителем А); б — гетероселективная сольватация (ка тион преимущественно сольватируется растворителем А, а анион — раствори телем В).
 Солюбилизация § явление образования устойчивого изотропного раствора малорастворимого вещества (солюбилизата) при добавлении ПАВ
Солюбилизация § явление образования устойчивого изотропного раствора малорастворимого вещества (солюбилизата) при добавлении ПАВ
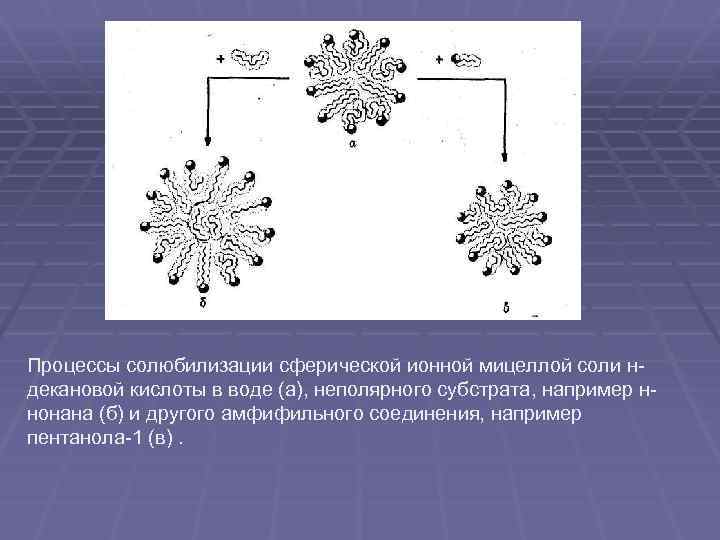 Процессы солюбилизации сферической ионной мицеллой соли н декановой кислоты в воде (а), неполярного субстрата, например н нонана (б) и другого амфифильного соединения, например пентанола 1 (в).
Процессы солюбилизации сферической ионной мицеллой соли н декановой кислоты в воде (а), неполярного субстрата, например н нонана (б) и другого амфифильного соединения, например пентанола 1 (в).
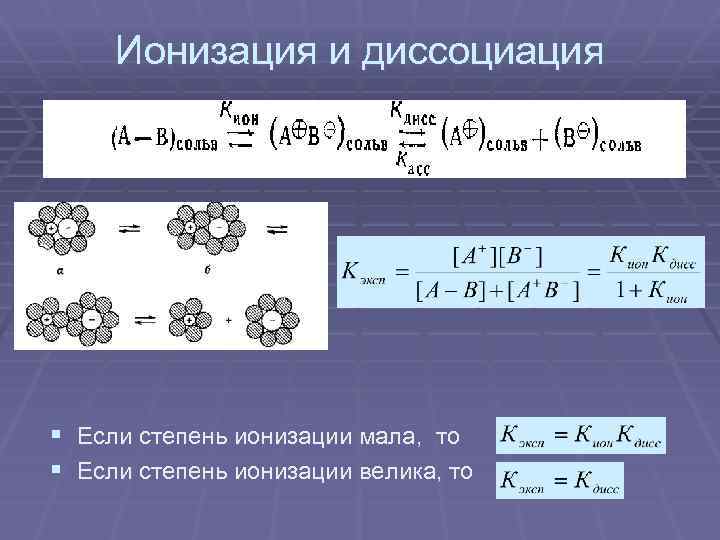 Ионизация и диссоциация § Если степень ионизации мала, то § Если степень ионизации велика, то
Ионизация и диссоциация § Если степень ионизации мала, то § Если степень ионизации велика, то
 Действие растворителя 1. Диссоциация Растворители с высокой диэлектрической проницаемостью являются диссоциирующими, так как: При < 15 ионы в растворе практически отсутствуют При > 40 в растворе нет ассоциированных ионов!
Действие растворителя 1. Диссоциация Растворители с высокой диэлектрической проницаемостью являются диссоциирующими, так как: При < 15 ионы в растворе практически отсутствуют При > 40 в растворе нет ассоциированных ионов!
 § 2. Ионизация связи обусловлена не столько величиной , сколько донорно акцепторным взаимодействием. Если растворитель АЭП/ДЭП имеет еще и высокую , то равновесие еще больше смещено вправо. Поэтому хороший ионизирующий растворитель должен иметь и высокую .
§ 2. Ионизация связи обусловлена не столько величиной , сколько донорно акцепторным взаимодействием. Если растворитель АЭП/ДЭП имеет еще и высокую , то равновесие еще больше смещено вправо. Поэтому хороший ионизирующий растворитель должен иметь и высокую .


