Презинтация Белки Л.1.ppt
- Количество слайдов: 27


Рассматриваются вопросы: 1. Биологическая роль белков. 2. Строение аминокислот. 3. Строение молекулы белка. 4. Классификация белков. 5. Физико-химические свойства белков. 5. 1. Молекулярная масса белков. 5. 2. Амфотерность белков. 5. 3. Растворимость белков. 5. 4. Высаливание белков. 5. 6. Денатурация белков

Вопросы для разминки. n 1. Что такое белки? n n n 2. Из каких веществ образуются белки? 3. Сколько аминокислот строят природные белки? 4. Почему белки относят к высокомолекулярным соединениям? 5. Какое значение имеют белки в природе? 6. Где встречаются белки в живых организмах?

Состав Строение молекул Физические свойства Белки Химические свойства Биологические функции
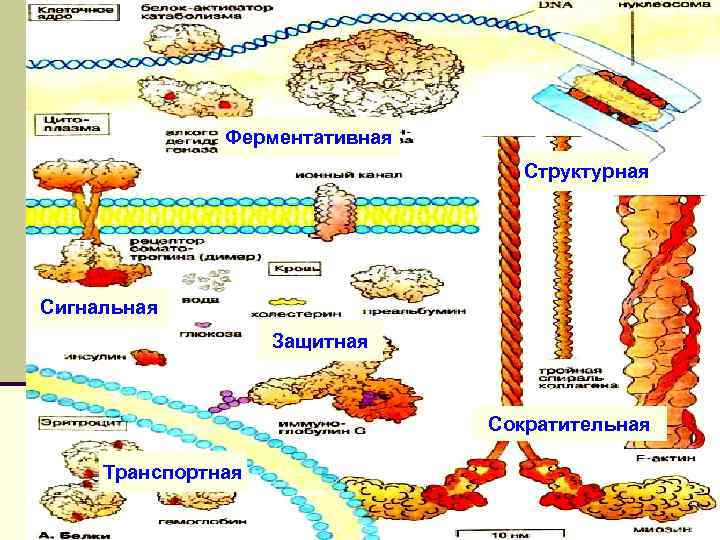
Ферментативная Структурная Биологическое значение белков Сигнальная Защитная Сократительная Транспортная
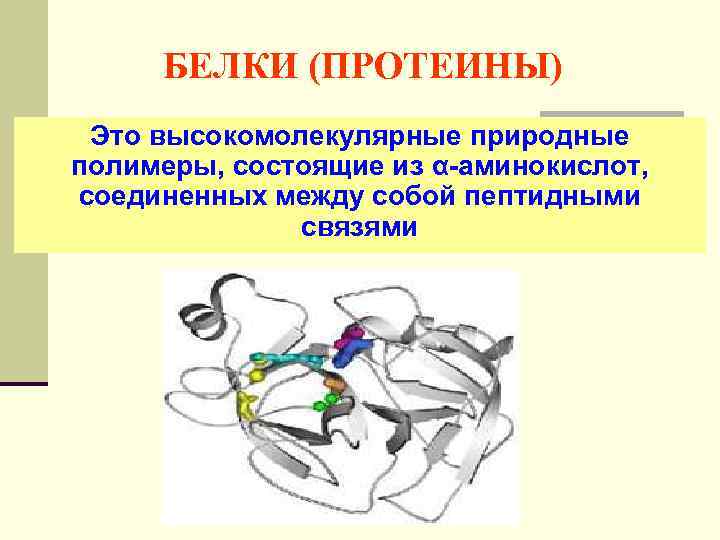
БЕЛКИ (ПРОТЕИНЫ) Это высокомолекулярные природные полимеры, состоящие из α-аминокислот, соединенных между собой пептидными связями

История открытия белка Первый белок, очищенный от примесей был получен в 1728 г. Я. Беккари. Это был белок пшеничного зерна клейковина Белки стали называть протеинами (термин предложен в 1838 году Мульдером) (от греческого protos – первый)

Уровни структурной организации белков 4 уровня структурной организации белков: Первичная Вторичная Третичная Четвертичная
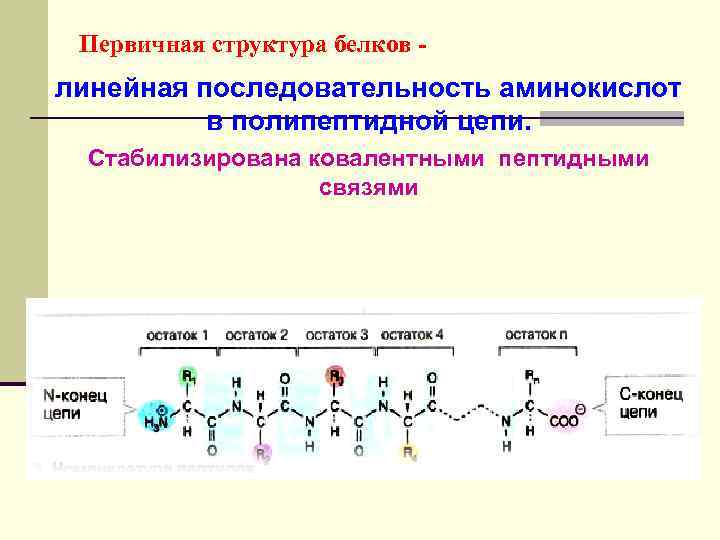
Первичная структура белков - линейная последовательность аминокислот в полипептидной цепи. Стабилизирована ковалентными пептидными связями
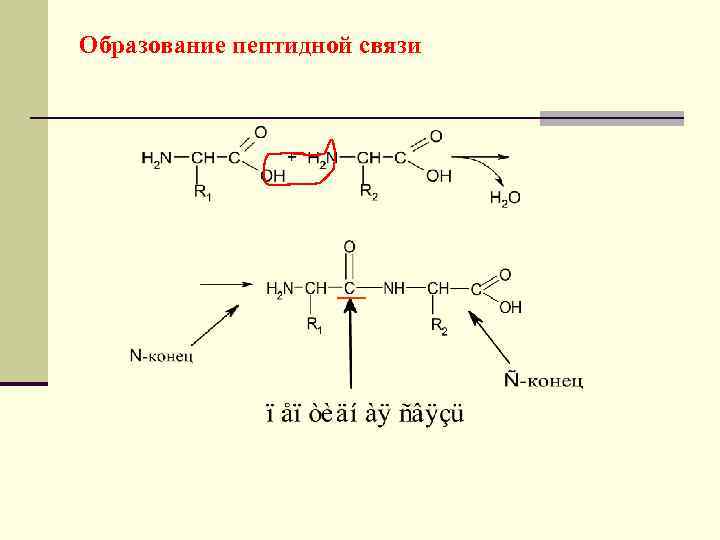
Образование пептидной связи
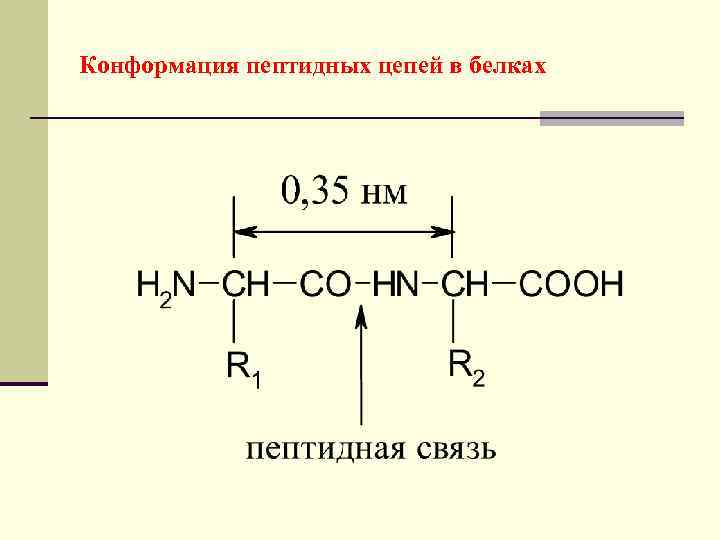
Конформация пептидных цепей в белках
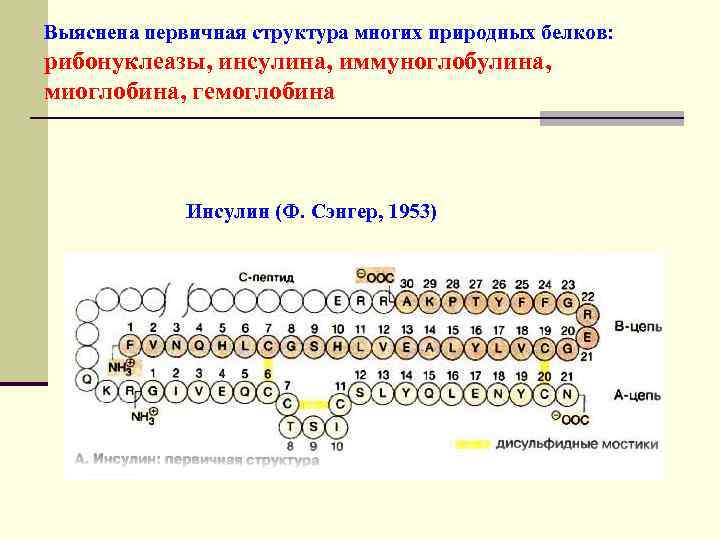
Выяснена первичная структура многих природных белков: рибонуклеазы, инсулина, иммуноглобулина, миоглобина, гемоглобина Инсулин (Ф. Сэнгер, 1953)
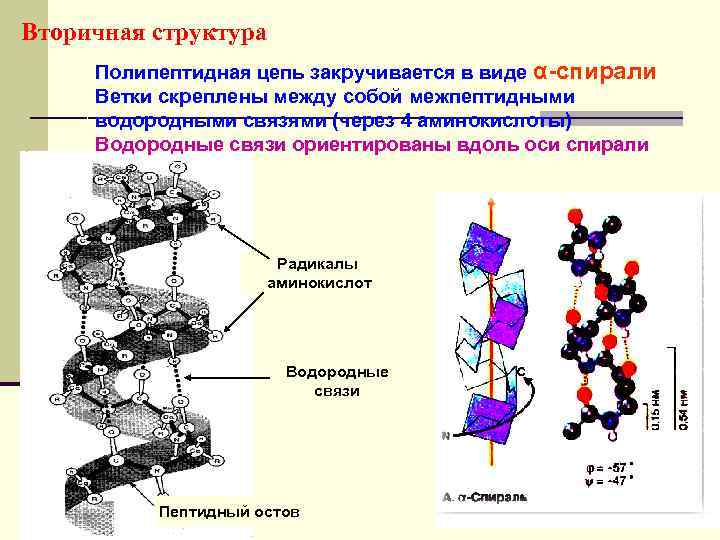
Вторичная структура Полипептидная цепь закручивается в виде α-спирали Ветки скреплены между собой межпептидными водородными связями (через 4 аминокислоты) Водородные связи ориентированы вдоль оси спирали Радикалы аминокислот Водородные связи Пептидный остов
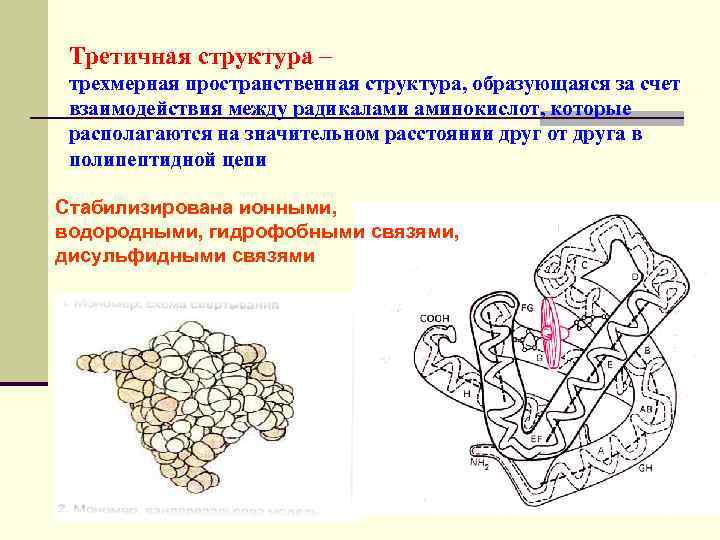
Третичная структура – трехмерная пространственная структура, образующаяся за счет взаимодействия между радикалами аминокислот, которые располагаются на значительном расстоянии друг от друга в полипептидной цепи Стабилизирована ионными, водородными, гидрофобными связями, дисульфидными связями
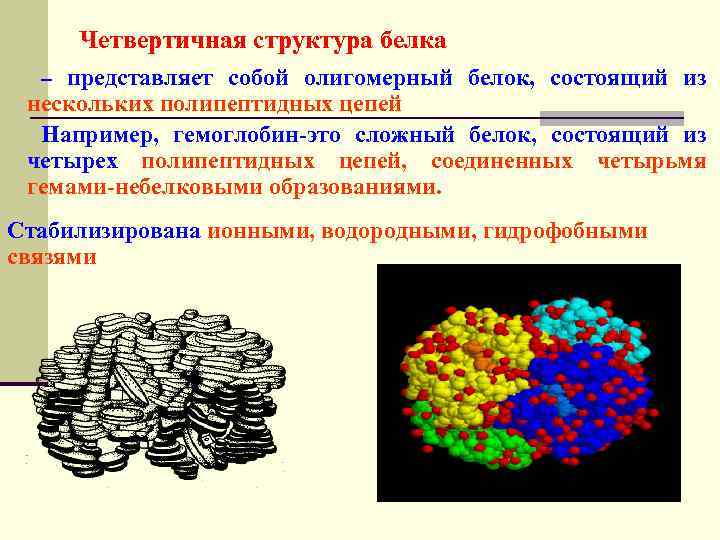
Четвертичная структура белка представляет собой олигомерный белок, состоящий из нескольких полипептидных цепей Например, гемоглобин-это сложный белок, состоящий из четырех полипептидных цепей, соединенных четырьмя гемами-небелковыми образованиями. – Стабилизирована ионными, водородными, гидрофобными связями

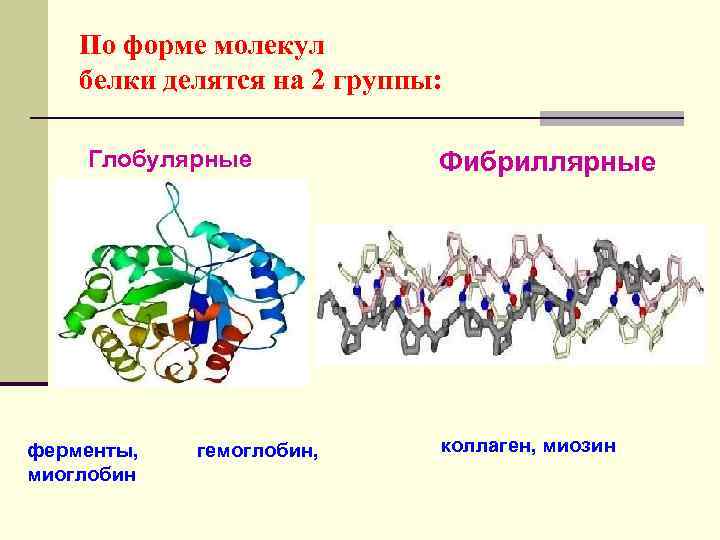
По форме молекул белки делятся на 2 группы: Глобулярные ферменты, миоглобин гемоглобин, Фибриллярные коллаген, миозин
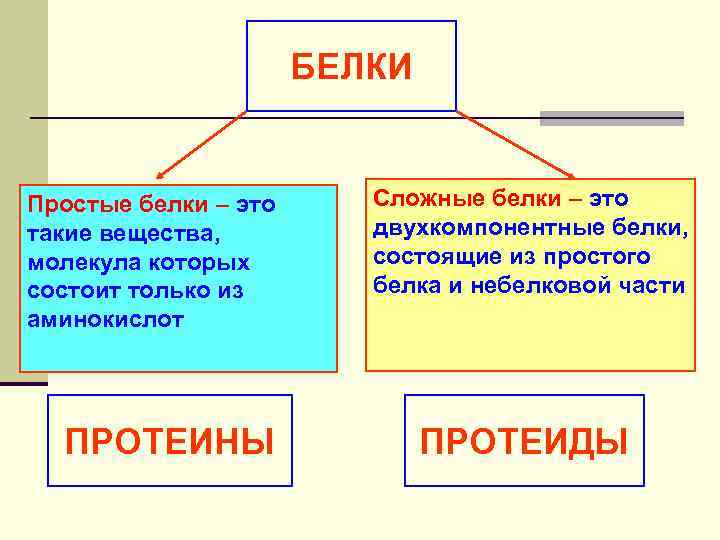
БЕЛКИ Простые белки – это такие вещества, молекула которых состоит только из аминокислот ПРОТЕИНЫ Сложные белки – это двухкомпонентные белки, состоящие из простого белка и небелковой части ПРОТЕИДЫ

Белки представляют собой наиболее сложные коллоидные соединения 1. В растворах белки обнаруживают очень низкое осмотическое давление 2. Незначительная способность к диффузии 3. Высокая вязкость 4. Набухание в очень больших пределах с образованием гелей и студней 5. Способность к адсорбции 6. Амфотерность 7. Ионизация, наличие заряда, электрофоретическая подвижность 8. Гидрофильность, растворимость в воде 9. Склонность к денатурации, осаждению 10. Способность к гидролизу с расщеплением пептидных связей 11. Растворы белков обладают способностью к светорассеянию и способностью к поглощению УФ-излучения при 280 нм
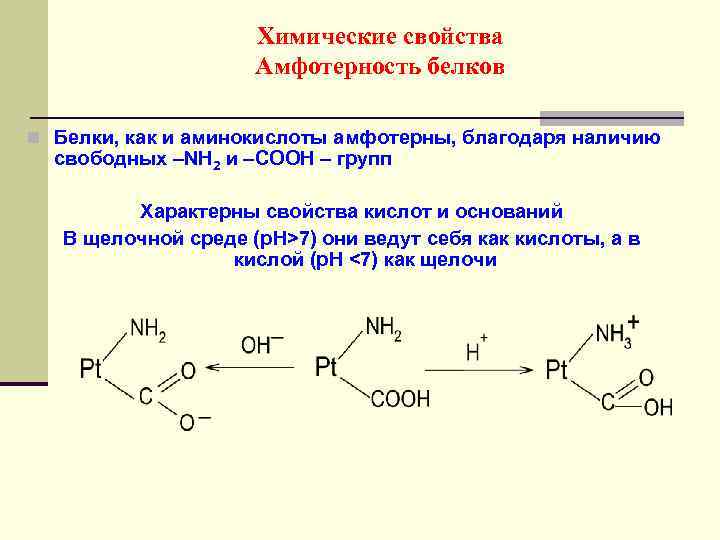
Химические свойства Амфотерность белков n Белки, как и аминокислоты амфотерны, благодаря наличию свободных –NH 2 и –СООН – групп Характерны свойства кислот и оснований В щелочной среде (р. Н>7) они ведут себя как кислоты, а в кислой (р. Н <7) как щелочи

Денатурация белков В основе денатурации лежат глубокие внутримолекулярные перестройки, приводящие к изменению специфической конфигурации белковой молекулы (вторичной, третичной структуры) Физические агенты: нагревание, УФ-лучи, рентгеновские лучи, ультразвуковое излучение, высокое давление Химические агенты: концентрированные кислоты и щелочи, соли тяжелых металлов, алкалоидные реактивы, многие органические растворители Необратимая денатурация Обратимая денатурация
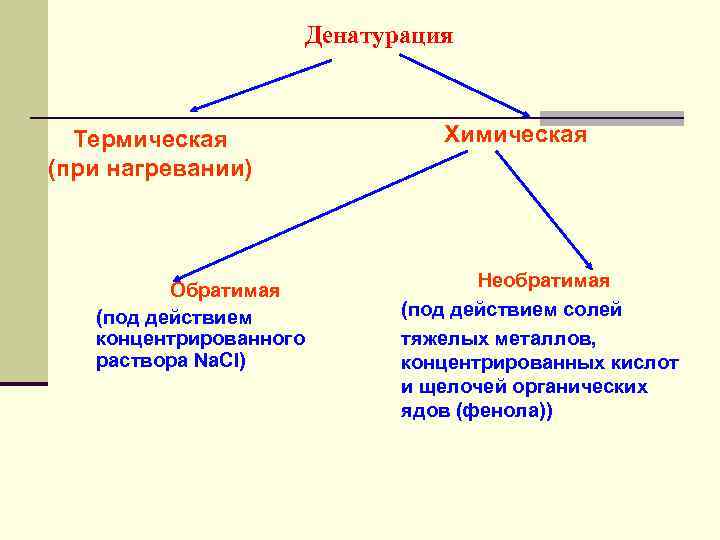
Денатурация Термическая (при нагревании) Обратимая (под действием концентрированного раствора Nа. Сl) Химическая Необратимая (под действием солей тяжелых металлов, концентрированных кислот и щелочей органических ядов (фенола))
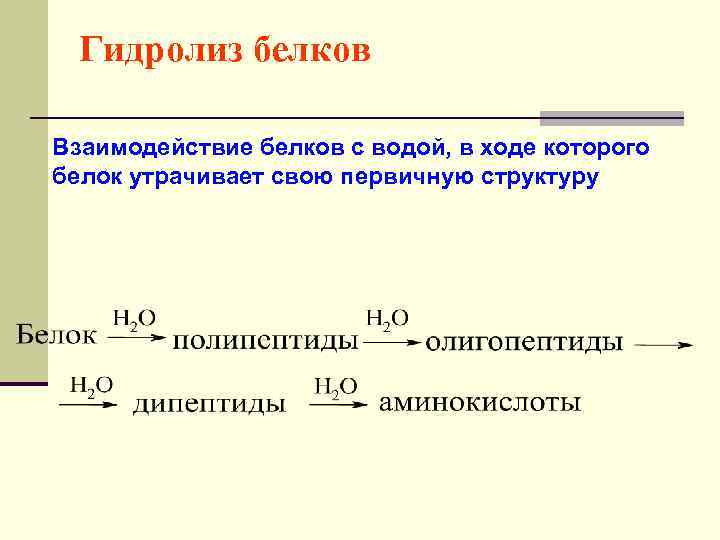
Гидролиз белков Взаимодействие белков с водой, в ходе которого белок утрачивает свою первичную структуру

Цветные реакции на белки n. Биуретовая Белок + Cu(OH)2 → фиолетовая окраска → реакция на пептидные связи n. Ксантопротеиновая Белок + HNO 3(к) → желтая окраска → реакция на ароматические циклы n. Фоля Белок + Pb(NO 3)2 +Na. OH → черный осадок → реакция на серу

Вопросы для закрепления 1. К какому классу органических соединений можно отнести белки? 2. К каким классам веществ, по химическим свойствам, можно отнести белки: а)к кислотам; б) к основаниям; в)к амфотерным соединениям? 3. Почему белки относятся к полимерам? Чем они отличаются от других полимеров? 4. Что такое: а)первичная структура белка; б)второе структура белка; в)третичная структура белка; г)четвертичная структура белка. 5. Перечислите функции белков.

Литература С. С. Михайлов. Спортивная биохимия. М. : 2010. Химия в таблицах и схемах. , С-Петербург, 2006. , Рудзитис Г. Е. , Фельдман Ф. Г. Химия: 11 класс. М. : Просвещение, 2003
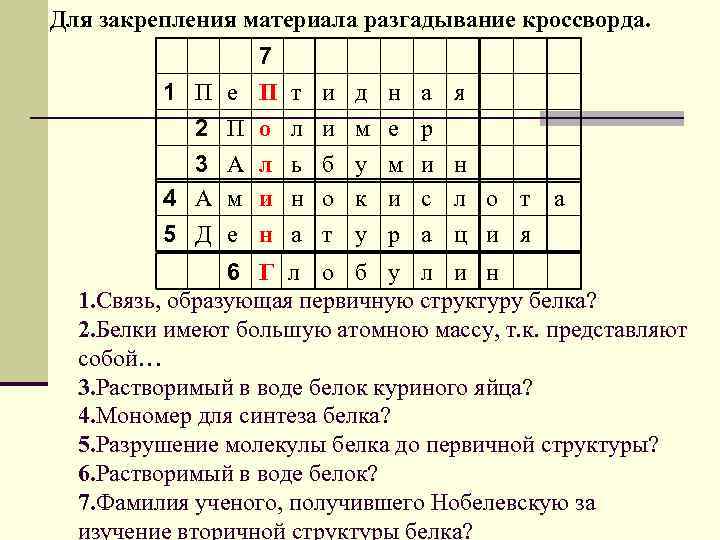
Для закрепления материала разгадывание кроссворда. 1 П 2 3 4 А 5 Д е П А м е 7 П о л и н т л ь н а и и б о т д м у к у н е м и р а р и с а я н л о т а ц и я 6 Г л о б у л и н 1. Связь, образующая первичную структуру белка? 2. Белки имеют большую атомною массу, т. к. представляют собой… 3. Растворимый в воде белок куриного яйца? 4. Мономер для синтеза белка? 5. Разрушение молекулы белка до первичной структуры? 6. Растворимый в воде белок? 7. Фамилия ученого, получившего Нобелевскую за изучение вторичной структуры белка?
Презинтация Белки Л.1.ppt