Catalytic Oxidation1.ppt
- Количество слайдов: 34
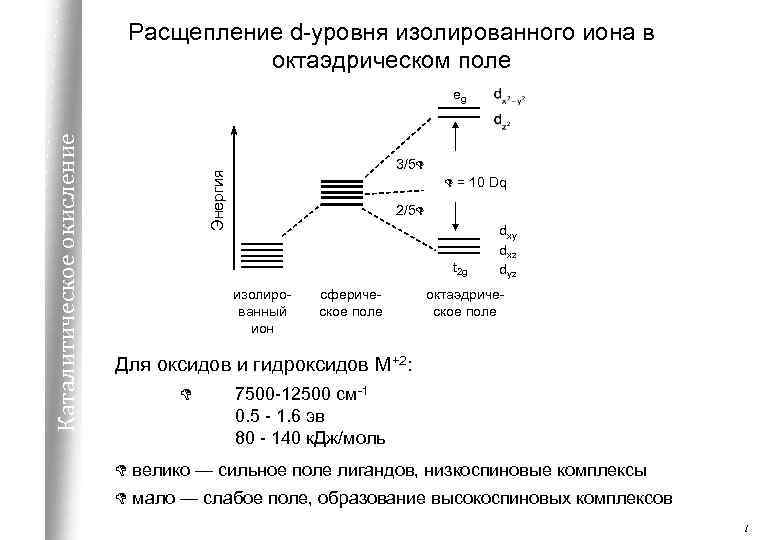 Расщепление d-уровня изолированного иона в октаэдрическом поле 3/5 D Энергия Каталитическое окисление eg D = 10 Dq 2/5 D t 2 g изолированный ион сферическое поле dxy dxz dyz октаэдрическое поле Для оксидов и гидроксидов М+2: D 7500 -12500 см-1 0. 5 - 1. 6 эв 80 - 140 к. Дж/моль D велико — сильное поле лигандов, низкоспиновые комплексы D мало — слабое поле, образование высокоспиновых комплексов 1
Расщепление d-уровня изолированного иона в октаэдрическом поле 3/5 D Энергия Каталитическое окисление eg D = 10 Dq 2/5 D t 2 g изолированный ион сферическое поле dxy dxz dyz октаэдрическое поле Для оксидов и гидроксидов М+2: D 7500 -12500 см-1 0. 5 - 1. 6 эв 80 - 140 к. Дж/моль D велико — сильное поле лигандов, низкоспиновые комплексы D мало — слабое поле, образование высокоспиновых комплексов 1
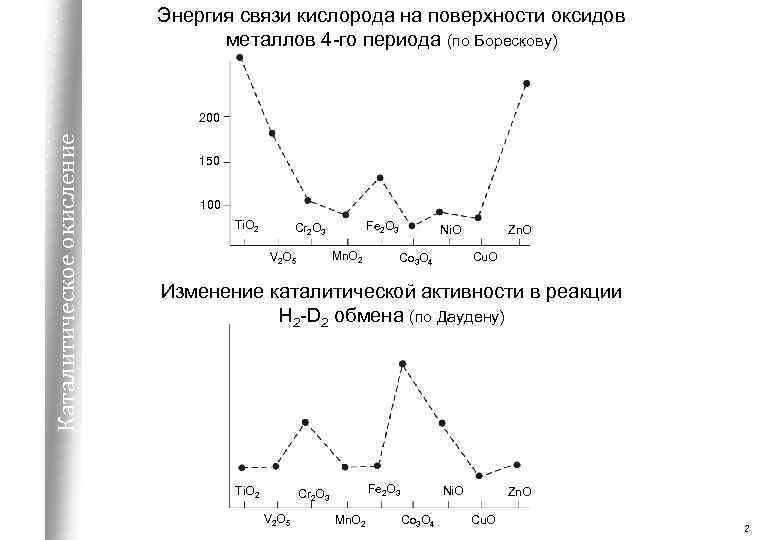 Энергия связи кислорода на поверхности оксидов металлов 4 -го периода (по Борескову) Каталитическое окисление 200 150 100 Ti. O 2 Fe 2 O 3 Cr 2 O 3 Mn. O 2 V 2 O 5 Zn. O Ni. O Cu. O Co 3 O 4 Изменение каталитической активности в реакции H 2 -D 2 обмена (по Даудену) Ti. O 2 Fe 2 O 3 Cr 2 O 3 V 2 O 5 Mn. O 2 Ni. O Co 3 O 4 Zn. O Cu. O 2
Энергия связи кислорода на поверхности оксидов металлов 4 -го периода (по Борескову) Каталитическое окисление 200 150 100 Ti. O 2 Fe 2 O 3 Cr 2 O 3 Mn. O 2 V 2 O 5 Zn. O Ni. O Cu. O Co 3 O 4 Изменение каталитической активности в реакции H 2 -D 2 обмена (по Даудену) Ti. O 2 Fe 2 O 3 Cr 2 O 3 V 2 O 5 Mn. O 2 Ni. O Co 3 O 4 Zn. O Cu. O 2
 Корреляция с теплотой образования окисла Pd -3 lg a (моль/м 2·с) Каталитическое окисление (Одзаки, Моро-ока, Морикава, 1966) Pt Корреляция активности в окислении изобутилена при 300 о. С с величиной Но Mn Co -8 Cr Ce Ni Th Fe 50 100 150 DНo, ккал/моль Сила адсорбции возрастает: n-C 4 H 8 > C 2 H 2 > C 3 H 6 > C 2 H 4 > C 3 H 8 Возрастание порядка реакции по углеводороду 3
Корреляция с теплотой образования окисла Pd -3 lg a (моль/м 2·с) Каталитическое окисление (Одзаки, Моро-ока, Морикава, 1966) Pt Корреляция активности в окислении изобутилена при 300 о. С с величиной Но Mn Co -8 Cr Ce Ni Th Fe 50 100 150 DНo, ккал/моль Сила адсорбции возрастает: n-C 4 H 8 > C 2 H 2 > C 3 H 6 > C 2 H 4 > C 3 H 8 Возрастание порядка реакции по углеводороду 3
 Каталитическое окисление Полное окисление Стационарный состав поверхности оксидных катализаторов при наличии избытка О 2 в реакционной смеси очень близок к равновесному, достигаемому при обработке Кт одним кислородом. Таким образом, трудным этапом реакции окисления является отрыв кислорода от поверхности Кт окисленным веществом. Г. К. Боресков, в «Механизм катализа» , 1984 lg R NO NH 3 C 6 H 6 C 2 H 2 CH 4 Co Cu Ni Fe 40 V 80 Zn Ti 120 E = Eo + aqo a ~ 0. 5 Свойства катализаторов определяются их взаимодействием с кислородом, взаимодействие с окисляемым веществом существенно не сказывается. H 2 к. Дж/г-атом Co Cu Ni Fe Mn Cr V Zn Ti 4
Каталитическое окисление Полное окисление Стационарный состав поверхности оксидных катализаторов при наличии избытка О 2 в реакционной смеси очень близок к равновесному, достигаемому при обработке Кт одним кислородом. Таким образом, трудным этапом реакции окисления является отрыв кислорода от поверхности Кт окисленным веществом. Г. К. Боресков, в «Механизм катализа» , 1984 lg R NO NH 3 C 6 H 6 C 2 H 2 CH 4 Co Cu Ni Fe 40 V 80 Zn Ti 120 E = Eo + aqo a ~ 0. 5 Свойства катализаторов определяются их взаимодействием с кислородом, взаимодействие с окисляемым веществом существенно не сказывается. H 2 к. Дж/г-атом Co Cu Ni Fe Mn Cr V Zn Ti 4
 Катализ окислами Каталитическое окисление Полное окисление требует слабо связанного кислорода. При окислении парафинов реакционная способность тем выше, чем меньше энергия связи С—Н (Поповский. 1972) lg V 3 катализ в присутствии О 2 окисление в отсутствии О 2 1 360 440 С—Н, к. Дж/моль 5
Катализ окислами Каталитическое окисление Полное окисление требует слабо связанного кислорода. При окислении парафинов реакционная способность тем выше, чем меньше энергия связи С—Н (Поповский. 1972) lg V 3 катализ в присутствии О 2 окисление в отсутствии О 2 1 360 440 С—Н, к. Дж/моль 5
 Каталитическое окисление Полное окисление Различие в скорости окисления различных веществ обусловлено необходимостью разрыва или ослабления определенных связей в окисляемой молекуле, что сказывается на величине Ео в уравнении E = Eo + aqo При окислении парафинов — это связь С–Н, а при окислении олефинов — С=С. Общее уравнение: где qi – теплота разрываемых связей qj – теплота образующихся связей 6
Каталитическое окисление Полное окисление Различие в скорости окисления различных веществ обусловлено необходимостью разрыва или ослабления определенных связей в окисляемой молекуле, что сказывается на величине Ео в уравнении E = Eo + aqo При окислении парафинов — это связь С–Н, а при окислении олефинов — С=С. Общее уравнение: где qi – теплота разрываемых связей qj – теплота образующихся связей 6
 Каталитическое окисление Зависимость энергии связи кислорода с окислами от степени удаления кислорода с поверхности Г. К. Боресков Catalysis, Science and Technology, volume 3, page 39, Springer-Verlag, 1982 7
Каталитическое окисление Зависимость энергии связи кислорода с окислами от степени удаления кислорода с поверхности Г. К. Боресков Catalysis, Science and Technology, volume 3, page 39, Springer-Verlag, 1982 7
 Два типа механизмов окисления Стадийный: Каталитическое окисление M M=O + O 2 M M=O + R Марс, ван Кревелен, 1954 M + R=O Слитный: M + О 2 M+R M M—R M=О M + RO 8
Два типа механизмов окисления Стадийный: Каталитическое окисление M M=O + O 2 M M=O + R Марс, ван Кревелен, 1954 M + R=O Слитный: M + О 2 M+R M M—R M=О M + RO 8
 Катализ окислами Каталитическое окисление Стадийный и слитный механизм на примере окисления метана сл й ы йн ) и ад 00 o C ст ит н ый (>4 9
Катализ окислами Каталитическое окисление Стадийный и слитный механизм на примере окисления метана сл й ы йн ) и ад 00 o C ст ит н ый (>4 9
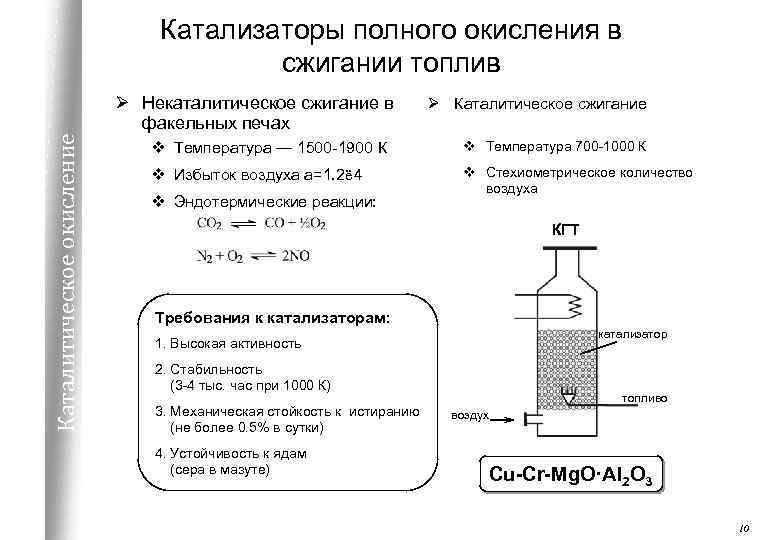 Катализаторы полного окисления в сжигании топлив Каталитическое окисление Ø Некаталитическое сжигание в факельных печах Ø Каталитическое сжигание v Температура — 1500 -1900 К v Температура 700 -1000 К v Избыток воздуха a=1. 2ё 4 v Стехиометрическое количество воздуха v Эндотермические реакции: КГТ Требования к катализаторам: катализатор 1. Высокая активность 2. Стабильность (3 -4 тыс. час при 1000 К) 3. Механическая стойкость к истиранию (не более 0. 5% в сутки) 4. Устойчивость к ядам (сера в мазуте) топливо воздух Cu-Cr-Mg. O·Al 2 O 3 10
Катализаторы полного окисления в сжигании топлив Каталитическое окисление Ø Некаталитическое сжигание в факельных печах Ø Каталитическое сжигание v Температура — 1500 -1900 К v Температура 700 -1000 К v Избыток воздуха a=1. 2ё 4 v Стехиометрическое количество воздуха v Эндотермические реакции: КГТ Требования к катализаторам: катализатор 1. Высокая активность 2. Стабильность (3 -4 тыс. час при 1000 К) 3. Механическая стойкость к истиранию (не более 0. 5% в сутки) 4. Устойчивость к ядам (сера в мазуте) топливо воздух Cu-Cr-Mg. O·Al 2 O 3 10
 Катализаторы полного окисления в сжигании промвыбросов Каталитическое окисление Некаталитически газовые сбросы Кт (стац. слой) воздух газ Катализаторы: Cu. O/Al 2 O 3 (30% Cu) — ИКТ-12 -6 Cu+Cr/Al 2 O 3 (Cr: Cu=2: 1) 20 -30% окислов — ИКТ-12 -8 1. Большой расход природного газа 2. Образование NO, CO 11
Катализаторы полного окисления в сжигании промвыбросов Каталитическое окисление Некаталитически газовые сбросы Кт (стац. слой) воздух газ Катализаторы: Cu. O/Al 2 O 3 (30% Cu) — ИКТ-12 -6 Cu+Cr/Al 2 O 3 (Cr: Cu=2: 1) 20 -30% окислов — ИКТ-12 -8 1. Большой расход природного газа 2. Образование NO, CO 11
 Селективное окисление. Введение фрагментов Каталитическое окисление ; ; Особенности катализаторов селективного окисления: 1. Специфичность по реагенту 2. Катализаторы — бинарные системы, резко отличающиеся от свойств компонентов 3. Сложное строение поверхности катализатора 12
Селективное окисление. Введение фрагментов Каталитическое окисление ; ; Особенности катализаторов селективного окисления: 1. Специфичность по реагенту 2. Катализаторы — бинарные системы, резко отличающиеся от свойств компонентов 3. Сложное строение поверхности катализатора 12
 Каталитическое окисление Г. К. Боресков в книге «Механизм катализа» , 1984: «Для реакций парциального окисления недопустимо присутствие на поверхности катализатора слабосвязанного кислорода из-за неизбежности дальнейшего окисления желаемых продуктов неполного окисления. Энергия связи кислорода на катализаторах должна быть выше 250 к. Дж/моль. Для взаимодействия со столь прочносвязанным кислородом окисляемого вещества необходима его активация в результате его взаимодействия с катализатором. Характер этого взаимодействия определяет как скорость реакции, так и природу образующихся продуктов. » 13
Каталитическое окисление Г. К. Боресков в книге «Механизм катализа» , 1984: «Для реакций парциального окисления недопустимо присутствие на поверхности катализатора слабосвязанного кислорода из-за неизбежности дальнейшего окисления желаемых продуктов неполного окисления. Энергия связи кислорода на катализаторах должна быть выше 250 к. Дж/моль. Для взаимодействия со столь прочносвязанным кислородом окисляемого вещества необходима его активация в результате его взаимодействия с катализатором. Характер этого взаимодействия определяет как скорость реакции, так и природу образующихся продуктов. » 13
 Варианты активации С-Н связи (Соколовский, 1977) С Каталитическое окисление 1. Гомолитическая активация Н А В d+ 2. Гетеролитическая активация с образованием карбокатиона 3. Гетеролитическая активация с протонизацией водорода под действием нуклеофильного центра и образованием фрагмента, имеющего карбанионный характер. С d- Н А+ В– d- С B– d+ Н A+ 14
Варианты активации С-Н связи (Соколовский, 1977) С Каталитическое окисление 1. Гомолитическая активация Н А В d+ 2. Гетеролитическая активация с образованием карбокатиона 3. Гетеролитическая активация с протонизацией водорода под действием нуклеофильного центра и образованием фрагмента, имеющего карбанионный характер. С d- Н А+ В– d- С B– d+ Н A+ 14
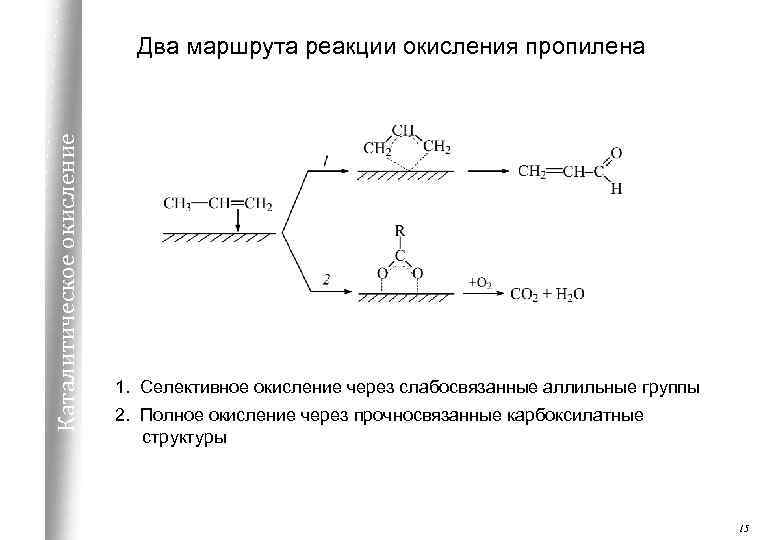 Каталитическое окисление Два маршрута реакции окисления пропилена 1. Селективное окисление через слабосвязанные аллильные группы 2. Полное окисление через прочносвязанные карбоксилатные структуры 15
Каталитическое окисление Два маршрута реакции окисления пропилена 1. Селективное окисление через слабосвязанные аллильные группы 2. Полное окисление через прочносвязанные карбоксилатные структуры 15
 Каталитическое окисление Для протекания селективного окисления необходимо обеспечить десорбцию частично окисленной молекулы с поверхности катализатора до того, как она окислится дальше до СО 2. Правило Захтлера Селективность тем выше, чем выше градиент энтальпии восстановления DHвосст при увеличении степени восстановления поверхности оксида (Хвосст): Это означает, что увеличение прочности связанного кислорода по мере восстановления поверхности приводит к повышению селективности. 16
Каталитическое окисление Для протекания селективного окисления необходимо обеспечить десорбцию частично окисленной молекулы с поверхности катализатора до того, как она окислится дальше до СО 2. Правило Захтлера Селективность тем выше, чем выше градиент энтальпии восстановления DHвосст при увеличении степени восстановления поверхности оксида (Хвосст): Это означает, что увеличение прочности связанного кислорода по мере восстановления поверхности приводит к повышению селективности. 16
 Каталитическое окисление Иллюстрация правила Захтлера DG 0 — свободная энергия восстановления, к. Дж/моль О 2, при степени восстановления 0. 22 17
Каталитическое окисление Иллюстрация правила Захтлера DG 0 — свободная энергия восстановления, к. Дж/моль О 2, при степени восстановления 0. 22 17
 Каталитическое окисление Концепция Захтлера и де Бура (1964) Ø Легко восстанавливаемый окисел: активен, но не селективен Ø Трудно восстанавливаемый окисел: малоактивен 18
Каталитическое окисление Концепция Захтлера и де Бура (1964) Ø Легко восстанавливаемый окисел: активен, но не селективен Ø Трудно восстанавливаемый окисел: малоактивен 18
 Каталитическое окисление Промышленные процессы V 2 O 5/Ti. O 2, псевдоожиженный слой (V 2 О 5+Mo. O 3)/носитель, псевдоожиженный слой Fe 2(Mo. O 4)3+Mo. O 3, неподвижный слой Ag, неподвижный слой смешанные молибдаты висмута (>1 млн т в год) 19
Каталитическое окисление Промышленные процессы V 2 O 5/Ti. O 2, псевдоожиженный слой (V 2 О 5+Mo. O 3)/носитель, псевдоожиженный слой Fe 2(Mo. O 4)3+Mo. O 3, неподвижный слой Ag, неподвижный слой смешанные молибдаты висмута (>1 млн т в год) 19
 Каталитическое окисление Окислительный аммонолиз DG 0 = – 136 ккал/моль (при 430 о. С) Катализатор изобретен Граселли (фирма Сохайо, США), 1960 г. Общая схема: углеводород n/2 O 2 - n/4 O 2 ne продукт селективного окисления 2 элемента: H 2 O Ma — окисляет углеводород Mb — окисляется кислородом, а затем передает его Ма 20
Каталитическое окисление Окислительный аммонолиз DG 0 = – 136 ккал/моль (при 430 о. С) Катализатор изобретен Граселли (фирма Сохайо, США), 1960 г. Общая схема: углеводород n/2 O 2 - n/4 O 2 ne продукт селективного окисления 2 элемента: H 2 O Ma — окисляет углеводород Mb — окисляется кислородом, а затем передает его Ма 20
 Каталитическое окисление Окислительный аммонолиз пропилена Ø Катализаторы: v v v Bi 2 O 3 + Mo. O 3 Fe 2 O 3 + Sb 2 O 4 (Fe. Sb. O 4) UO 3 + Sb 2 O 4 Sn. O 2 + Sb 2 O 4 Добавки K, P, W, Te Ø Сложный катализатор v Co 6 Ni 2 Fe 3 Bi 2 (Mo. O 4)12 O 2 v K, P, Si. O 2 Катализаторы легко восстанавливаются олефинами и NH 3 (но не Н 2 и СО) 21
Каталитическое окисление Окислительный аммонолиз пропилена Ø Катализаторы: v v v Bi 2 O 3 + Mo. O 3 Fe 2 O 3 + Sb 2 O 4 (Fe. Sb. O 4) UO 3 + Sb 2 O 4 Sn. O 2 + Sb 2 O 4 Добавки K, P, W, Te Ø Сложный катализатор v Co 6 Ni 2 Fe 3 Bi 2 (Mo. O 4)12 O 2 v K, P, Si. O 2 Катализаторы легко восстанавливаются олефинами и NH 3 (но не Н 2 и СО) 21
 Каталитическое окисление Особенности механизма по Граселли 1. В а. ц. присутствуют 2 группы Мo=О, которые активируют NH 3 с образованием диимидных групп. 2. Селективный продукт образуется при взаимодействии пропилена с диимидной группой; кислород решетки участвует в окислении восстановленного центра. 22
Каталитическое окисление Особенности механизма по Граселли 1. В а. ц. присутствуют 2 группы Мo=О, которые активируют NH 3 с образованием диимидных групп. 2. Селективный продукт образуется при взаимодействии пропилена с диимидной группой; кислород решетки участвует в окислении восстановленного центра. 22
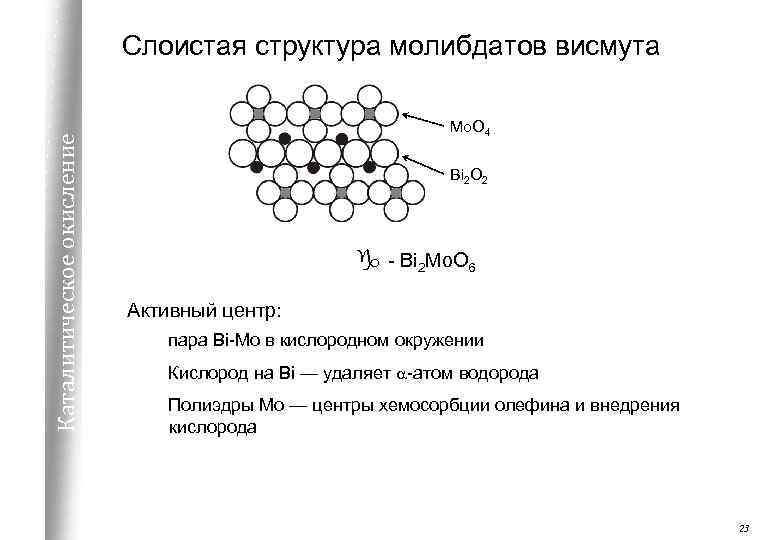 Каталитическое окисление Слоистая структура молибдатов висмута Mo. O 4 Bi 2 O 2 g - Bi 2 Mo. O 6 Активный центр: пара Bi-Mo в кислородном окружении Кислород на Bi — удаляет a-атом водорода Полиэдры Mo — центры хемосорбции олефина и внедрения кислорода 23
Каталитическое окисление Слоистая структура молибдатов висмута Mo. O 4 Bi 2 O 2 g - Bi 2 Mo. O 6 Активный центр: пара Bi-Mo в кислородном окружении Кислород на Bi — удаляет a-атом водорода Полиэдры Mo — центры хемосорбции олефина и внедрения кислорода 23
 Каталитическое окисление Механизм по Граселли O O C O Bi Mo O NH 3 O O NH Bi +CH 2=CHCH 3 Mo O O NH C NH Bi Mo O O NH slow H H HO O Bi HO N C Mo H O O – NH 3 O N C Bi HO H Mo O O O NH NH Bi Mo O O NH [O] (решеточный кислород) HO O N C Bi Mo O O O HO H – C=C–CN O OH Bi Mo O O [O] O – H 2 O O O Bi Mo O O O 24
Каталитическое окисление Механизм по Граселли O O C O Bi Mo O NH 3 O O NH Bi +CH 2=CHCH 3 Mo O O NH C NH Bi Mo O O NH slow H H HO O Bi HO N C Mo H O O – NH 3 O N C Bi HO H Mo O O O NH NH Bi Mo O O NH [O] (решеточный кислород) HO O N C Bi Mo O O O HO H – C=C–CN O OH Bi Mo O O [O] O – H 2 O O O Bi Mo O O O 24
 Каталитическое окисление Механизм окисления пропилена по Соколовскому и Булгакову (1977) образование димера С 6 - H 2 O 25
Каталитическое окисление Механизм окисления пропилена по Соколовскому и Булгакову (1977) образование димера С 6 - H 2 O 25
 Каталитическое окисление Промежуточное образование аллильных форм Sachtler, de Boer (1964) C=C* CO Вывод: эквивалентность концевых атомов углерода 26
Каталитическое окисление Промежуточное образование аллильных форм Sachtler, de Boer (1964) C=C* CO Вывод: эквивалентность концевых атомов углерода 26
 Окислительный аммонолиз Каталитическое окисление Sohio: Standart Oi. C Co of Ohio Н 2 О пар воздух CH 2=CHCN абсорбер NH 3 C 3 H 6 U-Sb/Si. O 2: акрилонитрил HCN ацетонитрил СО СО 2 непрореагир. С 3 H 6 HCN система разделения 400 -500 Oc t – несколько секунд 82. 1 5. 7 следы 6. 7 3. 4 0. 3 27
Окислительный аммонолиз Каталитическое окисление Sohio: Standart Oi. C Co of Ohio Н 2 О пар воздух CH 2=CHCN абсорбер NH 3 C 3 H 6 U-Sb/Si. O 2: акрилонитрил HCN ацетонитрил СО СО 2 непрореагир. С 3 H 6 HCN система разделения 400 -500 Oc t – несколько секунд 82. 1 5. 7 следы 6. 7 3. 4 0. 3 27
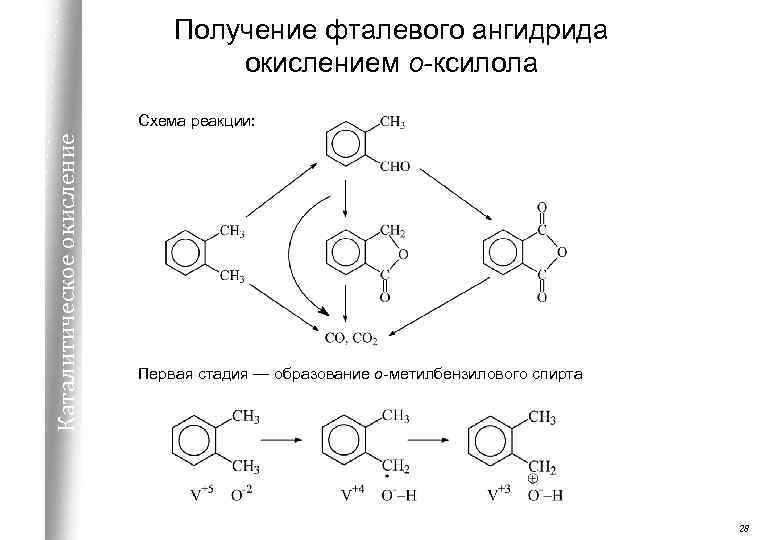 Получение фталевого ангидрида окислением о-ксилола Каталитическое окисление Схема реакции: Первая стадия — образование о-метилбензилового спирта 28
Получение фталевого ангидрида окислением о-ксилола Каталитическое окисление Схема реакции: Первая стадия — образование о-метилбензилового спирта 28
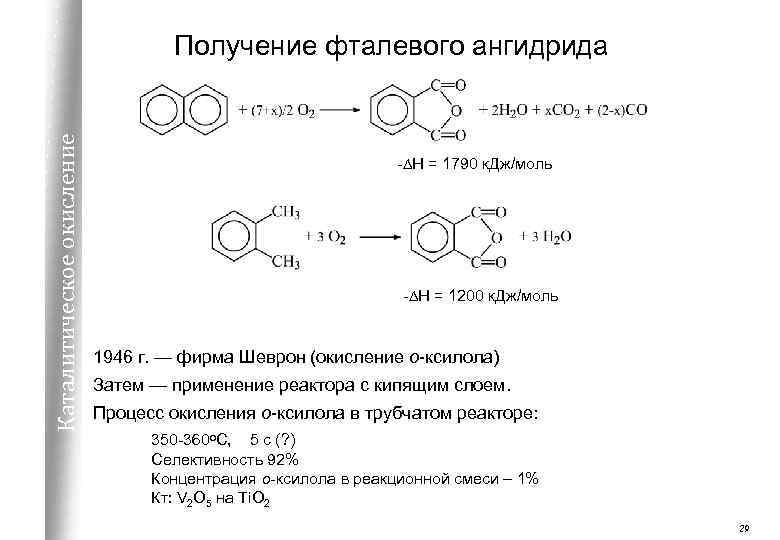 Каталитическое окисление Получение фталевого ангидрида -DH = 1790 к. Дж/моль -DH = 1200 к. Дж/моль 1946 г. — фирма Шеврон (окисление о-ксилола) Затем — применение реактора с кипящим слоем. Процесс окисления о-ксилола в трубчатом реакторе: 350 -360 о. С, 5 с (? ) Селективность 92% Концентрация о-ксилола в реакционной смеси – 1% Кт: V 2 O 5 на Ti. O 2 29
Каталитическое окисление Получение фталевого ангидрида -DH = 1790 к. Дж/моль -DH = 1200 к. Дж/моль 1946 г. — фирма Шеврон (окисление о-ксилола) Затем — применение реактора с кипящим слоем. Процесс окисления о-ксилола в трубчатом реакторе: 350 -360 о. С, 5 с (? ) Селективность 92% Концентрация о-ксилола в реакционной смеси – 1% Кт: V 2 O 5 на Ti. O 2 29
 Каталитическое окисление Окисление метанола в формальдегид на Fe-Mo катализаторе Ø Катализатор: Fe(Mo. O 4)3 с некоторым избытком Mo. O 3 Ø Трубчатый реактор, 350 -400 о. С Ø Избыток О 2, содержание СН 3 ОН < 6. 7 об. % Ø Селективность: 91 -94% Ø Окислительно-восстановительный механизм: CH 3 OH + К ат–O 2 К ат + O 2 CH 2 O газ + К ат 2 К ат–O 30
Каталитическое окисление Окисление метанола в формальдегид на Fe-Mo катализаторе Ø Катализатор: Fe(Mo. O 4)3 с некоторым избытком Mo. O 3 Ø Трубчатый реактор, 350 -400 о. С Ø Избыток О 2, содержание СН 3 ОН < 6. 7 об. % Ø Селективность: 91 -94% Ø Окислительно-восстановительный механизм: CH 3 OH + К ат–O 2 К ат + O 2 CH 2 O газ + К ат 2 К ат–O 30
 Каталитическое окисление Окислительное дегидрирование бутиленов в бутадиен C 4 H 8 + ½O 2 C 4 H 6 + H 2 O DH = – 121 к. Дж/моль Ø Катализатор: Mn. Fe 2 O 4 Zn. Cr. Fe. O 4 Ø Процесс Petro-Tex (1965) воздух + С 4 Н 8 + Н 2 О (Н 2 О : С 4 Н 8 = 12) 350 -500 о. С Ø Конверсия бутиленов: 65% Ø Селективность: 93% 31
Каталитическое окисление Окислительное дегидрирование бутиленов в бутадиен C 4 H 8 + ½O 2 C 4 H 6 + H 2 O DH = – 121 к. Дж/моль Ø Катализатор: Mn. Fe 2 O 4 Zn. Cr. Fe. O 4 Ø Процесс Petro-Tex (1965) воздух + С 4 Н 8 + Н 2 О (Н 2 О : С 4 Н 8 = 12) 350 -500 о. С Ø Конверсия бутиленов: 65% Ø Селективность: 93% 31
 Окислительное дегидрирование Каталитическое окисление Представления о механизме: М 1 — координация олефина (Мо) М 2 — активация кислорода (Bi, Sn) CH 2 CH CH CH 3 M 1 32
Окислительное дегидрирование Каталитическое окисление Представления о механизме: М 1 — координация олефина (Мо) М 2 — активация кислорода (Bi, Sn) CH 2 CH CH CH 3 M 1 32
 Газофазное окисление этилена в ацетальдегид Каталитическое окисление (Рабо и др. , Юнион Карбайд, 1973) Катализатор: 0. 1 ¸ 1% Pd 3 ¸ 5% V 2 O 5 Al 2 O 3 (добавки Cu. O, Ir, Ru, Pt) 110 - 185 o. C, 1 -30 атм 60 -85% 25 -10% Селективность в окислении пропилена: 60 -85% — ацетон 10 -30% — уксусная кислота 33
Газофазное окисление этилена в ацетальдегид Каталитическое окисление (Рабо и др. , Юнион Карбайд, 1973) Катализатор: 0. 1 ¸ 1% Pd 3 ¸ 5% V 2 O 5 Al 2 O 3 (добавки Cu. O, Ir, Ru, Pt) 110 - 185 o. C, 1 -30 атм 60 -85% 25 -10% Селективность в окислении пропилена: 60 -85% — ацетон 10 -30% — уксусная кислота 33
 Каталитическое окисление Нанесенные металлокомплексы как катализаторы -H 2 O —OH O O 2+ O + Pd + H + CH 3 CR O 2 H 2 O 34
Каталитическое окисление Нанесенные металлокомплексы как катализаторы -H 2 O —OH O O 2+ O + Pd + H + CH 3 CR O 2 H 2 O 34


