Гидросфера.ppt
- Количество слайдов: 44
 Распространённость химических элементов в ГИДРОСФЕРЕ
Распространённость химических элементов в ГИДРОСФЕРЕ
 ГИДРОСФЕРА (от гидро. . . и сфера) - совокупность всех водных объектов земного шара: океанов, морей, рек, озер, водохранилищ, болот, подземных вод, ледников и снежного покрова.
ГИДРОСФЕРА (от гидро. . . и сфера) - совокупность всех водных объектов земного шара: океанов, морей, рек, озер, водохранилищ, болот, подземных вод, ледников и снежного покрова.
 Вода покрывает более 70% поверхности земного шара, а средняя глубина Мирового океана около 4 км. Масса гидросферы примерно 1, 46 • 10²¹кг. Это в 275 раз больше массы атмосферы, но лишь 1/4000 от массы всей Земли. Гидросферу на 94% составляют воды Мирового океана, в которых растворены соли (в среднем 3, 5%), а также ряд газов. Верхний слой океана содержит : углекислого газа - 140 трлн. тонн , растворенного кислорода - 8 трлн. тонн.
Вода покрывает более 70% поверхности земного шара, а средняя глубина Мирового океана около 4 км. Масса гидросферы примерно 1, 46 • 10²¹кг. Это в 275 раз больше массы атмосферы, но лишь 1/4000 от массы всей Земли. Гидросферу на 94% составляют воды Мирового океана, в которых растворены соли (в среднем 3, 5%), а также ряд газов. Верхний слой океана содержит : углекислого газа - 140 трлн. тонн , растворенного кислорода - 8 трлн. тонн.
 Объем гидросферы - 1370 млн. куб. км, что составляет 1/800 объема планеты Земля. Этот объем распределяется следующим образом: - мировой океан - 1120 млн. куб. км (94%); - подземные воды - 200 млн. куб. км (4%); - материковые ледники и ледники приполярных областей - 30 млн. куб. км (1, 6%); - реки, озера и болота - 4 млн. куб. км (0, 25%); - атмосфера - 12 тыс. куб. км. Количество воды в гидросфере практически постоянно.
Объем гидросферы - 1370 млн. куб. км, что составляет 1/800 объема планеты Земля. Этот объем распределяется следующим образом: - мировой океан - 1120 млн. куб. км (94%); - подземные воды - 200 млн. куб. км (4%); - материковые ледники и ледники приполярных областей - 30 млн. куб. км (1, 6%); - реки, озера и болота - 4 млн. куб. км (0, 25%); - атмосфера - 12 тыс. куб. км. Количество воды в гидросфере практически постоянно.
 Самое глубокое озеро Байкал глубина достигает 1620 м. Площадь самого крупного озера Каспийского моря 371 000 км 2.
Самое глубокое озеро Байкал глубина достигает 1620 м. Площадь самого крупного озера Каспийского моря 371 000 км 2.
 ГЛУБИНА МИРОВОГО ОКЕАНА Средняя - 3 700 м; Максимальная – 11 022 м (Марианская впадина)
ГЛУБИНА МИРОВОГО ОКЕАНА Средняя - 3 700 м; Максимальная – 11 022 м (Марианская впадина)
 Температурный режим Мирового океана Максимальные средние годовые температуры +28 град С – экватор Минимальные средние годовые температуры -1, 8 град С – приполярные области Средняя температура приповерхностно-го слоя +17, 5 град С Средняя температура Мирового океана +4 град С
Температурный режим Мирового океана Максимальные средние годовые температуры +28 град С – экватор Минимальные средние годовые температуры -1, 8 град С – приполярные области Средняя температура приповерхностно-го слоя +17, 5 град С Средняя температура Мирового океана +4 град С
 История открытия. В 1783 году А. Лавуазье и П. Лаплас синтезировали воду, доказав, что она представляет собой не простой элемент, а сложное вещество, образующееся из двух простых, которые были названы кислородом и водородом. В 1805 году Ж. Л. Гей-Люссак и А. Гумбольт показали, что вода образуется из двух объёмов водорода и одного объёма кислорода, то есть была получена формула воды. После открытия периодического закона, стало ясно, что по всем параметрам вода является уникальным веществом, свойства которого не укладываются в рамки общих
История открытия. В 1783 году А. Лавуазье и П. Лаплас синтезировали воду, доказав, что она представляет собой не простой элемент, а сложное вещество, образующееся из двух простых, которые были названы кислородом и водородом. В 1805 году Ж. Л. Гей-Люссак и А. Гумбольт показали, что вода образуется из двух объёмов водорода и одного объёма кислорода, то есть была получена формула воды. После открытия периодического закона, стало ясно, что по всем параметрам вода является уникальным веществом, свойства которого не укладываются в рамки общих
 Свойства воды Температуры кипения и плавления воды при атмосферном давлении -соответственно 100 и 0 град С. Удельная теплоёмкость воды - самая высокая из всех жидкостей. Для того, чтобы нагреть 1 г воды на один градус затрачивается 4, 2 Дж теплоты (1 кал). При этом удельная теплоёмкость льда и водяного пара вдвое ниже. Аномально высокими являются скрытые теплоты плавления и испарения воды. Для того, чтобы превратить 1 кг льда в пар надо затратить 3 000 к. Дж тепла – значительно больше, чем для другой жидкости.
Свойства воды Температуры кипения и плавления воды при атмосферном давлении -соответственно 100 и 0 град С. Удельная теплоёмкость воды - самая высокая из всех жидкостей. Для того, чтобы нагреть 1 г воды на один градус затрачивается 4, 2 Дж теплоты (1 кал). При этом удельная теплоёмкость льда и водяного пара вдвое ниже. Аномально высокими являются скрытые теплоты плавления и испарения воды. Для того, чтобы превратить 1 кг льда в пар надо затратить 3 000 к. Дж тепла – значительно больше, чем для другой жидкости.
 Свойства воды Диэлектрическая постоянная – самая высокая из всех жидкостей, составляет около 81, что предопределяет одну из особенностей водных растворов – явление электролитической диссоциации, Максимальная плотность – соответствует температуре 3, 98 град. С. При дальнейшкм охлаждении плотность воды снижается до 0, 99987 г/см 3, при нагревании до 30 град. Она составляет 0, 9957, до 50 – 0, 988, до 100 – 0, 958, до 250 – 0, 799. Чистый лёд имеет плотность 0, 918. Только вода (лёд) не тонет в собственном расплаве.
Свойства воды Диэлектрическая постоянная – самая высокая из всех жидкостей, составляет около 81, что предопределяет одну из особенностей водных растворов – явление электролитической диссоциации, Максимальная плотность – соответствует температуре 3, 98 град. С. При дальнейшкм охлаждении плотность воды снижается до 0, 99987 г/см 3, при нагревании до 30 град. Она составляет 0, 9957, до 50 – 0, 988, до 100 – 0, 958, до 250 – 0, 799. Чистый лёд имеет плотность 0, 918. Только вода (лёд) не тонет в собственном расплаве.
 Водородные связи форма ассоциации между электроотрицательным атомом и атомом водорода H, связанным ковалентно с другим электроотрицательным атомом. Одна молекула воды может образовать до четырёх классических водородных связей с соседями
Водородные связи форма ассоциации между электроотрицательным атомом и атомом водорода H, связанным ковалентно с другим электроотрицательным атомом. Одна молекула воды может образовать до четырёх классических водородных связей с соседями
 Структура воды(тетра эдрическая) и льда (гексагональная)
Структура воды(тетра эдрическая) и льда (гексагональная)
 Тетраэдрическая структура воды
Тетраэдрическая структура воды
 Гексагональная структура льда
Гексагональная структура льда
 Активация воды Процесс получения воды с осбыми свойствами при одновременном воздействии на воду высоких температур ( до 400 град С) и давлений (до 100 Мпа). В активированной воде было обнаружено резкое снижение энергии водородных связей. Активированная вода характеризуется: снижением р. Н, увеличением электропроводности, повышением растворяющей способности воды по отношению ко многим минералам (кальциту, кварцу, магнезиту, доломиту, гипсу и др. ), растворённые в активированной воде соединения значительно труднее выпадают в осадок, чем из неактивированной воды.
Активация воды Процесс получения воды с осбыми свойствами при одновременном воздействии на воду высоких температур ( до 400 град С) и давлений (до 100 Мпа). В активированной воде было обнаружено резкое снижение энергии водородных связей. Активированная вода характеризуется: снижением р. Н, увеличением электропроводности, повышением растворяющей способности воды по отношению ко многим минералам (кальциту, кварцу, магнезиту, доломиту, гипсу и др. ), растворённые в активированной воде соединения значительно труднее выпадают в осадок, чем из неактивированной воды.
 Талая вода Изменение свойств воды происходит в результате замерзания и последующего медленного оттаивания воды без перемешивания. Наблюдается : повышенная биологическая активность усиление роста растений усиление скорости роста животных бурному росту микроорганизмов в полярных морях у кромки плавающих льдов снижение холестерина в крови, ? Одной из гипотез, объясняющих свойства талой воды, является гипотеза о снижении в ней содержаний дейтерия.
Талая вода Изменение свойств воды происходит в результате замерзания и последующего медленного оттаивания воды без перемешивания. Наблюдается : повышенная биологическая активность усиление роста растений усиление скорости роста животных бурному росту микроорганизмов в полярных морях у кромки плавающих льдов снижение холестерина в крови, ? Одной из гипотез, объясняющих свойства талой воды, является гипотеза о снижении в ней содержаний дейтерия.
 Обработка воды электрическим полем ослабляет структурные связи. Так, после обработки воды переменным электрическим током на 11 -18% увеличивается скорость испарения. магнитным полем приводит к снижению накипи в паровых котлах, а также к увеличению скорости затвердевания и улучшения качества цемента.
Обработка воды электрическим полем ослабляет структурные связи. Так, после обработки воды переменным электрическим током на 11 -18% увеличивается скорость испарения. магнитным полем приводит к снижению накипи в паровых котлах, а также к увеличению скорости затвердевания и улучшения качества цемента.


 Круговорот природных вод. Потеря воды в космос Поступление воды из космоса Осадки Гидрологический оборот Испарени е Биологический круговорот Сток Океан Водоросли Отжатие ископаемых вод Геологический круговорот Поступление ювенильных вод Возврат воды в мантию
Круговорот природных вод. Потеря воды в космос Поступление воды из космоса Осадки Гидрологический оборот Испарени е Биологический круговорот Сток Океан Водоросли Отжатие ископаемых вод Геологический круговорот Поступление ювенильных вод Возврат воды в мантию
 Возобновление ресурсов вод Подземные воды n х (100 – 1 000)л Ледники полярные n х (8000 – 15 000)л Воды Мирового океана n х (2500 – 3000)л Бессточные озёра 200 – 300 л Проточные озёра несколько л Реки 11 -20 сут Пар атмосферы 8 сут Вода организмов несколько часов Чем медленнее водообмен, тем выше минерализация воды в элементе атмосферы
Возобновление ресурсов вод Подземные воды n х (100 – 1 000)л Ледники полярные n х (8000 – 15 000)л Воды Мирового океана n х (2500 – 3000)л Бессточные озёра 200 – 300 л Проточные озёра несколько л Реки 11 -20 сут Пар атмосферы 8 сут Вода организмов несколько часов Чем медленнее водообмен, тем выше минерализация воды в элементе атмосферы
 Источники растворённых веществ в гидросфере: : мантия (летучие компоненты магмы), литосфера (породы и минералы), биота (органическое вещество), атмосфера (осадки).
Источники растворённых веществ в гидросфере: : мантия (летучие компоненты магмы), литосфера (породы и минералы), биота (органическое вещество), атмосфера (осадки).
 Факторы формирования состава вод: Физико-географические (рельеф, гидрология, климат, выветривание, цементация) Геологические (геологическая структура, тектонические движения, тип пород, магматизм, газовый фактор) Физико-химические (химические свойства элементов, растворимость химических соединений, кислотнощелочные и окислительно-восстановительные условия) Физические (температура, давление, время и пространство) Биологические (влияние живого вещества, почвы, ландшафт) Искусственные (воздействие деятельности человека)
Факторы формирования состава вод: Физико-географические (рельеф, гидрология, климат, выветривание, цементация) Геологические (геологическая структура, тектонические движения, тип пород, магматизм, газовый фактор) Физико-химические (химические свойства элементов, растворимость химических соединений, кислотнощелочные и окислительно-восстановительные условия) Физические (температура, давление, время и пространство) Биологические (влияние живого вещества, почвы, ландшафт) Искусственные (воздействие деятельности человека)
 Факторы формирования состава вод: прямые факторы, непосредственно воздействующие на состав воды (горные породы так как растворяясь, они непосредственно обогащают воду ионами и химическими соединениями), косвенные, определяющие условия в которых происходит взаимодействие вещества с водой (тектонические движения, так как под их воздействием вода из одних пород отжимается в другие, где может изменять свой состав).
Факторы формирования состава вод: прямые факторы, непосредственно воздействующие на состав воды (горные породы так как растворяясь, они непосредственно обогащают воду ионами и химическими соединениями), косвенные, определяющие условия в которых происходит взаимодействие вещества с водой (тектонические движения, так как под их воздействием вода из одних пород отжимается в другие, где может изменять свой состав).
 Процессы формирования вод : Перенос вещества (фильтрация, молекулярная диффузия) Процессы переводящие вещество в раствор: – растворение (полное разрушение кристаллической решётки минералов и переход всех ионов в раствор) – выщелачивание (избирательное растворение отдельных минералов) Стимуляторами этих процессов являются процессы окисления. Например, окисление пирита: 2 Fe. S 2 +7 O 2 +2 H 2 O→ 2 Fe. SO 4 +2 H 2 SO 4 4 Fe. SO 4 +2 H 2 SO 4 +O 2 → 2 Fe(SO 4)2 +H 2 O Процессы, выводящие вещество из раствора: – кристаллизация (образование новых минеральных фаз). Примером может служить процесс галогенеза – сгущение солёных природных вод при испарении. – сорбция (поглощение растворённых веществ из ненасыщенных солями вод различного рода твёрдыми фазами или коллоидами). Адсорбция – поглощение поверхностью, абсорбция – всей массой.
Процессы формирования вод : Перенос вещества (фильтрация, молекулярная диффузия) Процессы переводящие вещество в раствор: – растворение (полное разрушение кристаллической решётки минералов и переход всех ионов в раствор) – выщелачивание (избирательное растворение отдельных минералов) Стимуляторами этих процессов являются процессы окисления. Например, окисление пирита: 2 Fe. S 2 +7 O 2 +2 H 2 O→ 2 Fe. SO 4 +2 H 2 SO 4 4 Fe. SO 4 +2 H 2 SO 4 +O 2 → 2 Fe(SO 4)2 +H 2 O Процессы, выводящие вещество из раствора: – кристаллизация (образование новых минеральных фаз). Примером может служить процесс галогенеза – сгущение солёных природных вод при испарении. – сорбция (поглощение растворённых веществ из ненасыщенных солями вод различного рода твёрдыми фазами или коллоидами). Адсорбция – поглощение поверхностью, абсорбция – всей массой.
 Процессы формирования вод : Процессы , сочетающие воспроизводство и поглощение растворённых веществ: – ионный обмен (поглощение одних ионов и замена на другие). – окислительно – восстановительные и биогеохимические реакции окисление : 4 Fe(HCO 3)2 +2 H 2 O+O 2 → 4 Fe(OH)3 +8 CO 2↑ восстановление : Na 2 SO 4 +2 Cорг +2 H 2 O→ 2 Na. HCO 3 +H 2 S↑ – радиоактивный распад (характерен для долгоживущих, радиоактивных элементов типа урана и тория). При распаде образуются радий, радон, альфа-частицы, электроны, нейтроны. Выделение радона (газ) из пород в воду или воздух называется эманированием. Процессы добавления и удаления молекул растворителя. Гидратация – присоединение твёрдой фазой молекул воды: ангидрит – гипс (Ca. SO 4 →Ca. SO 4 n. H 2 O). Дегидратация – обратный процесс, происходящий при повышении температуры и давления в системе
Процессы формирования вод : Процессы , сочетающие воспроизводство и поглощение растворённых веществ: – ионный обмен (поглощение одних ионов и замена на другие). – окислительно – восстановительные и биогеохимические реакции окисление : 4 Fe(HCO 3)2 +2 H 2 O+O 2 → 4 Fe(OH)3 +8 CO 2↑ восстановление : Na 2 SO 4 +2 Cорг +2 H 2 O→ 2 Na. HCO 3 +H 2 S↑ – радиоактивный распад (характерен для долгоживущих, радиоактивных элементов типа урана и тория). При распаде образуются радий, радон, альфа-частицы, электроны, нейтроны. Выделение радона (газ) из пород в воду или воздух называется эманированием. Процессы добавления и удаления молекул растворителя. Гидратация – присоединение твёрдой фазой молекул воды: ангидрит – гипс (Ca. SO 4 →Ca. SO 4 n. H 2 O). Дегидратация – обратный процесс, происходящий при повышении температуры и давления в системе
 Состав морской воды
Состав морской воды
 Состав морской воды Cl>SO 4>HCO 3 Na>Mg>Ca
Состав морской воды Cl>SO 4>HCO 3 Na>Mg>Ca
 Материковые воды 1. 2. 3. 4. 5. Подземные (почвенные, грунтовые, межпластовые/ артезианские) Поверхностные Реки-постоянные водные потоки на поверхности суши Озёра-водоёмы замедленного водообмена Болота-избыточно увлажнённые участки суши с влаголюбивой растительностью и слоем торфа более 0, 3 м Ледники-движущиеся массы льда, возникшие на суше в результате накопления и преобразования твёрдых атм. осадков Атм. воды – воды, входящие в состав атм. Воздуха в парообразном состоянии, в виде мелких капель, кристаллов льда
Материковые воды 1. 2. 3. 4. 5. Подземные (почвенные, грунтовые, межпластовые/ артезианские) Поверхностные Реки-постоянные водные потоки на поверхности суши Озёра-водоёмы замедленного водообмена Болота-избыточно увлажнённые участки суши с влаголюбивой растительностью и слоем торфа более 0, 3 м Ледники-движущиеся массы льда, возникшие на суше в результате накопления и преобразования твёрдых атм. осадков Атм. воды – воды, входящие в состав атм. Воздуха в парообразном состоянии, в виде мелких капель, кристаллов льда
 Средний состав пресных вод
Средний состав пресных вод
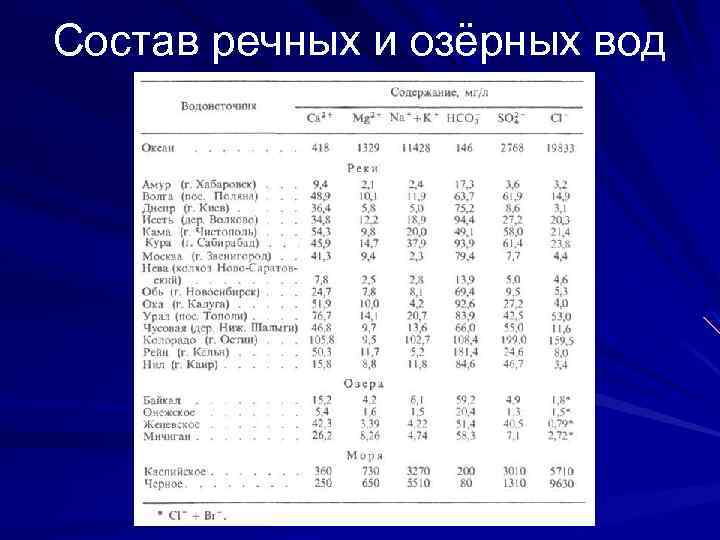 Состав речных и озёрных вод
Состав речных и озёрных вод
 Состав пресных вод Речных, озёрных, грунтовых Cl
Состав пресных вод Речных, озёрных, грунтовых Cl
 Хим. элементы пресных вод главные (диапазон концентраций 1, 01000 ч/млн) второстепенные (0, 01 -10, 0 ч/млн) малые (0, 00001 -0, 1 ч/млн) микрокомпоненты (не более 0, 001 ч/млн).
Хим. элементы пресных вод главные (диапазон концентраций 1, 01000 ч/млн) второстепенные (0, 01 -10, 0 ч/млн) малые (0, 00001 -0, 1 ч/млн) микрокомпоненты (не более 0, 001 ч/млн).
 Гидрохимическая зональность проявляется в закономерном изменении состава и минерализации подземных вод по площади и глубине. Гидрогеохимической зоной - называется часть гидрогеологического разреза, содержащая воды определённой минерализации и состава. Выделяются три зоны: пресных вод ( минерализация до 1 г/л), солёных вод ( минерализация от1 до 35 г/л), рассольных вод ( минерализация свыше 35 г/л). Различные сочетания гидрогеохимических зон в разрезе образуют гидрогеохимический пояс, который может быть одно-, двух-, трёхзональным и более. Если обозначить зону пресных вод буквой А, солёных – Б, рассольных – В, то сочетания этих зон в разрезе и соответственно гидрогеохимические пояса могут быть, например, такими: А, АБ, БВ, АБАБВ и др.
Гидрохимическая зональность проявляется в закономерном изменении состава и минерализации подземных вод по площади и глубине. Гидрогеохимической зоной - называется часть гидрогеологического разреза, содержащая воды определённой минерализации и состава. Выделяются три зоны: пресных вод ( минерализация до 1 г/л), солёных вод ( минерализация от1 до 35 г/л), рассольных вод ( минерализация свыше 35 г/л). Различные сочетания гидрогеохимических зон в разрезе образуют гидрогеохимический пояс, который может быть одно-, двух-, трёхзональным и более. Если обозначить зону пресных вод буквой А, солёных – Б, рассольных – В, то сочетания этих зон в разрезе и соответственно гидрогеохимические пояса могут быть, например, такими: А, АБ, БВ, АБАБВ и др.
 Горизонтальная (географическая, широтная) зональность – прослеживается от широты к широте, от полюсов к экватору. Происходит смена состава вод с севера на юг, приведённая на следующей схеме:
Горизонтальная (географическая, широтная) зональность – прослеживается от широты к широте, от полюсов к экватору. Происходит смена состава вод с севера на юг, приведённая на следующей схеме:
 Горизонтальная (географическая, широтная) зональность
Горизонтальная (географическая, широтная) зональность
 Сточными водами называются воды, использованные на бытовые, производственные или другие нужды и загрязненные при этом дополнительными примесями, изменившими их первоначальный химический состав и физические свойства, а также воды, стекающие с территории населенных пунктов и промышленных предприятий в результате выпадения атмосферных осадков или поливки улиц.
Сточными водами называются воды, использованные на бытовые, производственные или другие нужды и загрязненные при этом дополнительными примесями, изменившими их первоначальный химический состав и физические свойства, а также воды, стекающие с территории населенных пунктов и промышленных предприятий в результате выпадения атмосферных осадков или поливки улиц.
 Классификация сточных вод бытовые (хозяйственно-фекальные), производственные (промышленные) дождевые (атмосферные).
Классификация сточных вод бытовые (хозяйственно-фекальные), производственные (промышленные) дождевые (атмосферные).
 Городские сточные воды - это смесь бытовых сточных вод жилых и общественных зданий и промышленных предприятий, а также производственных сточных вод коммунально-бытового обслуживания, общественного питания, местной и пищевой промышленности
Городские сточные воды - это смесь бытовых сточных вод жилых и общественных зданий и промышленных предприятий, а также производственных сточных вод коммунально-бытового обслуживания, общественного питания, местной и пищевой промышленности
 Дождевые воды образуются в результате выпадения атмосферных осадков. Их подразделяют на дождевые и талые, получающиеся от таяния льда и снега. Отличительной особенностью дождевого стока являются его эпизодичность и резкая неравномерность. Воды от мытья и поливки улиц, а также от фонтанов и дренажей по качественной характеристике загрязняющих примесей близки к дождевым водам и удаляются совместно с ними.
Дождевые воды образуются в результате выпадения атмосферных осадков. Их подразделяют на дождевые и талые, получающиеся от таяния льда и снега. Отличительной особенностью дождевого стока являются его эпизодичность и резкая неравномерность. Воды от мытья и поливки улиц, а также от фонтанов и дренажей по качественной характеристике загрязняющих примесей близки к дождевым водам и удаляются совместно с ними.
 Дождевые воды Для городов европейской части России расход дождевого стока в среднем один раз в году может достигать 100 -150 л/с с 1 га, а один раз в 10 лет - 200 -300 л/с с 1 га. Вместе с тем суммарный за весь год дождевой сток с застроенных территорий не превышает 1500 - 2000 м 3 с 1 га.
Дождевые воды Для городов европейской части России расход дождевого стока в среднем один раз в году может достигать 100 -150 л/с с 1 га, а один раз в 10 лет - 200 -300 л/с с 1 га. Вместе с тем суммарный за весь год дождевой сток с застроенных территорий не превышает 1500 - 2000 м 3 с 1 га.
 Бытовые воды максимальный расход бытовых вод с 1 га жилой застройки города в зависимости от плотности населения колеблется от 0, 5 до 2 л/с, или 10000 -25000 м 3/год. в средних условиях европейской территории России за год дождевых вод стекает в 7 -15 раз меньше, чем бытовых, но максимальные секундные расходы дождевых вод в 50 -150 раз больше, чем расходы бытовых вод.
Бытовые воды максимальный расход бытовых вод с 1 га жилой застройки города в зависимости от плотности населения колеблется от 0, 5 до 2 л/с, или 10000 -25000 м 3/год. в средних условиях европейской территории России за год дождевых вод стекает в 7 -15 раз меньше, чем бытовых, но максимальные секундные расходы дождевых вод в 50 -150 раз больше, чем расходы бытовых вод.
 Состав сточных вод Сточные воды загрязнены всевозможными примесями органического и минерального происхождения, которые могут находиться в них в виде раствора, коллоидов, суспензии и нерастворимых веществ. Степень загрязнения сточных вод оценивается концентрацией, т. е. массой примесей в единице объема в мг/л или г/м 3
Состав сточных вод Сточные воды загрязнены всевозможными примесями органического и минерального происхождения, которые могут находиться в них в виде раствора, коллоидов, суспензии и нерастворимых веществ. Степень загрязнения сточных вод оценивается концентрацией, т. е. массой примесей в единице объема в мг/л или г/м 3
 Состав сточных вод Бытовые сточные воды кроме органических и минеральных примесей содержат биологические примеси, состоящие из бактерий, в том числе и болезнетворных, а поэтому они потенциально опасны. Производственные сточные воды загрязнены в основном отходами производства, иногда представляющими определенную ценность.
Состав сточных вод Бытовые сточные воды кроме органических и минеральных примесей содержат биологические примеси, состоящие из бактерий, в том числе и болезнетворных, а поэтому они потенциально опасны. Производственные сточные воды загрязнены в основном отходами производства, иногда представляющими определенную ценность.


