06 - Молекулы-3.pptx
- Количество слайдов: 74

РАСПРЕДЕЛЕНИЕ ПЛОТНОСТИ ЭЛЕКТРОННОГО ОБЛАКА В МОЛЕКУЛАХ
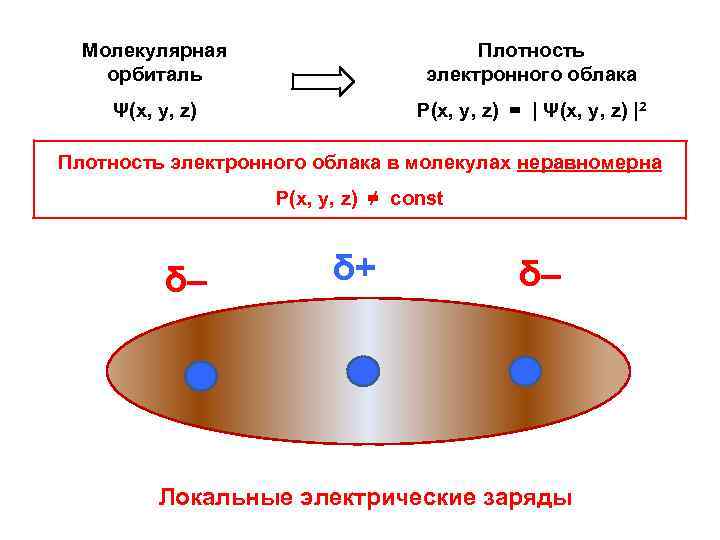
Молекулярная орбиталь Плотность электронного облака Ψ(x, y, z) Р(x, y, z) = | Ψ(x, y, z) |2 Плотность электронного облака в молекулах неравномерна Р(x, y, z) ≠ const δ– δ+ δ– Локальные электрические заряды
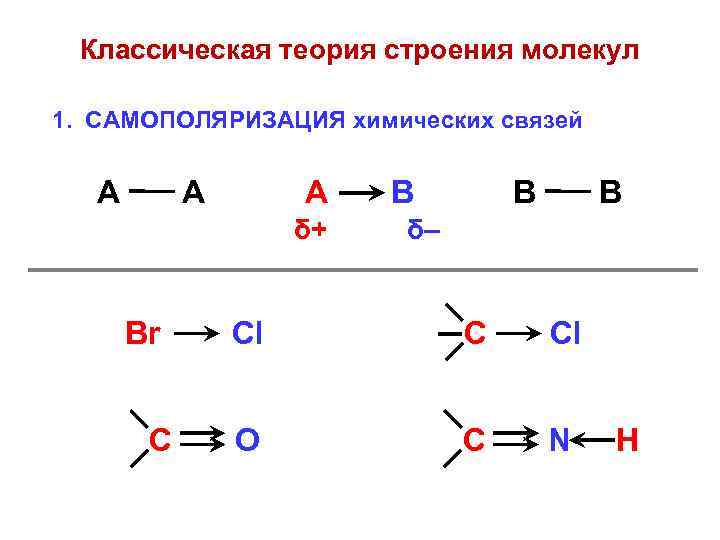
Классическая теория строения молекул 1. САМОПОЛЯРИЗАЦИЯ химических связей А А А δ+ Br C В В В δ– Cl C Cl O C N H
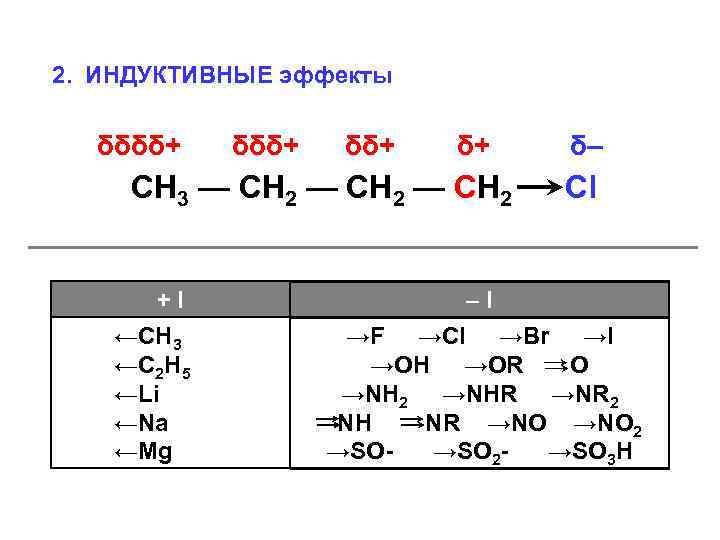
2. ИНДУКТИВНЫЕ эффекты δδδδ+ δδ+ δ+ СН 3 — СН 2 +I ←СН 3 ←С 2 Н 5 ←Li ←Na ←Mg δ– Cl –I →F →Cl →Br →I →OH →OR O →NH 2 →NHR →NR 2 NH NR →NO 2 →SO→SO 2→SO 3 H
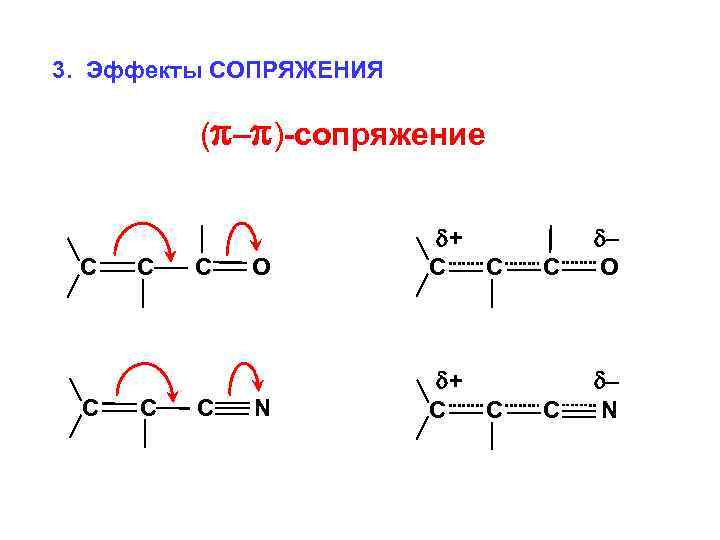
3. Эффекты СОПРЯЖЕНИЯ ( – )-сопряжение С С С О + С С N + С С С – О С – N
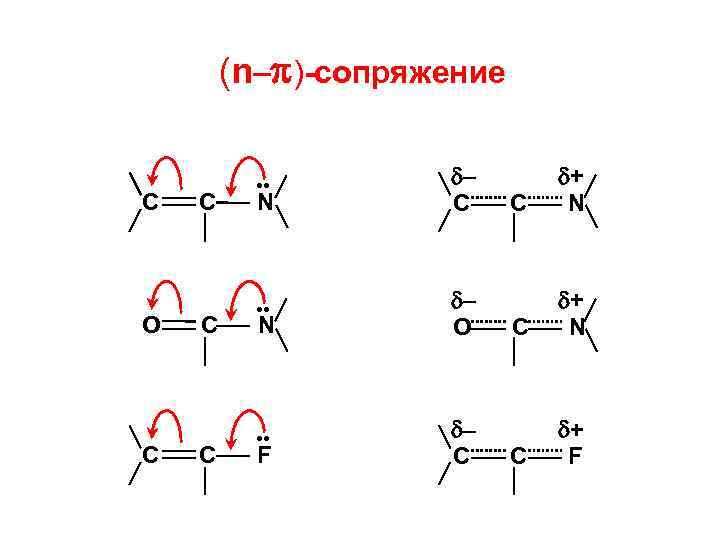
(n– )-сопряжение С O С С • • – O • • – С N N F С + N С + F
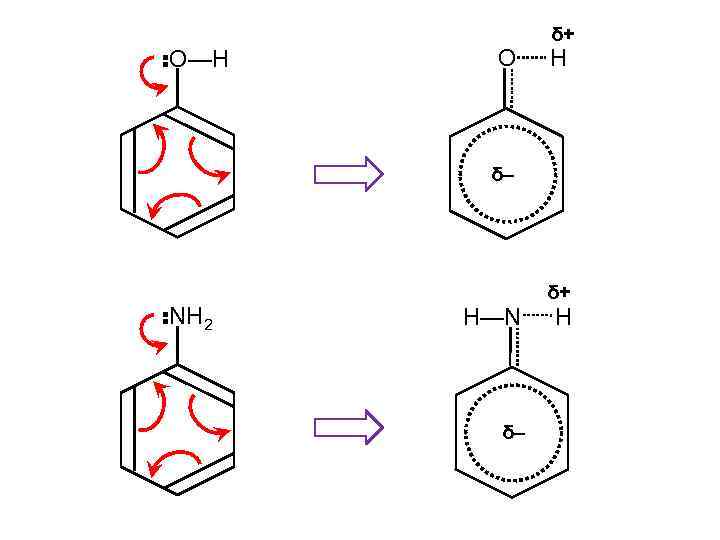
: О—Н О δ+ Н δ– : NН 2 δ+ Н—N δ– Н
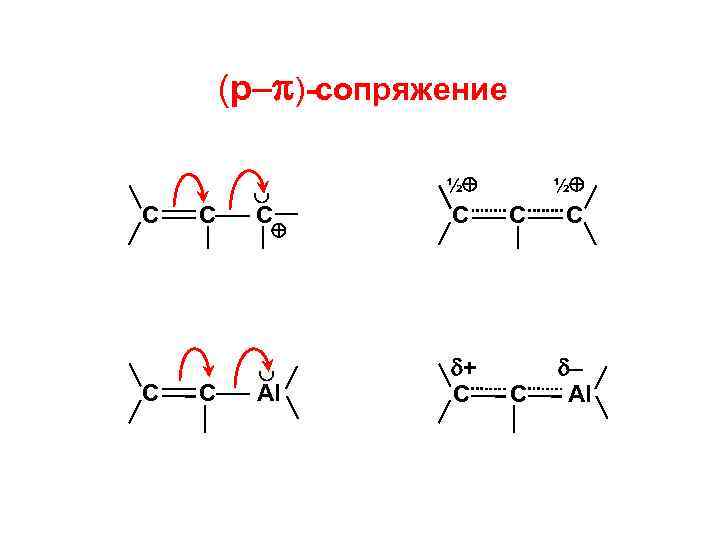
(p– )-сопряжение С C С С ½ С С + C Al ½ С С С – Al
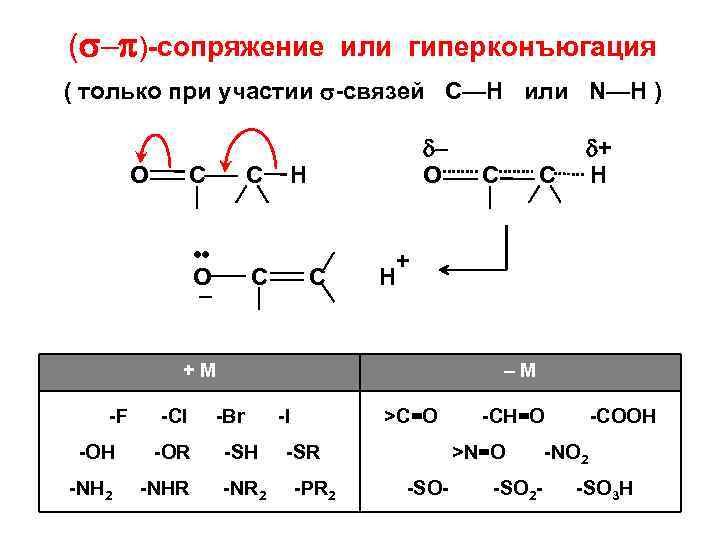
( – )-сопряжение или гиперконъюгация ( только при участии -связей С—Н или N—H ) О С С • • О – – О H С С -Cl -OH -OR -NH 2 -NHR С + H +М -F С + H –М -Br -SH -NR 2 -I >C=O -SR -PR 2 -CH=O >N=O -SO- -SO 2 - -COOH -NO 2 -SO 3 H
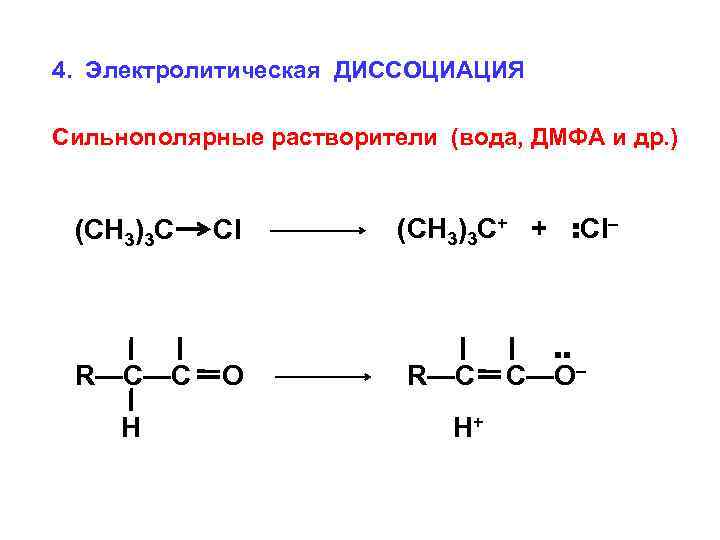
4. Электролитическая ДИССОЦИАЦИЯ Сильнополярные растворители (вода, ДМФА и др. ) Cl R—C—C O H (CH 3)3 C+ + : Cl– R—C H+ : (CH 3)3 C C—O–
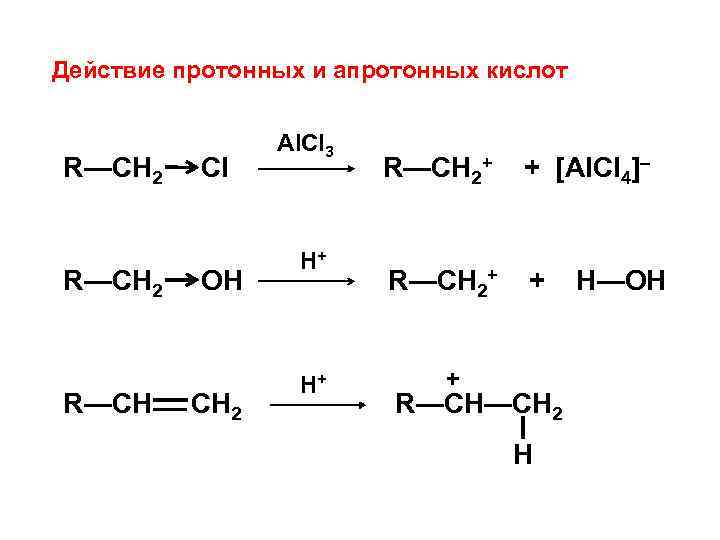
Действие протонных и апротонных кислот R—CH 2 R—CH Cl OH CH 2 Al. Cl 3 H+ H+ R—CH 2+ + [Al. Cl 4]– R—CH 2+ + + R—CH—CH 2 H H—OH
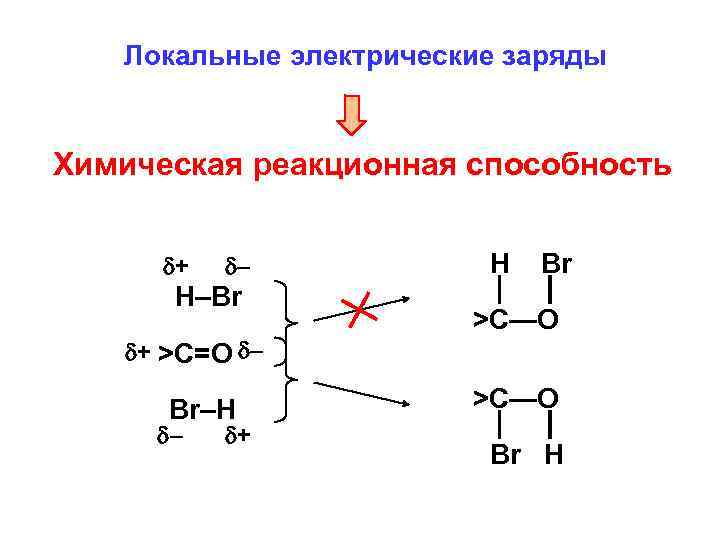
Локальные электрические заряды Химическая реакционная способность + – H–Br + >C=O – Br–H – + H Br >C—O Br H
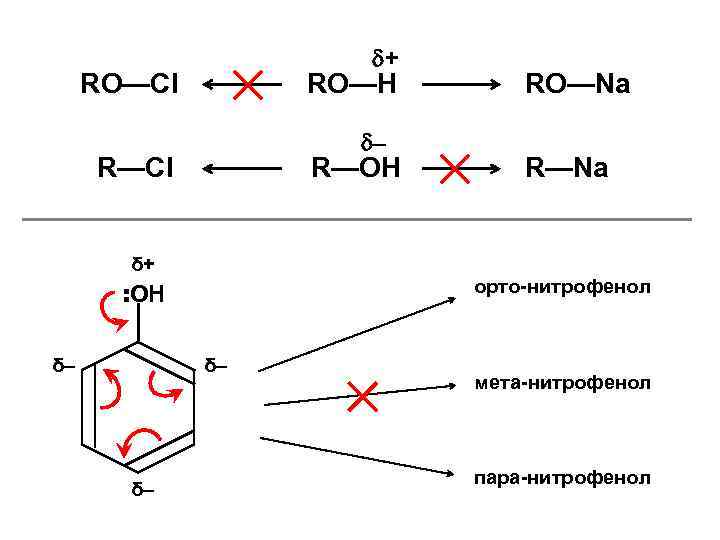
+ RO—Cl RO—H – R—Cl R—OH RO—Na R—Na δ+ орто-нитрофенол : OH δ– δ– δ– мета-нитрофенол пара-нитрофенол
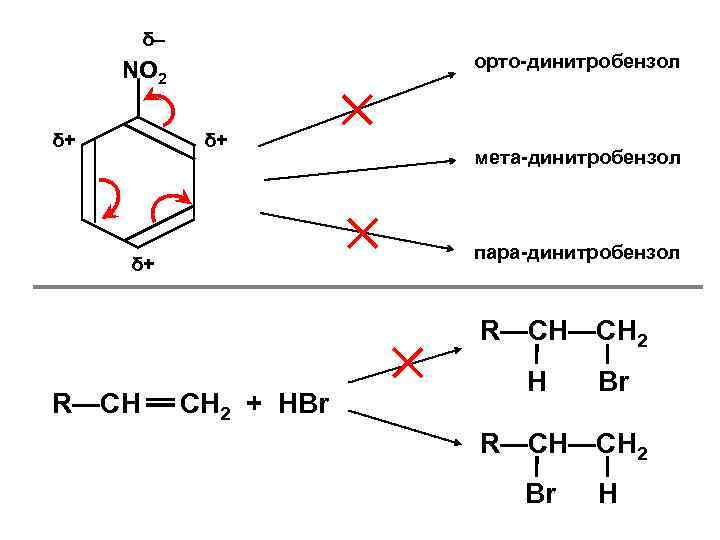
δ– орто-динитробензол NO 2 δ+ δ+ мета-динитробензол пара-динитробензол δ+ R—CH—CH 2 R—CH CH 2 + HBr H Br R—CH—CH 2 Br H
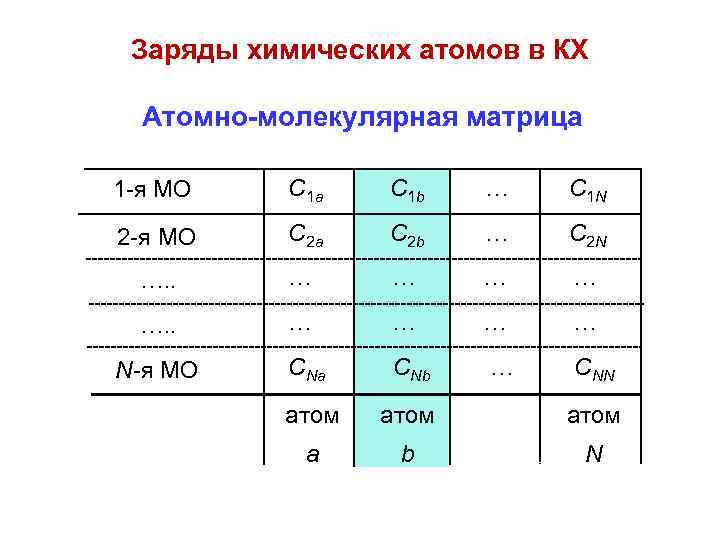
Заряды химических атомов в КХ Атомно-молекулярная матрица 1 -я МО C 1 a C 1 b … C 1 N 2 -я МО C 2 a C 2 b … C 2 N …. . … … … … N-я МО CNa CNb атом а b N … CNN

(Сik)2 = Рik ( вероятность нахождения электрона с номером i в окрестности атома с номером k, или, другими словами, электронная плотность на атоме с номером k, создаваемая электроном с номером i ) (Сik)2 = Nk i (электронная плотность на атоме с номером k, создаваемая всеми электронами молекулы или среднее число электронов, принадлежащих этому атому ) Nk = –Qk (электрический заряд той доли электронной оболочки, которая входит в состав атома с номером k )
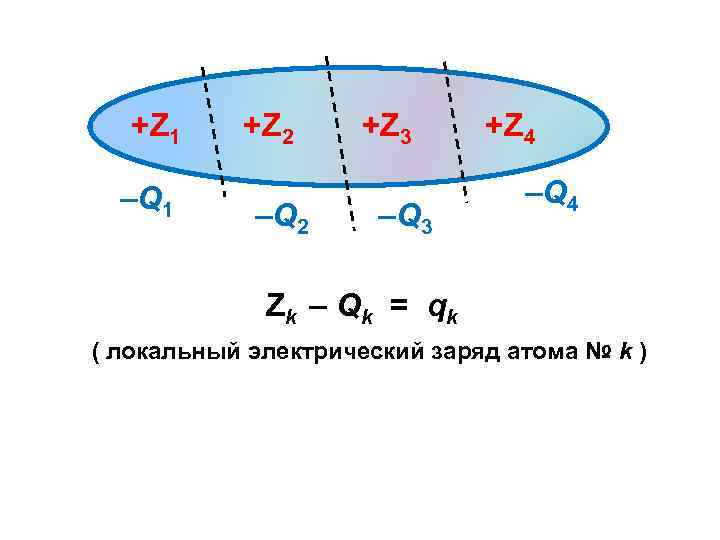
+Z 1 –Q 1 +Z 2 –Q 2 +Z 3 –Q 3 +Z 4 –Q 4 Zk – Q k = qk ( локальный электрический заряд атома № k )
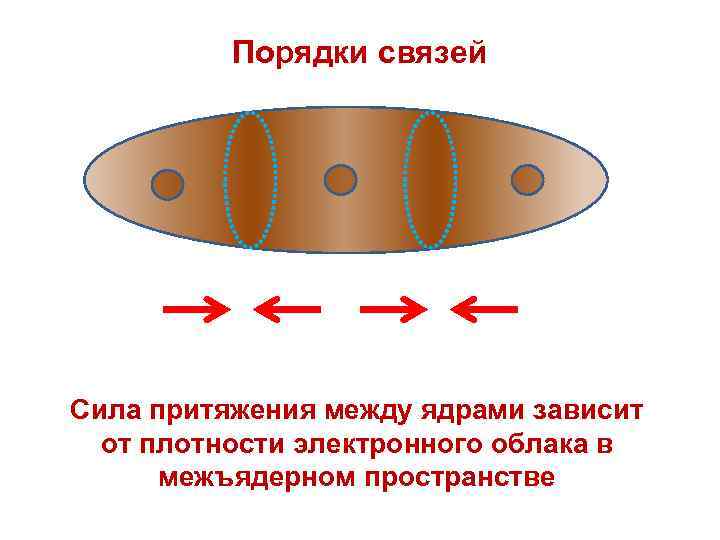
Порядки связей Сила притяжения между ядрами зависит от плотности электронного облака в межъядерном пространстве
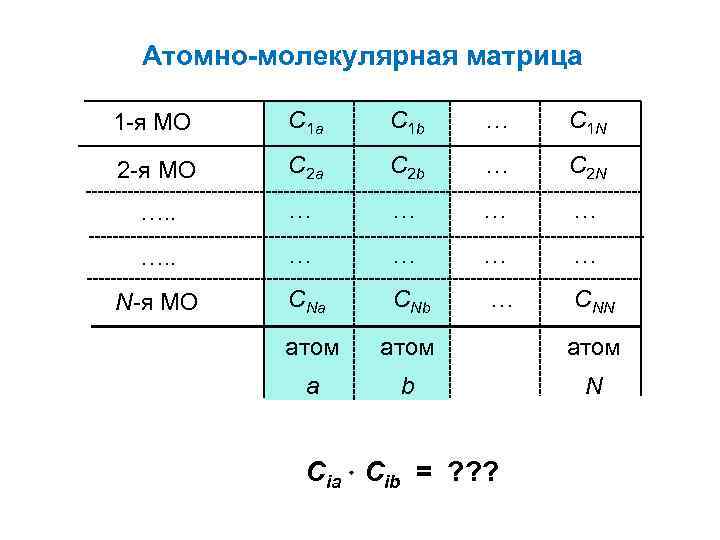
Атомно-молекулярная матрица 1 -я МО C 1 a C 1 b … C 1 N 2 -я МО C 2 a C 2 b … C 2 N …. . … … … … N-я МО CNa CNb атом а b N … Cia Cib = ? ? ? CNN
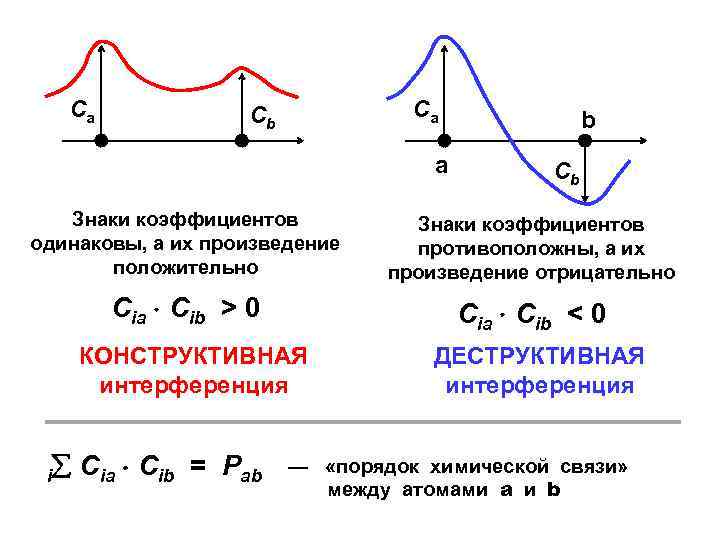
Ca Ca Cb a b Cb Знаки коэффициентов одинаковы, а их произведение положительно Знаки коэффициентов противоположны, а их произведение отрицательно Cia Cib > 0 Cia Cib < 0 КОНСТРУКТИВНАЯ интерференция i Cia Cib = Pab ДЕСТРУКТИВНАЯ интерференция — «порядок химической связи» между атомами a и b

PQ-матрицы Матрица Коулсона K (РQ)nm = ( Cin Cim ) i = Nn при n = m Pnm при n m Матрица Малликена М (РQ)nm = (1 + Snm) i Cin Cim ————— 1 – Ti Snm (Ti — собственные значения "топологической" матрицы) Суммирование следует проводить по всем заселенным спин-орбиталям

1 2 H—O—H 3 T = 0 0 1 1 1 0 T = – 2, 0, + 2 Элемент топологической матрицы Tij равен: 1 (при наличии связи между атомами i и j ) 0 (при отсутствии связи). –T 0 1 0 –T 1 1 1 –T = 0 –T 3 + 2 T = T(T 2 – 2) = 0
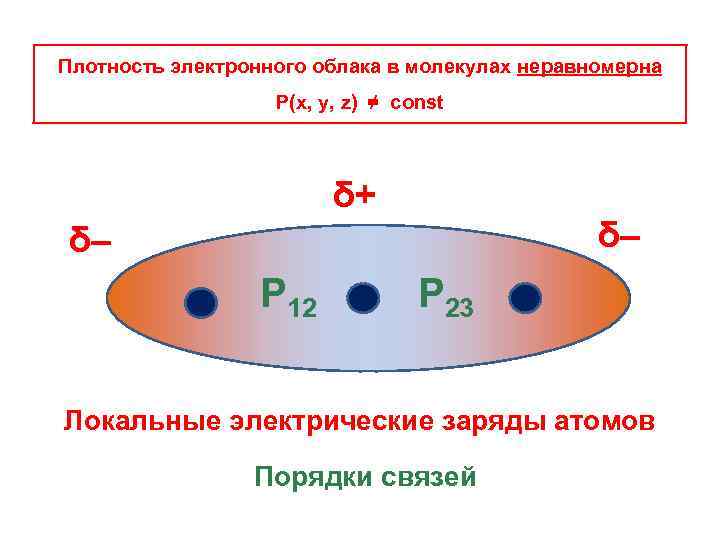
Плотность электронного облака в молекулах неравномерна Р(x, y, z) ≠ const δ+ δ– δ– Р 12 Р 23 Локальные электрические заряды атомов Порядки связей
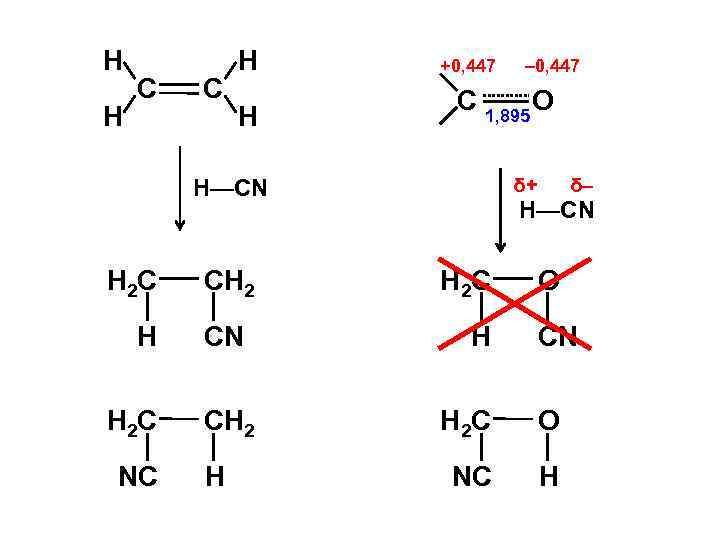
Н Н С С Н Н +0, 447 C 1, 895 O δ+ H—CN H 2 С H H 2 С NC СH 2 CN СH 2 H – 0, 447 δ– H—CN H 2 С H O CN H 2 С O NC H
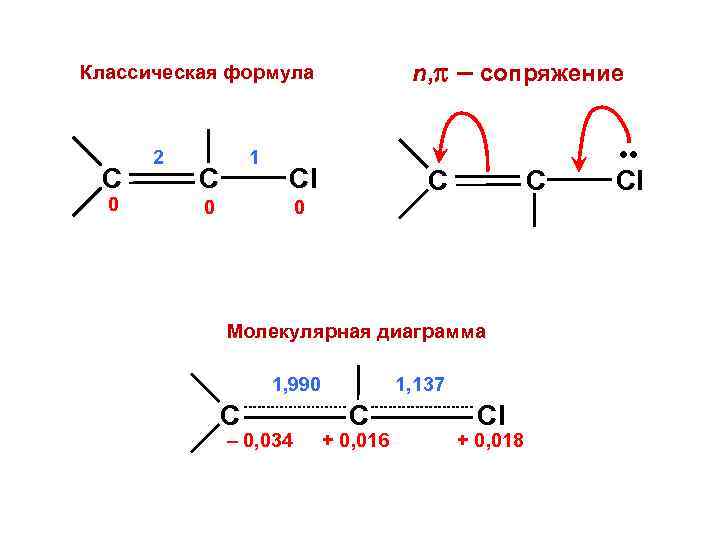
n, – сопряжение Классическая формула C 0 2 1 C Cl 0 C Молекулярная диаграмма 1, 990 C – 0, 034 1, 137 C + 0, 016 Cl + 0, 018 • • Cl
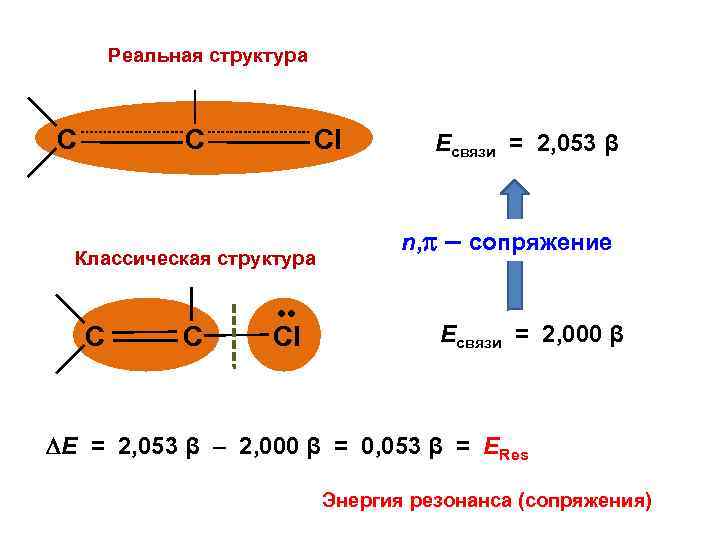
Реальная структура C C Cl Классическая структура C C • • Cl Есвязи = 2, 053 β n, – сопряжение Есвязи = 2, 000 β Е = 2, 053 β – 2, 000 β = 0, 053 β = ЕRes Энергия резонанса (сопряжения)
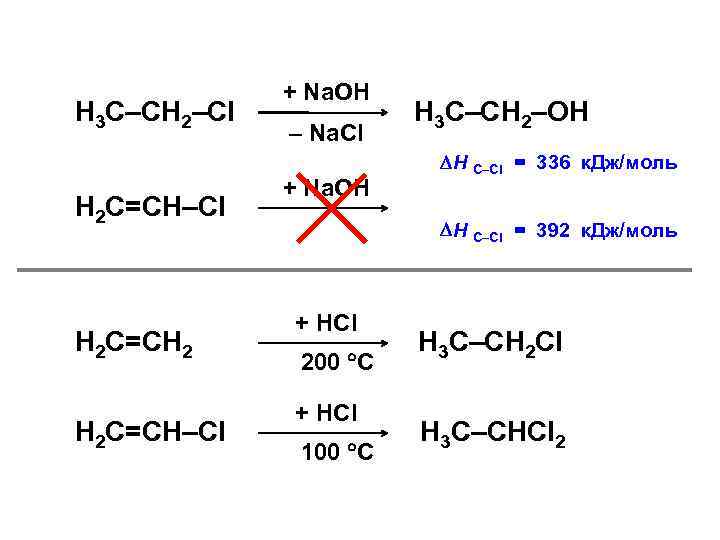
Н 3 С–СН 2–Cl Н 2 С=СН 2 Н 2 С=СН–Cl + Na. OH – Na. Cl + Na. OH Н 3 С–СН 2–OH Н С–Cl = 336 к. Дж/моль Н С–Cl = 392 к. Дж/моль + HCl 200 C + HCl 100 C Н 3 С–СН 2 Cl Н 3 С–СНCl 2

05. 11. 2014
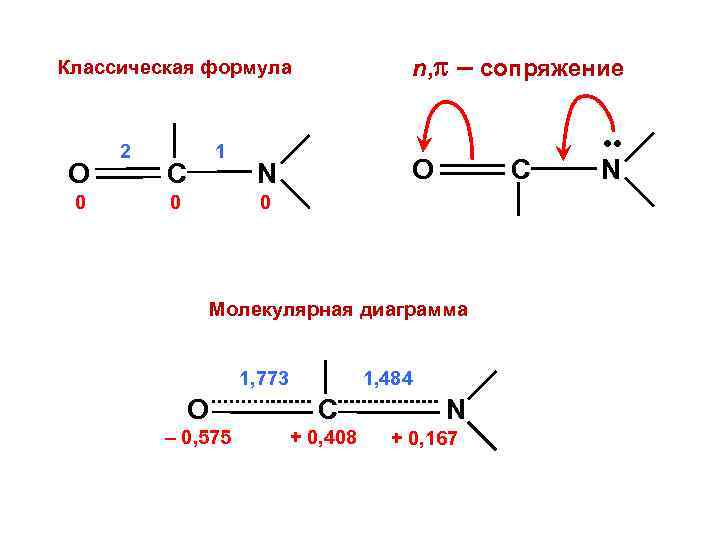
n, – сопряжение Классическая формула O 0 2 1 C 0 O N C 0 Молекулярная диаграмма 1, 773 1, 484 O C – 0, 575 + 0, 408 N + 0, 167 • • N
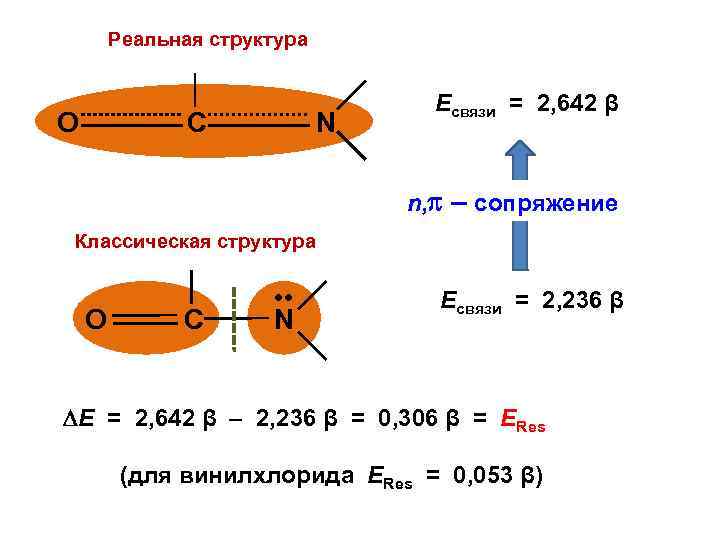
Реальная структура О C N Есвязи = 2, 642 β n, – сопряжение Классическая структура O C • • N Есвязи = 2, 236 β Е = 2, 642 β – 2, 236 β = 0, 306 β = ЕRes (для винилхлорида ЕRes = 0, 053 β)
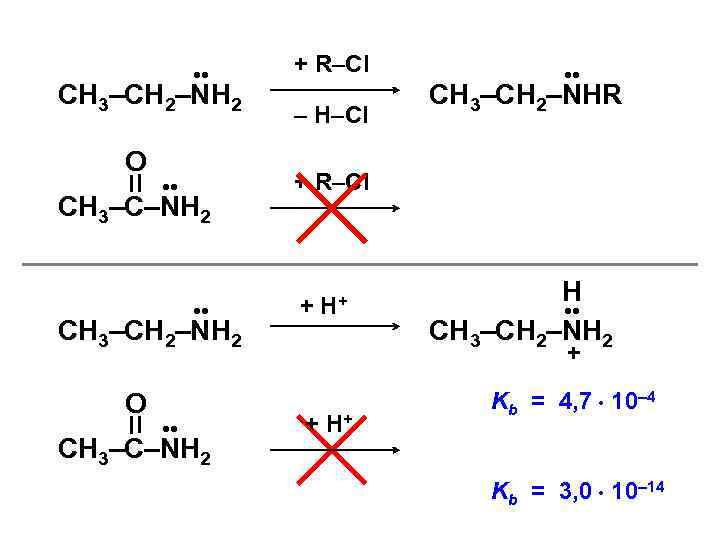
• • СН 3–СН 2–NH 2 O • • СН 3–С–NH 2 + R–Cl – H–Cl • • СН 3–СН 2–NHR + R–Cl + H+ Н • • СН 3–СН 2–NH 2 + + H+ Kb = 4, 7 10– 4 Kb = 3, 0 10– 14
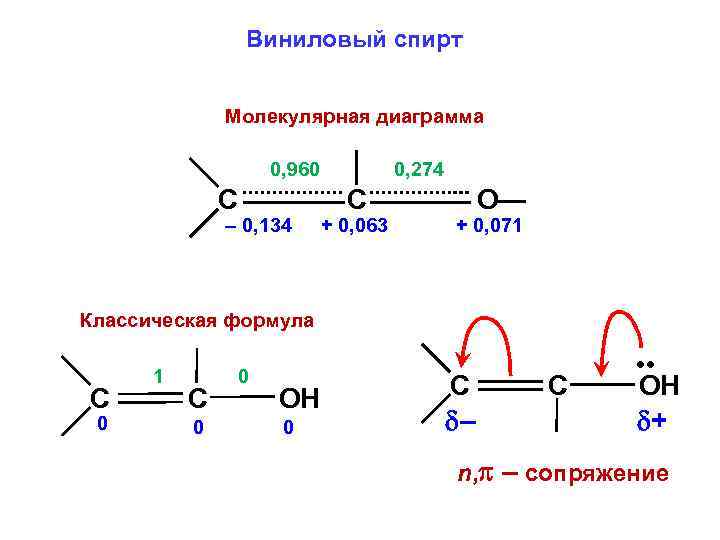
Виниловый спирт Молекулярная диаграмма 0, 960 C – 0, 134 0, 274 C + 0, 063 О— + 0, 071 Классическая формула C 0 1 C 0 0 ОН 0 C – C • • ОН + n, – сопряжение
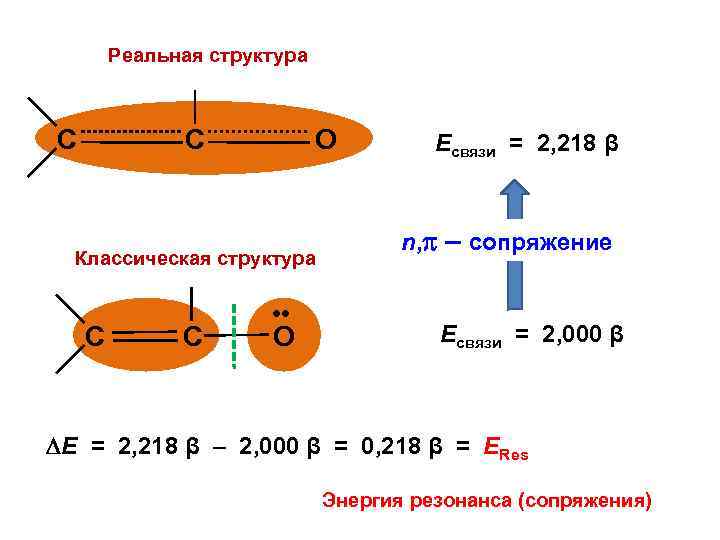
Реальная структура C C О Классическая структура C C • • О Есвязи = 2, 218 β n, – сопряжение Есвязи = 2, 000 β Е = 2, 218 β – 2, 000 β = 0, 218 β = ЕRes Энергия резонанса (сопряжения)
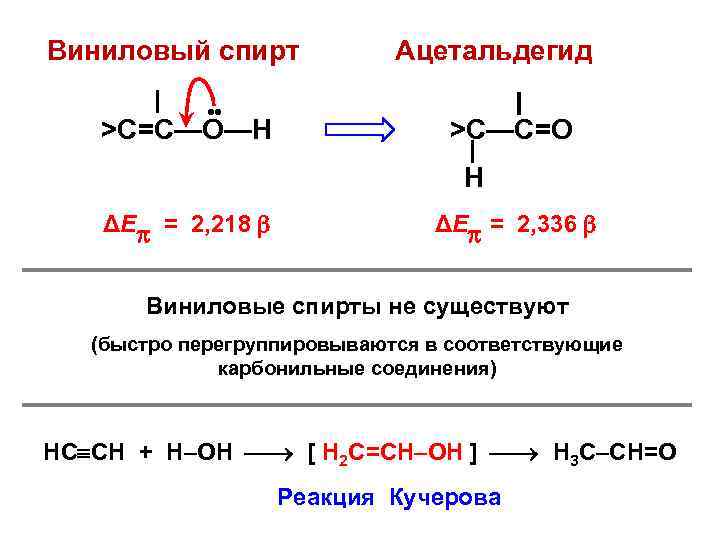
Виниловый спирт • • >C=C—О—Н Ацетальдегид >C—C=О Н ΔЕ = 2, 218 ΔЕ = 2, 336 Виниловые спирты не существуют (быстро перегруппировываются в соответствующие карбонильные соединения) НС СН + Н–ОН [ Н 2 С=СН–ОН ] Н 3 С–СН=О Реакция Кучерова
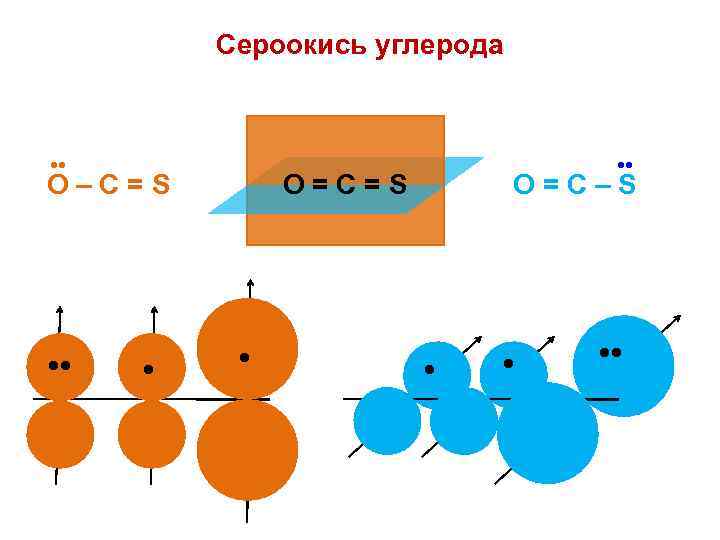
Сероокись углерода • • O=С=S O–С=S • • • O=С–S • • • •
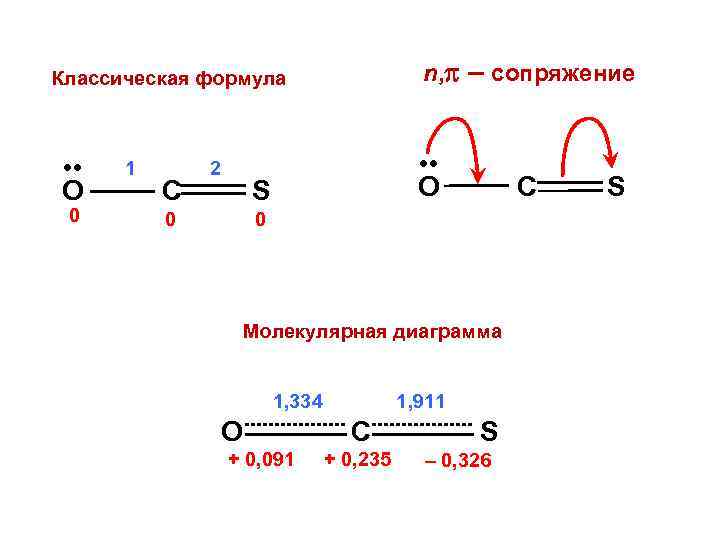
n, – сопряжение Классическая формула • • O 0 1 C 2 • • O S 0 C 0 Молекулярная диаграмма 1, 334 O + 0, 091 1, 911 C + 0, 235 S – 0, 326 S
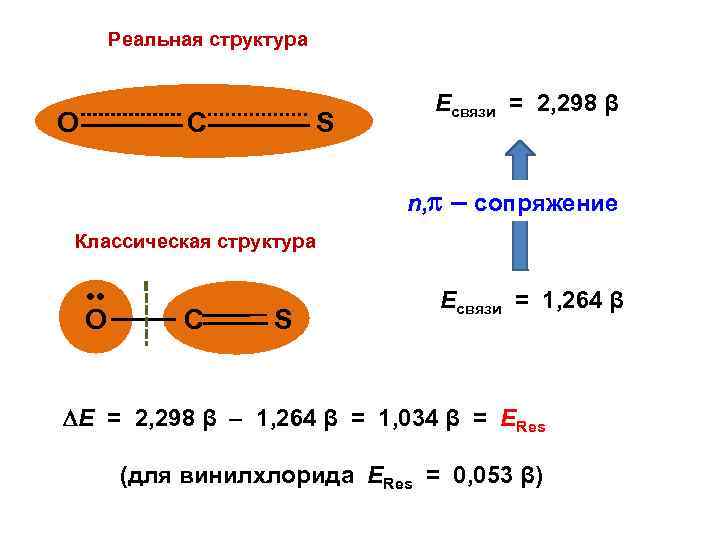
Реальная структура О C S Есвязи = 2, 298 β n, – сопряжение Классическая структура • • O C S Есвязи = 1, 264 β Е = 2, 298 β – 1, 264 β = 1, 034 β = ЕRes (для винилхлорида ЕRes = 0, 053 β)
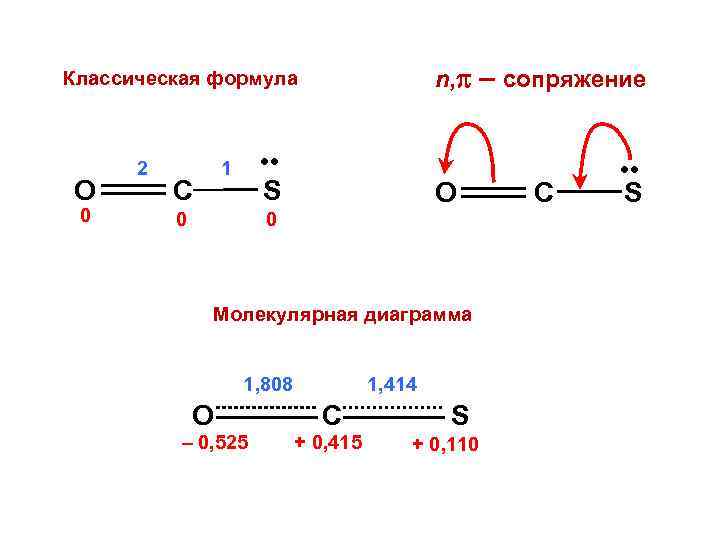
n, – сопряжение Классическая формула O 0 2 • • S 1 C 0 O 0 Молекулярная диаграмма 1, 808 O – 0, 525 1, 414 C + 0, 415 S + 0, 110 C • • S
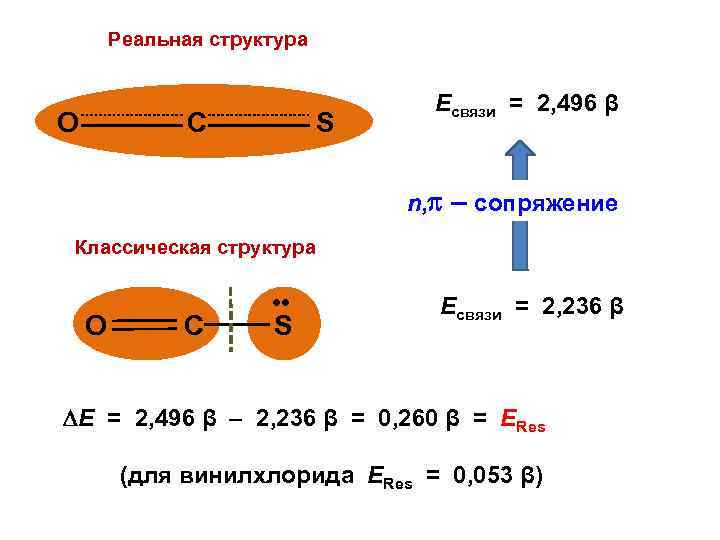
Реальная структура О C S Есвязи = 2, 496 β n, – сопряжение Классическая структура O C • • S Есвязи = 2, 236 β Е = 2, 496 β – 2, 236 β = 0, 260 β = ЕRes (для винилхлорида ЕRes = 0, 053 β)

• • O–С=S 0, 334 O=С–S 0, 911 O C + 0, 091 + 0, 235 0, 808 S – 0, 326 Реальная структура 1, 142 O 0, 414 C – 0, 525 + 0, 415 S + 0, 110 Классическая структура 1, 325 O C S – 0, 434 + 0, 650 – 0, 216 • • 1, 000 O 0 ЕRes = 1, 034 β + 0, 260 β = 1, 294 β 1, 000 C 0 • • S 0 ( 84 к. Дж/моль)
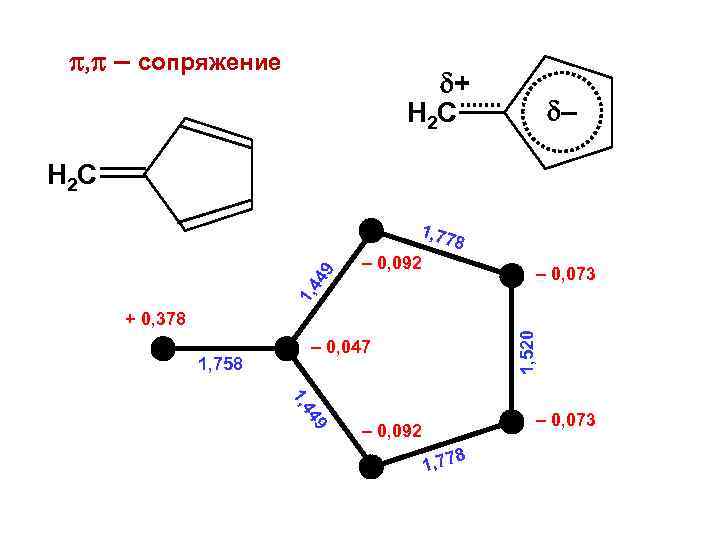
, – сопряжение + H 2 C – H 2 C 8 – 0, 092 – 0, 073 1, 4 49 1, 77 1, 758 1, 520 + 0, 378 – 0, 047 44 1, 9 – 0, 073 – 0, 092 8 1, 77
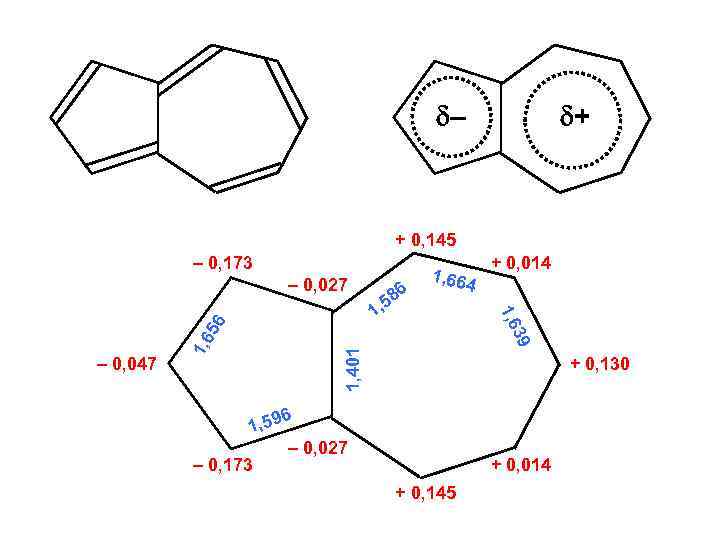
– + + 0, 145 – 0, 173 1, 401 1, 6 – 0, 047 86 , 5 1 + 0, 014 39 1, 6 56 – 0, 027 1, 664 + 0, 130 6 1, 59 – 0, 027 – 0, 173 + 0, 014 + 0, 145
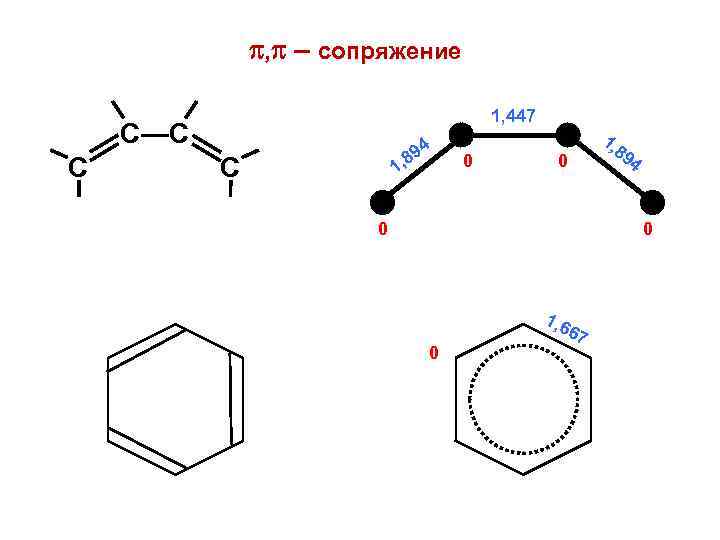
, – сопряжение 1, 447 С—С С 94 8 1, С 0 0 0 1, 89 4 0 1, 6 0 67
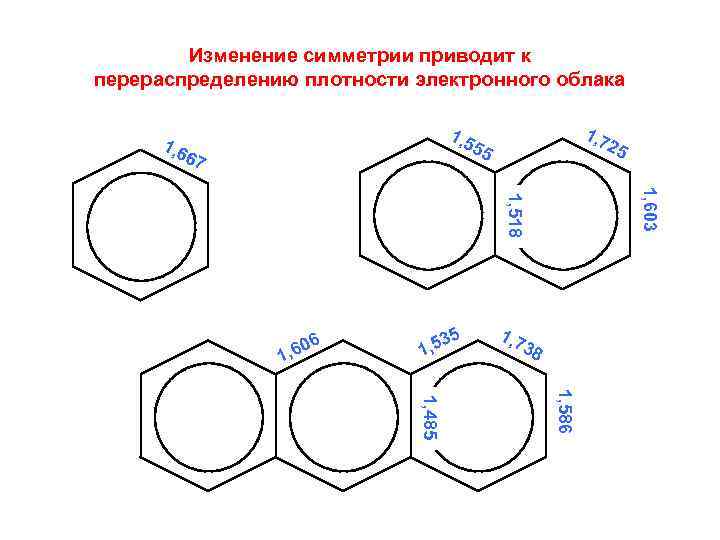
Изменение симметрии приводит к перераспределению плотности электронного облака 1, 7 1, 5 55 1, 6 67 1, 603 1, 518 1 6 , 60 5 3 1, 5 1, 7 25 38 1, 586 1, 485
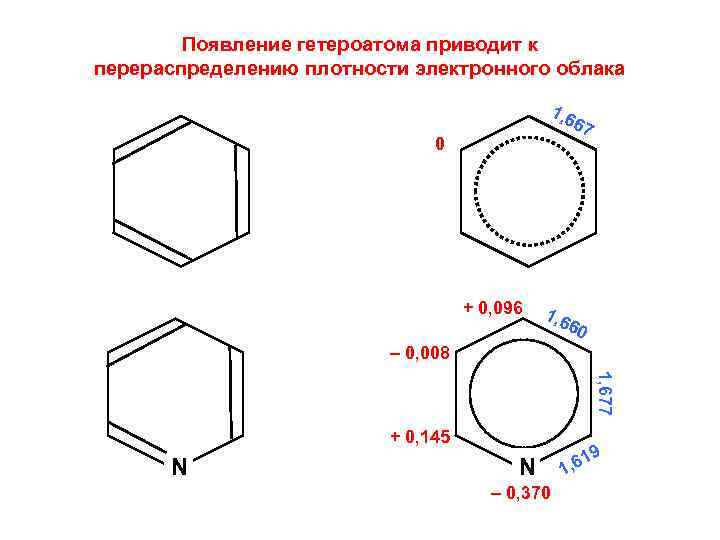
Появление гетероатома приводит к перераспределению плотности электронного облака 1, 6 67 0 + 0, 096 1, 6 60 – 0, 008 1, 677 + 0, 145 N N – 0, 370 9 1 1, 6
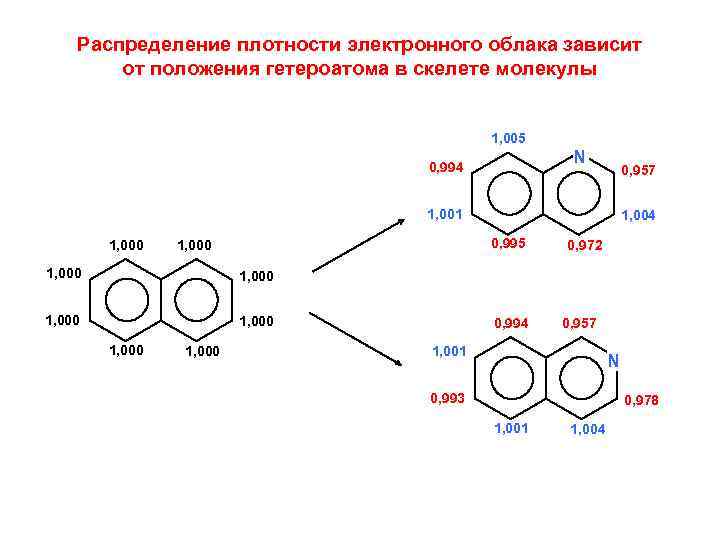
Распределение плотности электронного облака зависит от положения гетероатома в скелете молекулы 1, 005 N 0, 994 0, 957 1, 001 1, 000 1, 004 0, 995 1, 000 1, 000 0, 972 1, 000 0, 994 0, 957 1, 001 N 0, 993 0, 978 1, 001 1, 004
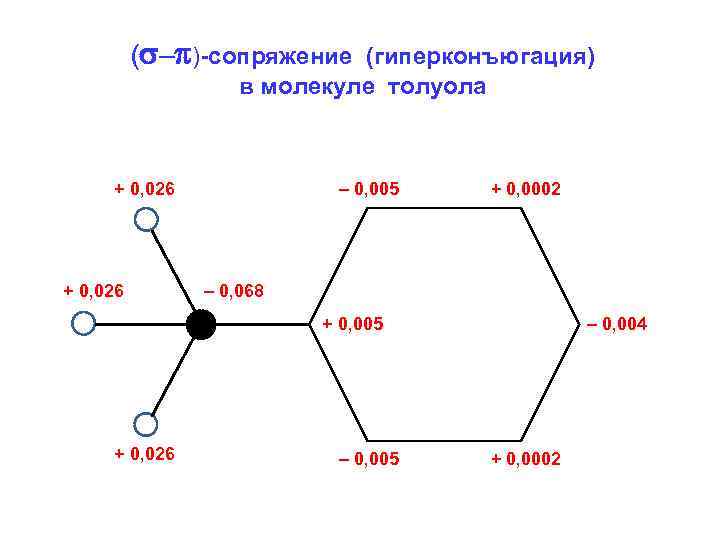
( – )-сопряжение (гиперконъюгация) в молекуле толуола + 0, 026 – 0, 005 + 0, 0002 – 0, 068 + 0, 005 + 0, 026 – 0, 005 – 0, 004 + 0, 0002
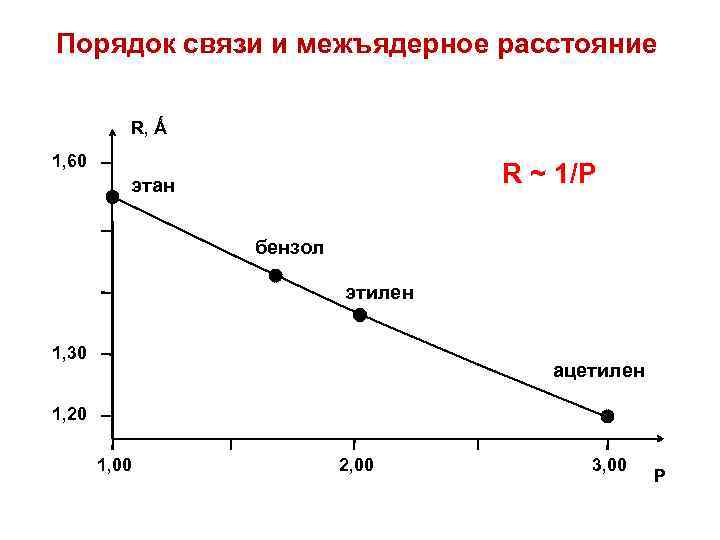
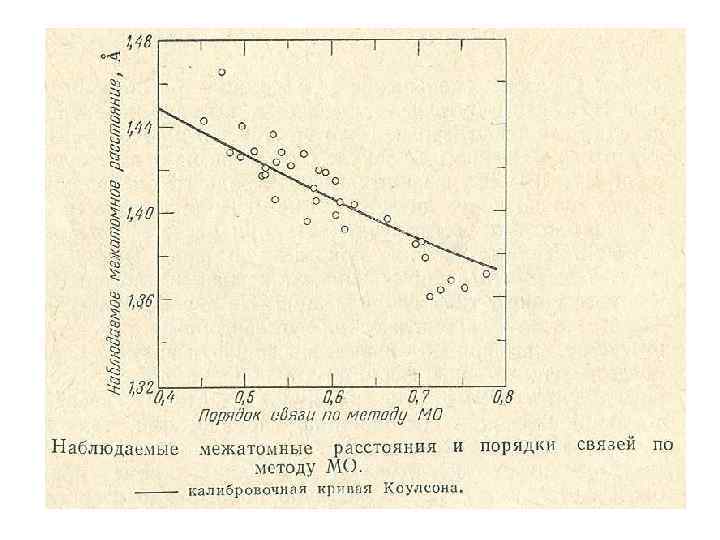
Порядок связи и межъядерное расстояние R, Ǻ 1, 60 R ~ 1/P этан бензол этилен 1, 30 ацетилен 1, 20 1, 00 2, 00 3, 00 P
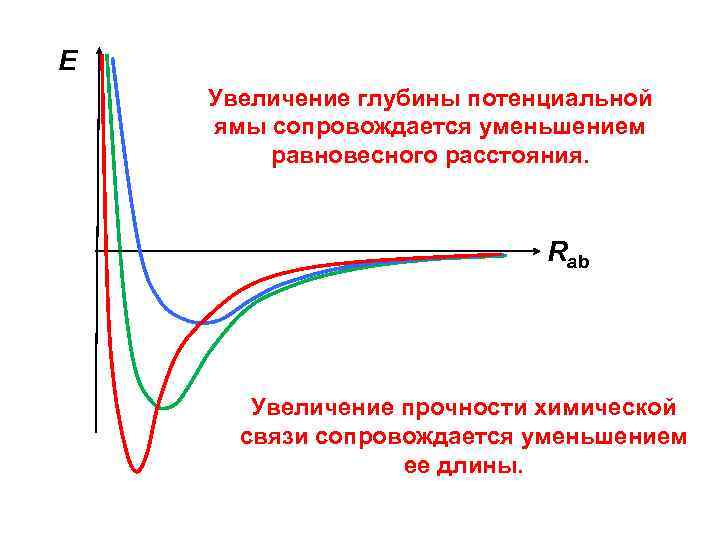
E Увеличение глубины потенциальной ямы сопровождается уменьшением равновесного расстояния. Rab Увеличение прочности химической связи сопровождается уменьшением ее длины.
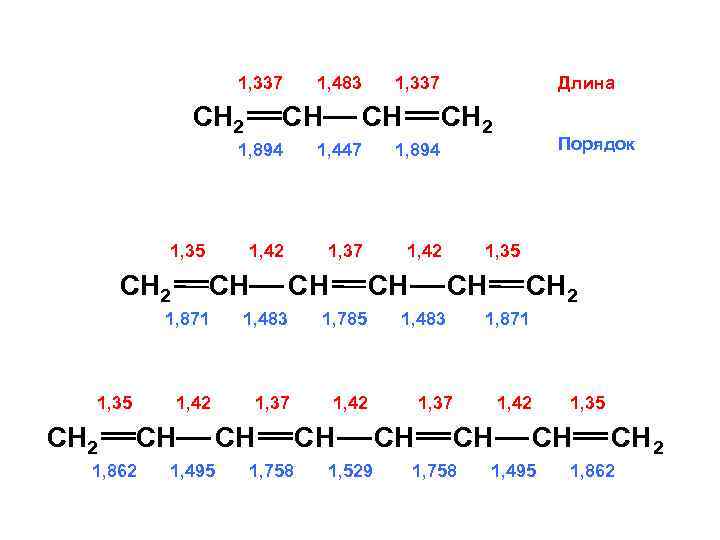
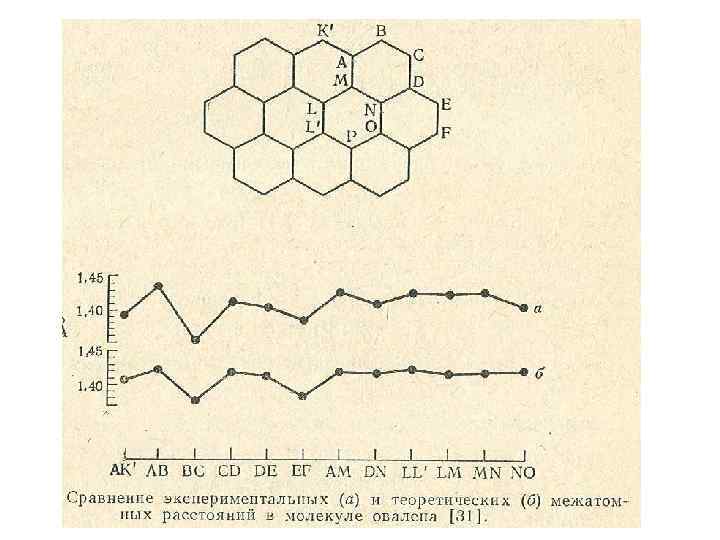
1, 337 СН 2 1, 483 СН 1, 337 СН Длина СН 2 1, 894 СН 2 1, 37 1, 42 СН СН СН 1, 871 СН 2 1, 483 1, 785 1, 42 1, 35 1, 37 1, 862 СН 1, 495 1, 758 СН 1, 529 1, 35 СН 1, 42 СН Порядок 1, 894 1, 42 1, 35 1, 447 1, 483 СН 2 1, 871 1, 37 СН 1, 42 СН 1, 758 1, 35 СН 1, 495 СН 2 1, 862

Формула Коулсона R = R 1 – R 2 2–P 1+K P– 1 Р — порядок связи R 1 — длина простой связи R 2 — длина двойной связи K — коффициент, зависящий от класса соединений (для УВ = 0, 507)
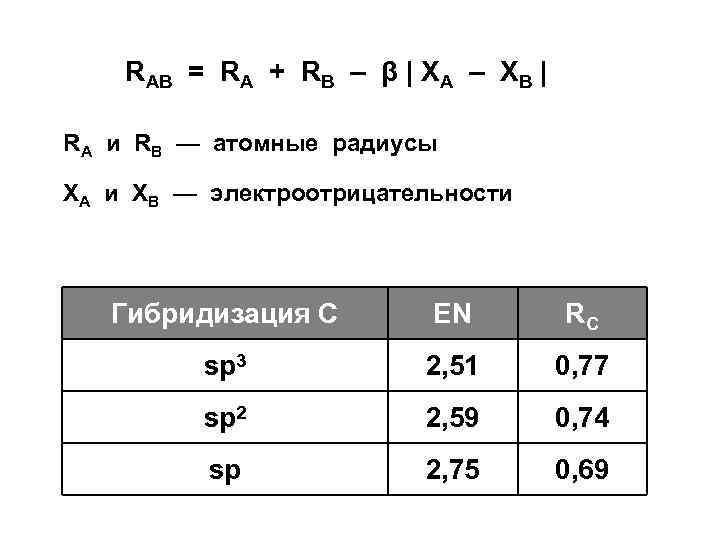
RAB = RA + RB – β | XA – XB | RA и RB — атомные радиусы XA и XB — электроотрицательности Гибридизация С EN RC sp 3 2, 51 0, 77 sp 2 2, 59 0, 74 sp 2, 75 0, 69
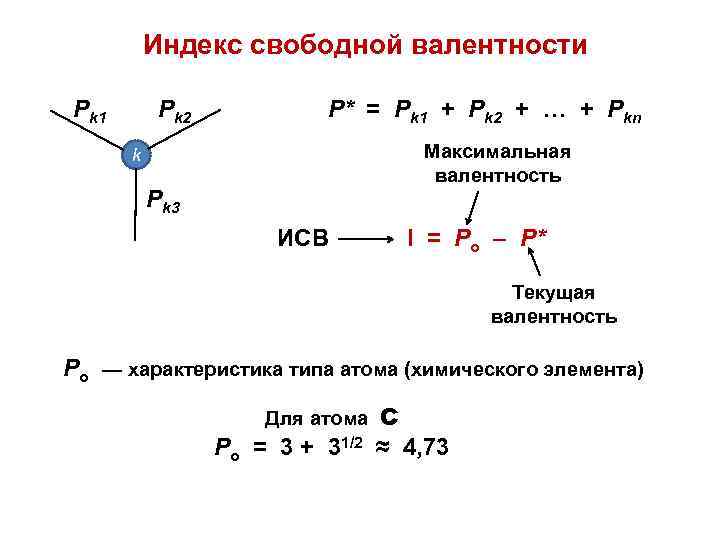
Индекс свободной валентности Pk 1 Pk 2 P* = Pk 1 + Pk 2 + … + Pkn Максимальная валентность k Pk 3 ИСВ I = Po – P* Текущая валентность Po — характеристика типа атома (химического элемента) Для атома Ро = 3 + 31/2 С ≈ 4, 73
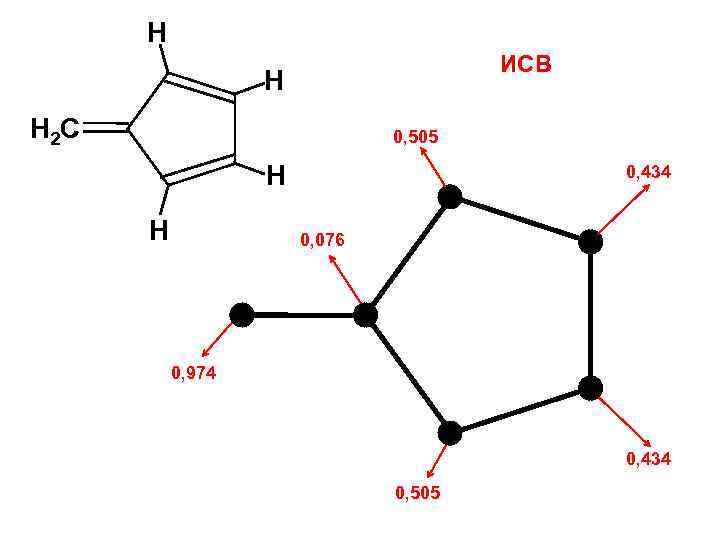
Н ИСВ Н H 2 C 0, 505 Н Н 0, 434 0, 076 0, 974 0, 434 0, 505
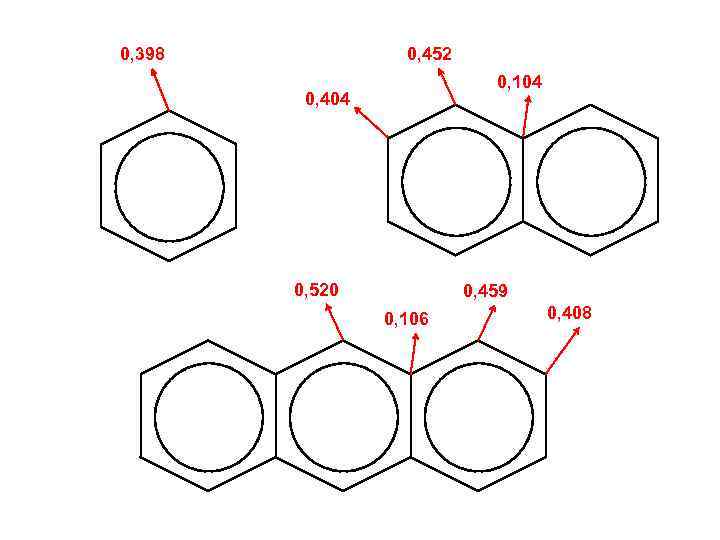
0, 398 0, 452 0, 104 0, 404 0, 520 0, 459 0, 106 0, 408
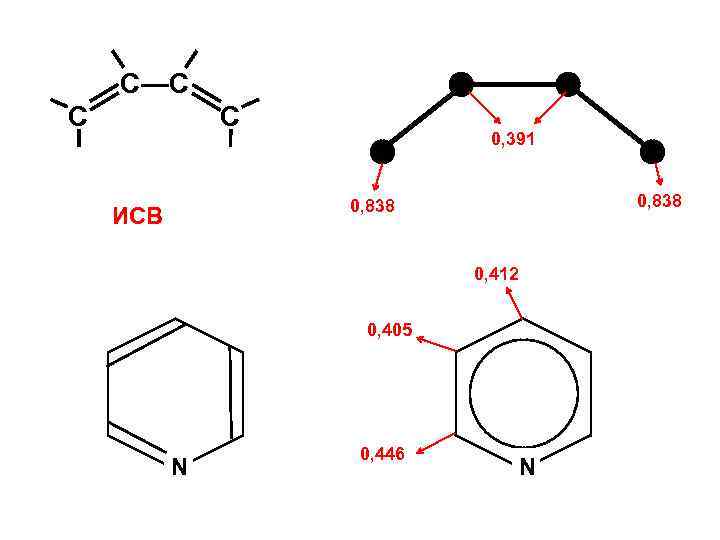
С—С С С 0, 391 0, 838 ИСВ 0, 412 0, 405 N 0, 446 N
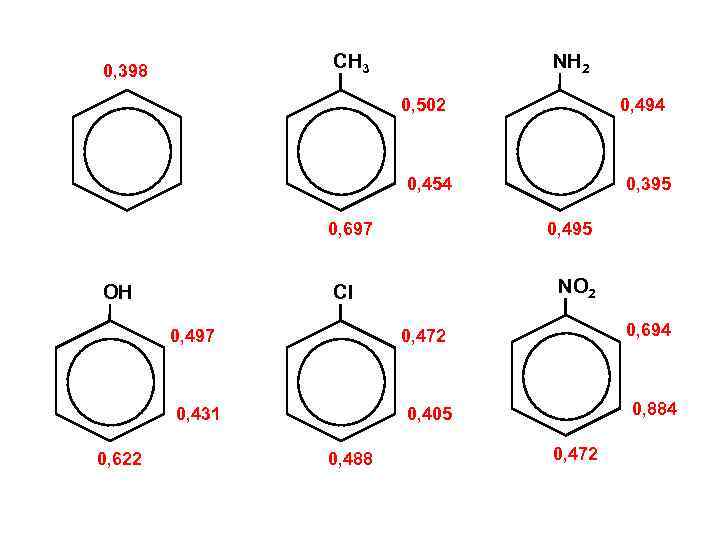
СН 3 0, 398 NН 2 0, 502 0, 494 0, 454 0, 697 OН NO 2 0, 694 0, 472 0, 431 0, 622 0, 495 Cl 0, 497 0, 395 0, 884 0, 405 0, 488 0, 472
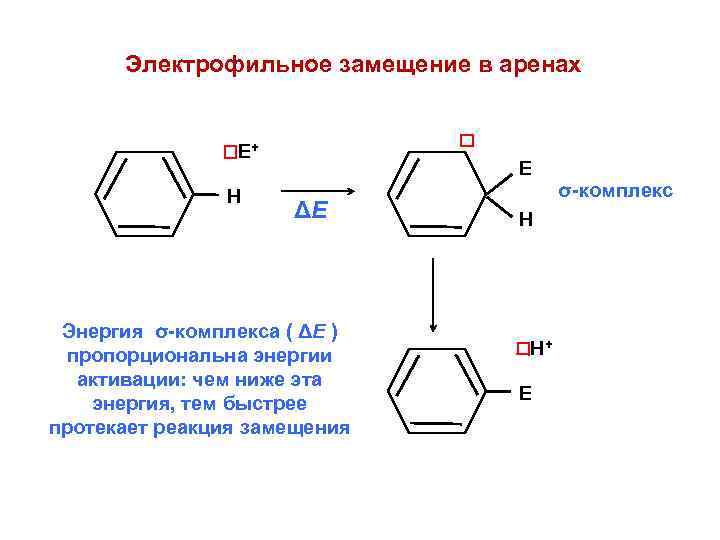
Электрофильное замещение в аренах Е+ Н Е ΔЕ Энергия σ-комплекса ( ΔЕ ) пропорциональна энергии активации: чем ниже эта энергия, тем быстрее протекает реакция замещения σ-комплекс Н Н+ Е

Нитрование фенантрена 1, 80 36, 1% 1, 86 26, 2% 2, 18 6, 8% 2, 04 1, 96 Энергии образования -комплексов 5, 6% 21, 8% Относительные выходы продуктов замещения

15. 11. 2014

Поверхность потенциальной энергии (ППЭ)

Поверхность потенциальной энергии (ППЭ) Е = F ( Rij ) ППЭ Е = Тэ + Uэ-я + Uэ-э + uя-я ( ядра считаются неподвижными, т. е. Тя = 0 )
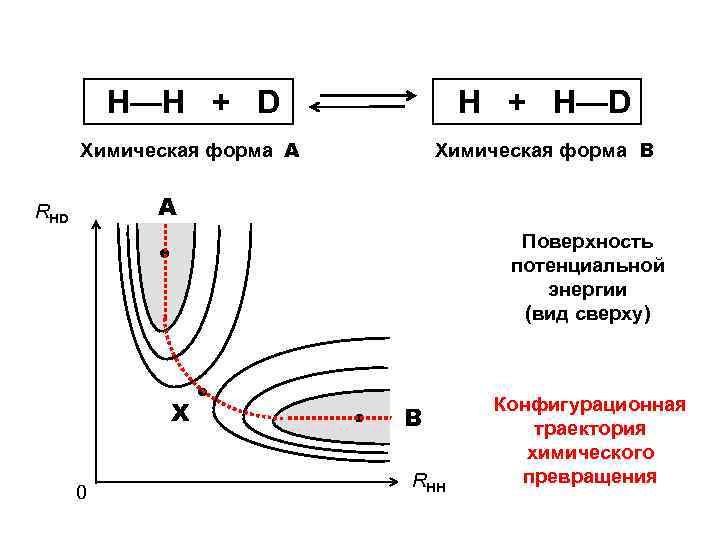
Н—Н + D Н + H—D Химическая форма А Химическая форма В А RHD Поверхность потенциальной энергии (вид сверху) X 0 В RHH Конфигурационная траектория химического превращения
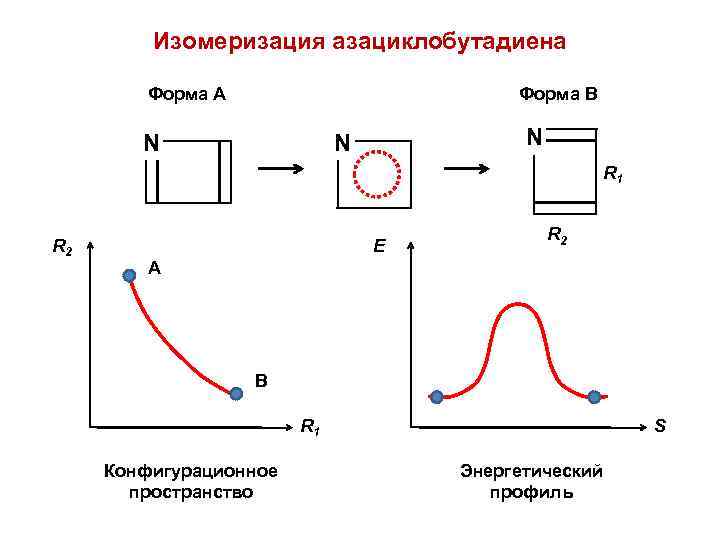
Изомеризация азациклобутадиена Форма А Форма В N N N R 1 R 2 E R 2 А В R 1 Конфигурационное пространство S Энергетический профиль
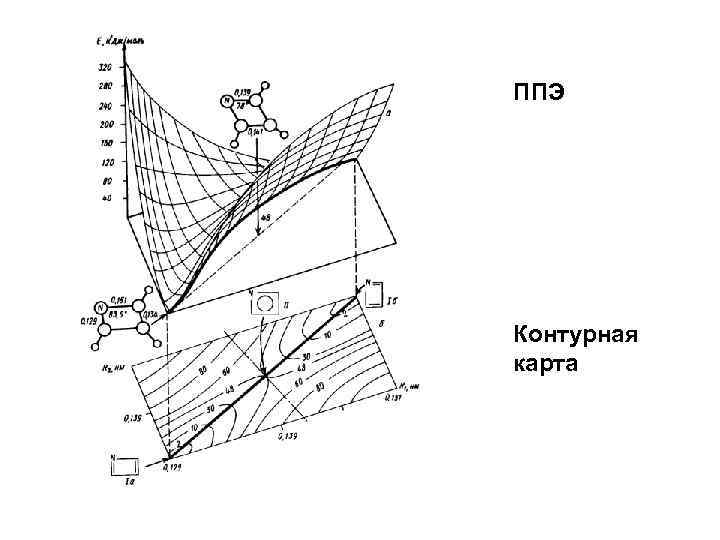
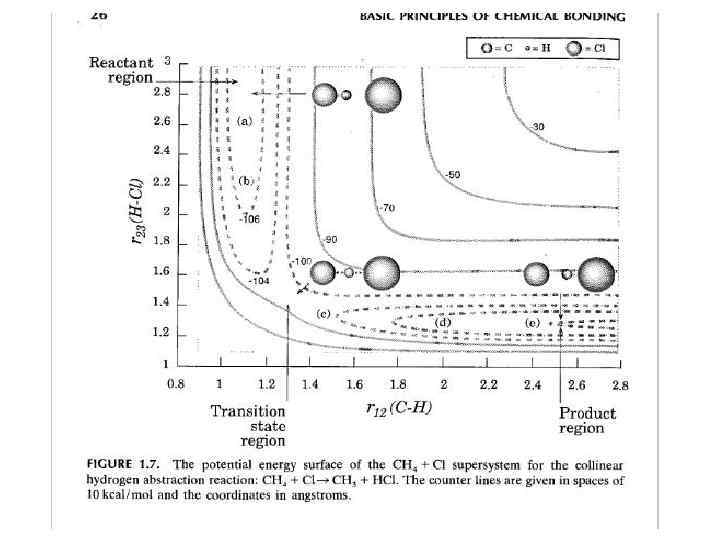
ППЭ Контурная карта
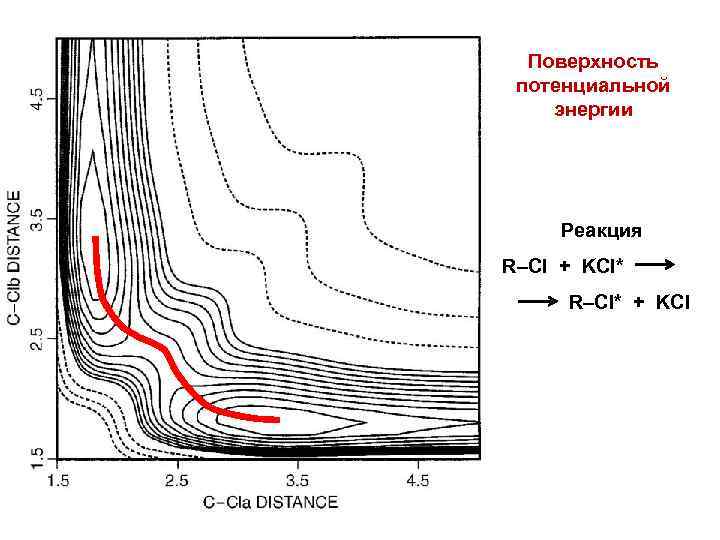
Поверхность потенциальной энергии Реакция R–Cl + KCl* R–Cl* + KCl
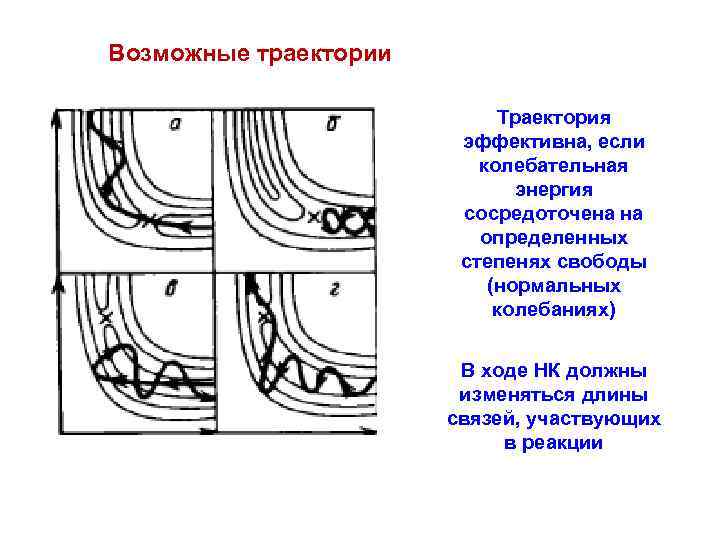
Возможные траектории Траектория эффективна, если колебательная энергия сосредоточена на определенных степенях свободы (нормальных колебаниях) В ходе НК должны изменяться длины связей, участвующих в реакции

Градиентные карты электронной плотности Проблема: есть ли химическая связь между указанной парой атомных ядер? Решение: для выбранной ядерной конфигурации решается электронная задача, т. е. вычисляется распределение электронной плотности и строится градиентная карта. Ядра связаны химически, если между ними есть «градиентный путь» .
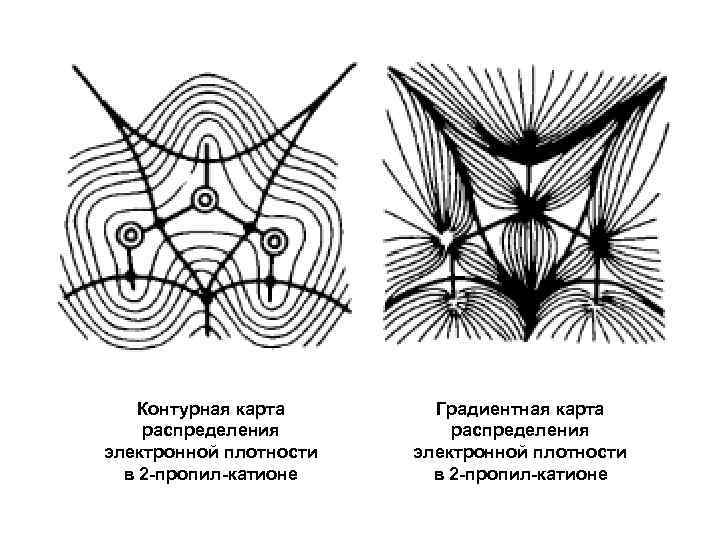
Контурная карта распределения электронной плотности в 2 -пропил-катионе Градиентная карта распределения электронной плотности в 2 -пропил-катионе
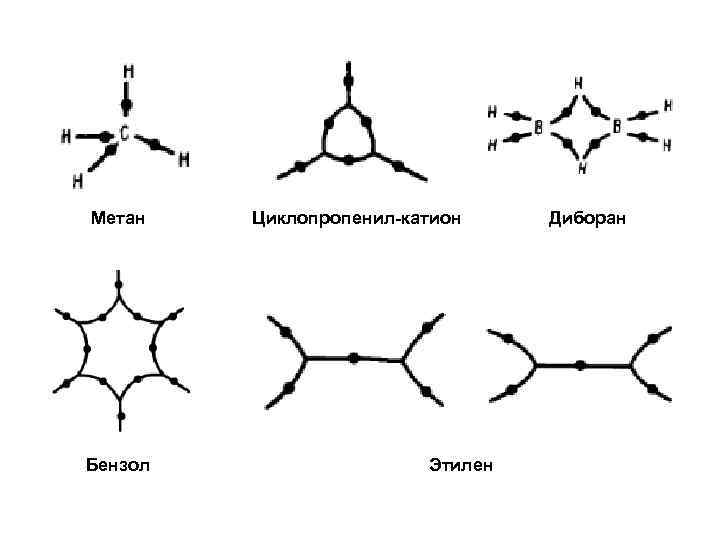
Метан Бензол Циклопропенил-катион Этилен Диборан

ВЫВОД Методы КВАНТОВОЙ ХИМИИ позволяют перевести теоретические представления КЛАССИЧЕСКОЙ ХИМИИ на количественный уровень, в частности — вычислять распределение электронной плотности в молекулах и на этой основе оценивать величины локальных электрических зарядов на атомах, порядки связей между ними, индексы свободной валентности и другие характеристики реакционной способности.
06 - Молекулы-3.pptx