3 Толл рецепторы 2012.ppt
- Количество слайдов: 44
 Распознавание чужого в системе врожденного иммунитета. Взаимодействие врожденного и адаптивного иммунитета. Патогенассоциированные лиганды и патогенраспознающие рецепторы.
Распознавание чужого в системе врожденного иммунитета. Взаимодействие врожденного и адаптивного иммунитета. Патогенассоциированные лиганды и патогенраспознающие рецепторы.
 Выживание человека в среде, изобилующей потенциально патогенными для него микроорганизмами, возможно при условии наличия у него совокупности механизмов немедленного распознавания и элиминации микробов, которые составляют систему врожденного иммунитета (естественного, конституционального). Эта система определяет стереотипные и консервативные в эволюции молекулы, присущие одновременно большим группам микроорганизмов. Эти молекулы получили название лиганды или «патогенассоциированные молекулярные паттерны» (ПАМП) по Ч. Дженвею (1989). Это обычно повторяющиеся молекулярные углеводные и липидные структуры на поверхности микроорганизмов.
Выживание человека в среде, изобилующей потенциально патогенными для него микроорганизмами, возможно при условии наличия у него совокупности механизмов немедленного распознавания и элиминации микробов, которые составляют систему врожденного иммунитета (естественного, конституционального). Эта система определяет стереотипные и консервативные в эволюции молекулы, присущие одновременно большим группам микроорганизмов. Эти молекулы получили название лиганды или «патогенассоциированные молекулярные паттерны» (ПАМП) по Ч. Дженвею (1989). Это обычно повторяющиеся молекулярные углеводные и липидные структуры на поверхности микроорганизмов.
 Главные особенности РАМР: 1 - чужеродность, 2 - связь с патогенностью микроорганизмов, 3 - консервативность строения.
Главные особенности РАМР: 1 - чужеродность, 2 - связь с патогенностью микроорганизмов, 3 - консервативность строения.

 Патогенассоциированные молекулярные паттерны (ПАМП): пептидогликан липид А и ЛПС (LPS) липотейхоевые кислоты липоарабиноманнан у возбудителей туберкулеза флагеллин формилметиониловые пептиды неметилированные по цитозину Cp. G пары – тандемы цитизин-фосфат-гуанозин Cp. G ДНК бактерий терминальные остатки D-маннозы и L-фукозы, маннаны двуспиральные и односпиральные ДНК вирусов Они имеются у разных микробов, грибов, вирусов, на эукариотических клетках.
Патогенассоциированные молекулярные паттерны (ПАМП): пептидогликан липид А и ЛПС (LPS) липотейхоевые кислоты липоарабиноманнан у возбудителей туберкулеза флагеллин формилметиониловые пептиды неметилированные по цитозину Cp. G пары – тандемы цитизин-фосфат-гуанозин Cp. G ДНК бактерий терминальные остатки D-маннозы и L-фукозы, маннаны двуспиральные и односпиральные ДНК вирусов Они имеются у разных микробов, грибов, вирусов, на эукариотических клетках.
 В организме человека имеются особые структуры клеток и жидкостей, которые распознают ПАМП. Их называют – «паттернраспознающие рецепторы» (ПРР). Их синтез генетически детерминирован и передается по наследству через половые клетки. ПРР подразделяются на 3 группы: 1 - гуморальные, или растворимые, или секреторные, 2 - клеточные, или мембранные, или эндоцитирующие, 3 - сигнальные
В организме человека имеются особые структуры клеток и жидкостей, которые распознают ПАМП. Их называют – «паттернраспознающие рецепторы» (ПРР). Их синтез генетически детерминирован и передается по наследству через половые клетки. ПРР подразделяются на 3 группы: 1 - гуморальные, или растворимые, или секреторные, 2 - клеточные, или мембранные, или эндоцитирующие, 3 - сигнальные
 Паттерраспознающие рецепторы подразделяют на 3 группы: I группа – гуморальные растворимые или секретируемые – распознают РАМР, связываясь с ними на поверхности патогенов. II группа – мембранные: а) клеточные – обеспечивают распознавание внеклеточных РАМР и немедленное «оповещение» – передачу сигнала внутрь клетки; б) внутриклеточные цитозольные и расположенные на мембранах цитоплазматических гранул взаимодействуют с внутриклеточными патогенами и их РАМР. III группа – внутриклеточные или сигнальные.
Паттерраспознающие рецепторы подразделяют на 3 группы: I группа – гуморальные растворимые или секретируемые – распознают РАМР, связываясь с ними на поверхности патогенов. II группа – мембранные: а) клеточные – обеспечивают распознавание внеклеточных РАМР и немедленное «оповещение» – передачу сигнала внутрь клетки; б) внутриклеточные цитозольные и расположенные на мембранах цитоплазматических гранул взаимодействуют с внутриклеточными патогенами и их РАМР. III группа – внутриклеточные или сигнальные.

 Паттернраспознающие рецепторы (ПРР):
Паттернраспознающие рецепторы (ПРР):
 I группа. Секретируемые (растворимые) внеклеточные рецепторы К ним относятся: Øманнозосвязывающий лектин (МСЛ или МСБ), Øлипополисахаридсвязывающий белок (ЛПС-Б), Øантибиотические пептиды или белки острой фазы – СРБ и сывороточной амилоидный протеин (САП). Липополисахаридсвязывающий белок (ЛПС-Б): Синтезируется гепатоцитами и секретируется в кровь. Связывает ЛПС грамотрицательных бактерий, обеспечивает их фагоцитоз. Через СД 14 -рецептор идет активация макрофагов с образованием провоспалительных цитокинов, обеспечивающих мобилизацию дополнительных факторов резистентности к инфекции.
I группа. Секретируемые (растворимые) внеклеточные рецепторы К ним относятся: Øманнозосвязывающий лектин (МСЛ или МСБ), Øлипополисахаридсвязывающий белок (ЛПС-Б), Øантибиотические пептиды или белки острой фазы – СРБ и сывороточной амилоидный протеин (САП). Липополисахаридсвязывающий белок (ЛПС-Б): Синтезируется гепатоцитами и секретируется в кровь. Связывает ЛПС грамотрицательных бактерий, обеспечивает их фагоцитоз. Через СД 14 -рецептор идет активация макрофагов с образованием провоспалительных цитокинов, обеспечивающих мобилизацию дополнительных факторов резистентности к инфекции.
 Маннозосвязывающий лектин (МСЛ): За распознавание углеводных компонентов микробных клеток отвечает обширная группа белковлектинов (лектины от лат. legere – различать, выбирать). Относится к семейству коллектинов. МСЛ состоит из 4 основных доменов, обладает способностью связываться с лектиновой и коллагеновой структурами. Относится к коллектинам. Синтезируется в печени, гомологенен С 1 r и С 1 s – компонентам комплемента. МСЛ взаимодействует с олигосахаридами клеточной стенки микробов и вирионов в присутствии ионов Ca 2+ (Klebsiella pneumoniae, E. coli, Salmonella enterica, Neisseria, Staphylococcus, Streptococcus, Микобактерии, хламидии), а также грибами и простейшими.
Маннозосвязывающий лектин (МСЛ): За распознавание углеводных компонентов микробных клеток отвечает обширная группа белковлектинов (лектины от лат. legere – различать, выбирать). Относится к семейству коллектинов. МСЛ состоит из 4 основных доменов, обладает способностью связываться с лектиновой и коллагеновой структурами. Относится к коллектинам. Синтезируется в печени, гомологенен С 1 r и С 1 s – компонентам комплемента. МСЛ взаимодействует с олигосахаридами клеточной стенки микробов и вирионов в присутствии ионов Ca 2+ (Klebsiella pneumoniae, E. coli, Salmonella enterica, Neisseria, Staphylococcus, Streptococcus, Микобактерии, хламидии), а также грибами и простейшими.
 Комплекс патоген + МСЛ эффективно Ø фагоцитируется благодаря наличию рецептора у макрофагов и нейтрофилов, Ø активирует систему комплемента по лектиновому пути. При недостаточности МСЛ повышается чувствительность к менингококковой и вирусной инфекциям, а также к рецидивирующим абсцессам, атопическому дерматиту. При повышенном уровне МСЛ могут активироваться аутоиммунные процессы, наблюдается персистенция микобактерий.
Комплекс патоген + МСЛ эффективно Ø фагоцитируется благодаря наличию рецептора у макрофагов и нейтрофилов, Ø активирует систему комплемента по лектиновому пути. При недостаточности МСЛ повышается чувствительность к менингококковой и вирусной инфекциям, а также к рецидивирующим абсцессам, атопическому дерматиту. При повышенном уровне МСЛ могут активироваться аутоиммунные процессы, наблюдается персистенция микобактерий.
 Антибиотические пептиды (СРБ) и др. : СРБ относится к семейству пентраксинов, состоит из 5 субъединиц, устойчивы к действию протеолитических ферментов. Способны к кальцийопосредованному связыванию полисахаридов (С-полисахарид S. pneumoniae) через остатки фосфохолина, ЛПНП и ЛПОНП, сиаловые кислоты клеток организма. Сывороточный амилоидный протеин (САП) относится к семейству длинных пентраксинов, состоит из 10 субъединиц, связывает ДНК и фрагменты хроматина, углеводы через фосфоэтаноламин, фибронектин. СРБ и САП активируют классический путь активации системы комплемента без участия антител благодаря взаимодействию с С 1 q-компонентом. Участвуют в удалении стареющих и некротических клеток, играют роль опсонинов в удалении микробов. Активируют систему комплемента, фагоциты, нормальные киллеры.
Антибиотические пептиды (СРБ) и др. : СРБ относится к семейству пентраксинов, состоит из 5 субъединиц, устойчивы к действию протеолитических ферментов. Способны к кальцийопосредованному связыванию полисахаридов (С-полисахарид S. pneumoniae) через остатки фосфохолина, ЛПНП и ЛПОНП, сиаловые кислоты клеток организма. Сывороточный амилоидный протеин (САП) относится к семейству длинных пентраксинов, состоит из 10 субъединиц, связывает ДНК и фрагменты хроматина, углеводы через фосфоэтаноламин, фибронектин. СРБ и САП активируют классический путь активации системы комплемента без участия антител благодаря взаимодействию с С 1 q-компонентом. Участвуют в удалении стареющих и некротических клеток, играют роль опсонинов в удалении микробов. Активируют систему комплемента, фагоциты, нормальные киллеры.
 II. Клеточные или эндоцитирующие рецепторы расположены на ЦПМ фагоцитов. Они распознают ПАМП, ликализованные на поверхности микробных клеток, вирионов, эукариотических клеток. К ним относятся: CD 14 -рецептор макрофагов для связывания комплексов ЛПС бактерий + ЛПС-связывающий белки, рецептор комплемента третьего типа (CR 3) для связывания ЛПС, углеводов простейших и грибов макрофагами, маннозный рецептор макрофагов – для связывания маннозы бактерий, микобактерий, грибов,
II. Клеточные или эндоцитирующие рецепторы расположены на ЦПМ фагоцитов. Они распознают ПАМП, ликализованные на поверхности микробных клеток, вирионов, эукариотических клеток. К ним относятся: CD 14 -рецептор макрофагов для связывания комплексов ЛПС бактерий + ЛПС-связывающий белки, рецептор комплемента третьего типа (CR 3) для связывания ЛПС, углеводов простейших и грибов макрофагами, маннозный рецептор макрофагов – для связывания маннозы бактерий, микобактерий, грибов,
 скавенджер-рецепторы (СР) Лигандами для них являются химически модифицированные липопротеиды низкой плотности (ЛПНП), липид А липополисахаридов, липотейхоевые кислоты, полианионные соединения, модифицированные белки (коллаген, тромбоспондин), длинноцепочные жирные кислоты, апоптические клетки. Имеются на поверхности макрофагов и дендритных клетках. Осуществляют удаление из внутренней среды деградирующих и погибающих собственных клеток, эндотоксинов, микробов и их компонентов, модифицированных веществ без образования провоспалительных цитокинов.
скавенджер-рецепторы (СР) Лигандами для них являются химически модифицированные липопротеиды низкой плотности (ЛПНП), липид А липополисахаридов, липотейхоевые кислоты, полианионные соединения, модифицированные белки (коллаген, тромбоспондин), длинноцепочные жирные кислоты, апоптические клетки. Имеются на поверхности макрофагов и дендритных клетках. Осуществляют удаление из внутренней среды деградирующих и погибающих собственных клеток, эндотоксинов, микробов и их компонентов, модифицированных веществ без образования провоспалительных цитокинов.
 История… В 1985 году при исследовании различных мутаций у мушкидрозофилы знаменитый немецкий биолог Кристиана Нюсляйн-Фольхард обнаружила личинок-мутантов и наличие у них группы рецепторов, которые были названы Тоll-рецепторы ( «Тоll» с нем. – «невероятные» , «умопомрачительные» ). В 1997 году Руслан Меджитов и Чарльз Дженуэй из Йельского университета обнаружили Толлподобные рецепторы у млекопитающих и человека.
История… В 1985 году при исследовании различных мутаций у мушкидрозофилы знаменитый немецкий биолог Кристиана Нюсляйн-Фольхард обнаружила личинок-мутантов и наличие у них группы рецепторов, которые были названы Тоll-рецепторы ( «Тоll» с нем. – «невероятные» , «умопомрачительные» ). В 1997 году Руслан Меджитов и Чарльз Дженуэй из Йельского университета обнаружили Толлподобные рецепторы у млекопитающих и человека.
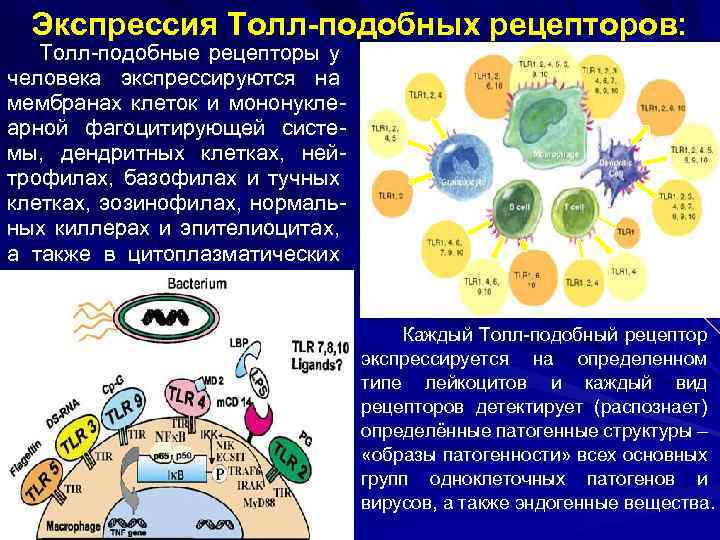 Экспрессия Толл-подобных рецепторов: Толл-подобные рецепторы у человека экспрессируются на мембранах клеток и мононуклеарной фагоцитирующей системы, дендритных клетках, нейтрофилах, базофилах и тучных клетках, эозинофилах, нормальных киллерах и эпителиоцитах, а также в цитоплазматических гранулах. Каждый Толл-подобный рецептор экспрессируется на определенном типе лейкоцитов и каждый вид рецепторов детектирует (распознает) определённые патогенные структуры – «образы патогенности» всех основных групп одноклеточных патогенов и вирусов, а также эндогенные вещества.
Экспрессия Толл-подобных рецепторов: Толл-подобные рецепторы у человека экспрессируются на мембранах клеток и мононуклеарной фагоцитирующей системы, дендритных клетках, нейтрофилах, базофилах и тучных клетках, эозинофилах, нормальных киллерах и эпителиоцитах, а также в цитоплазматических гранулах. Каждый Толл-подобный рецептор экспрессируется на определенном типе лейкоцитов и каждый вид рецепторов детектирует (распознает) определённые патогенные структуры – «образы патогенности» всех основных групп одноклеточных патогенов и вирусов, а также эндогенные вещества.
 TLR – консервативные молекулярные структуры. У человека обнаружено 10 вариантов TLR, которые взаимодействуют с различными структурами - лигандами. В зависимости от локализации толлподобные рецепторы делятся на 2 группы: 1 - мембранные TLR, 2 - внутриклеточные TLR.
TLR – консервативные молекулярные структуры. У человека обнаружено 10 вариантов TLR, которые взаимодействуют с различными структурами - лигандами. В зависимости от локализации толлподобные рецепторы делятся на 2 группы: 1 - мембранные TLR, 2 - внутриклеточные TLR.
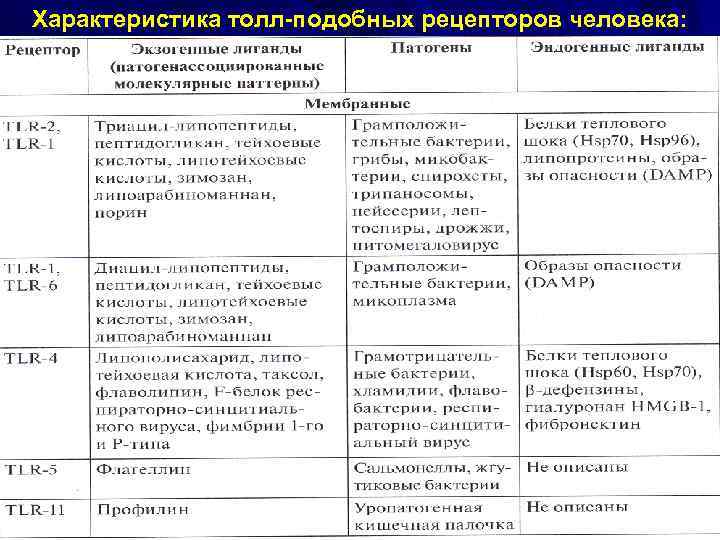 Характеристика толл-подобных рецепторов человека:
Характеристика толл-подобных рецепторов человека:

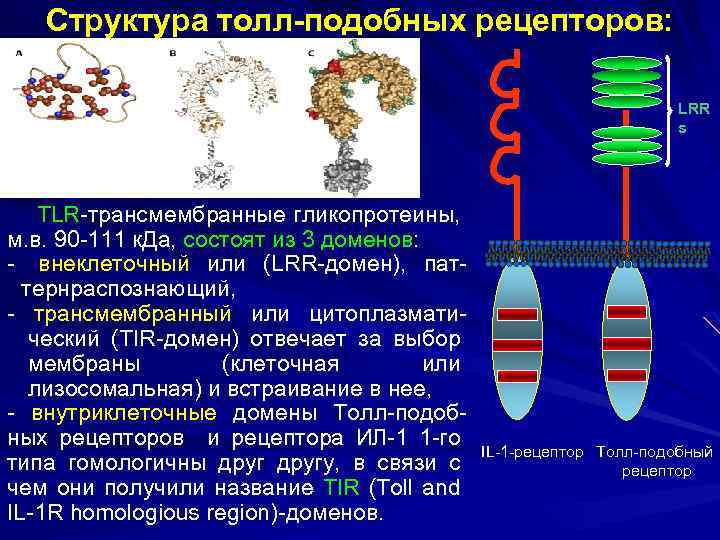 Структура толл-подобных рецепторов: LRR s TLR-трансмембранные гликопротеины, м. в. 90 -111 к. Да, состоят из 3 доменов: - внеклеточный или (LRR-домен), паттернраспознающий, - трансмембранный или цитоплазматический (TIR-домен) отвечает за выбор мембраны (клеточная или лизосомальная) и встраивание в нее, - внутриклеточные домены Толл-подобных рецепторов и рецептора ИЛ-1 1 -го типа гомологичны другу, в связи с чем они получили название TIR (Toll and IL-1 R homologious region)-доменов. IL-1 -рецептор Толл-подобный рецептор
Структура толл-подобных рецепторов: LRR s TLR-трансмембранные гликопротеины, м. в. 90 -111 к. Да, состоят из 3 доменов: - внеклеточный или (LRR-домен), паттернраспознающий, - трансмембранный или цитоплазматический (TIR-домен) отвечает за выбор мембраны (клеточная или лизосомальная) и встраивание в нее, - внутриклеточные домены Толл-подобных рецепторов и рецептора ИЛ-1 1 -го типа гомологичны другу, в связи с чем они получили название TIR (Toll and IL-1 R homologious region)-доменов. IL-1 -рецептор Толл-подобный рецептор
 В результате TLR, распознающие паттерны на поверхности бактерий, грибов, простейших, а также продукты жизнедеятельности микроорганизмов, локализованы на внешней клеточной мембране. Это мембранные TLR: TLR-1, TLR-2, TLR-4, TLR-6, TLR-11. Внутриклеточные TLR расположены внутри клеток организма человека – в эндосомах / лизосомах и распознают нуклеиновые кислоты. Это TLR-3, TLR-7, TLR-8, TLR-9. их паттернраспознающие домены направлены внутрь гранулы.
В результате TLR, распознающие паттерны на поверхности бактерий, грибов, простейших, а также продукты жизнедеятельности микроорганизмов, локализованы на внешней клеточной мембране. Это мембранные TLR: TLR-1, TLR-2, TLR-4, TLR-6, TLR-11. Внутриклеточные TLR расположены внутри клеток организма человека – в эндосомах / лизосомах и распознают нуклеиновые кислоты. Это TLR-3, TLR-7, TLR-8, TLR-9. их паттернраспознающие домены направлены внутрь гранулы.
 TLR специфичны к основным группам патогенов: 1 - грамположительным и грамотрицательным бактериям, 2 - вирусам, 3 - простейшим, 4 - грибам. Связывающие участки TLR обладают высоким сродством к лигандам паттернов. Эти участки представляют собой своеобразные подковообразные структуры.
TLR специфичны к основным группам патогенов: 1 - грамположительным и грамотрицательным бактериям, 2 - вирусам, 3 - простейшим, 4 - грибам. Связывающие участки TLR обладают высоким сродством к лигандам паттернов. Эти участки представляют собой своеобразные подковообразные структуры.
 Чаще всего TLR распознают: 1 - липидсодержащие структуры, 2 - олигонуклеотиды, 3 - углеводы, 4 - реже белки, 5 - нуклеиновые кислоты: вирусную двуспиральную РНК; участки ДНК бактерий, содержащие неметилированные последовательности Ср. G (цитидин-фосфат-гуанозин). Все 4 типа TLR, распознающие нуклеиновые кислоты, локализованы внутри клетки – в фаголизосоме, что предохраняет организм от распознавания собственных нуклеиновых кислот.
Чаще всего TLR распознают: 1 - липидсодержащие структуры, 2 - олигонуклеотиды, 3 - углеводы, 4 - реже белки, 5 - нуклеиновые кислоты: вирусную двуспиральную РНК; участки ДНК бактерий, содержащие неметилированные последовательности Ср. G (цитидин-фосфат-гуанозин). Все 4 типа TLR, распознающие нуклеиновые кислоты, локализованы внутри клетки – в фаголизосоме, что предохраняет организм от распознавания собственных нуклеиновых кислот.
 III группа – внутриклеточные ПРР находятся в цитозоле. К ним относятся: 1 - NOD-рецепторы (NLR NOD-like receptor) содержат нуклеотидсвязывающие олигомеризационные домены, распознают и связывают внутриклеточнорасположенные патогены. Рецепторы этой группы распознают пептидогликаны клеточной стенки микроорганизмов, в частности – мурамилдипетид, входящий в клеточную стенку как грамположительных, так и грамотрицательных микробов. Они распознают пептидогликаны, поступившие в цитозоль после фагоцитоза и расщепления микроорганизмов.
III группа – внутриклеточные ПРР находятся в цитозоле. К ним относятся: 1 - NOD-рецепторы (NLR NOD-like receptor) содержат нуклеотидсвязывающие олигомеризационные домены, распознают и связывают внутриклеточнорасположенные патогены. Рецепторы этой группы распознают пептидогликаны клеточной стенки микроорганизмов, в частности – мурамилдипетид, входящий в клеточную стенку как грамположительных, так и грамотрицательных микробов. Они распознают пептидогликаны, поступившие в цитозоль после фагоцитоза и расщепления микроорганизмов.
 2 - RIG-подобные рецепторы (RLR=RIG-like receptor) распознают чужеродную РНК. Их функция состоит в индукции синтеза интерферонов I типа в ответ на распознавание вирусной РНК-дву- и односпиральной. Они присутствуют на клетках врожденного иммунитета, кроме дендритных. 3 - DAI-подобный рецептор (DNA-dependent activator of IFN-regylatory factor – ДНКзависимый активатор регуляторных факторов интерферона), находится в цитозоле, распознает чужеродную ДНК.
2 - RIG-подобные рецепторы (RLR=RIG-like receptor) распознают чужеродную РНК. Их функция состоит в индукции синтеза интерферонов I типа в ответ на распознавание вирусной РНК-дву- и односпиральной. Они присутствуют на клетках врожденного иммунитета, кроме дендритных. 3 - DAI-подобный рецептор (DNA-dependent activator of IFN-regylatory factor – ДНКзависимый активатор регуляторных факторов интерферона), находится в цитозоле, распознает чужеродную ДНК.
 Взаимодействие ПАМП с ПРР клеток иммунной системы обеспечивает запуск эффекторных (нейтрализующих и элиминирующих патогены) механизмов врожденного иммунитета. Источник активации клеток врожденного иммунитета – это связывание рецепторами своих лиганд с последующей передачей в клетку активационного сигнала для экспрессии соответствующих генов. Для этого необходимы специальные внутриклеточные сигнальные молекулы: 1 - ферменты киназы (фосфорилируют белки или липиды, переводя их в активное состояние; 2 - адаптерные белки (передают промежуточные продукты активации между звеньями сигнальной цепи).
Взаимодействие ПАМП с ПРР клеток иммунной системы обеспечивает запуск эффекторных (нейтрализующих и элиминирующих патогены) механизмов врожденного иммунитета. Источник активации клеток врожденного иммунитета – это связывание рецепторами своих лиганд с последующей передачей в клетку активационного сигнала для экспрессии соответствующих генов. Для этого необходимы специальные внутриклеточные сигнальные молекулы: 1 - ферменты киназы (фосфорилируют белки или липиды, переводя их в активное состояние; 2 - адаптерные белки (передают промежуточные продукты активации между звеньями сигнальной цепи).
 Тоll-подобные рецепторы после взаимодействия с соответствующими лигандами начинают связывать специальные адапторные белки. При этом ТIR-домены взаимодействуют с 4 адаптерными белками: My. D 88 (Myeloid Differentiation Factor 88) TIRAP / MAL (TIR-adaptor protein = My. D 88 adaptor like) TRIF (Toll / IL-1 -receptor-associated adaptor protein inducing of interferon-p) TRAM (Toll-receptor-associated molecule = TRIF-related adaptor molecule)
Тоll-подобные рецепторы после взаимодействия с соответствующими лигандами начинают связывать специальные адапторные белки. При этом ТIR-домены взаимодействуют с 4 адаптерными белками: My. D 88 (Myeloid Differentiation Factor 88) TIRAP / MAL (TIR-adaptor protein = My. D 88 adaptor like) TRIF (Toll / IL-1 -receptor-associated adaptor protein inducing of interferon-p) TRAM (Toll-receptor-associated molecule = TRIF-related adaptor molecule)
 Эти адапторные белки обеспечивают проведение сигнала с Тоll- и толл-подобных рецепторов к белкам клетки, что завершается активацией транскрипционных факторов и транслокацией их в ядро. Выделяют 4 транскрипционных фактора: 1. NFk. B – нуклеарный фактор для активации провоспалительных генов. 2. АР-1 – транскрипционный фактор для включения различных иммунологически значимых генов (activator protein). 3. IRF-7 транскрипционные факторы для вклю4. IRF-3 чения генов интерферонов – соответственно ИФНα и ИФНβ. В результате активируются гены и синтезируются провоспалительные цитокины, интерфероны, антибиотические вещества.
Эти адапторные белки обеспечивают проведение сигнала с Тоll- и толл-подобных рецепторов к белкам клетки, что завершается активацией транскрипционных факторов и транслокацией их в ядро. Выделяют 4 транскрипционных фактора: 1. NFk. B – нуклеарный фактор для активации провоспалительных генов. 2. АР-1 – транскрипционный фактор для включения различных иммунологически значимых генов (activator protein). 3. IRF-7 транскрипционные факторы для вклю4. IRF-3 чения генов интерферонов – соответственно ИФНα и ИФНβ. В результате активируются гены и синтезируются провоспалительные цитокины, интерфероны, антибиотические вещества.
 Чаще всего происходит активация транскрипционного фактора – NFк. В (Nucltar Factor к В). Цитоплазматические участки молекул Тоll -подобных Рц содержат характерные последовательности остатков аминокислот (АК), названные TIR-доменом. Этот домен связывает белок – миелоидный фактор дифференциации Му. D 88, который активирует серин/треониновую киназу. Последняя, в свою очередь, активирует фактор транскрипции NFк. В (Nuclеar Factor of -chain В-lymphocytes).
Чаще всего происходит активация транскрипционного фактора – NFк. В (Nucltar Factor к В). Цитоплазматические участки молекул Тоll -подобных Рц содержат характерные последовательности остатков аминокислот (АК), названные TIR-доменом. Этот домен связывает белок – миелоидный фактор дифференциации Му. D 88, который активирует серин/треониновую киназу. Последняя, в свою очередь, активирует фактор транскрипции NFк. В (Nuclеar Factor of -chain В-lymphocytes).
 NFк. В мигрирует в ядро и запускает транскрипцию генов провоспалительных цитокинов (TNFα, ИЛ-1, ИЛ-6, ИЛ-12), хемокинов (ИЛ-8), NO-синтазы и костимуляторных молекул В 7. 1 (СD 80) и В 7. 2 (СD 86), необходимых для представления Аг Тлимфоцитам, и обеспечивает миграцию этих клеток из очага внедрения патогена в региональные лимфатические узлы, создавая необходимые условия для начала лимфоцитарного иммунного ответа. Одновременно NFк. В инициирует транскрипцию гена своего белка-ингибитора Ikβ, что обеспечивает спонтанное затухание сигнала с Тоllподобных Рц.
NFк. В мигрирует в ядро и запускает транскрипцию генов провоспалительных цитокинов (TNFα, ИЛ-1, ИЛ-6, ИЛ-12), хемокинов (ИЛ-8), NO-синтазы и костимуляторных молекул В 7. 1 (СD 80) и В 7. 2 (СD 86), необходимых для представления Аг Тлимфоцитам, и обеспечивает миграцию этих клеток из очага внедрения патогена в региональные лимфатические узлы, создавая необходимые условия для начала лимфоцитарного иммунного ответа. Одновременно NFк. В инициирует транскрипцию гена своего белка-ингибитора Ikβ, что обеспечивает спонтанное затухание сигнала с Тоllподобных Рц.
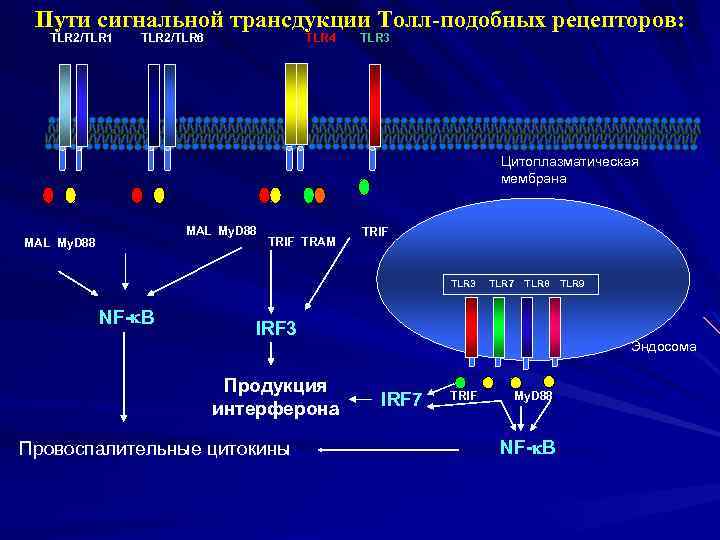 Пути сигнальной трансдукции Толл-подобных рецепторов: TLR 2/TLR 1 TLR 2/TLR 6 TLR 4 TLR 3 Цитоплазматическая мембрана MAL My. D 88 TRIF TRAM TRIF TLR 3 NF- B TLR 7 TLR 8 TLR 9 IRF 3 Продукция интерферона Провоспалительные цитокины Эндосома IRF 7 TRIF My. D 88 NF- B
Пути сигнальной трансдукции Толл-подобных рецепторов: TLR 2/TLR 1 TLR 2/TLR 6 TLR 4 TLR 3 Цитоплазматическая мембрана MAL My. D 88 TRIF TRAM TRIF TLR 3 NF- B TLR 7 TLR 8 TLR 9 IRF 3 Продукция интерферона Провоспалительные цитокины Эндосома IRF 7 TRIF My. D 88 NF- B
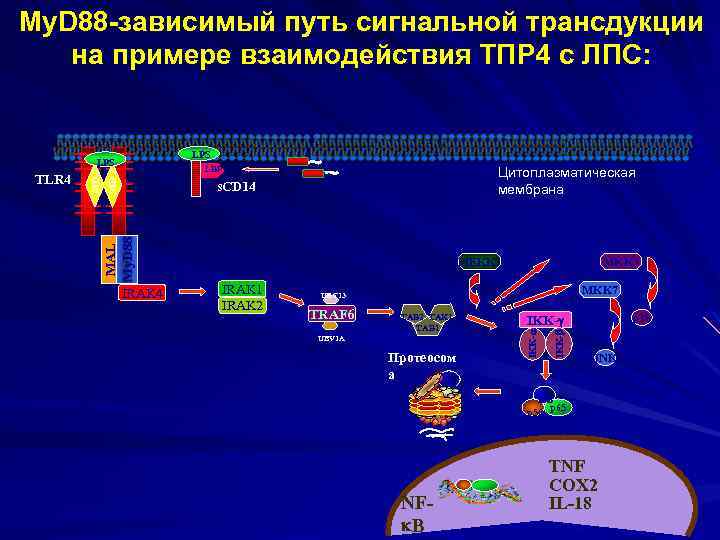 My. D 88 -зависимый путь сигнальной трансдукции на примере взаимодействия ТПР 4 с ЛПС: LPS Цитоплазматическая мембрана s. CD 14 IRAK 1 IRAK 2 MKK 3 MKK 7 UBC 13 TRAF 6 TAB 2 TAK 1 TAB 1 UBV 1 A Протеосом а p 38 IKK- IRAK 4 MEKK 3 IKK- MD-2 LBP MAL My. D 88 TLR 4 MD-2 LPS JNK I B p 50 p 65 NF B TNF COX 2 IL-18
My. D 88 -зависимый путь сигнальной трансдукции на примере взаимодействия ТПР 4 с ЛПС: LPS Цитоплазматическая мембрана s. CD 14 IRAK 1 IRAK 2 MKK 3 MKK 7 UBC 13 TRAF 6 TAB 2 TAK 1 TAB 1 UBV 1 A Протеосом а p 38 IKK- IRAK 4 MEKK 3 IKK- MD-2 LBP MAL My. D 88 TLR 4 MD-2 LPS JNK I B p 50 p 65 NF B TNF COX 2 IL-18
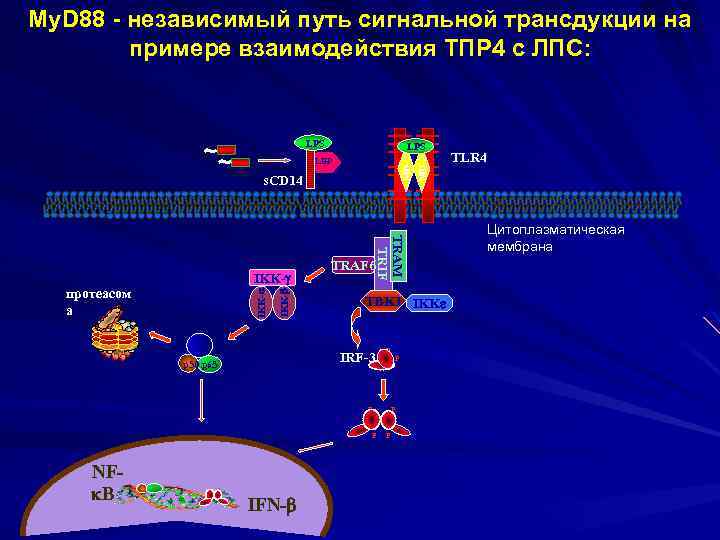 My. D 88 - независимый путь сигнальной трансдукции на примере взаимодействия ТПР 4 с ЛПС: LPS MD-2 LBP s. CD 14 IKK- протеасом а I B TRAM TRIF IKK- TRAF 6 TBK 1 IKK IRF-3 p 50 p 65 P P NF B IFN- MD-2 LPS P P TLR 4 Цитоплазматическая мембрана
My. D 88 - независимый путь сигнальной трансдукции на примере взаимодействия ТПР 4 с ЛПС: LPS MD-2 LBP s. CD 14 IKK- протеасом а I B TRAM TRIF IKK- TRAF 6 TBK 1 IKK IRF-3 p 50 p 65 P P NF B IFN- MD-2 LPS P P TLR 4 Цитоплазматическая мембрана
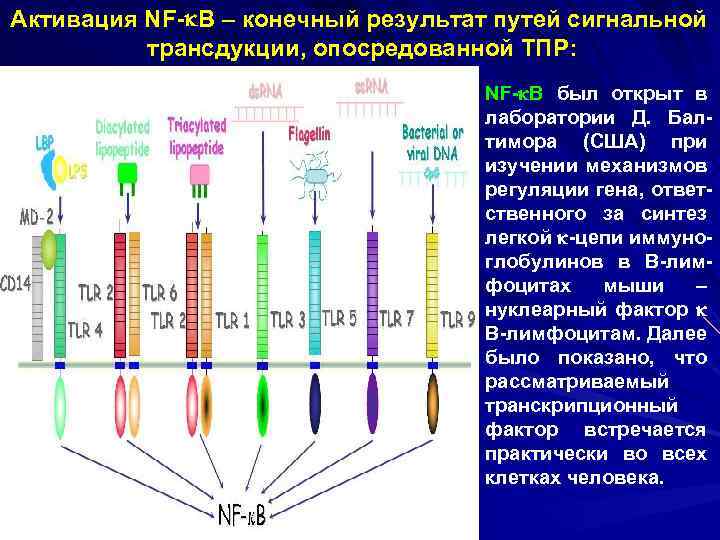 Активация NF- B – конечный результат путей сигнальной трансдукции, опосредованной ТПР: NF- B был открыт в лаборатории Д. Балтимора (США) при изучении механизмов регуляции гена, ответственного за синтез легкой -цепи иммуноглобулинов в В-лимфоцитах мыши – нуклеарный фактор В-лимфоцитам. Далее было показано, что рассматриваемый транскрипционный фактор встречается практически во всех клетках человека.
Активация NF- B – конечный результат путей сигнальной трансдукции, опосредованной ТПР: NF- B был открыт в лаборатории Д. Балтимора (США) при изучении механизмов регуляции гена, ответственного за синтез легкой -цепи иммуноглобулинов в В-лимфоцитах мыши – нуклеарный фактор В-лимфоцитам. Далее было показано, что рассматриваемый транскрипционный фактор встречается практически во всех клетках человека.
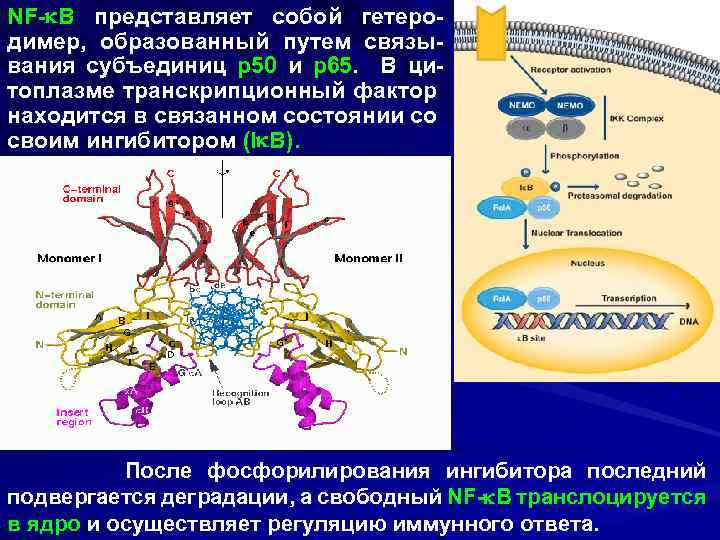 NF- B представляет собой гетеродимер, образованный путем связывания субъединиц р50 и р65. В цитоплазме транскрипционный фактор находится в связанном состоянии со своим ингибитором (I В). После фосфорилирования ингибитора последний подвергается деградации, а свободный NF- B транслоцируется в ядро и осуществляет регуляцию иммунного ответа.
NF- B представляет собой гетеродимер, образованный путем связывания субъединиц р50 и р65. В цитоплазме транскрипционный фактор находится в связанном состоянии со своим ингибитором (I В). После фосфорилирования ингибитора последний подвергается деградации, а свободный NF- B транслоцируется в ядро и осуществляет регуляцию иммунного ответа.
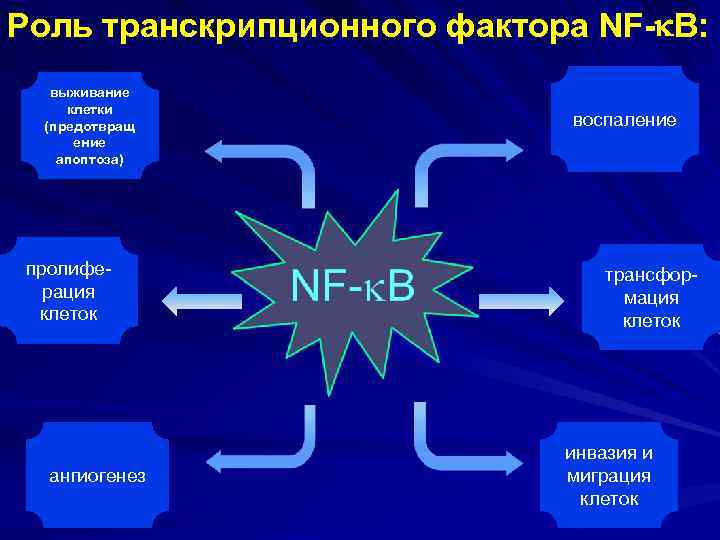 Роль транскрипционного фактора NF- B: выживание клетки (предотвращ ение апоптоза) пролиферация клеток ангиогенез воспаление трансформация клеток инвазия и миграция клеток
Роль транскрипционного фактора NF- B: выживание клетки (предотвращ ение апоптоза) пролиферация клеток ангиогенез воспаление трансформация клеток инвазия и миграция клеток
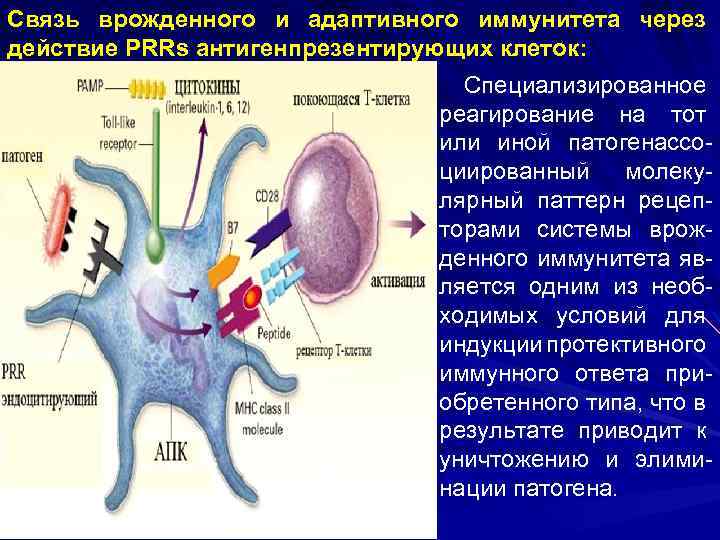 Связь врожденного и адаптивного иммунитета через действие PRRs антигенпрезентирующих клеток: Специализированное реагирование на тот или иной патогенассоциированный молекулярный паттерн рецепторами системы врожденного иммунитета является одним из необходимых условий для индукции протективного иммунного ответа приобретенного типа, что в результате приводит к уничтожению и элиминации патогена.
Связь врожденного и адаптивного иммунитета через действие PRRs антигенпрезентирующих клеток: Специализированное реагирование на тот или иной патогенассоциированный молекулярный паттерн рецепторами системы врожденного иммунитета является одним из необходимых условий для индукции протективного иммунного ответа приобретенного типа, что в результате приводит к уничтожению и элиминации патогена.
 Участие TLRs в развитии аллергии и аутоиммунных процессов: Активированный TLR Возможный результат активации TLR 4 Поражение почек по типу красной волчанки (Liu B, 2006) Антитела против ДНК, РНК, нуклеопротеинов (Bergland R, 2006) Распознавание аутологичной ДНК (Lamfier VS, 2006) Иммунный ответ на «некротические » ткани (Li M, 2001) Способствует развитию бронхиальной астмы у человека. ( Phipps S. , 2007) TLR 7 TLR 9 TLR 2
Участие TLRs в развитии аллергии и аутоиммунных процессов: Активированный TLR Возможный результат активации TLR 4 Поражение почек по типу красной волчанки (Liu B, 2006) Антитела против ДНК, РНК, нуклеопротеинов (Bergland R, 2006) Распознавание аутологичной ДНК (Lamfier VS, 2006) Иммунный ответ на «некротические » ткани (Li M, 2001) Способствует развитию бронхиальной астмы у человека. ( Phipps S. , 2007) TLR 7 TLR 9 TLR 2
 TLRs-мутации, полиморфизм и ассоциированные с ними заболевания : Рецепторы Мутации и полиморфизм Заболевания Микоплазменная и стафилококковая сепсис (грам-(+) бактерии) Тяжелый бронхиолит (RS-вирус), болезнь Крона, язвенный колит Инфекции, вызванные грамотрицательной флорой, низкий риск развития атеросклероза Мутации: TLR 4 -896 G CD 14 -159 T Неонатальный сепсис у недоношенных (грам-(-)) Полиморфизм TLR 4: D 299 G IRAK 4 Полиморфизм: R 7530 Полиморфизм: Asp 299 Gly Thr 399 Ile TLR 4 Рецидивирующие инфекции респираторного тракта Мутации: Asp 299 Gly Thr 399 Ile TLR 2 Полиморфизм: Arg 753 Gln Грамотрицательные инфекции (менингококковые), системный кандидоз, утяжеление атопии, снижение гиперреактивности верхних дыхательных путей, снижение риска развития атеросклероза Стоп-кодоны: 287, 293 Пиогенные грамположительные инфекции;
TLRs-мутации, полиморфизм и ассоциированные с ними заболевания : Рецепторы Мутации и полиморфизм Заболевания Микоплазменная и стафилококковая сепсис (грам-(+) бактерии) Тяжелый бронхиолит (RS-вирус), болезнь Крона, язвенный колит Инфекции, вызванные грамотрицательной флорой, низкий риск развития атеросклероза Мутации: TLR 4 -896 G CD 14 -159 T Неонатальный сепсис у недоношенных (грам-(-)) Полиморфизм TLR 4: D 299 G IRAK 4 Полиморфизм: R 7530 Полиморфизм: Asp 299 Gly Thr 399 Ile TLR 4 Рецидивирующие инфекции респираторного тракта Мутации: Asp 299 Gly Thr 399 Ile TLR 2 Полиморфизм: Arg 753 Gln Грамотрицательные инфекции (менингококковые), системный кандидоз, утяжеление атопии, снижение гиперреактивности верхних дыхательных путей, снижение риска развития атеросклероза Стоп-кодоны: 287, 293 Пиогенные грамположительные инфекции;

 Эндогенные факторы, воспринимаемые Толл-подобными рецепторами: §активированный комплемент § продукты разрушения клеток матрикса § фибриноген § белок А сурфактанта § белок теплового шока § нейротоксин эозинофилов и т. д.
Эндогенные факторы, воспринимаемые Толл-подобными рецепторами: §активированный комплемент § продукты разрушения клеток матрикса § фибриноген § белок А сурфактанта § белок теплового шока § нейротоксин эозинофилов и т. д.
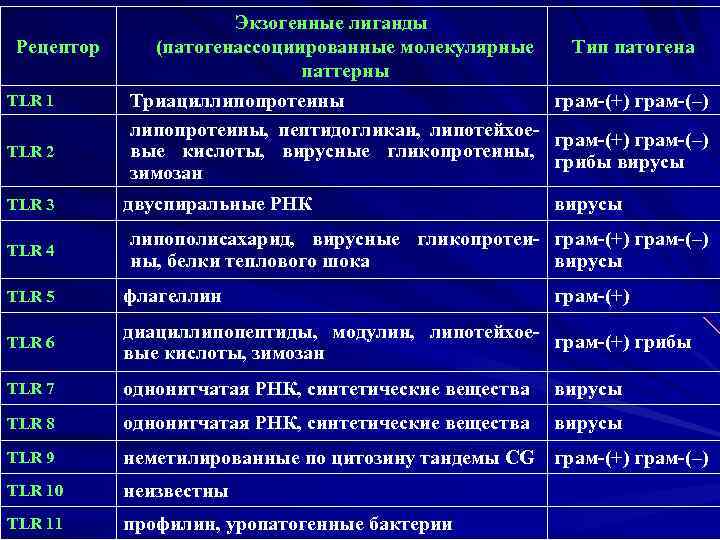 Рецептор TLR 1 TLR 2 TLR 3 TLR 4 Экзогенные лиганды Тип патогена (патогенассоциированные молекулярные паттерны Триациллипопротеины грам-(+) грам-(–) липопротеины, пептидогликан, липотейхоеграм-(+) грам-(–) вые кислоты, вирусные гликопротеины, грибы вирусы зимозан двуспиральные РНК вирусы липополисахарид, вирусные гликопротеи- грам-(+) грам-(–) ны, белки теплового шока вирусы TLR 5 флагеллин грам-(+) TLR 6 диациллипопептиды, модулин, липотейхоеграм-(+) грибы вые кислоты, зимозан TLR 7 однонитчатая РНК, синтетические вещества вирусы TLR 8 однонитчатая РНК, синтетические вещества вирусы TLR 9 неметилированные по цитозину тандемы CG грам-(+) грам-(–) TLR 10 неизвестны TLR 11 профилин, уропатогенные бактерии
Рецептор TLR 1 TLR 2 TLR 3 TLR 4 Экзогенные лиганды Тип патогена (патогенассоциированные молекулярные паттерны Триациллипопротеины грам-(+) грам-(–) липопротеины, пептидогликан, липотейхоеграм-(+) грам-(–) вые кислоты, вирусные гликопротеины, грибы вирусы зимозан двуспиральные РНК вирусы липополисахарид, вирусные гликопротеи- грам-(+) грам-(–) ны, белки теплового шока вирусы TLR 5 флагеллин грам-(+) TLR 6 диациллипопептиды, модулин, липотейхоеграм-(+) грибы вые кислоты, зимозан TLR 7 однонитчатая РНК, синтетические вещества вирусы TLR 8 однонитчатая РНК, синтетические вещества вирусы TLR 9 неметилированные по цитозину тандемы CG грам-(+) грам-(–) TLR 10 неизвестны TLR 11 профилин, уропатогенные бактерии
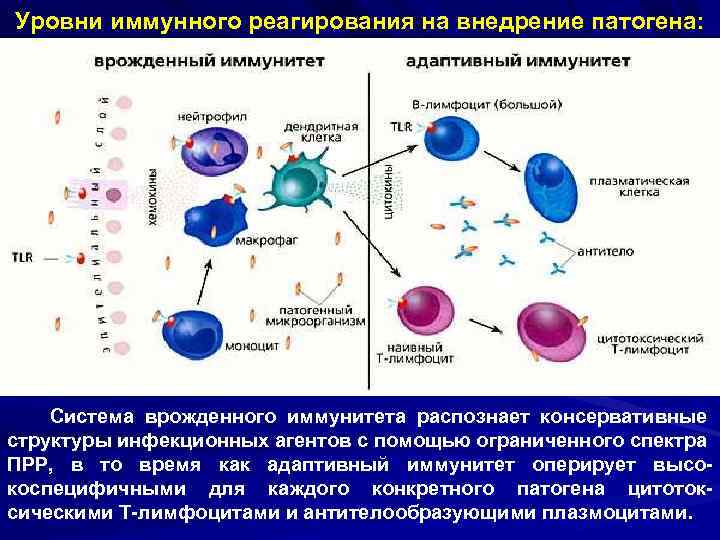 Уровни иммунного реагирования на внедрение патогена: Система врожденного иммунитета распознает консервативные структуры инфекционных агентов с помощью ограниченного спектра ПРР, в то время как адаптивный иммунитет оперирует высокоспецифичными для каждого конкретного патогена цитотоксическими Т-лимфоцитами и антителообразующими плазмоцитами.
Уровни иммунного реагирования на внедрение патогена: Система врожденного иммунитета распознает консервативные структуры инфекционных агентов с помощью ограниченного спектра ПРР, в то время как адаптивный иммунитет оперирует высокоспецифичными для каждого конкретного патогена цитотоксическими Т-лимфоцитами и антителообразующими плазмоцитами.


