 Радиоуглеродный метод Система 14 C – 14 N
Радиоуглеродный метод Система 14 C – 14 N
 Углерод элемент IV группы таблицы Менделеева; имеет 2 стабильных изотопа 12 C = 98, 89% и 13 C = 1, 11%; 4 радиоактивных, период полураспада трёх из которых очень мал: 10 C – 19, 1 сек 11 C – 20, 4 мин 15 C – 2, 4 сек 14 C – 5730 лет Содержание 14 C не превышает миллионных долей %, ещё меньше 11 C и 15 C (по правилу четности). Известно 112 минералов – носителей углерода. Свободный С находится в природе в виде алмаза и графита. Основная масса углерода – природные карбонаты и горючие ископаемые.
Углерод элемент IV группы таблицы Менделеева; имеет 2 стабильных изотопа 12 C = 98, 89% и 13 C = 1, 11%; 4 радиоактивных, период полураспада трёх из которых очень мал: 10 C – 19, 1 сек 11 C – 20, 4 мин 15 C – 2, 4 сек 14 C – 5730 лет Содержание 14 C не превышает миллионных долей %, ещё меньше 11 C и 15 C (по правилу четности). Известно 112 минералов – носителей углерода. Свободный С находится в природе в виде алмаза и графита. Основная масса углерода – природные карбонаты и горючие ископаемые.

 Нахождение в природе Содержание углерода в земной коре 0, 1 % по массе. Свободный углерод находится в природе в виде алмаза и графита. Основная масса углерода в виде природных карбонатов (известняки и доломиты), горючих ископаемых — антрацит (94— 97 % С), бурые угли (64— 80 % С), каменные угли (76— 95 % С), горючие сланцы (56 — 78 % С), нефть (82— 87 % С), горючих природных газов (до 99 % метана), торф (53— 56 % С), а также битумы и др. В атмосфере и гидросфере находится в виде диоксида углерода СО 2, в воздухе 0, 046 % СО 2 по массе, в водах рек, морей и океанов в ~60 раз больше. Углерод входит в состав растений и животных (~18 %).
Нахождение в природе Содержание углерода в земной коре 0, 1 % по массе. Свободный углерод находится в природе в виде алмаза и графита. Основная масса углерода в виде природных карбонатов (известняки и доломиты), горючих ископаемых — антрацит (94— 97 % С), бурые угли (64— 80 % С), каменные угли (76— 95 % С), горючие сланцы (56 — 78 % С), нефть (82— 87 % С), горючих природных газов (до 99 % метана), торф (53— 56 % С), а также битумы и др. В атмосфере и гидросфере находится в виде диоксида углерода СО 2, в воздухе 0, 046 % СО 2 по массе, в водах рек, морей и океанов в ~60 раз больше. Углерод входит в состав растений и животных (~18 %).
 Азот – элемент V группы таблицы Менделеева Атомная масса 14 а. е. м. Степени окисления – 3, +5 Азот имеет 2 стабильных изотопа: 14 N = 99, 64% 15 N = 0, 36% Искусственно получены четырнадцать радиоактивных изотопов азота с массовыми числами от 10 до 13 и от 16 до 25. Все они являются очень короткоживущими изотопами. Самый стабильный из них 13 N имеет период полураспада 10 мин.
Азот – элемент V группы таблицы Менделеева Атомная масса 14 а. е. м. Степени окисления – 3, +5 Азот имеет 2 стабильных изотопа: 14 N = 99, 64% 15 N = 0, 36% Искусственно получены четырнадцать радиоактивных изотопов азота с массовыми числами от 10 до 13 и от 16 до 25. Все они являются очень короткоживущими изотопами. Самый стабильный из них 13 N имеет период полураспада 10 мин.

 Распространённость Кларк в з. к. – 1, 9*10 -2% масс.
Распространённость Кларк в з. к. – 1, 9*10 -2% масс.

 Содержание в различных геосферах Азот – четвертый по распространенности элемент Солнечной системы. Главным резервуаром N является атмосфера – 75, 6% В морской воде – 5*10 -5% В биосфере Содержание N в мантии намного больше, чем в почве. Такое соотношение заставляет предположить, что главным источником N служит верхняя часть мантии, откуда он поступает В другие оболочки Земли с извержениями вулканов.
Содержание в различных геосферах Азот – четвертый по распространенности элемент Солнечной системы. Главным резервуаром N является атмосфера – 75, 6% В морской воде – 5*10 -5% В биосфере Содержание N в мантии намного больше, чем в почве. Такое соотношение заставляет предположить, что главным источником N служит верхняя часть мантии, откуда он поступает В другие оболочки Земли с извержениями вулканов.
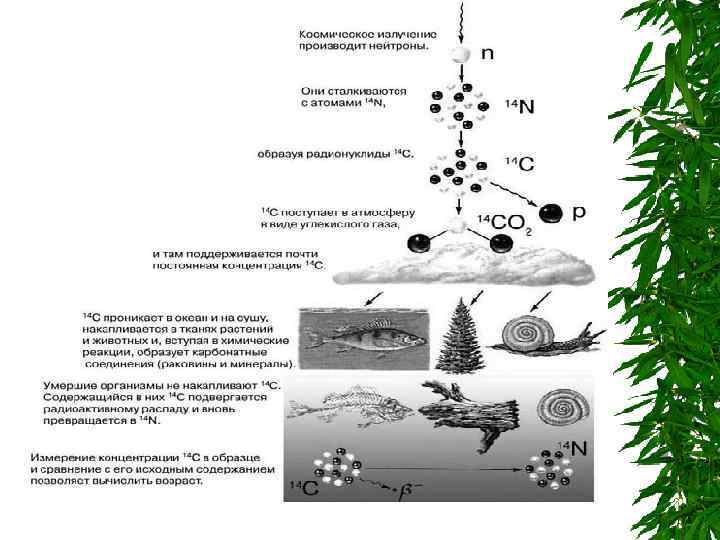
 Принципы 14 C – метода датирования В настоящее время известно, что 14 C образуется в атмосфере по различным ядерным реакциям при взаимодействии вторичных нейтронов со стабильными изотопами N, O и C. Наиболее важная реакция: Образовавшиеся атомы 14 C переходят в молекулы 14 CO 2 Происходит быстрое перемешивание 14 CO 2 в атмосфере и гидросфере, и концентрация 14 CO 2 становится постоянной. Она остаётся постоянной, так продолжающийся распад 14 C уравновешивается его образованием в атмосфере Молекулы CO 2 попадают в ткани растений в результате фотосинтеза, далее в организмы животных. Концентрация 14 C в живых тканях постоянная, поскольку продолжающийся распад 14 C уравновешивается его поглощением из атмосферы
Принципы 14 C – метода датирования В настоящее время известно, что 14 C образуется в атмосфере по различным ядерным реакциям при взаимодействии вторичных нейтронов со стабильными изотопами N, O и C. Наиболее важная реакция: Образовавшиеся атомы 14 C переходят в молекулы 14 CO 2 Происходит быстрое перемешивание 14 CO 2 в атмосфере и гидросфере, и концентрация 14 CO 2 становится постоянной. Она остаётся постоянной, так продолжающийся распад 14 C уравновешивается его образованием в атмосфере Молекулы CO 2 попадают в ткани растений в результате фотосинтеза, далее в организмы животных. Концентрация 14 C в живых тканях постоянная, поскольку продолжающийся распад 14 C уравновешивается его поглощением из атмосферы
 Когда растение или животное умирает, поглощение 14 C из атмосферы прекращается, и в результате радиоактивного распада активность 14 C начинает уменьшаться. При распаде испускается бета-частица и образуется стабильный изотоп 14 N
Когда растение или животное умирает, поглощение 14 C из атмосферы прекращается, и в результате радиоактивного распада активность 14 C начинает уменьшаться. При распаде испускается бета-частица и образуется стабильный изотоп 14 N
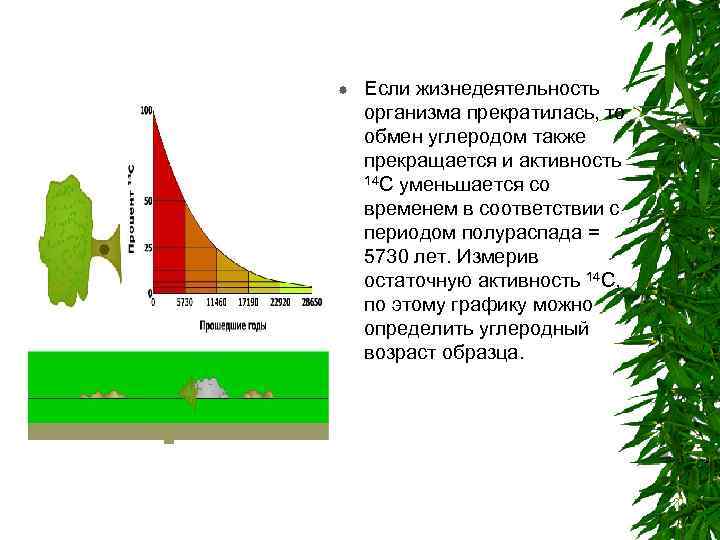 Если жизнедеятельность организма прекратилась, то обмен углеродом также прекращается и активность 14 C уменьшается со временем в соответствии с периодом полураспада = 5730 лет. Измерив остаточную активность 14 C, по этому графику можно определить углеродный возраст образца.
Если жизнедеятельность организма прекратилась, то обмен углеродом также прекращается и активность 14 C уменьшается со временем в соответствии с периодом полураспада = 5730 лет. Измерив остаточную активность 14 C, по этому графику можно определить углеродный возраст образца.
 Применение радиоуглеродного метода Лучший метод для датировки осадочных пород Палеонтология плейстоцена, эоплейстоцена
Применение радиоуглеродного метода Лучший метод для датировки осадочных пород Палеонтология плейстоцена, эоплейстоцена


