bb76bcac6fcb09fb2b60099222f29bfa.ppt
- Количество слайдов: 32

Работа выполнена учителем химии МОУ «СОШ № 2» ПОПКОВОЙ Е. Г.

«… Вода, у тебя нет ни цвета, ни вкуса, ни запаха, тебя невозможно описать, тобою наслаждаются, не ведая, что ты такое. Нельзя сказать, что ты необходима для жизни: ты – сама жизнь. Ты исполняешь нас радостью, которую не объяснишь нашими чувствами. С тобою возвращаются к нам силы, с которыми мы уже простились. По твоей милости в нас вновь начинают бурлить высохшие родники нашего сердца» . А. Сент - Экзюпери.

В кружево будто одеты Деревья, кусты, провода, И кажется сказкою это, А, в сущности, только вода.

Безбрежная ширь океана И тихая заводь пруда, Каскад водопада и брызги фонтана А всё это - только вода.

В бирюзовой дали исчезая Лебедями плывут облака. Вот туча идёт грозовая А, в сущности, только вода.

Высокие гребни вздымая, Бушует морская вода И топит, как будто играя, Большие морские суда.

Как пухом зимой одевает Снег белый родные поля, Но время придёт – всё растает И будет простая вода.

Вода у древних химиков считалась самым главным веществом: «Вода – начало всех начал» .

Водные источники у древних народов служили местом сборища всех богов, воде поклонялись как сверхъестественной силе, и она считалась матерью жизни и смерти.

Основатель греческой медицины Гиппократ, живший в 5 в. до н. э. , при лечении на одно из первых мест ставил воду.

Вода – самое распространённое вещество. • Три четверти поверхности планеты покрыто морями, океанами, реками, ледниками. • Вода в больших количествах содержится в земной коре. • Значительное количество воды содержит атмосфера. • Вода входит в состав горных пород и минералов (глина, гипс), • в состав почвы, • находится во всех растительных и животных организмах, достигая в некоторых случаях 99% их веса.

Вода в жизни человека • Без воды человек, например, мог бы прожить не более 2 – 3 дней. • За 60 лет человек в среднем выпивает 50 т. воды – целую железнодорожную цистерну. • Для обеспечения нормального существования человек должен вводить в организм воды больше 2 раза по весу, чем питательных веществ. • Если количество воды в человеческом теле уменьшится: – на 1 – 2% (0, 5 л) – человек испытывает лишь жажду; – на 5% (2 – 2, 5 л) – кожа сморщивается, во рту «пересыхает» , сознание затемняется; – (7 – 8 л) – человек умирает. • Кровь по химическому составу близка к морской воде (относительное содержание элементов в %).
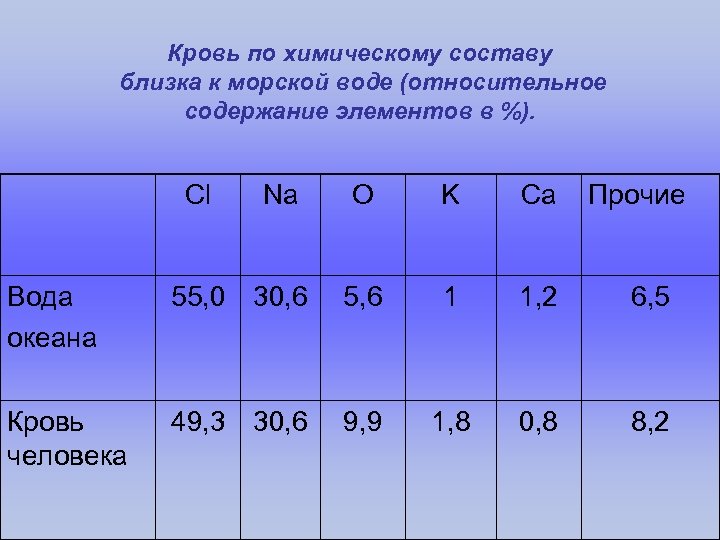
Кровь по химическому составу близка к морской воде (относительное содержание элементов в %). Cl Na O K Ca Прочие Вода океана 55, 0 30, 6 5, 6 1 1, 2 6, 5 Кровь человека 49, 3 30, 6 9, 9 1, 8 0, 8 8, 2

Химические свойства воды

Круговорот воды в природе. • В природе постоянно осуществляется круговорот веществ. Вода тоже не является исключением. В природе непрерывно идут процессы испарения, конденсации и выпадения осадков.

Значение воды. • Всё живое состоит из воды. • Вода – растворитель. • Вода – сырьё для химической промышленности. • Вода выступает в роли целителя, землекопа, средства тушения пожара, измерителя и т. д.

Экологическое состояние воды • Речные и морские суда загрязняют воду, в первую очередь, нефтепродуктами. • Ещё более интенсивно загрязняются водоёмы при лесосплаве. • Воды Мирового океана содержат миллиарды тонн калия, рубидия, урана, тория и радия. Вредные вещества, особенно обладающие длительным периодом полураспада, постепенно становятся постоянными компонентами морской воды и всё более влияют на её качества и биологическую продуктивность Мирового океана. • Десятки миллионов бутылок и пакетов из синтетических материалов используются для обитания различными рачками, моллюсками, водорослями. Течение переносит их на новые участки, приводя зачастую к неблагоприятным нарушениям уже сложившихся экологических систем, к нежелательному сдвигу природного равновесия.

Жесткость – это свойство природной воды, определяемое присутствием в ней растворенных солей кальция, магния, железа. Временная жесткость воды (карбонатная) характеризуется присутствием ионов: Постоянная жесткость воды характеризуется присутствием ионов:

В зависимости от значения жесткости воды различают следующие типы: • очень мягкие – 1, 5 мэкв/л; • мягкие – 1, 5 – 3, 0 мэкв/л; • средне-жёсткие – 3, 0 – 4, 5 мэкв/л; • довольно жёсткие – 4, 5 – 6, 5 мэкв/л; • жёсткие – 6, 5 – 11, 0 мэкв/л; • очень жёсткие – 11, 0 мэкв/л. Временная жёсткость может доходить до 70 80% общей жесткости воды.

Временную жесткость воды можно устранить: • кипячением • добавлением соды

ЖЕСТКАЯ ВОДА v снижает пенообразование и моющее действие мыла (образуются хлопья ) v ускоряет процесс коррозии vнеблагоприятно сказывается на органах пищеварения vможет вызвать моче-, желчно-, почечно-каменную болезнь v приводит к дополнительным энергозатратам (из-за образования накипи при термическом воздействии ) Накипь – Удаляют действием кислот

• Здоровье населения находится в прямой зависимости от состава природных вод в источниках, из которых осуществляется регулярное водоснабжение данной территории. Ежедневно употребляемая каждым человеком вода не должна, в идеале, содержать никаких вредных примесей, вредно воздействующих на здоровье человека. В то же время, природные воды должны содержать достаточное количество микроэлементов, участвующих в обменных процессах человека. Так, например, пониженное содержание фтора в питьевой воде способствует разрушению зубной эмали и развитию стоматологической патологии. Недостаток йода вызывает заболевания щитовидной железы. Бактериальное загрязнение природных вод представляет собой опасность возникновения и распространения инфекционных заболеваний, включая особо опасные инфекции.

Вода – привычное для нас вещество. И в то же время в ней столько необычного! В её свойствах много отклонений от нормы, аномалий.

Аномалия 1. Ближайшие родственники воды – Н 2 S – сероводород, Н 2 Se – селеноводород – газы, которые имеют температуру кипения ниже 0˚С. Вода же – жидкость с температурой кипения 100˚ С. Объяснение: Молекулы воды сцепляются друг с другом водородными связями. Это затрудняет испарение воды и повышает температуру кипения.


Аномалия 2. Вода – единственное вещество , которое при затвердевании расширяется. Поэтому плотность льда меньше плотности жидкой воды. Вот почему лёд плавает на поверхности воды. Объяснение: С понижением температуры увеличивается число водородных связей между молекулами воды. Это приводит к расположению молекул воды с ажурной кристаллической решёткой.

Аномалия 3. Вода – жидкость, хотя бывает в природе и в твёрдом, и в газообразном состояниях. е

Аномалия 4. Наличие водородных связей затрудняет испарение воды. Поэтому у неё очень высокая теплота испарения. Нет ни одного вещества, у которого бы удельная теплота испарения была бы больше, чем у воды.
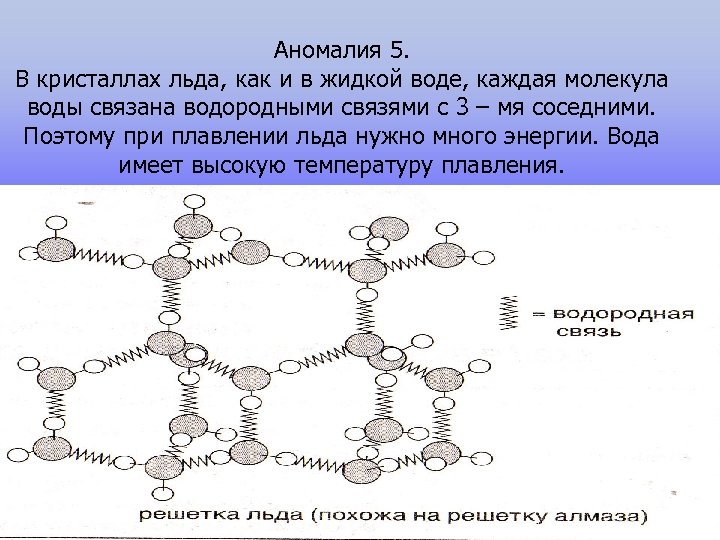
Аномалия 5. В кристаллах льда, как и в жидкой воде, каждая молекула воды связана водородными связями с 3 – мя соседними. Поэтому при плавлении льда нужно много энергии. Вода имеет высокую температуру плавления.

Аномалия 6. У воды самое высокое поверхностное натяжение из всех жидкостей, кроме ртути. Поверхность соды всегда затянута тончайшей плёнкой из молекул, прочно связанных водородными связями. Поэтому по поверхности воды бегают водомерки; вода поднимается вверх по сосудам стволов деревьев.

Аномалия 7. Вода – самое распространённое вещество на Земле, но мы говорим, что на Земле нет чистой воды. Всё, что мы называем водой, - растворы веществ в воде, так как вода – один из лучших растворителей.

Вода – привычное для нас вещество. И в то же время в ней столько необычного!
bb76bcac6fcb09fb2b60099222f29bfa.ppt