2b2333d2ce07d07966daa93445db9c7b.ppt
- Количество слайдов: 30
 р-элементы IVА группы. Подгруппа германия (Ґерманий, олово, свинец
р-элементы IVА группы. Подгруппа германия (Ґерманий, олово, свинец
 Германий Его соединения похожи на соединения кремния. Менее активен, чем кремний и олово – растворяется только в кислотах-окислителях и в щелочах в присутствии пероксида. Ge + 4 H 2 SO 4 (конц) = Ge(SO 4)2 + 2 SO 2 + 4 H 2 O Ge + 2 Na. OH + 2 H 2 O 2 = Na 2[Ge(OH)6] Олово и свинец Явно выражены металлические свойства. В отличие от более легких элементов IV группы, олово и свинец образуют преимущественно соли со степенью окисления +2: Sn + 2 HCl = Sn. Cl 2 + H 2 ↑
Германий Его соединения похожи на соединения кремния. Менее активен, чем кремний и олово – растворяется только в кислотах-окислителях и в щелочах в присутствии пероксида. Ge + 4 H 2 SO 4 (конц) = Ge(SO 4)2 + 2 SO 2 + 4 H 2 O Ge + 2 Na. OH + 2 H 2 O 2 = Na 2[Ge(OH)6] Олово и свинец Явно выражены металлические свойства. В отличие от более легких элементов IV группы, олово и свинец образуют преимущественно соли со степенью окисления +2: Sn + 2 HCl = Sn. Cl 2 + H 2 ↑
 Оба металла проявляют амфотерные свойства: Pb + 2 Na. OH + 2 H 2 O = Na 2[Pb(OH)4] + H 2 ↑ Концентрированная азотная кислота окисляет олово (и германий) до соответствующих кислот H 2 ЭО 3 , а свинец – до соли Pb(NO 3)2. Соединения свинца (IV) получаются только при действии сильных окислителей и сами являются сильными окислителями: 5 Pb. O 2 + 2 Mn. SO 4 + 3 H 2 SO 4 = 5 Pb. SO 4 + 2 HMn. O 4 + 2 H 2 O
Оба металла проявляют амфотерные свойства: Pb + 2 Na. OH + 2 H 2 O = Na 2[Pb(OH)4] + H 2 ↑ Концентрированная азотная кислота окисляет олово (и германий) до соответствующих кислот H 2 ЭО 3 , а свинец – до соли Pb(NO 3)2. Соединения свинца (IV) получаются только при действии сильных окислителей и сами являются сильными окислителями: 5 Pb. O 2 + 2 Mn. SO 4 + 3 H 2 SO 4 = 5 Pb. SO 4 + 2 HMn. O 4 + 2 H 2 O
 Оксид олова (IV) – полупроводник, причем прозрачный для видимого света. Поэтому его используют (вместе с оксидом индия) для изготовления токопроводящих дорожек жидкокристаллических индикаторов и дисплеев, а также для нагревателей стеклянной посуды и химических датчиков (сенсоров). К последним относятся популярные сейчас датчики СО/СН (угарный газ и углеводороды) на постах экологического контроля автомобилей. Свинцовые аккумуляторы (см. лекцию 5): ЭДС мин. 2, 1 В; зарядный ток = 1/10 емкости; емкость 3 -4 Ач/кг. Выпускается 100 млн. свинц. аккумуляторов в год. Pb. O 2 + 2 H 2 SO 4 + Pb ↔ Pb. SO 4 + 2 H 2 O + Pb. SO 4 → разряд
Оксид олова (IV) – полупроводник, причем прозрачный для видимого света. Поэтому его используют (вместе с оксидом индия) для изготовления токопроводящих дорожек жидкокристаллических индикаторов и дисплеев, а также для нагревателей стеклянной посуды и химических датчиков (сенсоров). К последним относятся популярные сейчас датчики СО/СН (угарный газ и углеводороды) на постах экологического контроля автомобилей. Свинцовые аккумуляторы (см. лекцию 5): ЭДС мин. 2, 1 В; зарядный ток = 1/10 емкости; емкость 3 -4 Ач/кг. Выпускается 100 млн. свинц. аккумуляторов в год. Pb. O 2 + 2 H 2 SO 4 + Pb ↔ Pb. SO 4 + 2 H 2 O + Pb. SO 4 → разряд
 Получение: Ge. O 2 +2 H 2 → Ge + 2 H 2 O↑, Ge. O 2 +C → Ge + CO 2↑ Ge. Cl 4 +2 H 2 → Ge + 4 HCl Sn. O 2 + 2 H 2 → Sn + 2 H 2 O Sn. O 2 + 2 C → Sn + 2 CO↑ Sn. Cl 2 + Mg → Sn + Mg. Cl 2 (200 -300ºС) 3 Sn. Cl 2 + 2 Al → 3 Sn + 2 Al. Cl 3 (250 -300ºС) 2 Sn. SO 4+2 H 2 O → 2 Sn↓(катод) + H 2 SO 4 + O 2↑(анод) Sn. Cl 2 → Sn↓(катод) + Cl 2↑(анод)
Получение: Ge. O 2 +2 H 2 → Ge + 2 H 2 O↑, Ge. O 2 +C → Ge + CO 2↑ Ge. Cl 4 +2 H 2 → Ge + 4 HCl Sn. O 2 + 2 H 2 → Sn + 2 H 2 O Sn. O 2 + 2 C → Sn + 2 CO↑ Sn. Cl 2 + Mg → Sn + Mg. Cl 2 (200 -300ºС) 3 Sn. Cl 2 + 2 Al → 3 Sn + 2 Al. Cl 3 (250 -300ºС) 2 Sn. SO 4+2 H 2 O → 2 Sn↓(катод) + H 2 SO 4 + O 2↑(анод) Sn. Cl 2 → Sn↓(катод) + Cl 2↑(анод)
 Pb. S + H 2 → Pb + H 2 S (400 -600ºС) Pb. O + H 2 → Pb + H 2 O (200 -350ºС) Pb. Cl 2 + H 2 → Pb + 2 HCl (300 -350ºС) Pb. O + CO → Pb + CO 2 (300 -400ºС) Pb(NO 3)2 + Zn → Pb↓ + Zn(NO 3)2 Pb. SO 4(вологий) + Zn → Pb↓(губка) + Zn. SO 4 2 Pb. S + 3 O 2 → 2 Pb. O + 2 SO 2↑ 2 Pb+2 O + Pb+2 S-2 → 3 Pb 0 + S+4 O 2↑ Pb. O + CO → Pb + CO 2 2 Pb(NO 3)2 + 2 H 2 O → 2 Pb↓(катод) +4 HNO 3 + O 2↑(анод)
Pb. S + H 2 → Pb + H 2 S (400 -600ºС) Pb. O + H 2 → Pb + H 2 O (200 -350ºС) Pb. Cl 2 + H 2 → Pb + 2 HCl (300 -350ºС) Pb. O + CO → Pb + CO 2 (300 -400ºС) Pb(NO 3)2 + Zn → Pb↓ + Zn(NO 3)2 Pb. SO 4(вологий) + Zn → Pb↓(губка) + Zn. SO 4 2 Pb. S + 3 O 2 → 2 Pb. O + 2 SO 2↑ 2 Pb+2 O + Pb+2 S-2 → 3 Pb 0 + S+4 O 2↑ Pb. O + CO → Pb + CO 2 2 Pb(NO 3)2 + 2 H 2 O → 2 Pb↓(катод) +4 HNO 3 + O 2↑(анод)
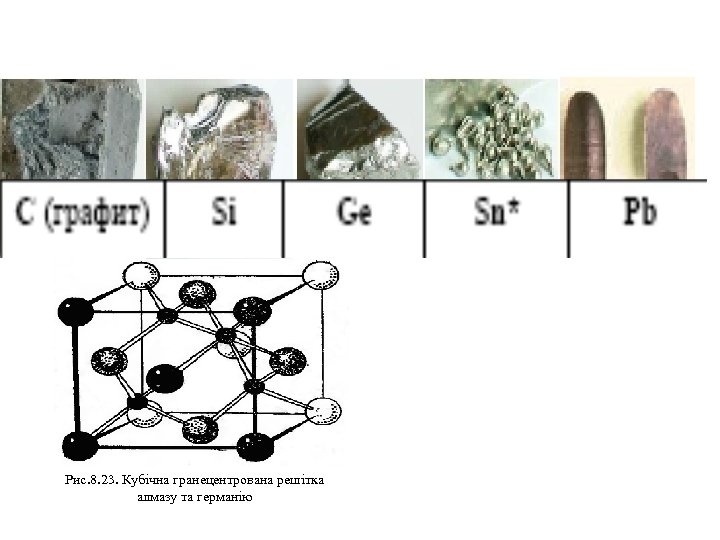 Рис. 8. 23. Кубічна гранецентрована решітка алмазу та германію
Рис. 8. 23. Кубічна гранецентрована решітка алмазу та германію
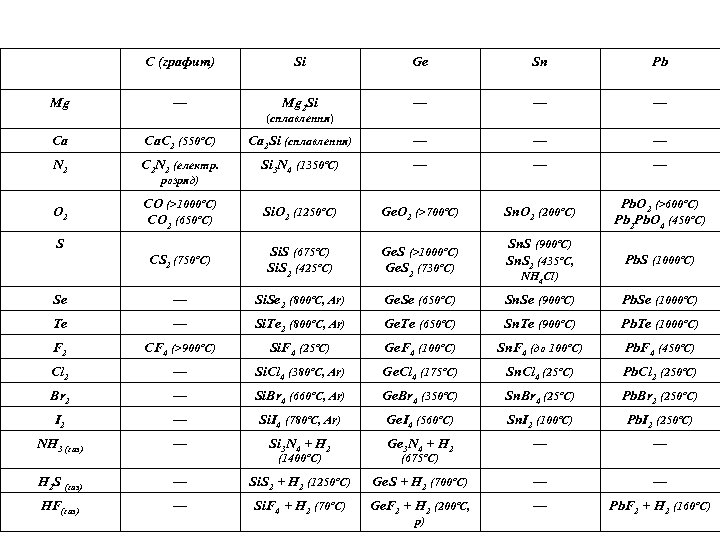 С (графит) Mg Si Ge Sn Pb — Mg 2 Si — — — (сплавлення) Ca Ca. C 2 (550ºC) Ca 2 Si (сплавлення) — — — N 2 C 2 N 2 (електр. Si 3 N 4 (1350ºC) — — — O 2 CO (>1000ºC) CO 2 (650ºC) Si. O 2 (1250ºC) Ge. O 2 (>700ºC) Sn. O 2 (200ºC) Pb. O 2 (>600ºC) Pb 2 Pb. O 4 (450ºC) CS 2 (750ºC) Si. S (675ºC) Si. S 2 (425ºC) Ge. S (>1000ºC) Ge. S 2 (730ºC) Sn. S (900ºC) Sn. S 2 (435ºC, Pb. S (1000ºC) Se — Si. Se 2 (800ºC, Ar) Ge. Se (650ºC) Sn. Se (900ºC) Pb. Se (1000ºC) Te — Si. Te 2 (800ºC, Ar) Ge. Te (650ºC) Sn. Te (900ºC) Pb. Te (1000ºC) F 2 CF 4 (>900ºC) Si. F 4 (25ºC) Ge. F 4 (100ºC) Sn. F 4 (до 100ºC) Pb. F 4 (450ºC) Cl 2 — Si. Cl 4 (380ºC, Ar) Ge. Cl 4 (175ºC) Sn. Cl 4 (25ºC) Pb. Cl 2 (250ºC) Br 2 — Si. Br 4 (660ºC, Ar) Ge. Br 4 (350ºC) Sn. Br 4 (25ºC) Pb. Br 2 (250ºC) I 2 — Si. I 4 (780ºC, Ar) Ge. I 4 (560ºC) Sn. I 2 (100ºC) Pb. I 2 (250ºC) NH 3 (газ) — Si 3 N 4 + H 2 Ge 3 N 4 + H 2 — — H 2 S (газ) — Si. S 2 + H 2 (1250ºC) Ge. S + H 2 (700ºC) — — HF(газ) — Si. F 4 + H 2 (70ºC) Ge. F 2 + H 2 (200ºC, — Pb. F 2 + H 2 (160ºC) розряд) S (1400ºC) NH 4 Cl) (675ºC) p)
С (графит) Mg Si Ge Sn Pb — Mg 2 Si — — — (сплавлення) Ca Ca. C 2 (550ºC) Ca 2 Si (сплавлення) — — — N 2 C 2 N 2 (електр. Si 3 N 4 (1350ºC) — — — O 2 CO (>1000ºC) CO 2 (650ºC) Si. O 2 (1250ºC) Ge. O 2 (>700ºC) Sn. O 2 (200ºC) Pb. O 2 (>600ºC) Pb 2 Pb. O 4 (450ºC) CS 2 (750ºC) Si. S (675ºC) Si. S 2 (425ºC) Ge. S (>1000ºC) Ge. S 2 (730ºC) Sn. S (900ºC) Sn. S 2 (435ºC, Pb. S (1000ºC) Se — Si. Se 2 (800ºC, Ar) Ge. Se (650ºC) Sn. Se (900ºC) Pb. Se (1000ºC) Te — Si. Te 2 (800ºC, Ar) Ge. Te (650ºC) Sn. Te (900ºC) Pb. Te (1000ºC) F 2 CF 4 (>900ºC) Si. F 4 (25ºC) Ge. F 4 (100ºC) Sn. F 4 (до 100ºC) Pb. F 4 (450ºC) Cl 2 — Si. Cl 4 (380ºC, Ar) Ge. Cl 4 (175ºC) Sn. Cl 4 (25ºC) Pb. Cl 2 (250ºC) Br 2 — Si. Br 4 (660ºC, Ar) Ge. Br 4 (350ºC) Sn. Br 4 (25ºC) Pb. Br 2 (250ºC) I 2 — Si. I 4 (780ºC, Ar) Ge. I 4 (560ºC) Sn. I 2 (100ºC) Pb. I 2 (250ºC) NH 3 (газ) — Si 3 N 4 + H 2 Ge 3 N 4 + H 2 — — H 2 S (газ) — Si. S 2 + H 2 (1250ºC) Ge. S + H 2 (700ºC) — — HF(газ) — Si. F 4 + H 2 (70ºC) Ge. F 2 + H 2 (200ºC, — Pb. F 2 + H 2 (160ºC) розряд) S (1400ºC) NH 4 Cl) (675ºC) p)
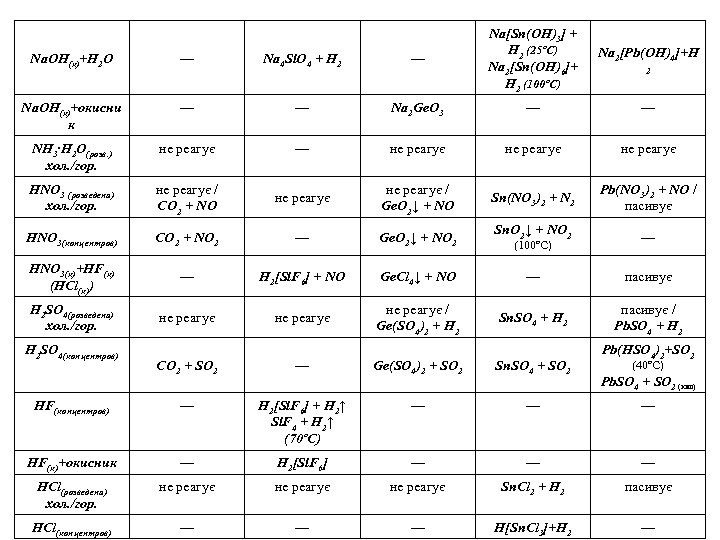 Na. OH(к)+H 2 O — Na 4 Si. O 4 + H 2 — Na[Sn(OH)3] + H 2 (25ºC) Na 2[Sn(OH)6]+ H 2 (100ºC) Na. OH(к)+окисни к — — Na 2 Ge. O 3 — — NH 3∙H 2 O(розв. ) хол. /гор. не реагує — не реагує HNO 3 (розведена) хол. /гор. не реагує / CO 2 + NO не реагує / Ge. O 2↓ + NO Sn(NO 3)2 + N 2 Pb(NO 3)2 + NO / пасивує HNO 3(концентров) CO 2 + NO 2 — Ge. O 2↓ + NO 2 Sn. O 2↓ + NO 2 — HNO 3(к)+HF(к) (HCl(к)) — H 2[Si. F 6] + NO Ge. Cl 4↓ + NO — пасивує H 2 SO 4(розведена) хол. /гор. не реагує / Ge(SO 4)2 + H 2 Sn. SO 4 + H 2 пасивує / Pb. SO 4 + H 2 SO 4(концентров) CO 2 + SO 2 — HF(концентров) — HF(к)+окисник (100ºC) Na 2[Pb(OH)4]+H 2 Pb(HSO 4)2+SO 2 Ge(SO 4)2 + SO 2 Sn. SO 4 + SO 2 H 2[Si. F 6] + Н 2↑ Si. F 4 + Н 2↑ (70ºС) — — H 2[Si. F 6] — — — HCl(розведена) хол. /гор. не реагує Sn. Cl 2 + H 2 пасивує HCl(концентров) — — — H[Sn. Cl 3]+H 2 — (40ºC) Pb. SO 4 + SO 2 (кип)
Na. OH(к)+H 2 O — Na 4 Si. O 4 + H 2 — Na[Sn(OH)3] + H 2 (25ºC) Na 2[Sn(OH)6]+ H 2 (100ºC) Na. OH(к)+окисни к — — Na 2 Ge. O 3 — — NH 3∙H 2 O(розв. ) хол. /гор. не реагує — не реагує HNO 3 (розведена) хол. /гор. не реагує / CO 2 + NO не реагує / Ge. O 2↓ + NO Sn(NO 3)2 + N 2 Pb(NO 3)2 + NO / пасивує HNO 3(концентров) CO 2 + NO 2 — Ge. O 2↓ + NO 2 Sn. O 2↓ + NO 2 — HNO 3(к)+HF(к) (HCl(к)) — H 2[Si. F 6] + NO Ge. Cl 4↓ + NO — пасивує H 2 SO 4(розведена) хол. /гор. не реагує / Ge(SO 4)2 + H 2 Sn. SO 4 + H 2 пасивує / Pb. SO 4 + H 2 SO 4(концентров) CO 2 + SO 2 — HF(концентров) — HF(к)+окисник (100ºC) Na 2[Pb(OH)4]+H 2 Pb(HSO 4)2+SO 2 Ge(SO 4)2 + SO 2 Sn. SO 4 + SO 2 H 2[Si. F 6] + Н 2↑ Si. F 4 + Н 2↑ (70ºС) — — H 2[Si. F 6] — — — HCl(розведена) хол. /гор. не реагує Sn. Cl 2 + H 2 пасивує HCl(концентров) — — — H[Sn. Cl 3]+H 2 — (40ºC) Pb. SO 4 + SO 2 (кип)
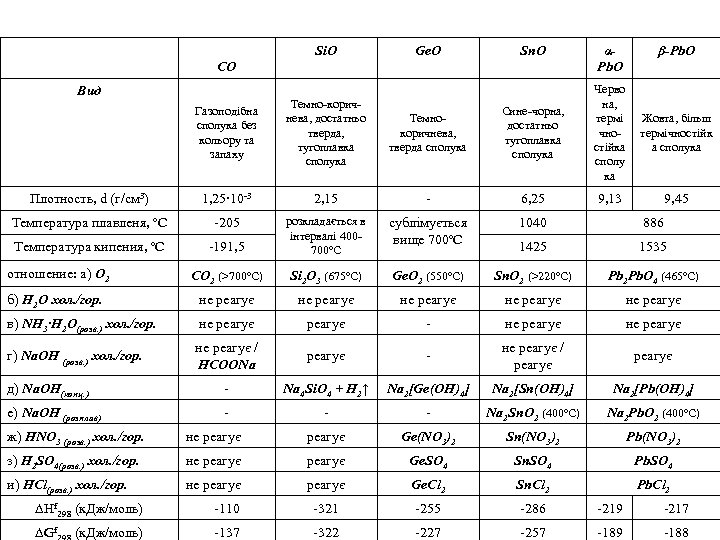 Si. O Ge. O Sn. O CO Вид αPb. O β-Pb. O Черво на, термі Жовта, більш чнотермічностійка а сполука сполу ка Газоподібна сполука без кольору та запаху Темно-коричнева, достатньо тверда, тугоплавка сполука Темнокоричнева, тверда сполука Сине-чорна, достатньо тугоплавка сполука Плотность, d (г/см 3) 1, 25∙ 10‑ 3 2, 15 ‑ 6, 25 Температура плавленя, ºС ‑ 205 886 ‑ 191, 5 сублімується вище 700ºС 1040 Температура кипения, ºС розкладається в інтервалі 400700ºС 1425 1535 отношение: а) О 2 CO 2 (>700ºC) Si 2 O 3 (675ºC) Ge. O 2 (550ºС) Sn. O 2 (>220ºC) Pb 2 Pb. O 4 (465ºC) б) H 2 O хол. /гор. не реагує не реагує в) NH 3∙H 2 O(розв. ) хол. /гор. не реагує ‑ не реагує г) Na. OH (розв. ) хол. /гор. не реагує / HCOONa реагує ‑ не реагує / реагує д) Na. OH(конц. ) ‑ Na 4 Si. O 4 + Н 2↑ Na 2[Ge(OH)4] Na 2[Sn(OH)4] Na 2[Pb(OH)4] е) Na. OH (розплав) ‑ ‑ ‑ Na 2 Sn. O 2 (400ºC) Na 2 Pb. O 2 (400ºC) 9, 13 9, 45 ж) HNO 3 (розв. ) хол. /гор. не реагує Ge(NO 3)2 Sn(NO 3)2 Pb(NO 3)2 з) H 2 SO 4(розв. ) хол. /гор. не реагує Ge. SO 4 Sn. SO 4 Pb. SO 4 и) HCl(розв. ) хол. /гор. не реагує Ge. Cl 2 Sn. Cl 2 Pb. Cl 2 ∆Нf 298 (к. Дж/моль) ‑ 110 ‑ 321 ‑ 255 ‑ 286 ‑ 219 ‑ 217 ∆Gf (к. Дж/моль) ‑ 137 ‑ 322 ‑ 227 ‑ 257 ‑ 189 ‑ 188
Si. O Ge. O Sn. O CO Вид αPb. O β-Pb. O Черво на, термі Жовта, більш чнотермічностійка а сполука сполу ка Газоподібна сполука без кольору та запаху Темно-коричнева, достатньо тверда, тугоплавка сполука Темнокоричнева, тверда сполука Сине-чорна, достатньо тугоплавка сполука Плотность, d (г/см 3) 1, 25∙ 10‑ 3 2, 15 ‑ 6, 25 Температура плавленя, ºС ‑ 205 886 ‑ 191, 5 сублімується вище 700ºС 1040 Температура кипения, ºС розкладається в інтервалі 400700ºС 1425 1535 отношение: а) О 2 CO 2 (>700ºC) Si 2 O 3 (675ºC) Ge. O 2 (550ºС) Sn. O 2 (>220ºC) Pb 2 Pb. O 4 (465ºC) б) H 2 O хол. /гор. не реагує не реагує в) NH 3∙H 2 O(розв. ) хол. /гор. не реагує ‑ не реагує г) Na. OH (розв. ) хол. /гор. не реагує / HCOONa реагує ‑ не реагує / реагує д) Na. OH(конц. ) ‑ Na 4 Si. O 4 + Н 2↑ Na 2[Ge(OH)4] Na 2[Sn(OH)4] Na 2[Pb(OH)4] е) Na. OH (розплав) ‑ ‑ ‑ Na 2 Sn. O 2 (400ºC) Na 2 Pb. O 2 (400ºC) 9, 13 9, 45 ж) HNO 3 (розв. ) хол. /гор. не реагує Ge(NO 3)2 Sn(NO 3)2 Pb(NO 3)2 з) H 2 SO 4(розв. ) хол. /гор. не реагує Ge. SO 4 Sn. SO 4 Pb. SO 4 и) HCl(розв. ) хол. /гор. не реагує Ge. Cl 2 Sn. Cl 2 Pb. Cl 2 ∆Нf 298 (к. Дж/моль) ‑ 110 ‑ 321 ‑ 255 ‑ 286 ‑ 219 ‑ 217 ∆Gf (к. Дж/моль) ‑ 137 ‑ 322 ‑ 227 ‑ 257 ‑ 189 ‑ 188
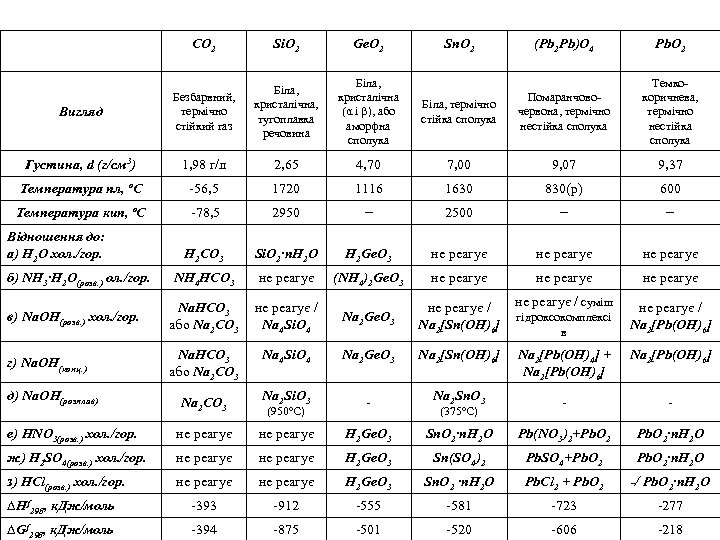 СО 2 Si. O 2 Ge. O 2 Вигляд Безбарвний, термічно стійкий газ Біла, кристалічна, тугоплавка речовина Біла, кристалічна (α і β), або аморфна сполука Густина, d (г/см 3) 1, 98 г/л 2, 65 Температура пл, ºС ‑ 56, 5 Температура кип, ºС (Pb 2 Pb)O 4 Pb. O 2 Біла, термічно стійка сполука Помаранчовочервона, термічно нестійка сполука Темкокоричнева, термічно нестійка сполука 4, 70 7, 00 9, 07 9, 37 1720 1116 1630 830(р) 600 ‑ 78, 5 2950 − 2500 − − H 2 CO 3 Si. O 2∙n. H 2 O H 2 Ge. O 3 не реагує NH 4 HCO 3 не реагує (NH 4)2 Ge. O 3 не реагує в) Nа. ОH(розв. ) хол. /гор. Na. HCO 3 або Nа 2 CO 3 не реагує / Nа 4 Si. O 4 Nа 2 Ge. O 3 не реагує / Na 2[Sn(ОН)6] не реагує / суміш не реагує / Na 2[Pb(ОН)6] г) Nа. ОH(конц. ) Na. HCO 3 або Nа 2 CO 3 Nа 4 Si. O 4 Nа 2 Ge. O 3 Na 2[Sn(ОН)6] Na 2[Pb(ОН)4] + Na 2[Pb(ОН)6] Nа 2 Si. O 3 ‑ Na 2 Sn. О 3 ‑ ‑ Відношення до: а) Н 2 О хол. /гор. б) NH 3∙H 2 O(розв. ) ол. /гор. д) Nа. ОH(розплав) Nа 2 CO 3 (950ºС) Sn. O 2 (375ºС) гідроксокомплексі в е) НNО 3(розв. ) хол. /гор. не реагує H 2 Ge. O 3 Sn. O 2∙n. H 2 О Pb(NO 3)2+Pb. O 2∙n. H 2 О ж) H 2 SO 4(розв. ) хол. /гор. не реагує H 2 Ge. O 3 Sn(SO 4)2 Pb. SO 4+Pb. O 2∙n. H 2 О з) HCl(розв. ) хол. /гор. не реагує H 2 Ge. O 3 Sn. O 2 ∙n. H 2 О Pb. Cl 2 + Pb. O 2 ‑/ Pb. O 2∙n. H 2 О ∆Нf 298, к. Дж/моль ‑ 393 ‑ 912 ‑ 555 ‑ 581 ‑ 723 ‑ 277 ∆Gf 298, к. Дж/моль ‑ 394 ‑ 875 ‑ 501 ‑ 520 ‑ 606 ‑ 218
СО 2 Si. O 2 Ge. O 2 Вигляд Безбарвний, термічно стійкий газ Біла, кристалічна, тугоплавка речовина Біла, кристалічна (α і β), або аморфна сполука Густина, d (г/см 3) 1, 98 г/л 2, 65 Температура пл, ºС ‑ 56, 5 Температура кип, ºС (Pb 2 Pb)O 4 Pb. O 2 Біла, термічно стійка сполука Помаранчовочервона, термічно нестійка сполука Темкокоричнева, термічно нестійка сполука 4, 70 7, 00 9, 07 9, 37 1720 1116 1630 830(р) 600 ‑ 78, 5 2950 − 2500 − − H 2 CO 3 Si. O 2∙n. H 2 O H 2 Ge. O 3 не реагує NH 4 HCO 3 не реагує (NH 4)2 Ge. O 3 не реагує в) Nа. ОH(розв. ) хол. /гор. Na. HCO 3 або Nа 2 CO 3 не реагує / Nа 4 Si. O 4 Nа 2 Ge. O 3 не реагує / Na 2[Sn(ОН)6] не реагує / суміш не реагує / Na 2[Pb(ОН)6] г) Nа. ОH(конц. ) Na. HCO 3 або Nа 2 CO 3 Nа 4 Si. O 4 Nа 2 Ge. O 3 Na 2[Sn(ОН)6] Na 2[Pb(ОН)4] + Na 2[Pb(ОН)6] Nа 2 Si. O 3 ‑ Na 2 Sn. О 3 ‑ ‑ Відношення до: а) Н 2 О хол. /гор. б) NH 3∙H 2 O(розв. ) ол. /гор. д) Nа. ОH(розплав) Nа 2 CO 3 (950ºС) Sn. O 2 (375ºС) гідроксокомплексі в е) НNО 3(розв. ) хол. /гор. не реагує H 2 Ge. O 3 Sn. O 2∙n. H 2 О Pb(NO 3)2+Pb. O 2∙n. H 2 О ж) H 2 SO 4(розв. ) хол. /гор. не реагує H 2 Ge. O 3 Sn(SO 4)2 Pb. SO 4+Pb. O 2∙n. H 2 О з) HCl(розв. ) хол. /гор. не реагує H 2 Ge. O 3 Sn. O 2 ∙n. H 2 О Pb. Cl 2 + Pb. O 2 ‑/ Pb. O 2∙n. H 2 О ∆Нf 298, к. Дж/моль ‑ 393 ‑ 912 ‑ 555 ‑ 581 ‑ 723 ‑ 277 ∆Gf 298, к. Дж/моль ‑ 394 ‑ 875 ‑ 501 ‑ 520 ‑ 606 ‑ 218
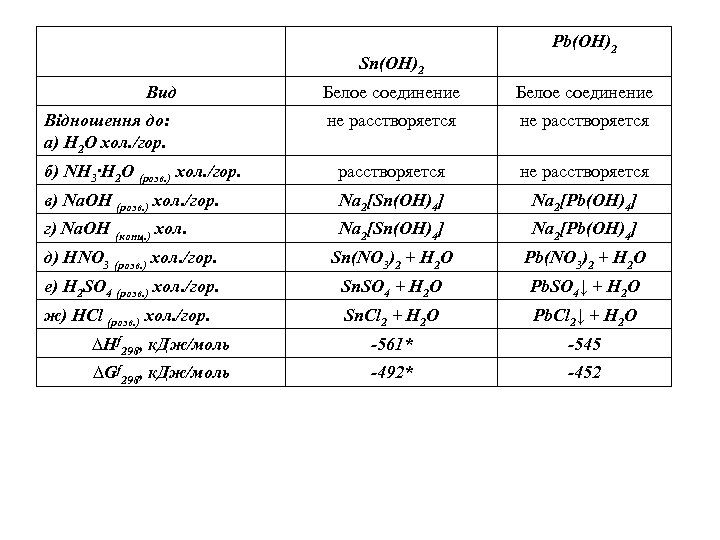 Sn(OH)2 Вид Pb(OH)2 Белое соединение не расстворяется б) NH 3∙H 2 O (розв. ) хол. /гор. расстворяется не расстворяется в) Nа. ОH (розв. ) хол. /гор. Na 2[Sn(ОН)4] Na 2[Pb(ОН)4] г) Nа. ОH (конц. ) хол. Na 2[Sn(ОН)4] Na 2[Pb(ОН)4] д) НNО 3 (розв. ) хол. /гор. Sn(NO 3)2 + H 2 О Pb(NO 3)2 + H 2 О е) H 2 SO 4 (розв. ) хол. /гор. Sn. SO 4 + H 2 О Pb. SO 4↓ + H 2 О ж) HCl (розв. ) хол. /гор. Sn. Cl 2 + H 2 О Pb. Cl 2↓ + H 2 О ∆Нf 298, к. Дж/моль -561* -545 ∆Gf 298, к. Дж/моль -492* -452 Відношення до: а) Н 2 О хол. /гор.
Sn(OH)2 Вид Pb(OH)2 Белое соединение не расстворяется б) NH 3∙H 2 O (розв. ) хол. /гор. расстворяется не расстворяется в) Nа. ОH (розв. ) хол. /гор. Na 2[Sn(ОН)4] Na 2[Pb(ОН)4] г) Nа. ОH (конц. ) хол. Na 2[Sn(ОН)4] Na 2[Pb(ОН)4] д) НNО 3 (розв. ) хол. /гор. Sn(NO 3)2 + H 2 О Pb(NO 3)2 + H 2 О е) H 2 SO 4 (розв. ) хол. /гор. Sn. SO 4 + H 2 О Pb. SO 4↓ + H 2 О ж) HCl (розв. ) хол. /гор. Sn. Cl 2 + H 2 О Pb. Cl 2↓ + H 2 О ∆Нf 298, к. Дж/моль -561* -545 ∆Gf 298, к. Дж/моль -492* -452 Відношення до: а) Н 2 О хол. /гор.
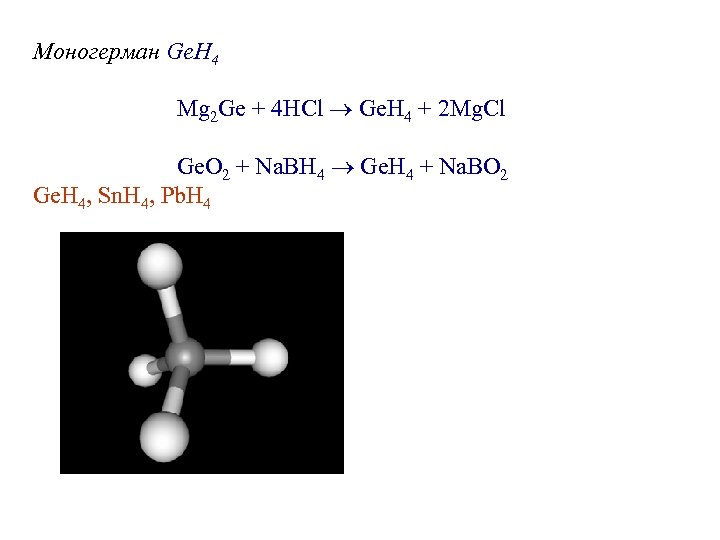 Моногерман Ge. H 4 Mg 2 Ge + 4 HCl Ge. H 4 + 2 Mg. Cl Ge. O 2 + Na. BH 4 Ge. H 4 + Na. BO 2 Ge. H 4, Sn. H 4, Pb. H 4
Моногерман Ge. H 4 Mg 2 Ge + 4 HCl Ge. H 4 + 2 Mg. Cl Ge. O 2 + Na. BH 4 Ge. H 4 + Na. BO 2 Ge. H 4, Sn. H 4, Pb. H 4
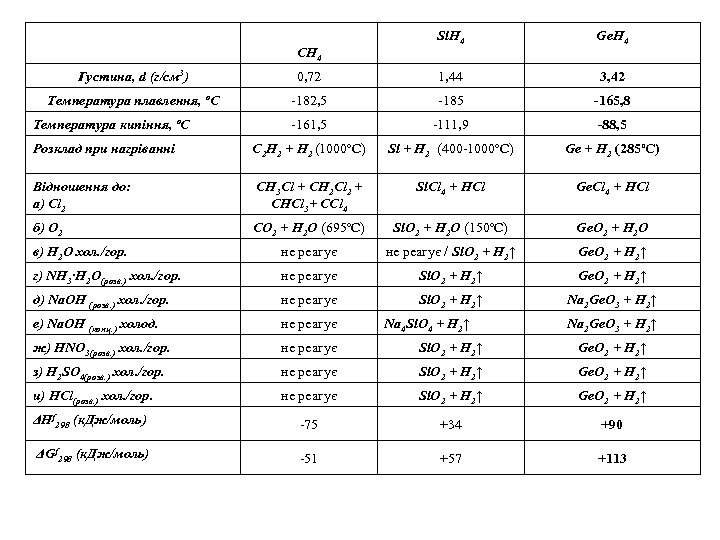 CH 4 Si. H 4 Ge. H 4 Густина, d (г/см 3) 0, 72 1, 44 3, 42 Температура плавлення, ºС ‑ 182, 5 ‑ 185 ‑ 165, 8 ‑ 161, 5 ‑ 111, 9 ‑ 88, 5 Розклад при нагріванні C 2 H 2 + H 2 (1000ºC) Si + H 2 (400 -1000ºC) Ge + H 2 (285ºC) Відношення до: а) Cl 2 CH 3 Cl + CH 2 Cl 2 + CHCl 3+ CCl 4 Si. Cl 4 + HCl Ge. Cl 4 + HCl б) O 2 CO 2 + H 2 O (695ºC) Si. O 2 + H 2 O (150ºC) Ge. O 2 + H 2 O в) Н 2 О хол. /гор. не реагує / Si. O 2 + H 2↑ Ge. O 2 + H 2↑ г) NH 3∙H 2 O(розв. ) хол. /гор. не реагує Si. O 2 + H 2↑ Ge. O 2 + H 2↑ д) Na. OH (розв. ) хол. /гор. не реагує Si. O 2 + H 2↑ Na 2 Ge. O 3 + H 2↑ е) Na. OH (конц. ) холод. не реагує ж) HNO 3(розв. ) хол. /гор. не реагує Si. O 2 + H 2↑ Ge. O 2 + H 2↑ з) H 2 SO 4(розв. ) хол. /гор. не реагує Si. O 2 + H 2↑ Ge. O 2 + H 2↑ и) HCl(розв. ) хол. /гор. не реагує Si. O 2 + H 2↑ Ge. O 2 + H 2↑ ΔНf 298 (к. Дж/моль) ‑ 75 +34 +90 ΔGf 298 (к. Дж/моль) ‑ 51 +57 +113 Температура кипіння, ºС Na 4 Si. O 4 + H 2↑ Na 2 Ge. O 3 + H 2↑
CH 4 Si. H 4 Ge. H 4 Густина, d (г/см 3) 0, 72 1, 44 3, 42 Температура плавлення, ºС ‑ 182, 5 ‑ 185 ‑ 165, 8 ‑ 161, 5 ‑ 111, 9 ‑ 88, 5 Розклад при нагріванні C 2 H 2 + H 2 (1000ºC) Si + H 2 (400 -1000ºC) Ge + H 2 (285ºC) Відношення до: а) Cl 2 CH 3 Cl + CH 2 Cl 2 + CHCl 3+ CCl 4 Si. Cl 4 + HCl Ge. Cl 4 + HCl б) O 2 CO 2 + H 2 O (695ºC) Si. O 2 + H 2 O (150ºC) Ge. O 2 + H 2 O в) Н 2 О хол. /гор. не реагує / Si. O 2 + H 2↑ Ge. O 2 + H 2↑ г) NH 3∙H 2 O(розв. ) хол. /гор. не реагує Si. O 2 + H 2↑ Ge. O 2 + H 2↑ д) Na. OH (розв. ) хол. /гор. не реагує Si. O 2 + H 2↑ Na 2 Ge. O 3 + H 2↑ е) Na. OH (конц. ) холод. не реагує ж) HNO 3(розв. ) хол. /гор. не реагує Si. O 2 + H 2↑ Ge. O 2 + H 2↑ з) H 2 SO 4(розв. ) хол. /гор. не реагує Si. O 2 + H 2↑ Ge. O 2 + H 2↑ и) HCl(розв. ) хол. /гор. не реагує Si. O 2 + H 2↑ Ge. O 2 + H 2↑ ΔНf 298 (к. Дж/моль) ‑ 75 +34 +90 ΔGf 298 (к. Дж/моль) ‑ 51 +57 +113 Температура кипіння, ºС Na 4 Si. O 4 + H 2↑ Na 2 Ge. O 3 + H 2↑
 1. 2. Тетрагалогениды Si, Ge, Sn, Pb Все ЕХ 4 (крім Pb. Cl 4) получают прямым галогенированием: Ge + 2 Cl 2 Ge. Cl 4 (NH 4)2 Pb. Cl 6 + H 2 SO 4 Pb. Cl 4↓+ (NH 4)2 SO 4 + 2 HCl 2. 2 KF + Si. F 4 = K 2 Si. F 6 2 Na. Cl + Sn. Cl 4 = Na 2 Sn. Cl 6 Ge. Cl 4 + 2 H 2 O Ge. O 2 + 4 HCl Ge + 2 F 2 Ge. F 4 Ba. Ge. F 6 Ge. F 4 + Ba. F 2 3 Ge. F 4 + 2 H 2 O Ge. O 2 + 2 H 2 Ge. F 6 Ge + 2 Cl 2 Ge. Cl 4 Ge. O 2 + 4 HCl Ge. Cl 4 + 2 H 2 O 2 Ge. Cl 4 + Ge 2 Ge. Cl 2 Ge + 3 HCl Hg. Ge. Cl 3 + H 2 2 HGe. Cl 3 2 Ge. Cl 2 + 2 HCl Ge. Cl 4 + Ge + 2 HCl Pb. F 4
1. 2. Тетрагалогениды Si, Ge, Sn, Pb Все ЕХ 4 (крім Pb. Cl 4) получают прямым галогенированием: Ge + 2 Cl 2 Ge. Cl 4 (NH 4)2 Pb. Cl 6 + H 2 SO 4 Pb. Cl 4↓+ (NH 4)2 SO 4 + 2 HCl 2. 2 KF + Si. F 4 = K 2 Si. F 6 2 Na. Cl + Sn. Cl 4 = Na 2 Sn. Cl 6 Ge. Cl 4 + 2 H 2 O Ge. O 2 + 4 HCl Ge + 2 F 2 Ge. F 4 Ba. Ge. F 6 Ge. F 4 + Ba. F 2 3 Ge. F 4 + 2 H 2 O Ge. O 2 + 2 H 2 Ge. F 6 Ge + 2 Cl 2 Ge. Cl 4 Ge. O 2 + 4 HCl Ge. Cl 4 + 2 H 2 O 2 Ge. Cl 4 + Ge 2 Ge. Cl 2 Ge + 3 HCl Hg. Ge. Cl 3 + H 2 2 HGe. Cl 3 2 Ge. Cl 2 + 2 HCl Ge. Cl 4 + Ge + 2 HCl Pb. F 4
 Германий образует сульфиды– Ge. S 2, Ge. S 2 Ge. O 2 + 3 S Ge. S 2 + SO 2 Ge. Cl 4 + 2 H 2 S Ge. S 2 + 4 HCl (реакцію каталізує HCl) Ge. S 2 + 6 Na. OH Na 2[Ge(OH)6] + 2 Na 2 S Ge. S 2 + (NH 4)2 S (NH 4)2 Ge. S 3 Ge + S Ge. S Ge. Cl 2 + H 2 S Ge. S + 2 HCl Ge. S 2 + Ge 2 Ge. S
Германий образует сульфиды– Ge. S 2, Ge. S 2 Ge. O 2 + 3 S Ge. S 2 + SO 2 Ge. Cl 4 + 2 H 2 S Ge. S 2 + 4 HCl (реакцію каталізує HCl) Ge. S 2 + 6 Na. OH Na 2[Ge(OH)6] + 2 Na 2 S Ge. S 2 + (NH 4)2 S (NH 4)2 Ge. S 3 Ge + S Ge. S Ge. Cl 2 + H 2 S Ge. S + 2 HCl Ge. S 2 + Ge 2 Ge. S
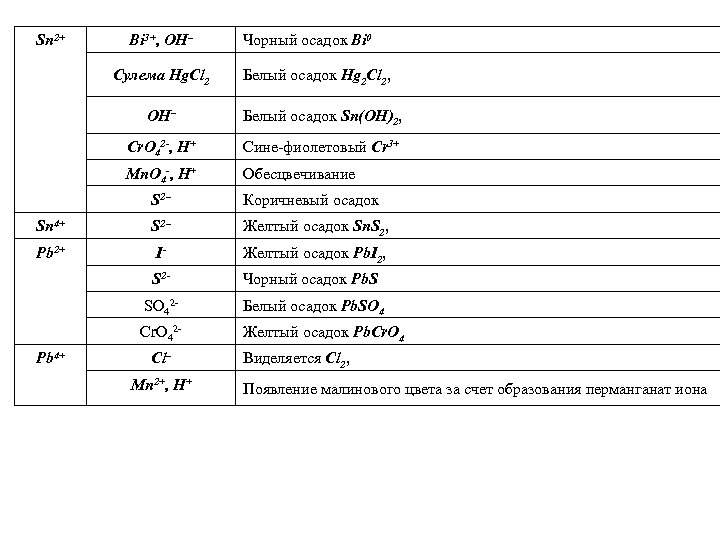 Sn 2+ Bi 3+, OH– Сулема Hg. Cl 2 Чорный осадок Bi 0 Белый осадок Hg 2 Cl 2, OH– Белый осадок Sn(OH)2, Cr. O 42 -, H+ Сине-фиолетовый Cr 3+ Mn. O 4 -, H+ Обесцвечивание S 2– Коричневый осадок Sn 4+ S 2– Желтый осадок Sn. S 2, Pb 2+ I- Желтый осадок Pb. I 2, S 2 - Чорный осадок Pb. S SO 42 - Белый осадок Pb. SO 4 Cr. O 42 - Желтый осадок Pb. Сr. O 4 Pb 4+ Cl– Mn 2+, H+ Виделяется Cl 2, Появление малинового цвета за счет образования перманганат иона
Sn 2+ Bi 3+, OH– Сулема Hg. Cl 2 Чорный осадок Bi 0 Белый осадок Hg 2 Cl 2, OH– Белый осадок Sn(OH)2, Cr. O 42 -, H+ Сине-фиолетовый Cr 3+ Mn. O 4 -, H+ Обесцвечивание S 2– Коричневый осадок Sn 4+ S 2– Желтый осадок Sn. S 2, Pb 2+ I- Желтый осадок Pb. I 2, S 2 - Чорный осадок Pb. S SO 42 - Белый осадок Pb. SO 4 Cr. O 42 - Желтый осадок Pb. Сr. O 4 Pb 4+ Cl– Mn 2+, H+ Виделяется Cl 2, Появление малинового цвета за счет образования перманганат иона
 Подгруппа углерода, в которую входят углерод, кремний, германий, олово и свинец, является главной подгруппой 4 группы Периодической системы. История открытия химических элементов IVA группы.
Подгруппа углерода, в которую входят углерод, кремний, германий, олово и свинец, является главной подгруппой 4 группы Периодической системы. История открытия химических элементов IVA группы.
 На внешней электронной оболочке атомов этих элементов имеется 4 электрона и их электронную конфигурацию в общем виде можно записать так: ns 2 np 2, где n - это номер периода, в котором расположен химический элемент. При переходе сверху вниз по группе неметаллические свойства ослабляются, а металлические возрастают, поэтому углерод и кремний - это неметаллы, а олово и свинец проявляет свойства типичных металлов. Образуя ковалентные полярные связи с атомами водорода, C и Si проявляют формальную степень окисления -4, а с более активными неметаллами (N, O, S) и галогенами проявляют степени окисления +2 и +4.
На внешней электронной оболочке атомов этих элементов имеется 4 электрона и их электронную конфигурацию в общем виде можно записать так: ns 2 np 2, где n - это номер периода, в котором расположен химический элемент. При переходе сверху вниз по группе неметаллические свойства ослабляются, а металлические возрастают, поэтому углерод и кремний - это неметаллы, а олово и свинец проявляет свойства типичных металлов. Образуя ковалентные полярные связи с атомами водорода, C и Si проявляют формальную степень окисления -4, а с более активными неметаллами (N, O, S) и галогенами проявляют степени окисления +2 и +4.
 При выяснениии механизма реакций иногда используют изотоп углерода 13 С (метод меченных атомов). Поэтому полезно знать, что распространненость изотопов углерода: 12 С - 98. 89 % и 13 С - 1. 11 %. Если ограничиться перечислением изотопов, распространенность которых более 0. 01 %, то у кремния таких изотопа 3, у германия - 5, у олова - 10, у свинца 4 стабильных изотопа. При обычных условиях углерод может существовать в виде двух аллотропных модификаций: алмаза и графита; сверхчистый кристаллический кремний - полупроводник.
При выяснениии механизма реакций иногда используют изотоп углерода 13 С (метод меченных атомов). Поэтому полезно знать, что распространненость изотопов углерода: 12 С - 98. 89 % и 13 С - 1. 11 %. Если ограничиться перечислением изотопов, распространенность которых более 0. 01 %, то у кремния таких изотопа 3, у германия - 5, у олова - 10, у свинца 4 стабильных изотопа. При обычных условиях углерод может существовать в виде двух аллотропных модификаций: алмаза и графита; сверхчистый кристаллический кремний - полупроводник.
 Первый потенциал ионизации, сродство к электрону и электроотрицательность по Полингу атомов элементов IVA группы. Из соединений элементов (Э) подгруппы углерода с водородом рассмотрим соединения типа ЭН 4. С увеличением заряда ядра атома Э стабильность гидридов уменьшается. При переходе от C к Pb устойчивость соединений со степенью окисления +4 уменьшается, а с +2 - увеличивается. У оксидов ЭО 2 уменьшается кислотный характер , а у оксидов ЭО увеличивается основной характер.
Первый потенциал ионизации, сродство к электрону и электроотрицательность по Полингу атомов элементов IVA группы. Из соединений элементов (Э) подгруппы углерода с водородом рассмотрим соединения типа ЭН 4. С увеличением заряда ядра атома Э стабильность гидридов уменьшается. При переходе от C к Pb устойчивость соединений со степенью окисления +4 уменьшается, а с +2 - увеличивается. У оксидов ЭО 2 уменьшается кислотный характер , а у оксидов ЭО увеличивается основной характер.
 Углерод в природе встречается в виде алмаза и графита. В ископаемых углях его содержится: от 92 % - в антраците, до 80 % - в буром угле. В связном состоянии углерод встречается в карбидах: Ca. CO 3 мел, известняк и мрамор, Mg. CO 3·Ca. CO 3 - доломит, Mg. CO 3 - магнезит. В воздухе углерод содержится в виде углекислого газа (0. 03 % по объему). Содержится углерод и в соединениях, растворенных в морской воде. Углерод входит в состав растений и животных, содержится в нефти и природном газе. В реакциях с активными неметаллами углерод легко окисляется: C+O 2=CO 2 2 C+O 2=2 CO C+2 S=CS 2 C+2 F 2=CF 4 Углерод может проявлять восстановительные свойства и при взаимодействии со сложными веществами: C+2 Cu. O=Cu+Co 2 C+2 H 2 SO 4(конц. )=CO 2+2 SO 2+H 2 O 2 C+Ba. SO 4=Ba. S+2 CO 2
Углерод в природе встречается в виде алмаза и графита. В ископаемых углях его содержится: от 92 % - в антраците, до 80 % - в буром угле. В связном состоянии углерод встречается в карбидах: Ca. CO 3 мел, известняк и мрамор, Mg. CO 3·Ca. CO 3 - доломит, Mg. CO 3 - магнезит. В воздухе углерод содержится в виде углекислого газа (0. 03 % по объему). Содержится углерод и в соединениях, растворенных в морской воде. Углерод входит в состав растений и животных, содержится в нефти и природном газе. В реакциях с активными неметаллами углерод легко окисляется: C+O 2=CO 2 2 C+O 2=2 CO C+2 S=CS 2 C+2 F 2=CF 4 Углерод может проявлять восстановительные свойства и при взаимодействии со сложными веществами: C+2 Cu. O=Cu+Co 2 C+2 H 2 SO 4(конц. )=CO 2+2 SO 2+H 2 O 2 C+Ba. SO 4=Ba. S+2 CO 2
 В реакциях с металлами и менее активными неметаллами углерод - окислитель: 2 C+H 2=C 2 H 2 C+Si=Si. C 2 C+Ca=Ca. C 2 3 C+4 Al=Al 4 C 3 Карбид алюминия является истинным карбидом: всеми четырьмя валентными связями каждый атом углерода связан с атомами металла. Карбид кальция является ацетиленидом, так как между углеродными атомами имеется тройная связь. Поэтому при взаимодействии карбидов алюминия с водой выделяется метан, а при взаимодействии карбида кальция с водой - ацетилен 4 Al 4 C 3+12 H 2 O=4 Al(OH)3+3 CH 4 Ca. C 2+2 H 2 O=Ca(OH)2 +C 2 H 2 Каменный уголь используется как топливо, применяется для получения синтез-газа. Из графита делают электроды, графитовые стержни используется в качестве замедлителя нейтронов в ядерных реакторах. Алмазы используют для изготовления режущих инструментов, абразивов, ограненные алмазы (бриллианты) являются драгоценными камнями.
В реакциях с металлами и менее активными неметаллами углерод - окислитель: 2 C+H 2=C 2 H 2 C+Si=Si. C 2 C+Ca=Ca. C 2 3 C+4 Al=Al 4 C 3 Карбид алюминия является истинным карбидом: всеми четырьмя валентными связями каждый атом углерода связан с атомами металла. Карбид кальция является ацетиленидом, так как между углеродными атомами имеется тройная связь. Поэтому при взаимодействии карбидов алюминия с водой выделяется метан, а при взаимодействии карбида кальция с водой - ацетилен 4 Al 4 C 3+12 H 2 O=4 Al(OH)3+3 CH 4 Ca. C 2+2 H 2 O=Ca(OH)2 +C 2 H 2 Каменный уголь используется как топливо, применяется для получения синтез-газа. Из графита делают электроды, графитовые стержни используется в качестве замедлителя нейтронов в ядерных реакторах. Алмазы используют для изготовления режущих инструментов, абразивов, ограненные алмазы (бриллианты) являются драгоценными камнями.
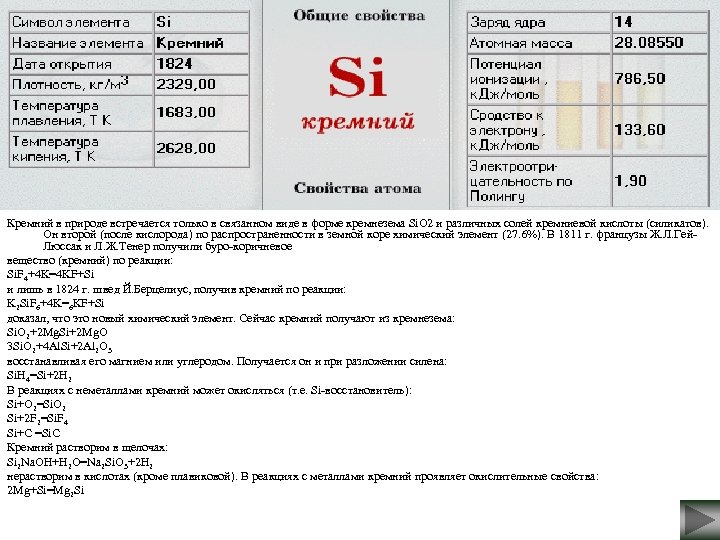 Кремний в природе встречается только в связанном виде в форме кремнезема Si. O 2 и различных солей кремниевой кислоты (силикатов). Он второй (после кислорода) по распространенности в земной коре химический элемент (27. 6%). В 1811 г. французы Ж. Л. Гей. Люссак и Л. Ж. Тенер получили буро-коричневое вещество (кремний) по реакции: Si. F 4+4 K=4 KF+Si и лишь в 1824 г. швед Й. Берцелиус, получив кремний по реакции: K 2 Si. F 6+4 K=6 KF+Si доказал, что это новый химический элемент. Сейчас кремний получают из кремнезема: Si. O 2+2 Mg. Si+2 Mg. O 3 Si. O 2+4 Al. Si+2 Al 2 O 3 восстанавливая его магнием или углеродом. Получается он и при разложении силена: Si. H 4=Si+2 H 2 В реакциях с неметаллами кремний может окисляться (т. е. Si-восстановитель): Si+O 2=Si. O 2 Si+2 F 2=Si. F 4 Si+C =Si. C Кремний растворим в щелочах: Si 2 Na. OH+H 2 O=Na 2 Si. O 3+2 H 2 нерастворим в кислотах (кроме плавиковой). В реакциях с металлами кремний проявляет окислительные свойства: 2 Mg+Si=Mg 2 Si
Кремний в природе встречается только в связанном виде в форме кремнезема Si. O 2 и различных солей кремниевой кислоты (силикатов). Он второй (после кислорода) по распространенности в земной коре химический элемент (27. 6%). В 1811 г. французы Ж. Л. Гей. Люссак и Л. Ж. Тенер получили буро-коричневое вещество (кремний) по реакции: Si. F 4+4 K=4 KF+Si и лишь в 1824 г. швед Й. Берцелиус, получив кремний по реакции: K 2 Si. F 6+4 K=6 KF+Si доказал, что это новый химический элемент. Сейчас кремний получают из кремнезема: Si. O 2+2 Mg. Si+2 Mg. O 3 Si. O 2+4 Al. Si+2 Al 2 O 3 восстанавливая его магнием или углеродом. Получается он и при разложении силена: Si. H 4=Si+2 H 2 В реакциях с неметаллами кремний может окисляться (т. е. Si-восстановитель): Si+O 2=Si. O 2 Si+2 F 2=Si. F 4 Si+C =Si. C Кремний растворим в щелочах: Si 2 Na. OH+H 2 O=Na 2 Si. O 3+2 H 2 нерастворим в кислотах (кроме плавиковой). В реакциях с металлами кремний проявляет окислительные свойства: 2 Mg+Si=Mg 2 Si
 При разложении соляной кислотой силицида магния получается силан: Mg 2 Si+4 HCl=2 Mg. C 12+Si. H 4 Кремний используется для получения многих сплавов на основе железа, меди и алюминия. Добавление кремния в сталь и чугун улучшает их механические свойства. Большие добавки кремния придают сплавам железа кислотоустойчивость. Сверхчистый кремний является полупроводником и используется для изготовления микросхем и в производстве солнечных батарей. Типичные степени окисления элементов группы IVA в различных соединениях.
При разложении соляной кислотой силицида магния получается силан: Mg 2 Si+4 HCl=2 Mg. C 12+Si. H 4 Кремний используется для получения многих сплавов на основе железа, меди и алюминия. Добавление кремния в сталь и чугун улучшает их механические свойства. Большие добавки кремния придают сплавам железа кислотоустойчивость. Сверхчистый кремний является полупроводником и используется для изготовления микросхем и в производстве солнечных батарей. Типичные степени окисления элементов группы IVA в различных соединениях.
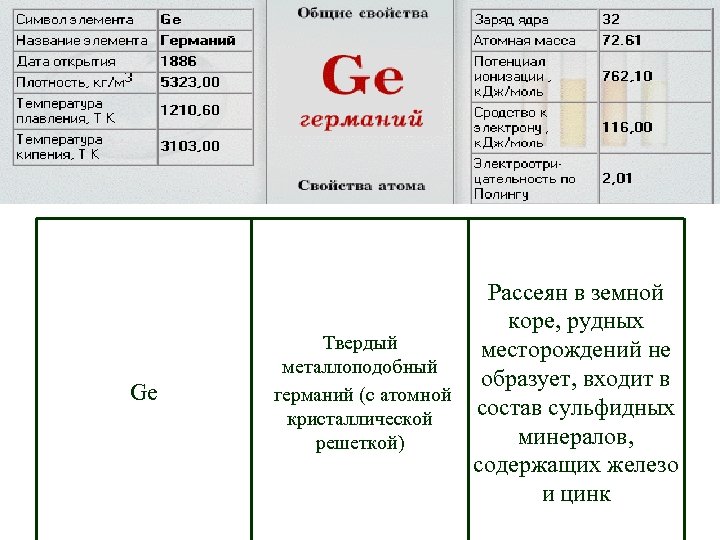 Ge Рассеян в земной коре, рудных Твердый месторождений не металлоподобный образует, входит в германий (с атомной состав сульфидных кристаллической минералов, решеткой) содержащих железо и цинк
Ge Рассеян в земной коре, рудных Твердый месторождений не металлоподобный образует, входит в германий (с атомной состав сульфидных кристаллической минералов, решеткой) содержащих железо и цинк
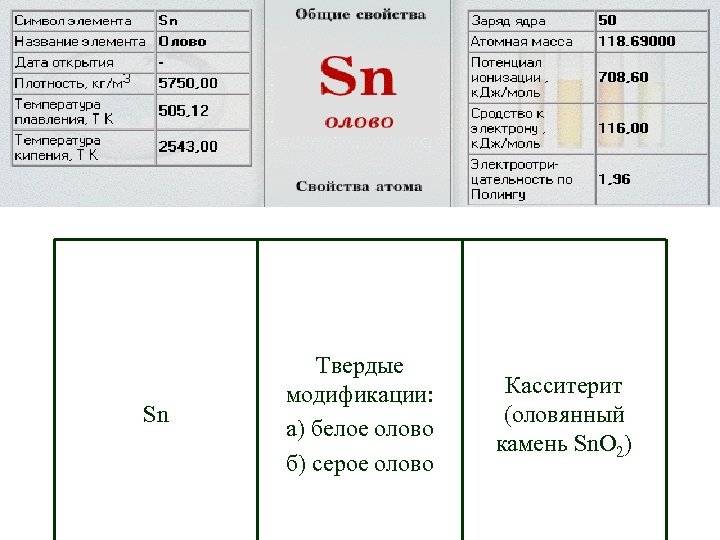 Sn Твердые модификации: а) белое олово б) серое олово Касситерит (оловянный камень Sn. O 2)
Sn Твердые модификации: а) белое олово б) серое олово Касситерит (оловянный камень Sn. O 2)
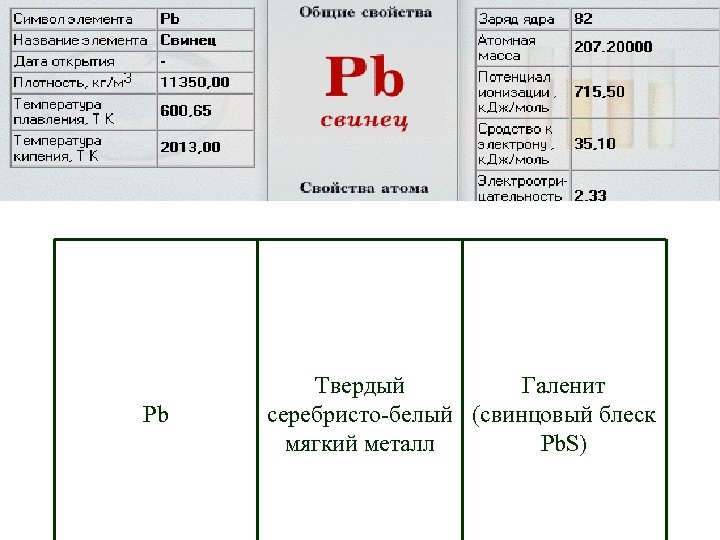 Pb Твердый Галенит серебристо-белый (свинцовый блеск мягкий металл Pb. S)
Pb Твердый Галенит серебристо-белый (свинцовый блеск мягкий металл Pb. S)
 Выдающийся русский химик, автор Периодического закона - родился в г. Тобольске, там же он закончил гимназию, а в 1850 г. был принят в Петербургский главный педагогический институт на физико-математический факультет. После защиты диссертации Менделеев в 1857 г. был назначен приват-доцентом. В 1859 г. он уехал заграничную командировку в Германию на два года, где работал в Гейдельберге у Бунзена, принял участие в работе Международного химического конгресса в Карлсруэ. После возвращения в Петербург Менделеев вел большую научную и преподавательскую деятельность, в 1865 г. защитил докторскую диссертацию, в которой была изложена его гидратная теория растворов и выдвинута идея о возможности существования в растворах соединений переменного состава. В 1867 г. Менделеев был назначен профессором химии Петербургского университета. Заняв кафедру химии столичного университета, он стал главой университетских химиков в России и инициатором создания Русского химического общества (1868 г. ). В 1868 г. Менделеев начал работать над учебником "Основы химии". Он писал, что его цель - "познакомить учащихся с основными данными и выводами химии в общедоступном научном зложении, указать на значение этих выводов для понимания как природы вещества и явлений вокруг нас совершающихся, так и тех применений, которые получила химия в сельском хозяйстве, технике". В процессе работы над второй частью учебника в феврале 1869 г. Менделеев сформулировал Периодический закон и предложил наиболее совершенную форму его воплощения в виде таблицы, которую он назвал "Опыт системы элементов, основанной на их атомном весе и химическом сходстве". В течение двух лет Менделеев работал над развитием и углублением открытого закона и готовил обобщающую статью "Естественная система элементов и применение ее к указанию свойств неоткрытых элементов". Менделеев предсказал существование экаалюминия (был открыт в 1875 г. французом Лекоком де Буабодраном и назван галлием), экабора (был открыт в 1879 г. шведом Л. Ф. Нильсоном и назван скандием) и экасилиция (был открыт в 1886 г. немцем К. А. Винклером и назван германием). К середине 80 -х годов XIX в. Периодический закон был признан всеми учеными и вошел в арсенал науки как один из важнейших законов природы. Изучая газы, Менделеев (в 1874 г. ) уточнил уравнение состояния для идеальных газов (уравнение Клапейрона-Менделеева). В 1877 г. Менделеев высказал гипотезу о происхождении нефти из карбидов тяжелых металлов и предложил принцип дробной перегонки при переработке нефти, в 1888 г. - выдвинул идею о подземной газификации углей, в 1891 г. - разработал технологию изготовления нового типа бездымного пороха.
Выдающийся русский химик, автор Периодического закона - родился в г. Тобольске, там же он закончил гимназию, а в 1850 г. был принят в Петербургский главный педагогический институт на физико-математический факультет. После защиты диссертации Менделеев в 1857 г. был назначен приват-доцентом. В 1859 г. он уехал заграничную командировку в Германию на два года, где работал в Гейдельберге у Бунзена, принял участие в работе Международного химического конгресса в Карлсруэ. После возвращения в Петербург Менделеев вел большую научную и преподавательскую деятельность, в 1865 г. защитил докторскую диссертацию, в которой была изложена его гидратная теория растворов и выдвинута идея о возможности существования в растворах соединений переменного состава. В 1867 г. Менделеев был назначен профессором химии Петербургского университета. Заняв кафедру химии столичного университета, он стал главой университетских химиков в России и инициатором создания Русского химического общества (1868 г. ). В 1868 г. Менделеев начал работать над учебником "Основы химии". Он писал, что его цель - "познакомить учащихся с основными данными и выводами химии в общедоступном научном зложении, указать на значение этих выводов для понимания как природы вещества и явлений вокруг нас совершающихся, так и тех применений, которые получила химия в сельском хозяйстве, технике". В процессе работы над второй частью учебника в феврале 1869 г. Менделеев сформулировал Периодический закон и предложил наиболее совершенную форму его воплощения в виде таблицы, которую он назвал "Опыт системы элементов, основанной на их атомном весе и химическом сходстве". В течение двух лет Менделеев работал над развитием и углублением открытого закона и готовил обобщающую статью "Естественная система элементов и применение ее к указанию свойств неоткрытых элементов". Менделеев предсказал существование экаалюминия (был открыт в 1875 г. французом Лекоком де Буабодраном и назван галлием), экабора (был открыт в 1879 г. шведом Л. Ф. Нильсоном и назван скандием) и экасилиция (был открыт в 1886 г. немцем К. А. Винклером и назван германием). К середине 80 -х годов XIX в. Периодический закон был признан всеми учеными и вошел в арсенал науки как один из важнейших законов природы. Изучая газы, Менделеев (в 1874 г. ) уточнил уравнение состояния для идеальных газов (уравнение Клапейрона-Менделеева). В 1877 г. Менделеев высказал гипотезу о происхождении нефти из карбидов тяжелых металлов и предложил принцип дробной перегонки при переработке нефти, в 1888 г. - выдвинул идею о подземной газификации углей, в 1891 г. - разработал технологию изготовления нового типа бездымного пороха.


