p-элементы IV.ppt
- Количество слайдов: 23
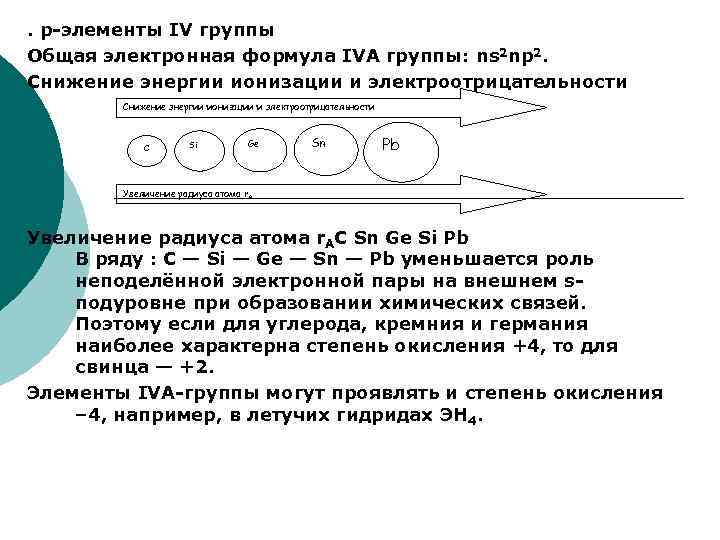
. р-элементы IV группы Общая электронная формула IVA группы: ns 2 np 2. Снижение энергии ионизации и электроотрицательности С Si Ge Sn Pb Увеличение радиуса атома r. AС Sn Ge Si Pb В ряду : С — Si — Ge — Sn — Pb уменьшается роль неподелённой электронной пары на внешнем sподуровне при образовании химических связей. Поэтому если для углерода, кремния и германия наиболее характерна степень окисления +4, то для свинца — +2. Элементы IVA-группы могут проявлять и степень окисления – 4, например, в летучих гидридах ЭН 4.

u u с возрастанием Ra и падением ЕИ при переходе от углерода к свинцу неметаллические свойства ослабевают, так как снижается способность присоединять электроны и увеличивается лёгкость их отдачи: C , Si— типичные неметаллы; Ge, Sn, Pb — амфотерные элементы c металлическими свойствами у Pb – В обычных условиях u u u С, Si, Ge и Sn устойчивы по отношению к воздуху и воде. Свинец же окисляется на воздухе. В электрохимическом ряду напряжений металлов -------Ge располагается после водорода не реагирует с кислотами типа HCl и разбавленной H 2 SO 4. ----- перед водородом.

• • • ====оксиды ЭО 2 ( Э- Si , C) являются кислотными, а гидроксиды Н 2 ЭО 3 — слабыми кислотами. ======оксиды и гидроксиды остальных элементов IVA группы амфотерны. ==== в подгруппе Ge : в ряду низших оксидов и гидроксидов при переходе от Ge к Pb усиливаются основные свойства, а у высших – нарастают кислотные. ====окислительно-восстановительные свойства С, Si, Ge, Sn и Pb достаточно устойчивы по отношению к воздуху и воде (металлы Sn и Pb — за счёт образования оксидной плёнки на поверхности). ======соединения Pb (+4) — сильные окислители: 5 Pb. O 2 + 2 Mn. SO 4 + 3 H 2 SO 4 5 Pb. SO 4 + 2 HMn. O 4 + 2 H 2 O Германиты и станниты, как производные соответствующих элементов в низших степенях окисления, являются сильными восстановителями: 2 Bi(OH)2 + 3 Na 2[Sn(OH)4] → 2 Bi + 3 Na 2[Sn(OH)6]. Для плюмбитов такие реакции не характерны. Для плюмбатов характерны оксилительные свойства в кислой среде. Комплексообразующие свойства наиболее характерны для Pb 2+ [[[[[[прочные комплексы с биолигандами.

Углерод и его соединения. алмаз, графит, карбин и аморфный углерод-. аллотропные модификации углерода • Конфигурация внешней электронной оболочки атома углерода: 2 s 2 p 2. При его возбуждении - на четырёх внешних атомных орбиталях находятся четыре неспаренных электрона: • ====углерод в соединениях обычно четырёхвалентен. • ======= Равенство в атоме углерода числа валентных электронов числу валентных орбиталей, • уникальное соотношение заряда ядра и радиуса атома сообщают ему способность одинаково легко присоединять и отдавать электроны в зависимости от свойств партнёра. • различные степени окисления [от – 4 до +4] и лёгкость гибридизации его атомных орбиталей по типу sp 3, sp 2 и sp 1 при образовании химических связей (всё это даёт атомам углерода возможность образовывать ординарные, двойные и тройные связи не только между собой, но и с атомами других элементов-органогенов): • – 4 CH ; – 3 CH – – 3 CH ; – 2 CH = – 2 CH ; – 2 CH OH; HC– 1 CH; – 1 C 6 H 6; 4 3 3 2 2 3 H 2 C 0=O

u u u u Окислительно-восстановительные свойства. С. о. С - от – 4 до +4, то в зависимости от реагента: С — восстановитель С + О 2 СО 2 С + 2 Fe 3 O 4 CO 2 +6 Fe. O С — окислитель С + 2 Н 2 СН 4 2 С + Са Ca. CO 2; При взаимодействии сильных окислителей с органическими веществами может протекать неполное или полное окисление атомов углерода этих соединений. ======Атом углерода в соединении — окислитель, если в результате реакции с атомами менее электроотрицательных элементов [водород, металлы], атом углерода понижает свою степень окислении : — – 2 СН 2— — – 3 СН 3, — – 1 С Н 2 I— — – 3 СН 2 Mg. I, ====Атом углерода в соединении — восстановитель, если в результате реакции с атомами более электроотрицательных элементов [С, О, N, S], атом углерода повышает свою степень окисления : —– 3 СН 3— — – 1 СН 2 ОН — +1 СН=О — +3 СООН

u u u u u Комплексообразующие свойства соединений углерода. У атома углерода в соединениях нет неподелённых электронных пар, лигандами могут выступать только соединения углерода, содержащие кратные связи с его участием. - оксидуглерода (II) и анион синильной кислоты. Углерод проявляет окислительные свойства и с активными металлами может образовывать карбиды. 2 С + Са = Ca. C 2; карбид кальция — «ацетиленид» 3 С + 4 Al = Al 4 C 3. карбид алюминия — «метанид» : Са. С 2 + 2 Н 2 О Сa(OH)2 + C 2 H 2 ; Al 4 C 3 + 12 H 2 O 4 Al(OH)3 + 3 CH 4.

• • • • — СО и СО 2. Структуру молекулы СО можно изобразить схемой: С О Повышенная кратность связи : - высокую стабильность и инертность при нормальных условиях с позиции кислотно-основных [СО — несолеобразующий оксид] и - окислительно-восстановительных свойств [СО — восстановитель при Т > 1000 К]. - активным лигандом в реакциях комплексообразования с атомами и катионами d-металлов, прежде всего с железом. Для СО наиболее характерны ====реакции окисления (с. о. +2), ==== присоединения– (неподеленные электронные пары атомов углерода и кислорода. ======К. С. . с катионами d-металлов с образованием карбоксигемоглобина [карбонилгемоглобина]: HHb + CO ↔HHb. CO, HHb. O 2 + CO ↔ HHb. CO + O 2. лечебные препараты- антидоты при отравлении СОвосстановленное железа

• Н 2 О + СО 2 Н 2 СО 3. • • • • Н 2 СО 3 образует средние ЭСО 3 и кислые соли (ЭНСО 3) ----все гидрокарбонаты хорошо растворимы в воде; ----из средних солей растворимы карбонаты щелочных металлов и аммония. ---Гидролиз- щелочная реакцию [р. Н > 7]: Na 2 CO 3 + HOH Na. HCO 3 + Na. OH. ----Гидрокарбонатная буферная система [Н 2 СО 3 + Na. НСО 3] служит главной буферной системой плазмы крови, обеспечивающей постоянного значения р. Н крови порядка 7, 40± 0, 05. При добавлении кислоты: НСО 3– + Na+ + H+ + Cl– Na+ + Cl– + Н 2 СО 3. При добавлении щелочи СН 3 СООН + Na+ + OH– СН 3 СОО– + Na+ + Н 2 О В фармации ----в качестве антацидных [нейтрализующих кислоты] средств при повышенной кислотности желудочного сока. Na. HCO 3 + HCl Na. Cl + H 2 O + CO 2 Ca. CO 3 + 2 HCl Ca. Cl 2 + H 2 O + CO 2 ----- Na. HCO 3 вводится внутривенно для коррекции метаболического ацидоза.

• Наличие в природных водах гидрокарбонатов кальция и магния обусловливает их временную жёсткость. • При кипячении такой воды её жёсткость устраняется: • Ca(HCO 3)2 t Ca. CO 3 + Н 2 О + СО 2 , • Mg(HCO 3)2 t Mg(OH)2 + 2 СО 2. • Соединения углерода с галогенами и серой: • Четырёххлористый углерод — CCl 4. • Фосген [дихлорангидрид угольной кислоты] — СОCl 2. • Фреоны — CCl 3 F, CCl 2 F 2, CHCl. F 2, CBr. F 3 и др. • Сероуглерод [дисульфид углерода] — CS 2. • Тиокарбонаты [сернистые аналоги карбоновых кислот] — • О S • тиоловая кислота R—C—SH и тионовая кислота R—C—ОH. • Цианаты — соли циановой кислоты общей формулы Me. OCN, где Ме — одновалентный металл. • Тиоцианаты [роданиды] — RSCN, например, СН 3 SCN.

• • • Кремний. – в 2 модификациях — кристаллической или аморфной. 3 Si + HNO 3 + 12 HF 3 Si. F 4 + 4 NO + 8 H 2 O. в щелочах: Si + 2 Na. OH + H 2 O Na 2 Si. O 3 + H 2 . При нагревании : ----Si + O 2 = Si. O 2 - Q, Si + 2 F 2 = Si. F 4. Соединения кремния с активными металлами — силициды —при высокой температуре: 2 Mg. O + 3 Si = Mg 2 Si + 2 Si. O или: 2 Mg + Si = Mg 2 Si С водой и кислотами - только силициды щелочных и щелочноземельных металлов. Ca 2 Si + 4 HCl 2 Ca. Cl 2 + Si. H 4 Щелочи разлагают силан Si. H 4 + 2 KOH + H 2 O K 2 Si. O 3 + 4 H 2 Вода тоже гидролизует силан, но медленнее: Si. H 4 + 2 H 2 O Si. O 2 + 4 H 2 Силан разлагается выше 400 С без доступа воздуха: Si. H 4 Si + 2 H 2

• • Получение: Na 2 Si. O 3 + 2 HCl 2 Na. Cl + H 2 Si. O 3 = H 2 O + Si. O 2. Силикаты — соли кремниевой кислоты ( элементы II, III и IV ). В природе широко представлены в виде минералов. Алюмосиликаты — группа природных и синтетических силикатов, содержащих в составе комплексные анионы Al и Si. Цеолиты M 2/n Al 2 O 3 x. Si. O 2 y. H 2 O [n — степень окисления щелочного или щелочноземельного металла М] Кремнийорганические полимеры [силиконы] — высокомолекулярные соединения, содержащие атомы Si в мономерном звене. Кремнийорганические полимеры, основные цепи которых построены из чередующихся атомов Si и О, называют силоксанами,

• Элементы подгруппы германия проявляют две степени окисления: +2 и +4, • в подгруппе сверху вниз устойчивость высшей степени окисления уменьшается, а низшей возрастает. • Ge+2 и Sn+2 – сильные восстановители. • соединения Pb+4 – являются сильными окислителями. В ряду Ge – Sn – Pb величина координационного числа возрастает от 4 до 12.

• • • Германий -----устойчив к действию воздуха, воды, О 2, соляной кислоты и разбавленной H 2 SO 4, ------медленно реагирует с концентрированной Н 2 SO 4. -----Реагирует с царской водкой и HNO 3 с образованием на поверхности плёнки Ge. O 2. Слабо реагирует с растворами едких щелочей, в присутствии Н 2 О 2 — легко, при этом образуются соли — германаты. Для германия, как аналога С и Si, характерна способность образовывать германоводороды (Ge. H 4 — моногерман, Ge 2 H 6 и Ge 3 H 8).

• С разбавленной H 2 SO 4 олово почти не реагирует, с концентрированной - медленно. • - В разбавленной HNO 3 -нитрат Sn(NO 3)2. • -Концентрированная HNO 3 - -оловянную кислоту. • Олово очень хорошо растворяется в царской водке. • С растворами щелочей медленно реагирует даже на холоду, при этом в растворе образуются гидроксостаннат -ионы [Sn(OH)6] 2–. • Оловянные кислоты, которые могут быть представлены как гидратированные формы Sn. O 2, имеют неопределённый состав, ближе всего отвечающий формуле Sn. O 2 1, 8 H 2 O. • -оловянная [ортооловянная] кислота образуется при действии NH 3 на Sn. Cl 4 или при действии кислот на Na 2[Sn(OH)6]. • -оловянная [метаоловянная] кислота образуется при взаимодействии металлического олова с концентрированной HNO 3.

• Свинец Pb. • Свойства соединений олова и свинца во многом похожи. • Олово (II) и свинец (II) оксиды Sn. O и Pb. O амфотерны так же, как и соответствующие гидроксиды Sn(OH)2 и Pb(OH)2. • Соли Pb 2+ — • ===ацетат, нитрат — хорошо растворимы в воде, • ====малорастворимы хлорид и фторид, • ====практически нерастворимы сульфат, карбонат, сульфид. • ====Все соединения свинца (II), в особенности растворимые, ядовиты.

• Биологическая роль • Sn + 2 HA Sn. A 2 + H 2 • Свинец и его соединения относятся к ядам, действующим преимущественно на нервную, сосудистую систему и непосредственно на кровь • 2 R–SH + Pb 2+ RS—Pb—SR + 2 H • В медицинской практике нашли применение наружные вяжущие антисептические средства: свинец ацетат Pb(CH 3 COO)2 3 H 2 O [примочки] и свинец (II) оксид Pb. O [входит в состав свинцового пластыря]. • Свинец и его соединения, особенно органические, влияют на синтез белка, энергетический баланс клетки и её генетический аппарат. Свинец является слабым мутагеном. Pb 4+ окисляет Fe 2+ в Fe 3+ и нарушает синтез гемоглобина. Многие факторы говорят в пользу денатурационного механизма. Установлено, что свинец — один из элементов, присутствие которых в продуктах питания влияет на развитие кариеса. • Массовая доля свинца в организме человека 10– 6%. • Безопасным для человека считают суточное поступление 0, 2– 2 мг свинца.


• В 1946 -1960 гг. И. Пригожин При отклонении ……. системы от стационарного состояния в ней наступают внутренние изменения, которые будут стремиться приблизить систему к стационарному состоянию. d. S=d. Sl +d. Si d. Sl 0 внутри организма d. Si 0 изменение при связи с внешней средой /d. Sl/ / d. Si / 2 формулировка з-на: Стационарное состояние ЖО соответсвет минимальный прирост энтропии: d. S→ min


Кислоты — жёсткие: H+, Li+, Na+, K+, Mn 2+, Cr 3+, Fe 3+, Co 3+, Mg 2+, Ca 2+; u мягкие: Cu+, Ag+, Au+, Pt 2+, Pt 4+, Hg 2+, Cd 2+. u Основания — жёсткие: H 2 O, OH –, NH 3, RNH 2, Cl–, PO 43–, SO 42–; u мягкие: SCN–, R 1 S–, R 2 S, H–, S 2 O 3 2–, SH. u правило: u Устойчивые комплексы образуются между жёсткой кислотой и жёстким основанием или между мягкой кислотой и мягким основанием. u

Комплексообразователи и лиганды нашего организма. u: u Ca 2+ < Mg 2+ < Mn 2+ < Fe 2+ < Cd 2+ < Co 2+ < Zn 2+ < Ni 2+ < Cu 2+ u - [Na+ и К+] присутствуют в основном в свободном виде, . u - Са 2+, Мg 2+ существуют как в свободном виде, так и в виде комплексов. u - Ионы тяжёлых металлов — Fe 2+, . — легче связываются с атомами азота и серы, например, в порфиринах. u

u u u u Общие понятия об активном центре металлоферментов. ферменты представляют собой комплексные соединения с металлами, ионы которых определяют активный центр фермента и пространственную структуру [конформацию] фермента. Кроме того, в силу хелатного эффекта они придают прочность белкам. В состав ферментов входят микроэлементы: Mn — в состав 12 ферментов; Fe — в состав 70 ферментов; Cu — в состав 30 ферментов; Zn — в состав более 100 ферментов; Мо и Со — в состав нескольких ферментов. .

u u u u Значение комплексов в медицине. Биохимик Дж. Вуд писал: . Биохимия — это координационная химия живых систем» . В медицине применяются: 1. Лекарственные препараты на основе комплексов металлов в онкологии, психиатрии, при воспалительных заболеваниях. 2. Радиодиагностика — использование комплексов металлов, меченых радиоактивными изотопами для выяснения путей перемещения лекарств. 3. Радиотерапия — направление радиоактивного изотопа в поражённый участок с целью локального воздействия на него. 4. Хелатотерапия — при металлотоксикозах и металлоаллергических заболеваниях.
p-элементы IV.ppt