SurfPhenom&DispSystems_2_Pletnev_2011.pptx
- Количество слайдов: 18

ПЯ и ДС (Лекция II) Понятие об адсорбции. Количественные характеристики адсорбции. Адсорбция на границе раствор-газ. Поверхностноактивные, инактивные и неактивные вещества. Вывод адсорбционного уравнения Гиббса для разбавленных растворов, его анализ. Поверхностная активность по Ребиндеру. Правило Траубе и его физическая сущность. Уравнение Шишковского. Строение адсорбционного слоя ПАВ на границе раствор/газ. Адсорбция на границе раздела раствор – твердое тело. Обращение правила Траубе при адсорбции из водных и углеводородных растворов. Правило уравнивания полярностей Ребиндера. М. Ю. Плетнёв, доктор хим. наук Кафедра коллоидной химии

О методах измерения поверхностного и межфазного натяжения Метод втягивания пластинки (Вильгельми) Метод вращающейся капли (Ж/Ж) Метод отрыва кольца или серьги (Дю-Нуи) Фото и рис. – из материалов фирмы Krüss.

Адсорбция – основные определения Адсорбция – процесс самопроизвольного переноса растворенного вещества (или компонента газовой фазы) из объемной фазы в поверхностный слой, сопровождающийся убылью свободной поверхностной энергии системы. Количественно адсорбция характеризуется величиной поверхностного избытка вещества (в молях, массовых долях по сравнению с концентрацией в объеме), приходящегося на единицу площади поверхности (ад)сорбента. Величину избыточной поверхностной концентрации (Г) выражают в моль/м 2, а если уд. поверхность твердого сорбента не известна, то размерность адсорбции – моль/кг, кг/кг или кг/м 3. При этом на поверхности адсорбента образуется адсорбционный слой из более-менее упорядоченных молекул. Слой может быть моно- или полимолекулярным. Сорбирующееся вещество – адсорбтив; связанное на поверхности вещество – адсорбат.

Правило уравнивания полярности по Ребиндеру Раствор в С 6 Н 6 Согласно этому правилу, вещество С может адсорбироваться на поверхности раздела фаз А и В в том случае, если присутствие вещества С в поверхностном слое приводит к уравниванию разности полярностей этих фаз. Иначе говоря, адсорбция будет идти, если значение полярности вещества С (например, характеризуемой диэлектрической проницаемостью εс), лежит между значениями полярностей веществ А и В, т. е. если будет соблюдаться условие: εА > εс > εВ или εА < εс < εВ. Из правила уравнивания полярностей П. А. Ребиндера также вытекает, что чем больше разность полярностей между растворенным веществом и растворителем, тем меньше растворимость вещества и тем лучше оно будет адсорбироваться. Из этого правила также следует, что дифильные молекулы ПАВ должны ориентироваться на границе раздела адсорбент – среда таким образом, чтобы полярная часть молекулы была обращена к полярной фазе, а неполярная часть (R) – к неполярной. Если одной из фаз является воздух, то его считают неполярной фазой.
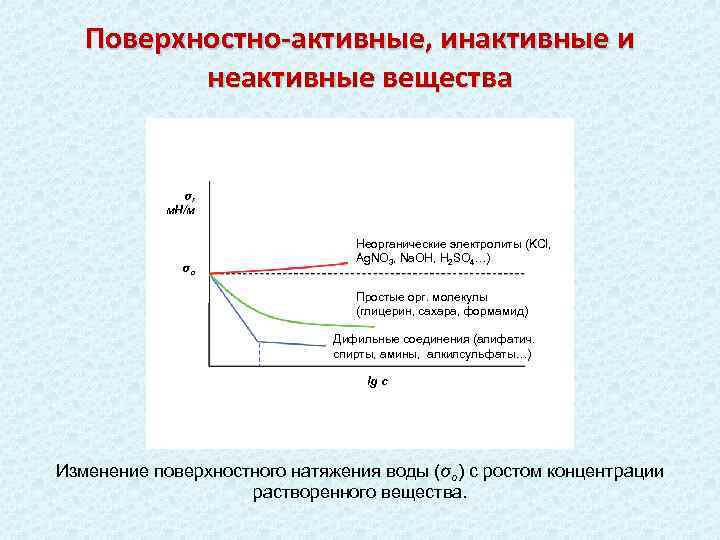
Поверхностно-активные, инактивные и неактивные вещества σ, м. Н/м σо Неорганические электролиты (KCl, Ag. NO 3, Na. OH, H 2 SO 4…) Простые орг. молекулы (глицерин, сахара, формамид) Дифильные соединения (алифатич. спирты, амины, алкилсульфаты…) lg c Изменение поверхностного натяжения воды (σо) с ростом концентрации растворенного вещества.

Адсорбционное уравнение Гиббса Работа А, затраченная в процессе перевода части молекул из объема на поверхность, равна и противоположна по знаку приращению свободной поверхностной энергии (энергии Гельмгольца) Fs и пропорциональна приросту поверхности ds: –d. A = d. Fs = σ∙ds, (1) где коэффициент пропорциональности σ – коэффициент поверхностного натяжения, который является характеристикой поверхности, а его размерность − Дж/м 2 или Н/м. Используя выражение для объединенного первого и второго законов термодинамики к гетерогенной системе и отдельным чистым фазам, Гиббс получил фундаментальное уравнение для межфазного слоя: (2) Здесь Us – полная энергия межфазного слоя, – межфазное натяжение, s – площадь границы раздела фаз, i – химический потенциал i-го компонента, ni. S – избыточное число молекул в межфазном слое. Далее, используя метод Гиббса, можно получить и другие подобные уравнения, в том числе для избыточных энергий Гельмгольца d. FS и Гиббса d. GS: , (3). Приравняем правые части уравнений (1) и (3). (4)

Адсорбционное уравнение Гиббса В результате получаем уравнение Гиббса–Дюгема, устанавливающее связь между изменением межфазного натяжения, составом слоя (через химический потенциал) и температурой: (5) Здесь величина названа адсорбцией Гиббса. В случае постоянства температуры уравнение (5) переходит в изотерму Гиббсовой адсорбции: (6) а для двухкомпонентной системы: (7) Этого уравнения недостаточно для нахождения адсорбции второго (растворенного) компонента. Поэтому в качестве разделяющей поверхности Гиббс выбрал поверхность, на которой адсорбция растворителя Г 1 = 0, и назвал ее эквимолярной. Тогда, используя выражение для химического потенциала разбавленного раствора, можно получить уравнение Гиббса: (8)

Правило Траубе В водных растворах ПАВ одного гомологического ряда с одинаковой молярной концентрацией поверхностное натяжение закономерно снижается с ростом молекулярной массы. Поверхностная активность (–dσ/dc = g при с → 0) в гомологических рядах алифатических соединений (спирты, карбоновые кислоты, их соли, эфиры и т. п. ) растет с удлинением цепи на одну группу СН 2 в 3– 3, 5 раза (Дюкло. Траубе). Это отражает тот факт, что переход ее из водного Quartz, p. H 6 окружения в адсорбционный -7 RNH 3+∙Ac− слой Ж/Г – процесс самопроизвольный, сопровождающийся изменением энергии Гиббса: ΔG°CH 2 ≈ − 3 к. Дж/моль.

Уравнение Шишковского Зависимость поверхностного натяжения водных растворов ПАВ от концентрации (с) хорошо описывается уравнением Шишковского: σ = σо - b. ln(1+Ac), где b и A – постоянные, причем константа b постоянна для всего гомологического ряда ПАВ, тогда как константа А растает в 3 -3, 5 раза при переходе от Сn-го к каждому последующему Cn+1 гомологу; σо – поверхностное натяжение чистого растворителя. Для очень разбавленных растворов поверхностное натяжение падает пропорционально концентрации ПАВ, и уравнение Шишковского сводится к линейной зависимости поверхностного натяжения от концентрации: π = σо - σ ≈ Аb. c. Здесь π – двухмерное (поверхностное) давление адсорбционного слоя ПАВ. В области больших концентраций (с >> 1/А) поверхностное натяжение линейно зависит от логарифма концентрации: b ln. Ac = B + blnс (здесь константа В = b ln. A) Площадка so, приходящаяся на долю одной молекулы в насыщенном адсорбционном слое: so = 1/Гm·N (N – число Авогадро).

Лекция II, ч. 2 Адгезия и когезия. Адгезионное соединение и его количественные характеристики. Уравнение Дюпре для работы адгезии. Смачивание и краевой угол. Уравнение Юнга. Условие самопроизвольного растекания жидкостей, коэффициент растекания по Гаркинсу. Связь адгезии и смачивания. Уравнения Дюпре-Юнга, его анализ.

Работа когезии и адгезии Смачивание и растекание Работа по разъединению столбика однородной жидкости единичной площади поверхности – работа когезии: Wk = 2σЖГ. Она численно равна (но противоположна по знаку) изменению свободной энергии и характеризует прочность молекулярных связей в данной жидкости. Работа адгезии тоже относится к единице площади и определяется как работа разрыва по межфазной поверхности двух разнородных жидкостей (тел): Wа = σВГ + σМГ – σВМ (уравнение Дюпре). При разрыве по месту склейки – адгезионный разрыв. При разрыве по материалу – когезионный разрыв.

Начальный и конечный коэффициент растекания При приведении в контакт двух несмешивающихся жидкостей (М и В) возможно три варианта поведения: несмачивание, ограниченное смачивание (образование линзы) и растекание. Для характеристики процесса растекания используют коэффциент растекания Гаркинса: SM/B = σВГ – σМГ – σВМ = Wа – Wk. SM/B > 0 или σВГ – (σМГ + σВМ) > 0 – т/д условие растекания; SM/B ≈ 0 – равновесие (линза); SM/B < 0 – растекания нет (несмачивающая линза). Характерный пример – растекание бензола по воде: Ø начальный SM/B = 72, 5 – 28, 8 – 34, 4 = 9, 3 м. Н/м Ø конечный SM/B = 63, 2 – 28, 9 – 34, 4 = – 0, 1 м. Н/м

Уравнение Юнга Равновесие капли на идеальной твердой поверхности описывается уравнением Юнга: σТЖ + σЖГ·CosΘ = σТГ , CosΘ = Работа адгезии Wa при контакте твердой и жидкой фаз единичной площади поверхности: Wа = σТГ + σЖГ – σТЖ. Wa тем больше, чем сильнее взаимодействие контактирующих фаз. Преобразуем выражение для Wa путем переноса σЖГ в левую его часть и подставим в ур. Юнга: CosΘ = откуда Wa = σЖГ (Cos Θ + 1). Wa – легко определяемая опытным путем величина. При Θ = 0 Wa = WК.

Уравнения Юнга и Дюпре-Юнга Микро- и нанорельеф поверхности σТЖ + σЖГ·CosΘ = σТГ CosΘ = (σТГ – σТЖ)/σЖГ Wa = σЖГ (CosΘ + 1) Наличие на поверхности листьев растений гидрофобного воскового слоя препятствует их смачиванию водой. Поэтому в растворы, суспензии, эмульсии инсектицидов и проч. агрохимикатов вводят ПАВ-смачиватели. Величина равновесного краевого угла определяется уравнением Юнга. Кафедра коллоидной химии 14
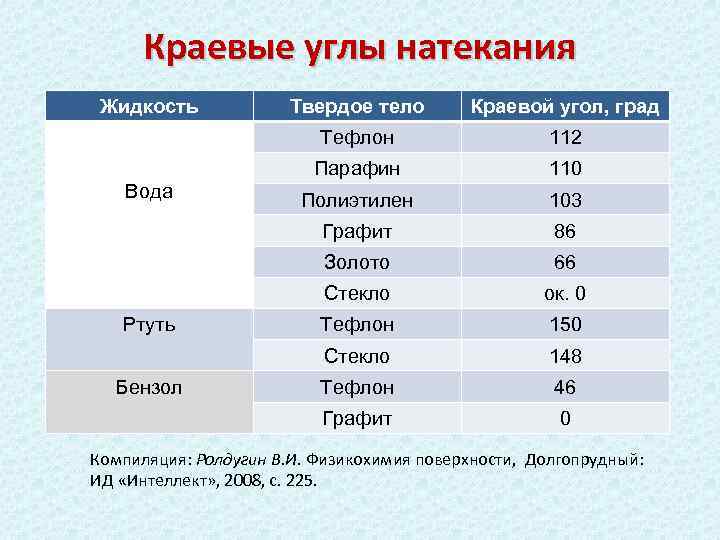
Краевые углы натекания Жидкость 110 Полиэтилен 103 Графит 86 Золото 66 Стекло ок. 0 Тефлон 150 Стекло 148 Тефлон 46 Графит Бензол 112 Парафин Ртуть Краевой угол, град Тефлон Вода Твердое тело 0 Компиляция: Ролдугин В. И. Физикохимия поверхности, Долгопрудный: ИД «Интеллект» , 2008, с. 225.

Избирательное смачивание: флотация и моющее действие Молекулярное сродство между жидкостью и твердой поверхностью также проявляется при избирательном смачивании. (т. е. когда тв. тело контактирует с двумя несмешивающимися жидкостями). Краевой угол в этом случае отсчитывается внутри более полярной жидкости: В М Θ Изучение избирательного смачивания в системе вода – жидкий углеводород ("масло") – твердая поверхность дает характеристику гидрофильности и гидрофобности (олеофильности) поверхности: при Θ < 90 o поверхность является гидрофильной, при Θ > 90 o – гидрофобной (олеофильной). Введение ПАВ позволяет тонко управлять смачиванием и избирательным смачиванием, меняя гидрофобную по природе поверхность на гидрофильную. В горно-рудной промышленности процесс флотации используют для обогащения руд с исп. реагентов-собирателей (например, для барита – алкисульфаты). В химической, нефтехимической, целлюлозно-бумажной и пищевой пром-ти флотацию применяют для выделения из жидкостей нерастворимых мелкодисперсных примесей (твердых или жидких), которые самопроизвольно плохо отстаиваются.
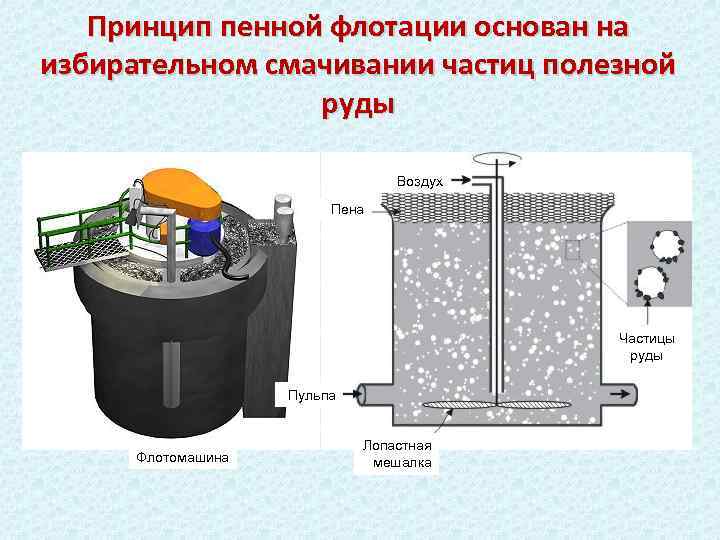
Принцип пенной флотации основан на избирательном смачивании частиц полезной руды Воздух Пена Частицы руды Пульпа Флотомашина Лопастная мешалка

Пожалуйста, задавайте вопросы Кафедра коллоидной хиии МИТХТ
SurfPhenom&DispSystems_2_Pletnev_2011.pptx