неметаллы.pptx
- Количество слайдов: 40

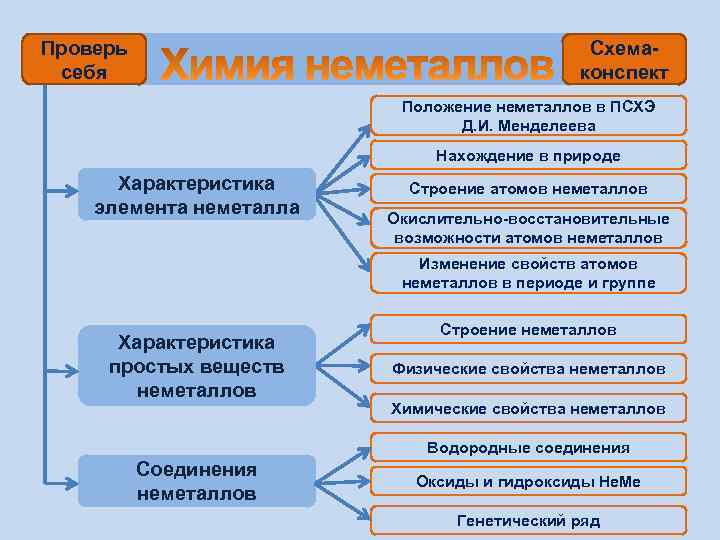
Проверь себя Схемаконспект Положение неметаллов в ПСХЭ Д. И. Менделеева Нахождение в природе Характеристика элемента неметалла Строение атомов неметаллов Окислительно-восстановительные возможности атомов неметаллов Изменение свойств атомов неметаллов в периоде и группе Характеристика простых веществ неметаллов Строение неметаллов Физические свойства неметаллов Химические свойства неметаллов Водородные соединения Соединения неметаллов Оксиды и гидроксиды Не. Ме Генетический ряд
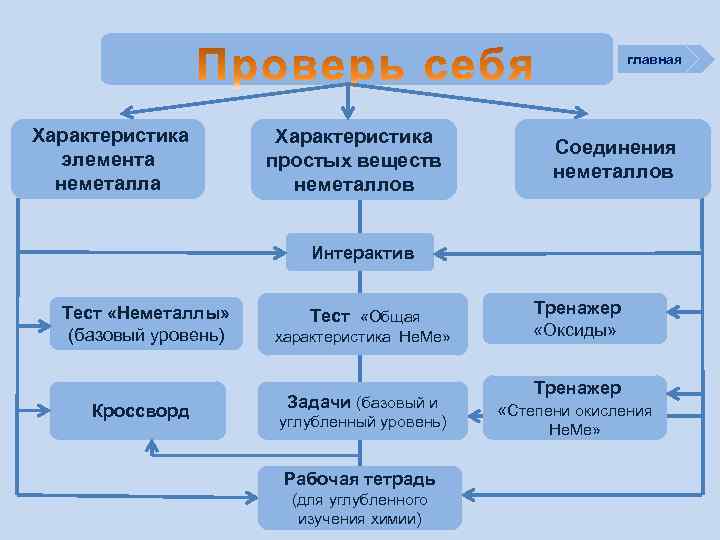
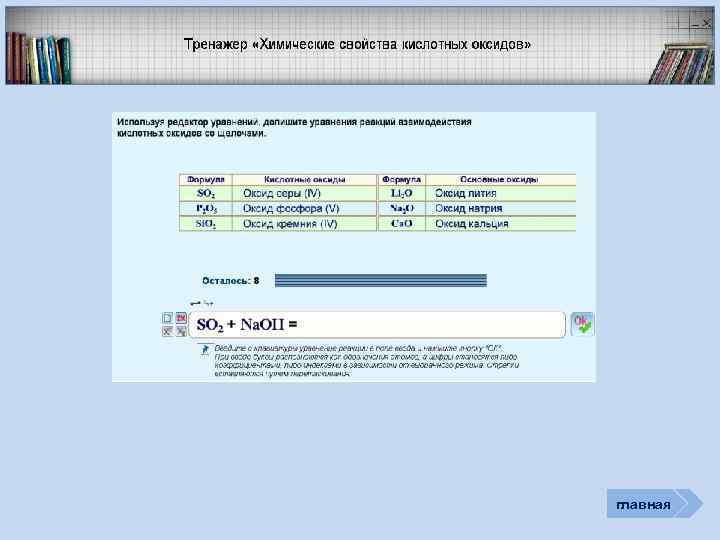
главная Характеристика элемента неметалла Характеристика простых веществ неметаллов Соединения неметаллов Интерактив Тест «Неметаллы» (базовый уровень) Кроссворд Тест «Общая характеристика Не. Ме» Задачи (базовый и углубленный уровень) Рабочая тетрадь (для углубленного изучения химии) Тренажер «Оксиды» Тренажер «Степени окисления Не. Ме»

Положение в ПСХЭ Д. И. Менделеева главная Перипери оды од Ряды Группы элементов 1 1 (H) 2 2 3 3 4 5 6 I II IV V VI VII Н В 5 10, 811 Бор С 6 12, 0112 Углерод Водород 7 8 N 14, 0067 O 15, 9994 F Азот 14 Si 28, 086 Р Кремний 1 1, 00797 Кислород 15 S 30, 9738 Фосфор 9 18, 9984 Фтор 16 Cl 32, 064 Сера 2 VIII He 4, 0026 Гелий Ne 10 20, 163 Неон 17 Ar 18 39, 948 35, 453 Хлор Аргон 4 5 6 7 8 9 В ПСХЭ Д. И. Менделеева граница, отделяющая металлы от неметаллов, проходит по следующим неметаллам – элементам главных подгрупп: B; Si; As; Te; At. Неметаллы располагаются правее и выше этой границы. 33 34 35 36 As 74, 9216 Se 78, 96 Br 79, 904 Kr 83, 80 Мышьяк Селен Бром 52 Te 127, 60 I Теллур 53 Xe 131, 30 54 126, 904 Иод Криптон Ксенон 85 86 At 210 Rn [222] Астат Радон 7 10 Высшие оксиды ЛВС R 2 O RO R 2 O 3 RO 2 R 2 O 5 RO 3 R 2 O 7 RH 4 RH 3 H 2 R HR RO 4
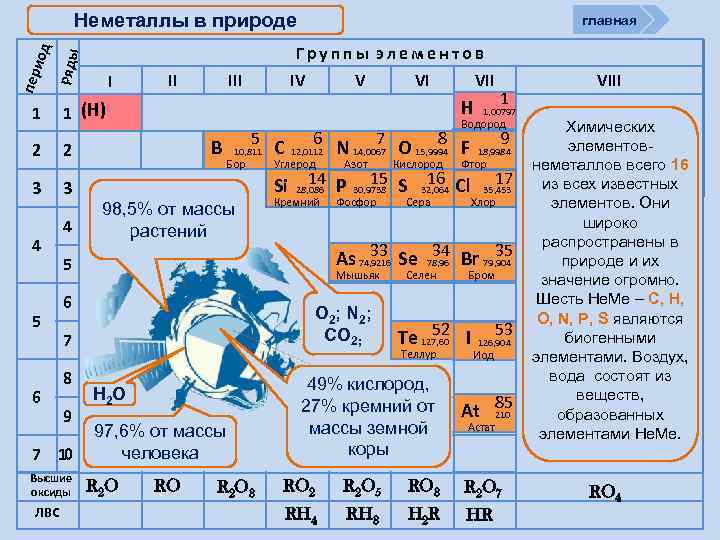
Неметаллы в природе главная Перипери оды од Ряды Группы элементов 1 1 (H) 2 2 3 3 4 5 6 4 II IV V В 5 10, 811 Бор 98, 5% от массы растений С 6 12, 0112 Углерод Высшие оксиды 7 8 N 14, 0067 O 15, 9994 F Азот 14 Si 28, 086 Р Кремний Н 2 О 97, 6% от массы человека R 2 O RO R 2 O 3 Кислород 15 S 30, 9738 Фосфор 1 1, 00797 9 18, 9984 Фтор 16 Cl 32, 064 Сера 17 35, 453 Хлор 33 34 35 As 74, 9216 Se 78, 96 Br 79, 904 O 2 ; N 2 ; CO 2; 7 9 VII Водород Мышьяк 6 8 VI Н 5 7 10 ЛВС I Селен Бром 52 Te 127, 60 I Теллур 49% кислород, 27% кремний от массы земной коры 53 126, 904 Иод 85 At 210 Астат RO 2 R 2 O 5 RO 3 R 2 O 7 RH 4 RH 3 H 2 R HR VIII Химических элементовнеметаллов всего 16 из всех известных элементов. Они широко распространены в природе и их значение огромно. Шесть Не. Ме – С, Н, О, N, P, S являются биогенными элементами. Воздух, вода состоят из веществ, образованных элементами Не. Ме. RO 4
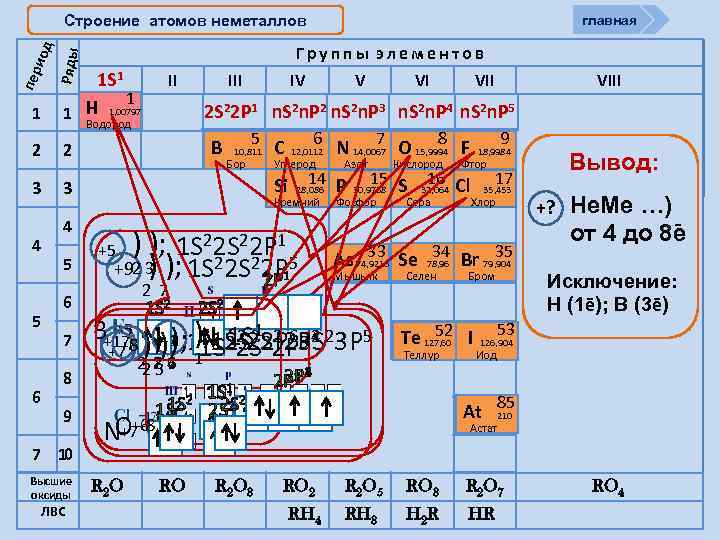
Cтроение атомов неметаллов Перипер одыиод Ряды Группы элементов 1 1 S 1 1 Н 1, 00797 1 Водород 2 2 3 4 5 6 II IV 5 6 7 8 9 7 10 Высшие оксиды ЛВС V В 5 10, 811 Бор С 6 12, 0112 Углерод ) ); 1 S 22 P 1 5 ) +92 3 ); 1 S 22 P 2 P 1 +5 2 7 1 S 2 Азот Кислород Фосфор Сера 15 30, 9738 S VIII Мышьяк 2 S 2 25 1 S 1 2 2 S 1 S +1 2 S 2 O+6 Н C +8 2 1 S 2 RO R 2 O 3 9 18, 9984 Фтор 16 32, 064 Cl Селен 35, 453 Хлор Бром 52 Te 127, 60 I Теллур 2 2 P 4 2 P 3 Вывод: 17 34 35 33 As 74, 9216 Se 78, 96 Br 79, 904 +5 1 6 В+17 ) )+1 1 S 1 S 22 P 4 23 P 5 2 1 S 2 ); 11 S 22 P 3 2 +8 +6 ) ); ); 2 S 2 P 3 S +7 2 26 84 7 R 2 O VII 7 8 N 14, 0067 O 15, 9994 F 14 Si 28, 086 Р Кремний N+7 VI 2 S 22 P 1 n. S 2 n. P 2 n. S 2 n. P 3 n. S 2 n. P 4 n. S 2 n. P 5 3 4 главная +? Не. Ме …) от 4 до 8 e Исключение: Н (1ē); В (3ē) 53 126, 904 Иод At 85 210 Астат RO 2 RH 4 R 2 O 5 RO 3 R 2 O 7 RH 3 H 2 R HR RO 4

Окислительно-восстановительные возможности атомов неметаллов Не. Ме - (8 – n) (восстановление) пер иод Не. Ме 0 + (8 – n) e окислитель главная Окислительные свойства атомов, т. е. способность принимать ē, характерны только для Не. Ме и изменяются в ПСХЭ периодически: в периодах возрастают, в группах убывают
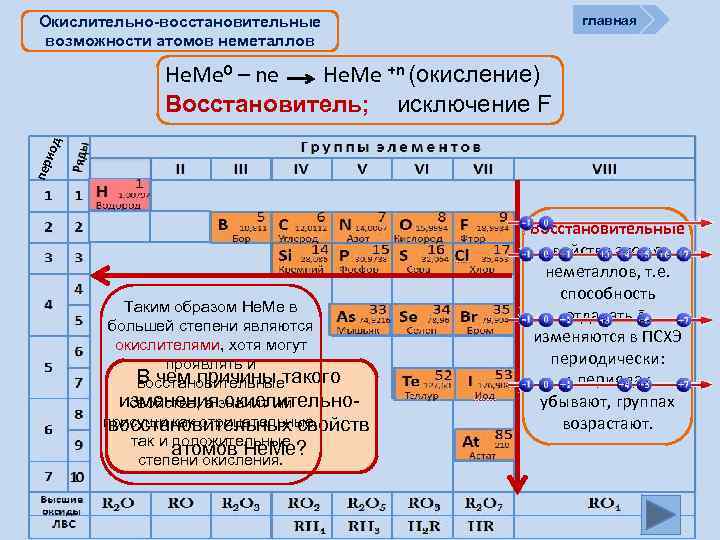
главная Окислительно-восстановительные возможности атомов неметаллов пер иод Не. Ме 0 – ne Не. Ме +n (окисление) Восстановитель; исключение F Таким образом Не. Ме в большей степени являются окислителями, хотя могут проявлять и В чем причины такого восстановительные изменениязначит им свойства, а окислительноприсущи как отрицательные, восстановительных свойств так и положительные атомов Не. Ме? степени окисления. Восстановительные свойства атомов неметаллов, т. е. способность отдавать ē, изменяются в ПСХЭ периодически: в периодах убывают, группах возрастают.
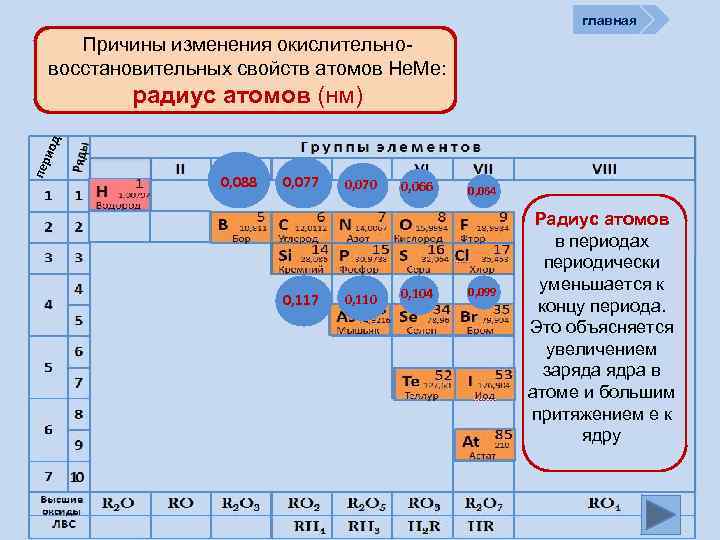
главная Причины изменения окислительновосстановительных свойств атомов Не. Ме: пер иод радиус атомов (нм) 0, 088 0, 077 0, 117 0, 070 0, 110 0, 066 0, 104 0, 064 0, 099 Радиус атомов в периодах периодически уменьшается к концу периода. Это объясняется увеличением заряда ядра в атоме и большим притяжением е к ядру
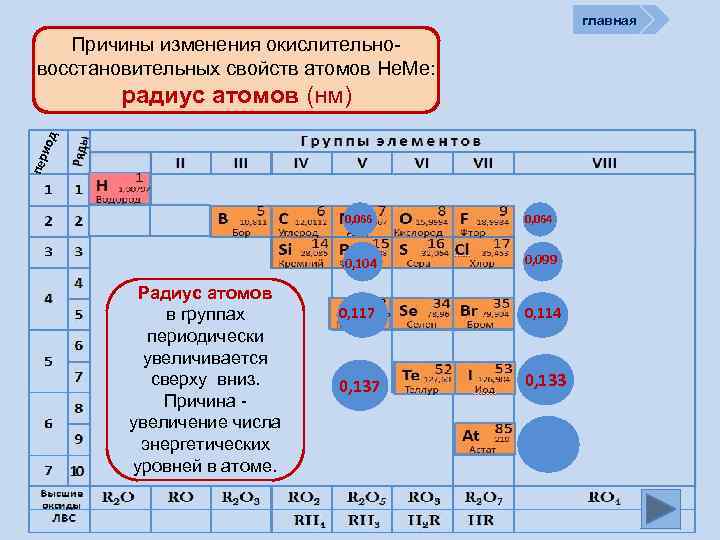
главная Причины изменения окислительновосстановительных свойств атомов Не. Ме: пер иод радиус атомов (нм) 0, 066 0, 104 Радиус атомов в группах периодически увеличивается сверху вниз. Причина увеличение числа энергетических уровней в атоме. 0, 064 0, 099 0, 117 0, 114 0, 137 0, 133
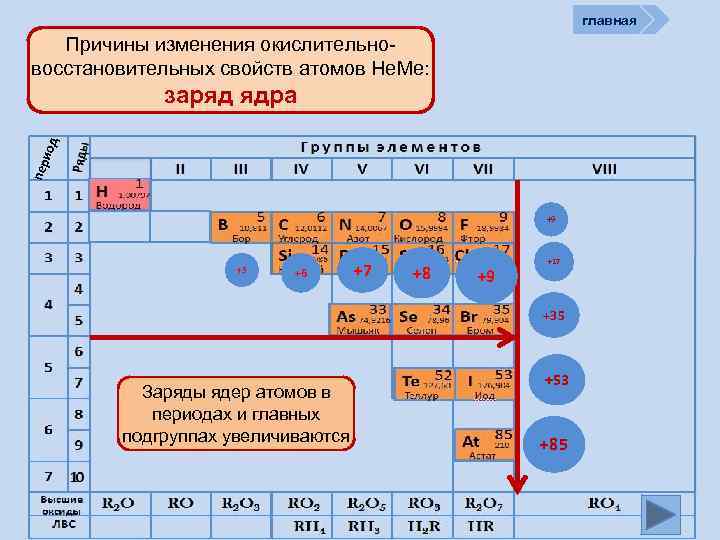
главная Причины изменения окислительновосстановительных свойств атомов Не. Ме: пер иод заряд ядра +9 +5 +6 +7 +8 +9 +17 +35 Заряды ядер атомов в периодах и главных подгруппах увеличиваются +53 +85
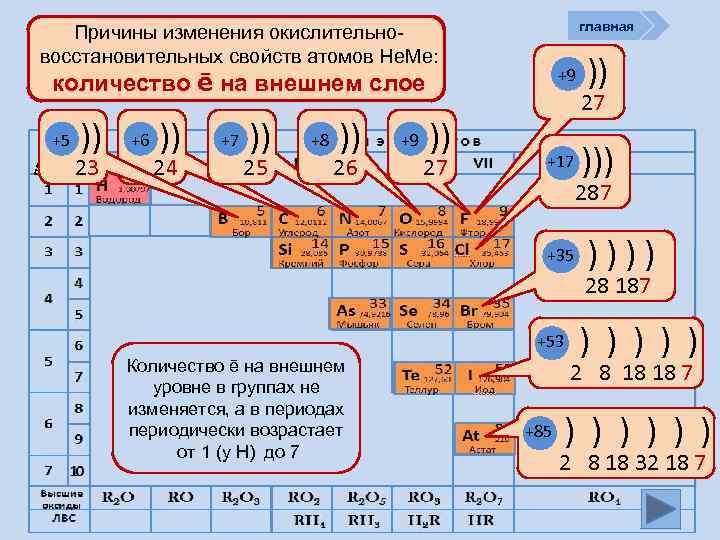
главная Причины изменения окислительновосстановительных свойств атомов Не. Ме: +9 количество ē на внешнем слое пери од +5 )) 23 +6 )) 24 +7 )) 25 +8 )) 26 +9 )) 27 +17 ))) 287 +35 )))) 28 187 +53 Количество ē на внешнем уровне в группах не изменяется, а в периодах периодически возрастает от 1 (у Н) до 7 ) ) ) 2 8 18 18 7 +85 ) ) ) 2 8 18 32 18 7
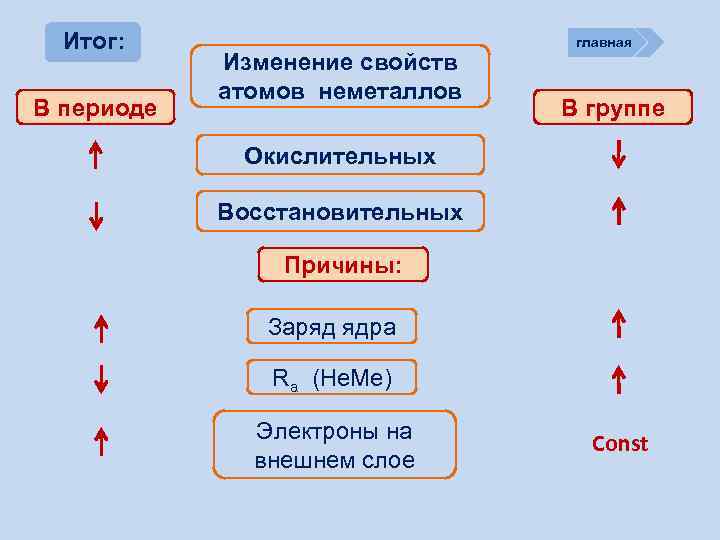
Итог: В периоде Изменение свойств атомов неметаллов главная В группе Окислительных Восстановительных Причины: Заряд ядра Ra (Не. Ме) Электроны на внешнем слое Const
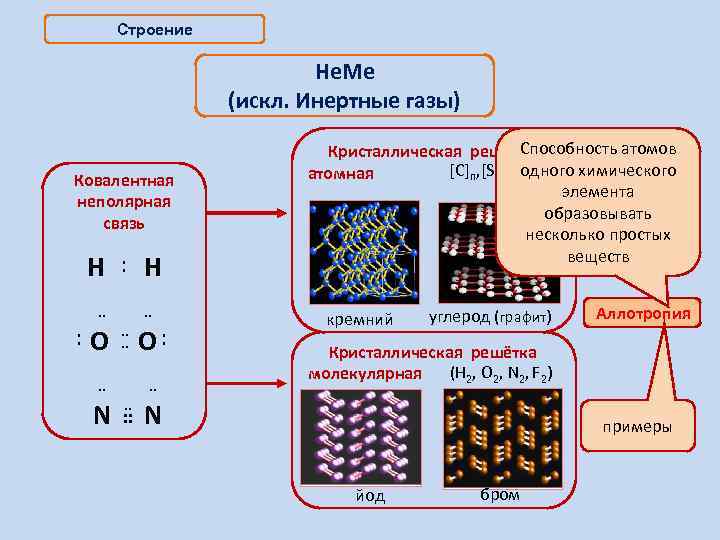
Строение Не. Ме (искл. Инертные газы) Ковалентная неполярная связь H : H ¨ ¨ : O ¨ O: ¨ ¨ ¨ Способность атомов Кристаллическая решётка одного химического [С]n, [Si]n, [S]n атомная элемента образовывать несколько простых веществ кремний углерод (графит) Аллотропия Кристаллическая решётка (Н 2, О 2, N 2, F 2) молекулярная ¨ N ¨ примеры йод бром
![главная Аллотропия озон красный кислород [О]n м. кр. р. графит белый желтый [Р]n а. главная Аллотропия озон красный кислород [О]n м. кр. р. графит белый желтый [Р]n а.](https://present5.com/presentation/1/102988471_456339385.pdf-img/102988471_456339385.pdf-15.jpg)
главная Аллотропия озон красный кислород [О]n м. кр. р. графит белый желтый [Р]n а. кр. р. [Р]4 м. кр. р. [Р]n а. кр. р. алмаз фуллерен [С]n а. кр. р.
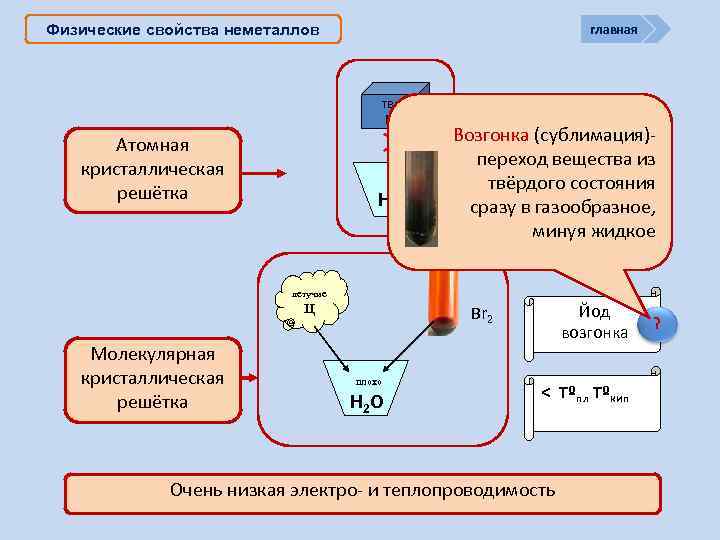
главная Физические свойства неметаллов тв. Ц Атомная кристаллическая решётка Н 2 О Возгонка (сублимация)переход вещества из > Tºпл Tºкип твёрдого состояния сразу в газообразное, минуя жидкое летучие Ц Молекулярная кристаллическая решётка Йод возгонка Br 2 плохо Н 2 О < Tºпл Tºкип Очень низкая электро- и теплопроводимость ?
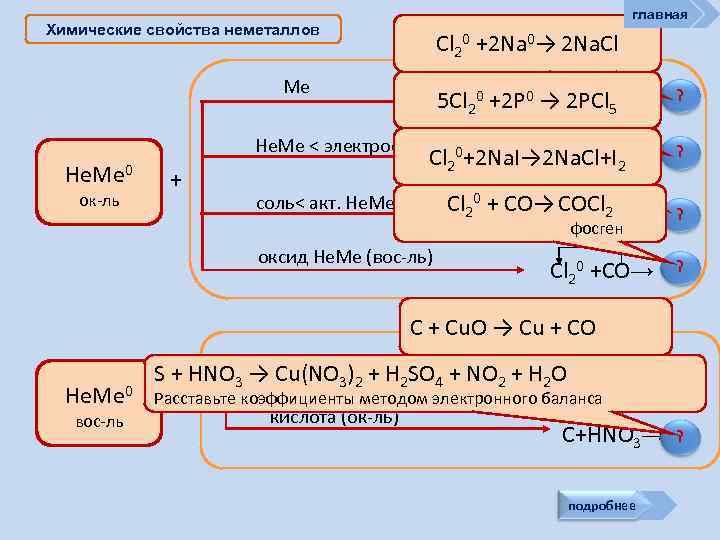
главная Химические свойства неметаллов Cl 20 +2 Na 0→ 2 Na. Cl Ме Cl 0 +Na 0 5 Cl 20 +2 P 0 → 22 PCl 5 → Не. Ме < электроотр. Не. Ме 0 ок-ль + 0+2 Na. I→ 2 Na. Cl+I → Cl 20 +P 02 Cl 2 ? ? Cl 20 + CO→ COCl 2 Cl 0 +Na. I→ соль< акт. Не. Ме ? Cl 20 +CO→ ? 2 фосген оксид Не. Ме (вос-ль) C + Cu. O → Cu + CO Не. Ме 0 вос-ль S + HNO 3 →оксид Ме)2 + H 2 SO 4 + NO 2 + H 2 OC +Cu. O→ Cu(NO 3 Расставьте коэффициенты методом электронного баланса + кислота (ок-ль) C+HNO 3→ подробнее ? ?

Химические свойства неметаллов главная Неметаллы могут: окислять металлы (вещества более или менее склонные отдавать электроны): 3 F 2 + 2 Al = 2 Al. F 3 S + Fe = Fe. S (tº) O 2 + 2 Mg = 2 Mg. O (с предв. tº) 2 C + Ca = Ca. C 2 (tº) окислять другие неметаллы (менее склонные принимать электроны): 2 F 2 + C = CF 4 (tº) S + H 2 = H 2 S (tº) O 2 + S = SO 2 (с предв. tº) окислять многие сложные вещества: 4 F 2 + CH 4 = CF 4 + 4 HF Cl 2 + 2 HBr = Br 2 + 2 HCl 3 O 2 + 4 NH 3 = 2 N 2 + 6 H 2 O (tº) вытеснять менее активные Не. Ме из солей: Hal 2 + F 2 = 2 Наl. F , где Наl = Сl, Вr, I Cl 2 + 2 Na. Br = Br 2 + 2 Na. Cl

Химические свойства неметаллов главная Неметаллы способны: (особенно графит и водород) проявлять восстановительные св-ва: 2 С + Mn. O 2 = Mn + 2 CO 4 H 2 + Fe 3 O 4 = 3 Fe + 4 H 2 O См. окислять другие неметаллы (менее склонные Хлор в левой части уравнения имеет степень принимать электроны): реакции у одних атомов окисления 0. В результате как восстановители реагировать с более электротрицательными у других +1 хлора степень окисления стала -1 (в НСl), неметаллами: (в хлорноватистой кислоте НОСl). Такая реакция — ? Si + 2 F 2 = Si. F 4 C пример реакции самоокисления+ O 2 = CO 2 C + 2 S = CS 2 самовосстановления, или диспропорционирования вступать в реакции самоокисления-самовосстановления ? Сl 2 + Н 2 О = НСl + НСl. O - 25 к. Дж. реакции самоокисления-самовосстановления со щелочами Сl 2 + 2 Nа. ОН = Nа. Сl + Nа. Сl. O + Н 2 О (на холоде) ЗСl 2 + 6 КОН = 2 КСl + КCl. O 3 + ЗН 2 О (при нагрев. )
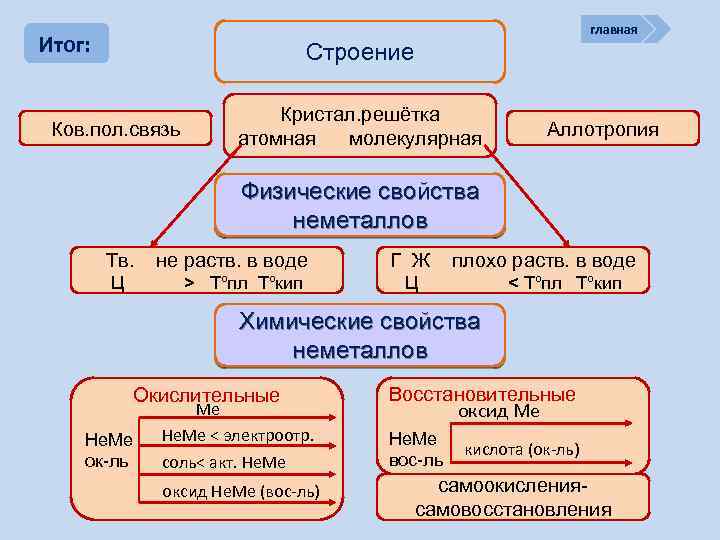
главная Итог: Строение Ков. пол. связь Кристал. решётка атомная молекулярная Аллотропия Физические свойства неметаллов Тв. Ц не раств. в воде > Tºпл Tºкип Г Ж плохо раств. в воде Ц < Tºпл Tºкип Химические свойства неметаллов Окислительные Не. Ме ок-ль Ме Не. Ме < электроотр. соль< акт. Не. Ме оксид Не. Ме (вос-ль) Восстановительные оксид Ме Не. Ме вос-ль кислота (ок-ль) самоокислениясамовосстановления
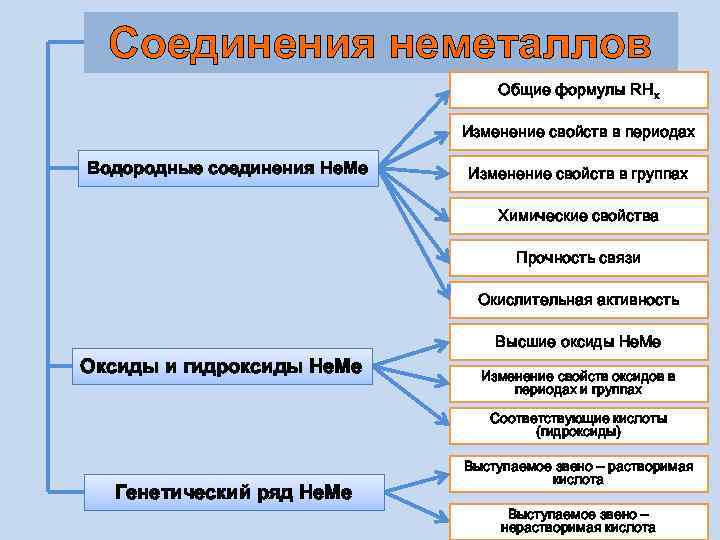
Соединения неметаллов Общие формулы RHx Изменение свойств в периодах Водородные соединения Не. Ме Изменение свойств в группах Химические свойства Прочность связи Окислительная активность Высшие оксиды Не. Ме Оксиды и гидроксиды Не. Ме Изменение свойств оксидов в периодах и группах Соответствующие кислоты (гидроксиды) Генетический ряд Не. Ме Выступаемое звено – растворимая кислота Выступаемое звено – нерастворимая кислота
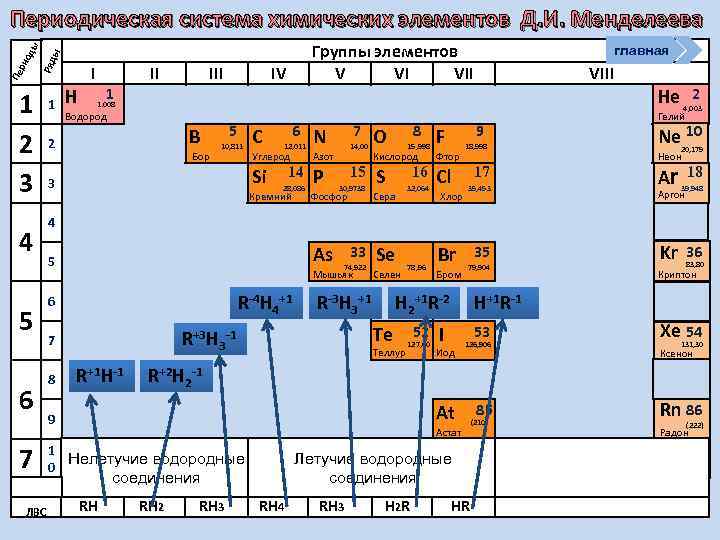
Группы элементов V VI VII ы Ряд Пе ри од ы Периодическая система химических элементов Д. И. Менделеева 1 2 3 4 5 6 7 ЛВС 1 Н I 1 II IV главная VIII 1. 008 Водород B 2 Бор 5 10, 811 C 6 12, 011 Углерод Р 14, 00 Азот Si 3 7 N 14 28, 086 Кремний 15 30, 9738 Фосфор 8 O 15, 998 9 F Кислород Фтор S Cl 16 32, 064 Сера Хлор 18, 998 17 35, 453 He 2 4, 003 Гелий Ne 10 20, 179 Неон Ar 39, 948 Kr 36 18 Аргон 4 As 5 Мышьяк R-4 Н 4+1 6 R+1 Н-1 Se Селен R-3 Н 3+1 78, 96 Br Бром 35 79, 904 Н 2+1 R-2 Te R+3 Н 3 -1 7 8 33 74, 922 Теллур 52 127, 60 Н+1 R-1 I 53 Иод 126, 906 Xe 54 131, 30 Ксенон R+2 Н 2 -1 At 9 Астат 1 Нелетучие водородные 0 Летучие водородные соединения RH 83, 80 Криптон RH 2 RH 3 RH 4 RH 3 H 2 R HR 85 (210) Rn 86 (222) Радон
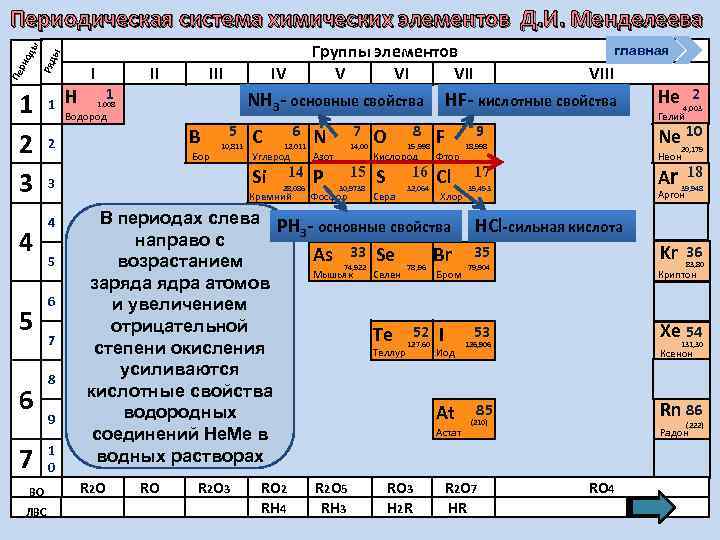
Группы элементов V VI VII ы Ряд Пе ри од ы Периодическая система химических элементов Д. И. Менделеева 1 2 3 4 5 6 7 ВО ЛВС 1 Н I 1 II IV NН 3 - основные свойства 1. 008 Водород B 2 Бор 5 10, 811 5 6 7 8 9 1 0 6 12, 011 7 N Углерод Р 14, 00 Азот Si 3 4 C 14 28, 086 Кремний 15 30, 9738 Фосфор 8 O 15, 998 F Фтор S Cl 16 Сера VIII НF- кислотные свойства Кислород 32, 064 главная Хлор 9 RO R 2 O 3 RO 2 RH 4 R 2 O 5 RH 3 RO 3 H 2 R Гелий 20, 179 Неон Ar 17 35, 453 R 2 O 7 HR 2 4, 003 Ne 10 18, 998 39, 948 Kr 36 18 Аргон В периодах слева РН - основные свойства НCl-сильная кислота 3 направо с 33 35 As 74, 922 Se 78, 96 Br 79, 904 возрастанием Мышьяк Селен Бром заряда ядра атомов и увеличением отрицательной 52 53 Te 127, 60 I 126, 906 степени окисления Теллур Иод усиливаются кислотные свойства 85 водородных At (210) Астат соединений Не. Ме в водных растворах R 2 O He RO 4 83, 80 Криптон Xe 54 131, 30 Ксенон Rn 86 (222) Радон
![Процесс растворения кислот в воде ] : : : [ : Н : F: Процесс растворения кислот в воде ] : : : [ : Н : F:](https://present5.com/presentation/1/102988471_456339385.pdf-img/102988471_456339385.pdf-24.jpg)
Процесс растворения кислот в воде ] : : : [ : Н : F: главная Н -1 Н : O: Н + : F: : Н : О: Н + -1 : : : -2 + Или сокращенно Н 2 О-2 + НF-1 Н 3 О+ + F-1 Фтороводород в водном растворе отщепляет положительные ионы водорода, т. е. проявляет кислотные свойства. Атом кислорода имеет неподеленную электронную пару, а атом водорода – свободную орбиталь, благодаря чему образуется дополнительная ковалентная полярная связь (донорно-акцепторная).
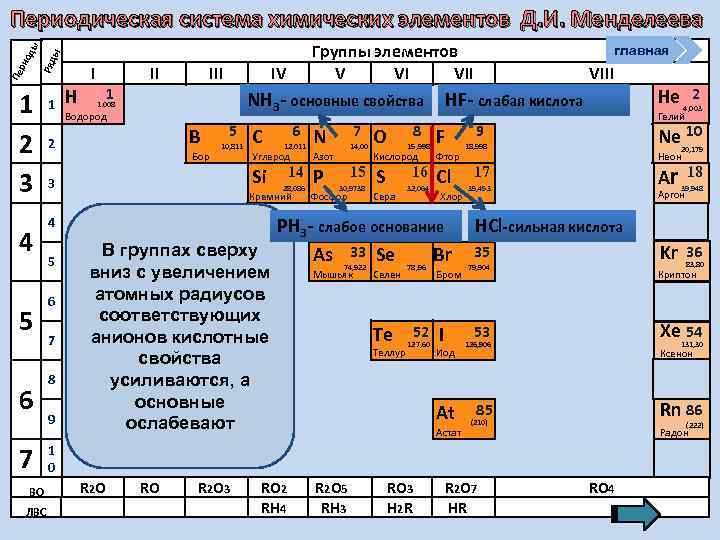
Группы элементов V VI VII ы Ряд Пе ри од ы Периодическая система химических элементов Д. И. Менделеева 1 2 3 4 5 6 7 ВО ЛВС 1 Н I 1 II IV NН 3 - основные свойства 1. 008 Водород B 2 Бор 5 10, 811 5 6 7 8 9 6 12, 011 7 N Углерод Р 14, 00 Азот Si 3 4 C 14 28, 086 Кремний 15 30, 9738 Фосфор 8 O 15, 998 F Фтор S Cl 16 Сера Хлор РН 3 - слабое основание В группах сверху As 33 Se Br вниз с увеличением атомных радиусов соответствующих анионов кислотные свойства усиливаются, а основные ослабевают 74, 922 Мышьяк Селен Te Теллур 78, 96 52 127, 60 VIII НF- слабая кислота Кислород 32, 064 главная Бром I At Астат 9 Ne 10 18, 998 20, 179 Неон Ar RO R 2 O 3 RO 2 RH 4 R 2 O 5 RH 3 RO 3 H 2 R 39, 948 Kr 17 35, 453 36 18 Аргон НCl-сильная кислота 35 79, 904 Xe 54 126, 906 131, 30 Ксенон Rn 86 85 (210) R 2 O 7 HR 83, 80 Криптон (222) Радон 1 0 R 2 O 2 4, 003 Гелий 53 Иод He RO 4
![Процесс растворения аммиака в воде - ][ ] : : : Н 2 О-2 Процесс растворения аммиака в воде - ][ ] : : : Н 2 О-2](https://present5.com/presentation/1/102988471_456339385.pdf-img/102988471_456339385.pdf-26.jpg)
Процесс растворения аммиака в воде - ][ ] : : : Н 2 О-2 + Н 3 N-3 [ : : : : Н: О : Н + Н: N: Н Или сокращенно Н -2 Н Н: N: Н + : О: Н Н : -3 + главная NН 4+ + OH- ? Атом азота имеет неподеленную электронную пару, а атом водорода – свободную орбиталь.
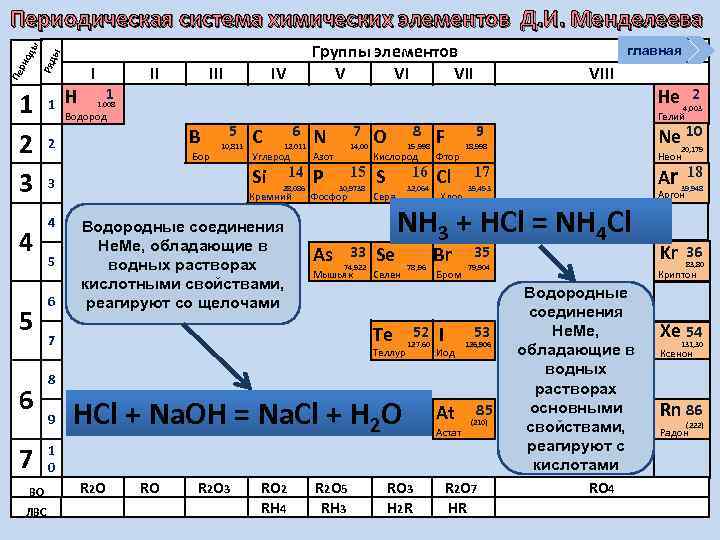
Группы элементов V VI VII ы Ряд Пе ри од ы Периодическая система химических элементов Д. И. Менделеева 1 2 3 4 5 6 7 ВО ЛВС 1 Н I 1 II IV Водород B Бор 5 10, 811 6 C 6 12, 011 7 N Углерод Р 14, 00 Азот Si 3 5 VIII 1. 008 2 4 главная 14 28, 086 Кремний Водородные соединения Не. Ме, обладающие в водных растворах кислотными свойствами, реагируют со щелочами 15 30, 9738 Фосфор As 33 74, 922 Мышьяк 8 O 15, 998 Кислород Фтор S Cl 16 Сера Se 32, 064 Хлор Селен Теллур 78, 96 52 127, 60 Br Бром I 9 HCl + Na. OH = Na. Cl + H 2 O RO R 2 O 3 RO 2 RH 4 R 2 O 5 RH 3 Ar 17 35 53 Иод At Астат 85 (210) RO 3 H 2 R R 2 O 7 HR 39, 948 Kr 36 18 Аргон 79, 904 1 0 R 2 O 20, 179 Неон 35, 453 8 9 Ne 10 18, 998 126, 906 2 4, 003 Гелий NH 3 + HCl = NH 4 Cl Te 7 F He 83, 80 Криптон Водородные соединения Не. Ме, обладающие в водных растворах основными свойствами, реагируют с кислотами RO 4 Xe 54 131, 30 Ксенон Rn 86 (222) Радон
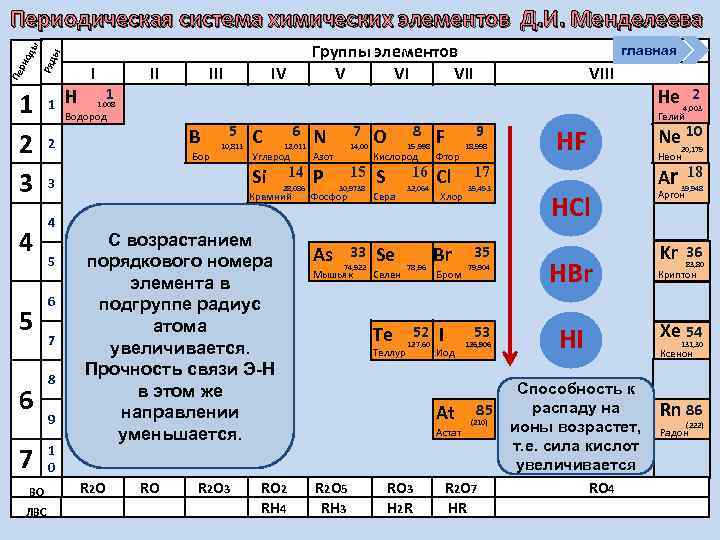
Группы элементов V VI VII ы Ряд Пе ри од ы Периодическая система химических элементов Д. И. Менделеева 1 2 3 4 5 6 7 ВО ЛВС 1 Н I 1 II IV Водород B Бор 5 10, 811 6 7 8 9 1 0 C 6 12, 011 Углерод Р 14 28, 086 С возрастанием порядкового номера элемента в подгруппе радиус атома увеличивается. Прочность связи Э-Н в этом же направлении уменьшается. RO R 2 O 3 14, 00 Азот Кремний R 2 O 7 N Si 3 5 VIII 1. 008 2 4 главная RO 2 RH 4 15 30, 9738 Фосфор As 33 74, 922 Мышьяк 8 O 15, 998 F Кислород Фтор S Cl 16 Сера Se Селен Te Теллур 32, 064 78, 96 52 127, 60 Хлор Br Бром I Иод Астат RO 3 H 2 R 35 79, 904 126, 906 85 (210) R 2 O 7 HR 2 4, 003 Гелий HF 17 35, 453 53 At R 2 O 5 RH 3 9 18, 998 He HCl HBr HI Способность к распаду на ионы возрастет, т. е. сила кислот увеличивается RO 4 Ne 10 20, 179 Неон Ar 39, 948 Kr 36 18 Аргон 83, 80 Криптон Xe 54 131, 30 Ксенон Rn 86 (222) Радон
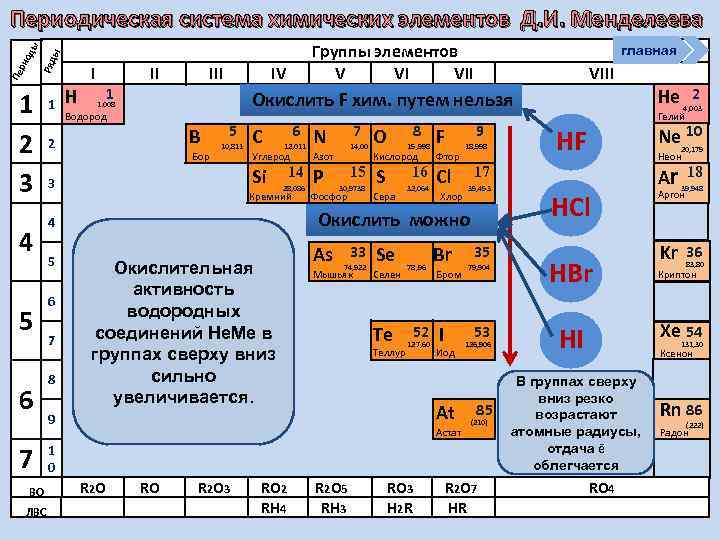
Группы элементов V VI VII ы Ряд Пе ри од ы Периодическая система химических элементов Д. И. Менделеева 1 2 3 4 5 6 7 ВО ЛВС 1 Н I 1 II IV Водород B Бор 5 10, 811 C 6 12, 011 Углерод Р 8 14, 00 Азот 14 28, 086 Кремний 15 30, 9738 Фосфор 8 O 15, 998 F Кислород Фтор S Cl 16 Сера 32, 064 Хлор 9 18, 998 Окислительная активность водородных соединений Не. Ме в группах сверху вниз сильно увеличивается. As 33 74, 922 Мышьяк Se Селен Te Теллур 78, 96 52 127, 60 Br Бром I 53 Иод At 9 35 79, 904 Астат 126, 906 85 (210) 1 0 R 2 O RO R 2 O 3 RO 2 RH 4 R 2 O 5 RH 3 RO 3 H 2 R R 2 O 7 HR He 2 4, 003 Гелий Ne 10 HF 20, 179 Неон 17 35, 453 Окислить можно 4 7 7 N Si 3 6 VIII Окислить F хим. путем нельзя 1. 008 2 5 главная HCl HBr Ar 39, 948 Kr 36 18 Аргон 83, 80 Криптон Xe 54 HI 131, 30 Ксенон В группах сверху вниз резко возрастают атомные радиусы, отдача ē облегчается RO 4 Rn 86 (222) Радон
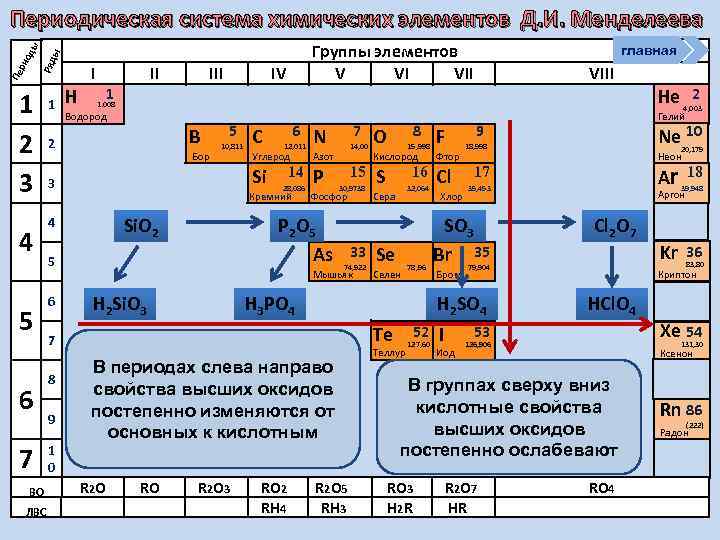
Группы элементов V VI VII ы Ряд Пе ри од ы Периодическая система химических элементов Д. И. Менделеева 1 2 3 4 5 6 7 ВО ЛВС 1 Н I II 1 III IV Водород B Бор 5 10, 811 C 6 12, 011 Углерод Р Si. O 2 14 28, 086 15 30, 9738 Фосфор P 2 O 5 As 5 14, 00 Азот Кремний 4 7 N Si 3 33 74, 922 Мышьяк H 2 Si. O 3 9 1 0 8 O 15, 998 Фтор S Cl 16 Se Селен 78, 96 R 2 O 3 RO 2 RH 4 Хлор 9 Бром R 2 O 5 RH 3 52 Теллур 127, 60 I 20, 179 Неон Ar 17 Cl 2 O 7 79, 904 HCl. O 4 126, 906 R 2 O 7 HR Kr 36 18 83, 80 Криптон Xe 54 131, 30 Ксенон В группах сверху вниз кислотные свойства 85 At (210) высших оксидов Астат постепенно ослабевают RO 3 H 2 R 39, 948 Аргон 53 Иод 2 4, 003 Ne 10 35, 453 SO 3 Br 35 He Гелий 18, 998 H 2 SO 4 В периодах слева направо свойства высших оксидов постепенно изменяются от основных к кислотным RO 32, 064 Сера Te R 2 O F Кислород H 3 PO 4 7 8 VIII 1. 008 2 6 главная RO 4 Rn 86 (222) Радон
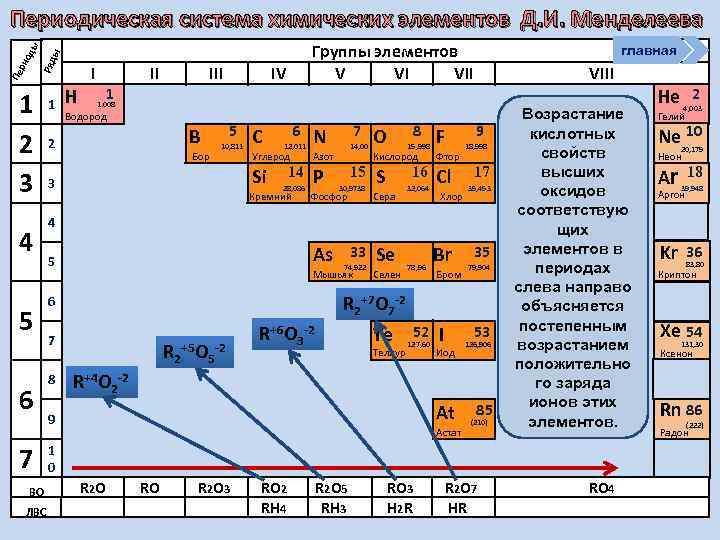
Группы элементов V VI VII ы Ряд Пе ри од ы Периодическая система химических элементов Д. И. Менделеева 1 2 3 4 5 6 7 ВО ЛВС 1 Н I 1 II IV главная VIII 1. 008 Водород B 2 Бор 5 10, 811 C 6 12, 011 Углерод Р 14, 00 Азот Si 3 7 N 14 28, 086 Кремний 15 30, 9738 Фосфор 8 O 15, 998 F Кислород Фтор S Cl 16 Сера 32, 064 Хлор 9 18, 998 17 35, 453 4 As 5 Мышьяк Se Селен 78, 96 Br Бром 35 79, 904 R 2+7 O 7 -2 6 7 8 33 74, 922 R 2+5 O 5 -2 R+6 O 3 -2 Te Теллур 52 127, 60 I 53 Иод 126, 906 R+4 O 2 -2 At 9 Астат 85 (210) Возрастание кислотных свойств высших оксидов соответствую щих элементов в периодах слева направо объясняется постепенным возрастанием положительно го заряда ионов этих элементов. 1 0 R 2 O RO R 2 O 3 RO 2 RH 4 R 2 O 5 RH 3 RO 3 H 2 R R 2 O 7 HR RO 4 He 2 4, 003 Гелий Ne 10 20, 179 Неон Ar 39, 948 Kr 36 18 Аргон 83, 80 Криптон Xe 54 131, 30 Ксенон Rn 86 (222) Радон
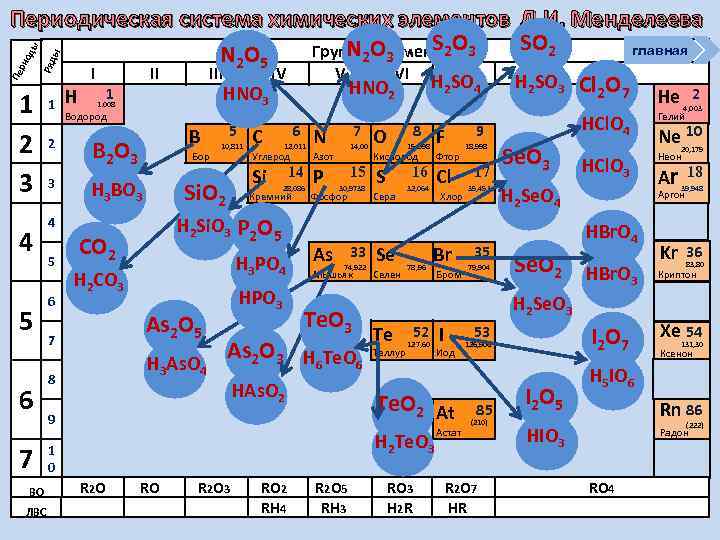
ы Ряд Пе ри од ы Периодическая система химических элементов Д. И. Менделеева S 2 O SO 2 главная N 2 элементов 3 Группы. O 3 N 2 O 5 I II IV V VI VIII H 2 SO 4 H 2 SO 3 Cl 2 O 7 HNO 2 HNO Н 1 He 2 1 2 3 4 5 6 7 ВО ЛВС 1 2 3 3 1. 008 Водород B B 2 O 3 Бор 6 10, 811 12, 011 Р H 3 As. O 4 14, 00 Азот 14 28, 086 H 3 PO 4 As 2 O 5 7 N Углерод Кремний H 2 CO 3 8 6 H 2 Si. O 3 P 2 O 5 CO 2 7 C Si Si. O 2 H 3 BO 3 4 5 5 HPO 3 15 30, 9738 Фосфор As 33 74, 922 Мышьяк Te. O 3 As 2 O 3 H 6 Te. O 6 HAs. O 2 8 O F 15, 998 Кислород Фтор S Cl 16 Сера Se Селен 32, 064 78, 96 Хлор Br Te Теллур 52 127, 60 H 2 Te. O 3 1 0 RO R 2 O 3 RO 2 RH 4 R 2 O 5 RH 3 17 35, 453 35 79, 904 Se. O 3 HCl. O 3 Неон H 2 Se. O 4 HBr. O 4 Se. O 2 I HBr. O 3 RO 3 H 2 R I 2 O 7 53 Иод Астат 126, 906 85 (210) R 2 O 7 HR I 2 O 5 Ne 10 20, 179 Ar 39, 948 Kr 36 18 Аргон H 2 Se. O 3 Te. O 2 At 9 R 2 O Бром HCl. O 4 9 18, 998 4, 003 Гелий 83, 80 Криптон Xe 54 131, 30 Ксенон H 5 IO 6 Rn 86 (222) HIO 3 Радон RO 4
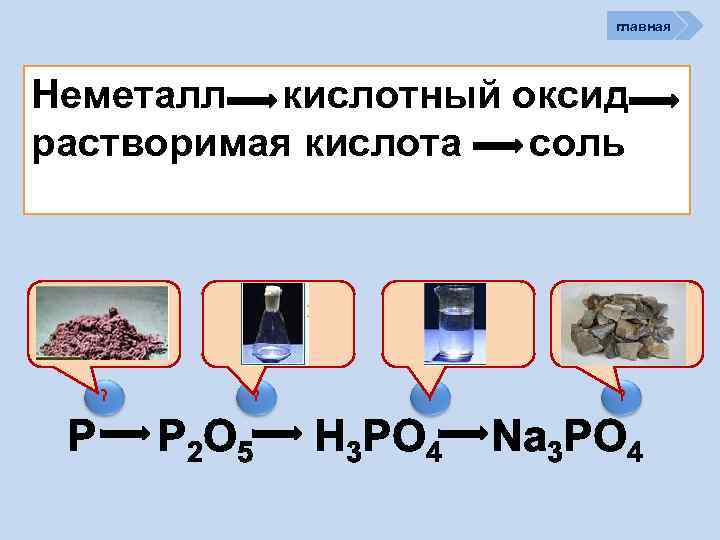
главная Неметалл кислотный оксид растворимая кислота cоль ? P 2 O 5 ? H 3 PO 4 ? Na 3 PO 4
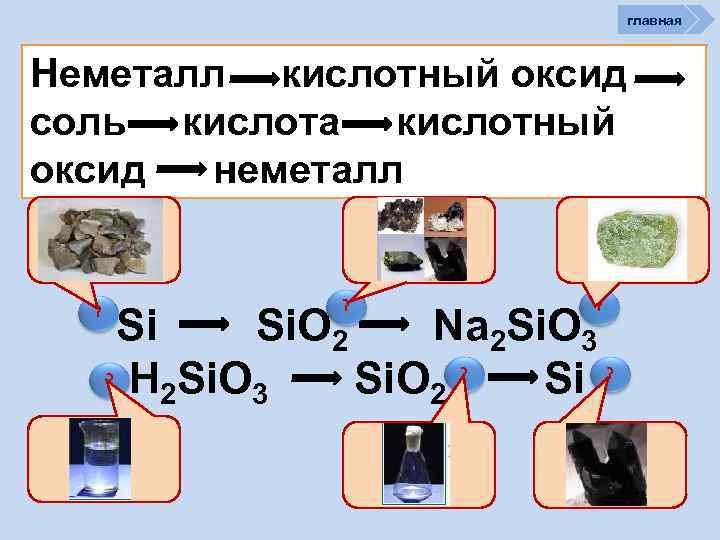
главная Неметалл кислотный оксид соль кислота кислотный оксид неметалл ? ? ? Si Si. O 2 Na 2 Si. O 3 ? ? ? H Si. O 2 Si 2 3
Проверь себя главная Интерактив. Положение неметаллов в ПСХЭ Д. И. Менделеева: http: //school-collection. edu. ru/catalog/res/d 77 a 57 b 7 -8 cff-11 db-b 606 -0800200 c 9 a 66/view/ Интерактив. Особенности строения атомов неметаллов: http: //school-collection. edu. ru/catalog/res/d 77 a 30 ca-8 cff-11 db-b 606 -0800200 c 9 a 66/view/ Интерактив. Окислительные свойства неметаллов: http: //school-collection. edu. ru/catalog/res/d 77 a 57 b 8 -8 cff-11 db-b 606 -0800200 c 9 a 66/view/ Интерактив. Оксиды и гидроксиды неметаллов: http: //school-collection. edu. ru/catalog/res/d 77 a 57 ba-8 cff-11 db-b 606 -0800200 c 9 a 66/view/
Для удобства работы с электронными образовательными ресурсами рекомендуем вам обновить существующую версию плеера ОМС до 1. 0. 0. 84. Скачать дистрибутив плеера ОМС. ftp: //ftp. fcior. edu. ru/oms/OMS. exe главная
главная
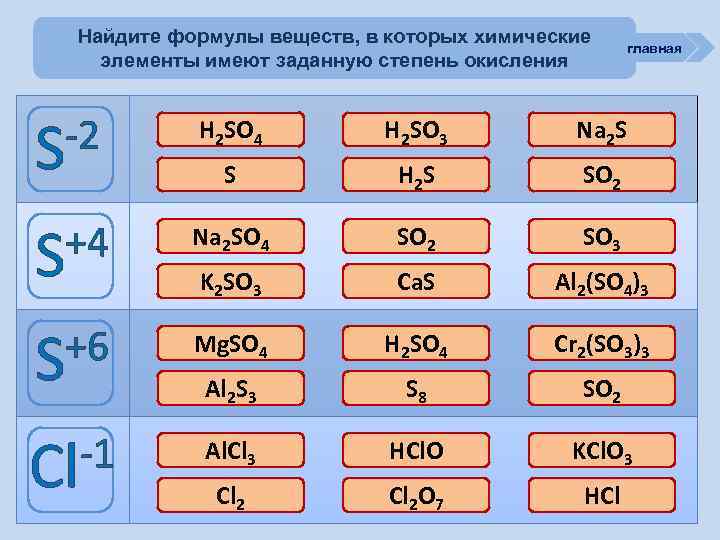
Найдите формулы веществ, в которых химические элементы имеют заданную степень окисления главная -2 S ошибка H 2 SO 4 ошибка H 2 SO 3 молодец Na 2 S ошибка S молодец H 2 S ошибка SO 2 +4 S ошибка Na 2 SO 4 молодец SO 2 ошибка SO 3 молодец K 2 SO 3 ошибка Ca. S Al 2(SO 4)3 ошибка +6 S молодец Mg. SO 4 молодец H 2 SO 4 Cr 2(SO 3)3 ошибка Al 2 S 3 ошибка S 8 ошибка SO 2 -1 Cl молодец Al. Cl 3 ошибка HCl. O ошибка KCl. O 3 ошибка Cl 2 O 7 молодец HCl

главная

главная
неметаллы.pptx