распечатка аминокислоты.ppt
- Количество слайдов: 26

Протеиногенные аминокислоты Кодируются генетически (20): 19 - α-аминокислоты (аминогруппа присоединена к αуглеродному атому той карбоновой кислоты, производным которых они являются). Общая формула этих аминокислот: COO + H 3 N C - H R α-углеродный атом аминокислот является асимметричным, кроме глицина. Это означает, что у каждой аминокислоты существует два оптически активных антипода. 3
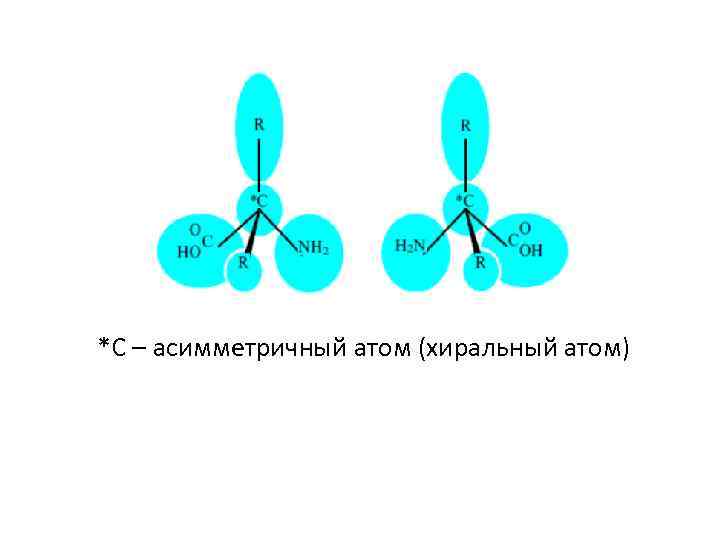
*С – асимметричный атом (хиральный атом)
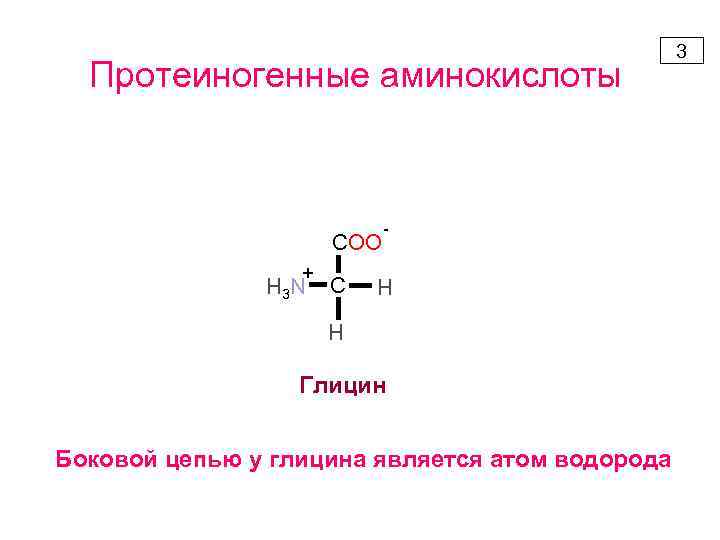
Протеиногенные аминокислоты COO + H 3 N C - H H Глицин Боковой цепью у глицина является атом водорода 3
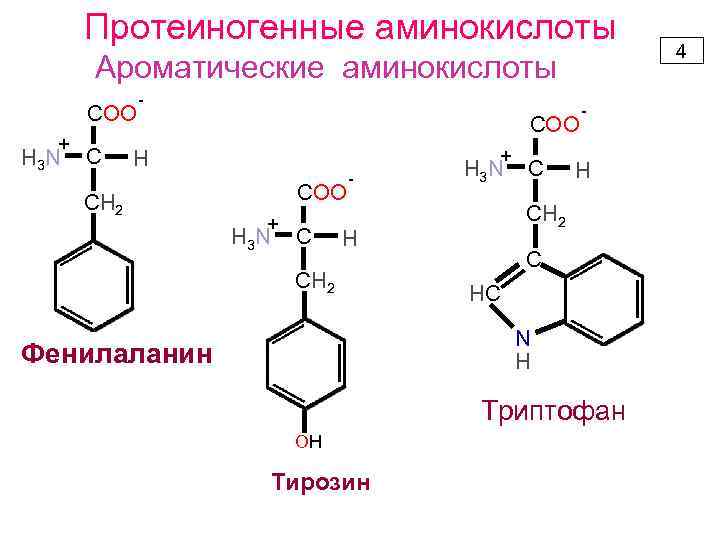
Протеиногенные аминокислоты Ароматические аминокислоты COO + H 3 N C - COO + H СН 2 COO + H 3 N C - H 3 N H СН 2 C - С HC N H Фенилаланин Триптофан OH Тирозин 4
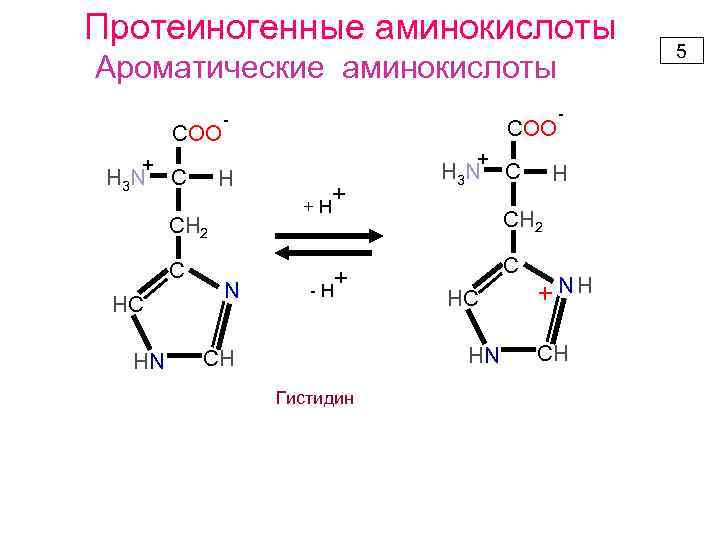
Протеиногенные аминокислоты Ароматические аминокислоты COO + H 3 N C - HC HN + H +H СН 2 C COO N + + -H H 3 N Гистидин H СН 2 C HC HN CH C - N Н+ + CH 5
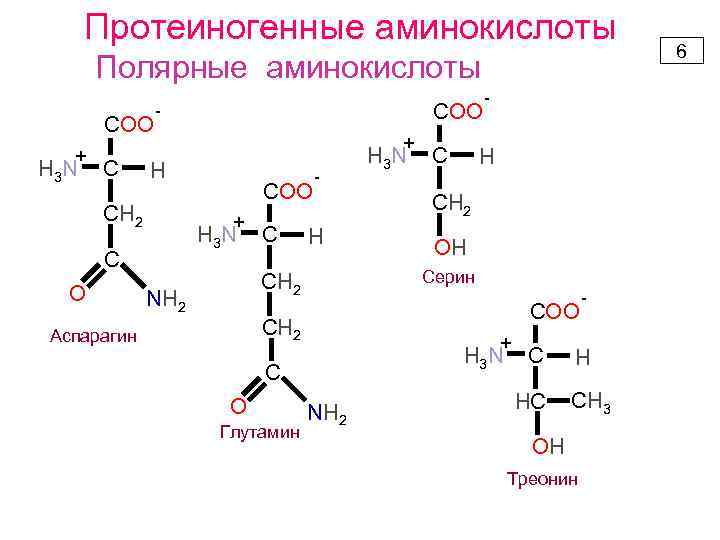
Протеиногенные аминокислоты Полярные аминокислоты COO + H 3 N C + H СН 2 COO + H 3 N C O COO - C - H Глутамин СН 2 OH + H 3 N C O H COO CH 2 Аспарагин C Серин СН 2 NH 2 H 3 N - NH 2 C HС - H CH 3 OH Треонин 6
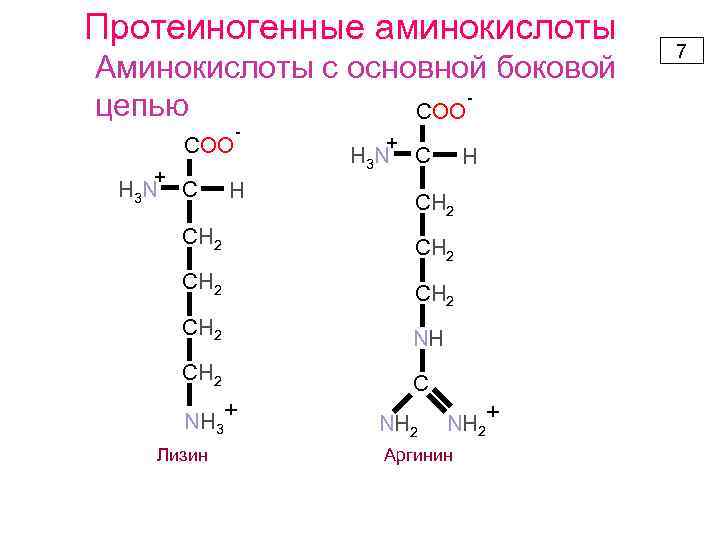
Протеиногенные аминокислоты Аминокислоты с основной боковой цепью COO + H 3 N C - H СН 2 + H 3 N C H СН 2 NH СН 2 C NH 3+ Лизин NH 2+ Аргинин 7
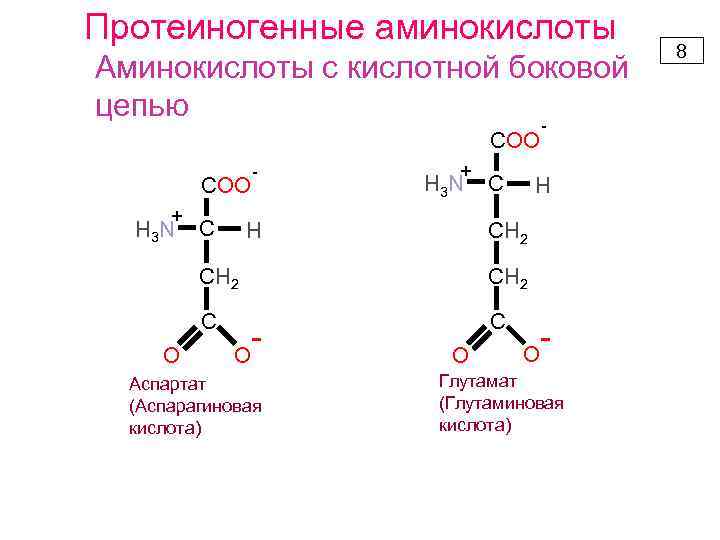
Протеиногенные аминокислоты Аминокислоты с кислотной боковой цепью COO + H 3 N C - + H 3 N H C H СН 2 С O Аспартат (Аспарагиновая кислота) O O Глутамат (Глутаминовая кислота) 8
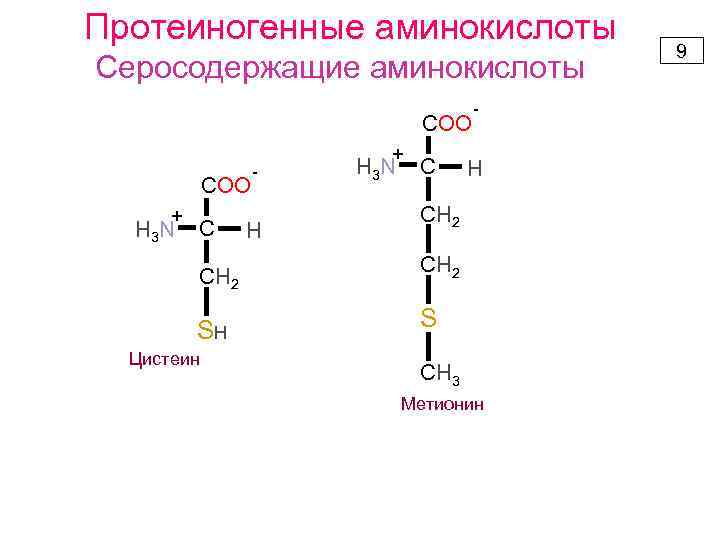
Протеиногенные аминокислоты Серосодержащие аминокислоты COO + H 3 N C СН 2 SH Цистеин - H + H 3 N C - H СН 2 S СН 3 Метионин 9
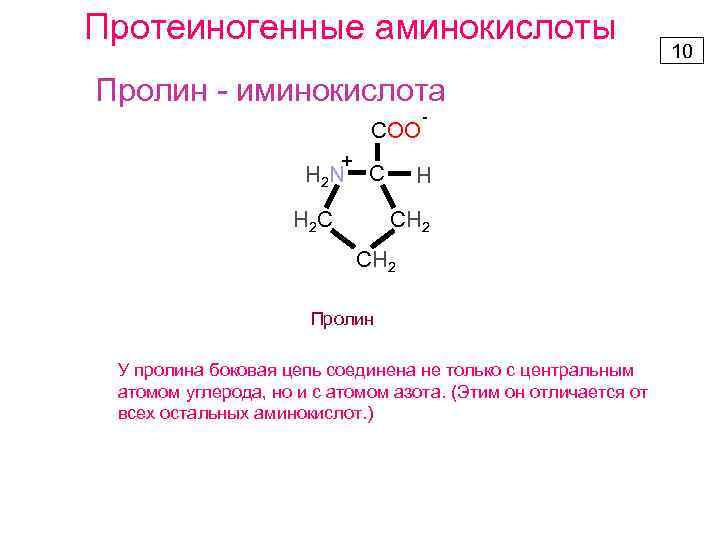
Протеиногенные аминокислоты Пролин - иминокислота COO + H 2 N C Н 2 С - H СН 2 Пролин У пролина боковая цепь соединена не только с центральным атомом углерода, но и с атомом азота. (Этим он отличается от всех остальных аминокислот. ) 10

11

12

13 Пептиды CH 3 H H N C +H N 3 C C O O C CH 3 H O - Пептидная связь Дипептид Ала-Ала

Образование пептидной связи 14
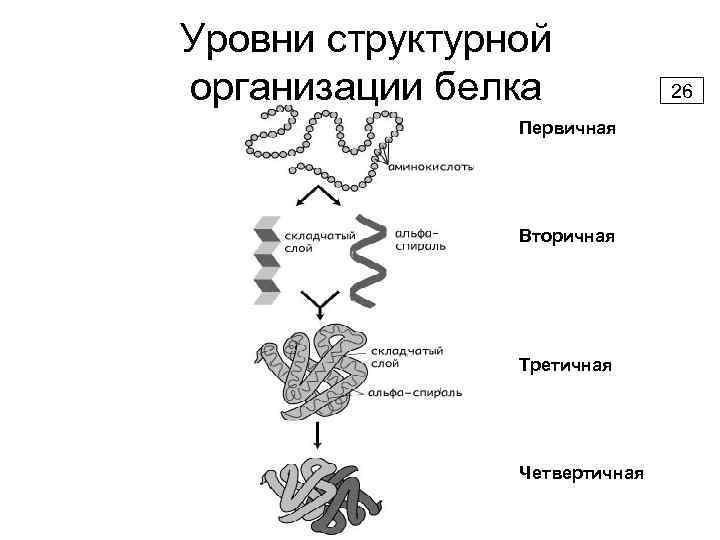
Уровни структурной организации белка Первичная Вторичная Третичная Четвертичная 26
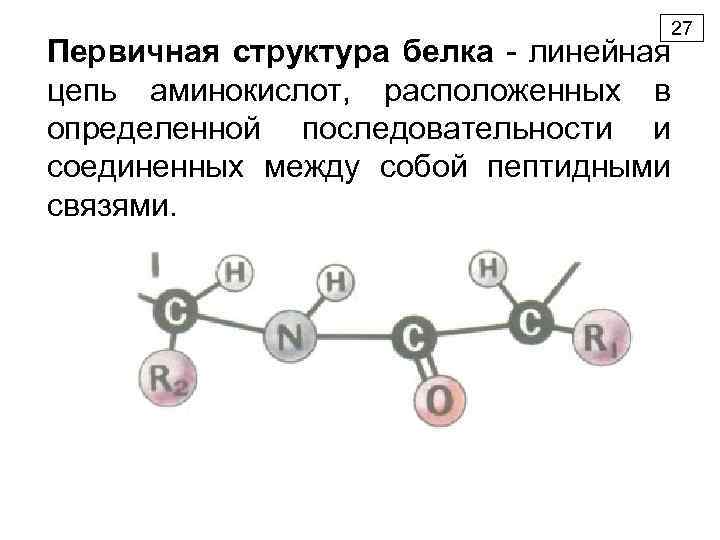
27 Первичная структура белка - линейная цепь аминокислот, расположенных в определенной последовательности и соединенных между собой пептидными связями.

Пептидная связь образуется за счет αкарбоксильной группы одной аминокислоты и α-аминной группы другой: 28
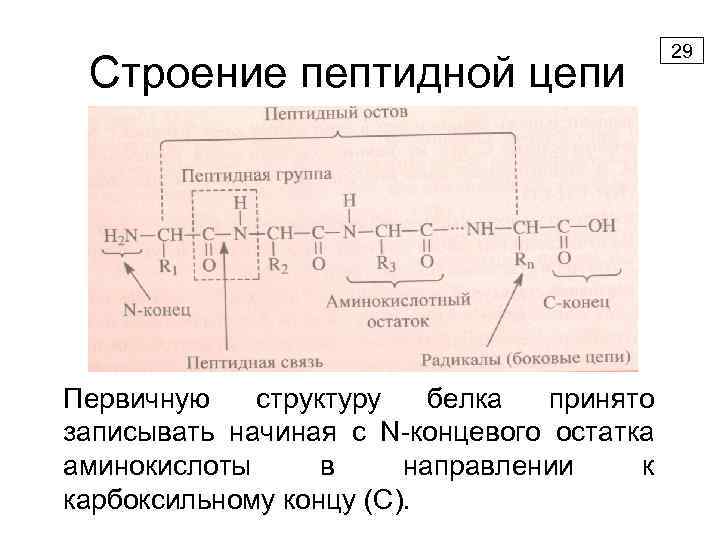
Строение пептидной цепи Первичную структуру белка принято записывать начиная с N-концевого остатка аминокислоты в направлении к карбоксильному концу (C). 29

Вторичная структура белков обусловлена способностью групп пептидной связи к водородным взаимодействиям: С=О…HN Способы укладки полипептидной цепи в пространстве: Ø α-спираль – образуется внутрицепочечными водородными связями между NH-группой одного остатка аминокислоты и СО-группой четвертого от нее остатка. 30

Ø β-структура (складчатый лист) – формируется водородными связями между пептидными группами полипептидных цепей, расположенными параллельно или антипараллельно (Б), или связями между участками одной полипептидной цепи, образуя складки (В). 31

Вторичная структура: слева - антипараллельный, справа - параллельный складчатый лист 32

Ø беспорядочный клубок – это участки, не имеющие 33 правильной, периодической пространственной организации. Содержание α-спиралей и β-структур в разных белках различно: у фибриллярных белков – только спираль или только складчатый лист; а у глобулярных белков – отдельные фрагменты полипептидной цепи: организованы в виде спирали либо складчатого листа, либо беспорядочного клубка. В одном и том же белке могут присутствовать все три способа укладки полипептидной цепи.

Третичная структура белка - укладка в пространстве полипептидной цепи, содержащей α-спирали, β-структуры и участки без периодической структуры (беспорядочный клубок). 34
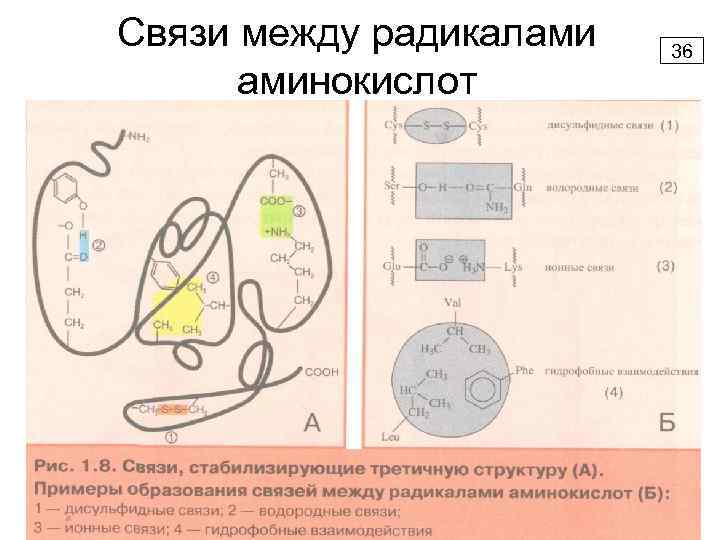
Связи между радикалами аминокислот 36

Уровни структурной организации белка 38

40 Сложные белки Белки Гликопротеины Липопротеины Фосфопротеины Простетические группы углеводы липиды фосфорная кислота Металлопротеины ионы различных металлов Нуклеопротеины нуклеиновые кислоты Гемопротеины геммы
распечатка аминокислоты.ppt