Простые вещества - Металлы.pptx
- Количество слайдов: 22
 Простые вещества – металлы
Простые вещества – металлы
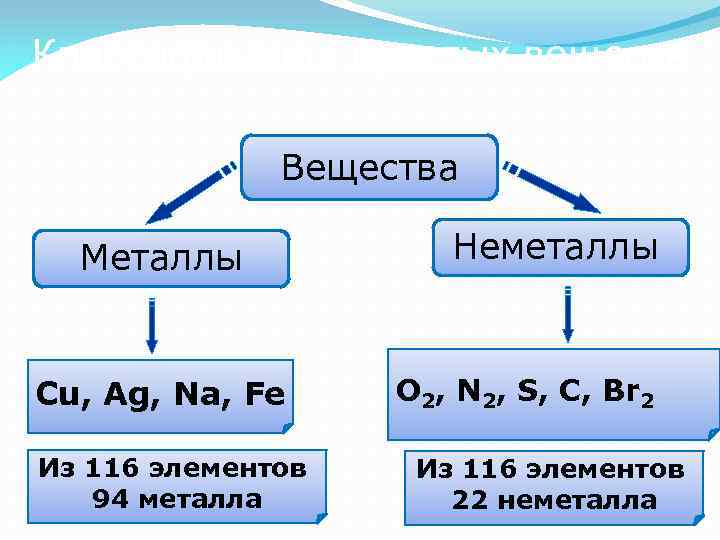 Классификация простых веществ Вещества Металлы Cu, Ag, Na, Fe Из 116 элементов 94 металла Неметаллы O 2, N 2, S, C, Br 2 Из 116 элементов 22 неметалла
Классификация простых веществ Вещества Металлы Cu, Ag, Na, Fe Из 116 элементов 94 металла Неметаллы O 2, N 2, S, C, Br 2 Из 116 элементов 22 неметалла
 Немного истории Каменный век Медный век IV-III тысячелетие до н. э. Бронзовый век конец IV- начало I тысячелетия до н. э. Железный век I тысячелетие до н. э. 3
Немного истории Каменный век Медный век IV-III тысячелетие до н. э. Бронзовый век конец IV- начало I тысячелетия до н. э. Железный век I тысячелетие до н. э. 3
 Металлы и небесные тела Металл Небесное тело, День недели бог Золото Воскресенье Серебро Солнце, Аполлон Луна, Диана Ртуть Меркурий Среда Медь Венера Пятница Железо Марс Вторник Олово Юпитер Четверг Свинец Сатурн Суббота Астрономический знак Понедельник 4
Металлы и небесные тела Металл Небесное тело, День недели бог Золото Воскресенье Серебро Солнце, Аполлон Луна, Диана Ртуть Меркурий Среда Медь Венера Пятница Железо Марс Вторник Олово Юпитер Четверг Свинец Сатурн Суббота Астрономический знак Понедельник 4
 Старинная легенда о металлах Когда закончилось строительство Иерусалимского храма, царь Соломон спросил: „Кто же из строителей самый главный? “. Вызвались: Каменщики Плотники Землекопы
Старинная легенда о металлах Когда закончилось строительство Иерусалимского храма, царь Соломон спросил: „Кто же из строителей самый главный? “. Вызвались: Каменщики Плотники Землекопы
 Однако мудрый Соломон объяснил, что инструменты каменщика, плотника и землекопа сделал кузнец. Следовательно, и слава главного строителя храма принадлежит кузнецу. В легенде отразилось огромное уважение, которым издревле пользовались мастера, покоряющие металл, заставляющие его служить людям. Царь Соломон Слава кузнецам! Иерусалимский храм
Однако мудрый Соломон объяснил, что инструменты каменщика, плотника и землекопа сделал кузнец. Следовательно, и слава главного строителя храма принадлежит кузнецу. В легенде отразилось огромное уважение, которым издревле пользовались мастера, покоряющие металл, заставляющие его служить людям. Царь Соломон Слава кузнецам! Иерусалимский храм
 Периодическая система химических элементов Д. И. Менделеева Пери – оды 1 I Н Na Литий 3 6. 939 Калий 29 39, 102 Сu Медь Rb 47 Ag Серебро Цезий 112, 40 Алюминий 55 Ва 132, 905 Иттрий Сd In 114, 82 Аu Золото Барий 80 200, 59 Ртуть 49 Индий * 138, 81 VIII VII 204, 37 Таллий 32 As 72, 59 Zr Цирконий Sn Мышьяк 41 92, 906 Nb Сурьма 73 Свинец 121, 75 Та Rf [262] 51, 996 Селен 42 95, 94 Теллур 183. 85 34 Br Мо Db Дубний [263] 27 Со 58, 9332 Кобальт 52 I 44 101, 07 Ru Рутений 45 Rh 102, 905 Родий 75 186, 2 Re Рений 84 At Sg Сиборгий 76 190, 2 Оs Осмий 77 192, 2 Ir Иридий [262] Bh Франций Радий Актиний Резерфордий Борий R 2 О RO R 2 O 3 RO 2 R 2 O 5 RO 3 R 2 O 7 RH 4 RH 3 RH 2 RH Ni Никель 46 106, 4 36 83, 80 Pd Палладий 78 195, 09 108 [265] Hs Хассий 109 [266] 54 Мt Мейтнерий RO 4 131, 30 Рt Платина Rn 85 Астат 107 58, 71 Ксенон 210 [210] 28 Xe 126, 9044 Йод W Аргон Криптон 53 78, 96 18 39, 948 Кr 35 Технеций Полоний 106 Fe Железо Тс [99] 26 55, 847 79, 904 Бром 43 Ar 17 Хлор 10 20, 183 Неон 35, 453 Марганец Вольфрам 208, 980 Фтор 44, 956 78, 96 Nе 9 18, 9984 Cr 25 Мn 24 83 Ро Висмут 105 Сера 74 180, 948 F 17 Cl 32, 064 Молибден Тантал 207, 19 Кислород 51 Тe 82 Вi Pb 8 15, 9994 33 Se 74, 9216 50 Sb Гафний О Хром Ниобий 118, 69 Олово Fr[223] 87 Rа 88 89 ** Ас 104 [226] 138, 81 [261] V Ванадий 178. 49 81 Фосфор 2 4. 0026 Гелий 15 S 30, 9738 50, 942 Германий 91, 22 Азот Ti 23 La 72 Hf Лантан Hg ТI Кремний 40 7 14, 0067 14 P 28, 086 31 Ge Y N 12, 01115 Титан 26, 9815 88, 905 56 57 Углерод 47, 90 Скандий 38 39 137. 34 6 Sc 22 44, 956 Галлий 87, 62 С 13 Si 26, 9815 Zn Ga Стронций 48 Бор 20 21 40, 08 Кальций 65, 37 5 10, 811 12 Al 24, 312 Магний 30 В Кадмий 196, 967 ЛВС Бериллий 37 Sr 85, 47 107, 868 Cs 4 9, 0122 Цинк Рубидий 79 Ве 19 Сa 63, 546 Высшие оксиды VI Не 11 Мg 22, 9898 Натрий К 7 V Водород 3 6 IV 1 Li 5 III 1, 00797 2 4 II Группы элементов Радон 86 [222]
Периодическая система химических элементов Д. И. Менделеева Пери – оды 1 I Н Na Литий 3 6. 939 Калий 29 39, 102 Сu Медь Rb 47 Ag Серебро Цезий 112, 40 Алюминий 55 Ва 132, 905 Иттрий Сd In 114, 82 Аu Золото Барий 80 200, 59 Ртуть 49 Индий * 138, 81 VIII VII 204, 37 Таллий 32 As 72, 59 Zr Цирконий Sn Мышьяк 41 92, 906 Nb Сурьма 73 Свинец 121, 75 Та Rf [262] 51, 996 Селен 42 95, 94 Теллур 183. 85 34 Br Мо Db Дубний [263] 27 Со 58, 9332 Кобальт 52 I 44 101, 07 Ru Рутений 45 Rh 102, 905 Родий 75 186, 2 Re Рений 84 At Sg Сиборгий 76 190, 2 Оs Осмий 77 192, 2 Ir Иридий [262] Bh Франций Радий Актиний Резерфордий Борий R 2 О RO R 2 O 3 RO 2 R 2 O 5 RO 3 R 2 O 7 RH 4 RH 3 RH 2 RH Ni Никель 46 106, 4 36 83, 80 Pd Палладий 78 195, 09 108 [265] Hs Хассий 109 [266] 54 Мt Мейтнерий RO 4 131, 30 Рt Платина Rn 85 Астат 107 58, 71 Ксенон 210 [210] 28 Xe 126, 9044 Йод W Аргон Криптон 53 78, 96 18 39, 948 Кr 35 Технеций Полоний 106 Fe Железо Тс [99] 26 55, 847 79, 904 Бром 43 Ar 17 Хлор 10 20, 183 Неон 35, 453 Марганец Вольфрам 208, 980 Фтор 44, 956 78, 96 Nе 9 18, 9984 Cr 25 Мn 24 83 Ро Висмут 105 Сера 74 180, 948 F 17 Cl 32, 064 Молибден Тантал 207, 19 Кислород 51 Тe 82 Вi Pb 8 15, 9994 33 Se 74, 9216 50 Sb Гафний О Хром Ниобий 118, 69 Олово Fr[223] 87 Rа 88 89 ** Ас 104 [226] 138, 81 [261] V Ванадий 178. 49 81 Фосфор 2 4. 0026 Гелий 15 S 30, 9738 50, 942 Германий 91, 22 Азот Ti 23 La 72 Hf Лантан Hg ТI Кремний 40 7 14, 0067 14 P 28, 086 31 Ge Y N 12, 01115 Титан 26, 9815 88, 905 56 57 Углерод 47, 90 Скандий 38 39 137. 34 6 Sc 22 44, 956 Галлий 87, 62 С 13 Si 26, 9815 Zn Ga Стронций 48 Бор 20 21 40, 08 Кальций 65, 37 5 10, 811 12 Al 24, 312 Магний 30 В Кадмий 196, 967 ЛВС Бериллий 37 Sr 85, 47 107, 868 Cs 4 9, 0122 Цинк Рубидий 79 Ве 19 Сa 63, 546 Высшие оксиды VI Не 11 Мg 22, 9898 Натрий К 7 V Водород 3 6 IV 1 Li 5 III 1, 00797 2 4 II Группы элементов Радон 86 [222]
 Основные особенности строения атомов металлов: 1. Небольшое число ē на последнем энергетическом уровне (1 - 3ē). 2. Относительно большой атомный радиус. © Осиевская И. А
Основные особенности строения атомов металлов: 1. Небольшое число ē на последнем энергетическом уровне (1 - 3ē). 2. Относительно большой атомный радиус. © Осиевская И. А
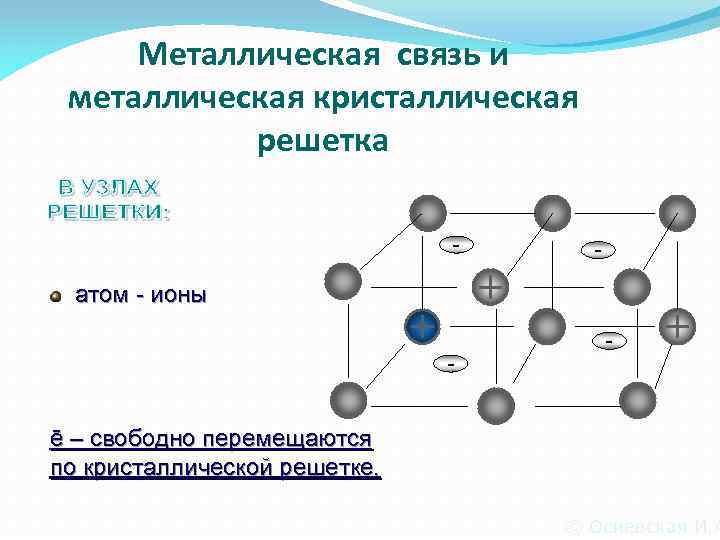 Металлическая связь и металлическая кристаллическая решетка - - атом - ионы - ē – свободно перемещаются по кристаллической решетке. © Осиевская И. А
Металлическая связь и металлическая кристаллическая решетка - - атом - ионы - ē – свободно перемещаются по кристаллической решетке. © Осиевская И. А
 Агрегатное состояние – твердые в-ва искл. : Hg – жидкий металл Цвет От сереблисто-белого до темно-серого, искл. Au (желтый) и Cu (красно-коричневый). Электро- и теплопроводность Причина – относительно _ свободные е
Агрегатное состояние – твердые в-ва искл. : Hg – жидкий металл Цвет От сереблисто-белого до темно-серого, искл. Au (желтый) и Cu (красно-коричневый). Электро- и теплопроводность Причина – относительно _ свободные е
 Пластичность/хрупкость Как правило пластичные (Au, Ag, Cu, Al и др. ), искл. Sn (серое), Твердость/мягкость Твердые (Cr, Fe) и мягкие (Au, Na, K). Температура плавления Изменяется в широком интервале Самая высокая: Самая низкая? Tпл. (W)= +3380°С Tпл. (Hg)= − 38, 8°С
Пластичность/хрупкость Как правило пластичные (Au, Ag, Cu, Al и др. ), искл. Sn (серое), Твердость/мягкость Твердые (Cr, Fe) и мягкие (Au, Na, K). Температура плавления Изменяется в широком интервале Самая высокая: Самая низкая? Tпл. (W)= +3380°С Tпл. (Hg)= − 38, 8°С
 От серебристо-белого до серого литий бериллий германий Искл. : золото и медь Металлический блеск
От серебристо-белого до серого литий бериллий германий Искл. : золото и медь Металлический блеск
 Теплопроводны Электропроводны
Теплопроводны Электропроводны
 Пластичность Алюминий + + + Золото + Медь Серое олово хрупкое
Пластичность Алюминий + + + Золото + Медь Серое олово хрупкое
 Температура плавления 3370 3500 3000 2500 1755 2000 1500 1083 961 1000 328 28 500 419 660 98 0 -500 -39 Hg Cs Na Sn Легкоплавкие t<1000ºC Zn Al Ag Cu Fe W Тугоплавкие t >1000ºC
Температура плавления 3370 3500 3000 2500 1755 2000 1500 1083 961 1000 328 28 500 419 660 98 0 -500 -39 Hg Cs Na Sn Легкоплавкие t<1000ºC Zn Al Ag Cu Fe W Тугоплавкие t >1000ºC
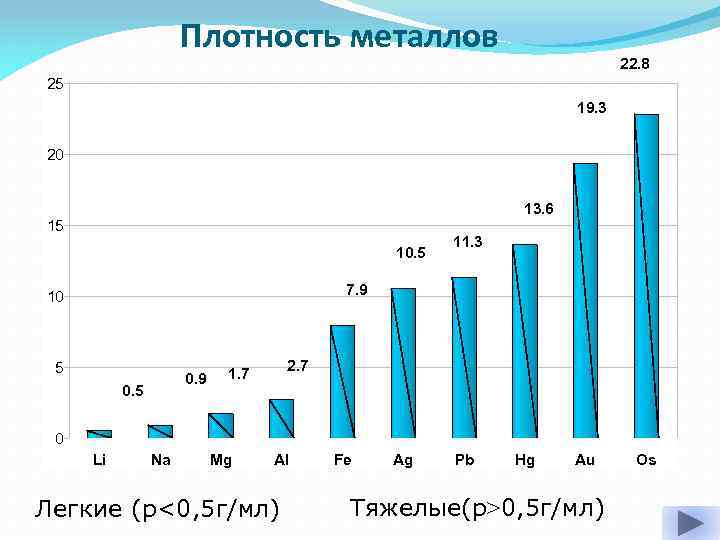 Плотность металлов 22. 8 25 19. 3 20 13. 6 15 10. 5 11. 3 7. 9 10 5 0. 9 0. 5 2. 7 1. 7 0 Li Na Mg Al Легкие (p<0, 5 г/мл) Fe Ag Pb Hg Au Тяжелые(p>0, 5 г/мл) Os
Плотность металлов 22. 8 25 19. 3 20 13. 6 15 10. 5 11. 3 7. 9 10 5 0. 9 0. 5 2. 7 1. 7 0 Li Na Mg Al Легкие (p<0, 5 г/мл) Fe Ag Pb Hg Au Тяжелые(p>0, 5 г/мл) Os

 М. В. Ломоносов «металл – это светлое тело, которое ковать можно» 18
М. В. Ломоносов «металл – это светлое тело, которое ковать можно» 18
 Металлы – это ковкие, пластичные, тягучие вещества, которые имеют металлический блеск и способны проводить тепло и электрический ток. © Осиевская И. А
Металлы – это ковкие, пластичные, тягучие вещества, которые имеют металлический блеск и способны проводить тепло и электрический ток. © Осиевская И. А
 Проба указывает на содержание чистого драгоценного металла в граммах в 1 килограмме (1000 г) ювелирного сплава. Платина - 950; Золото - 375, 500, 583, 585, 750, 958; Серебро - 750, 800, 875, 916, 925, 960;
Проба указывает на содержание чистого драгоценного металла в граммах в 1 килограмме (1000 г) ювелирного сплава. Платина - 950; Золото - 375, 500, 583, 585, 750, 958; Серебро - 750, 800, 875, 916, 925, 960;
 Литературная страничка Называем в честь металлов Иногда наперебой Если нервы, то стальные, А характер – золотой. Золотой у солнца лучик, Снег – скопленье серебра, Из свинцовой мрачной тучи Дождик льет, как из ведра. А у рыжих - медный волос Или просто медный блеск. Золотой пленяет голос, Золотой проходит век. Золотая лихорадка Губит душу у людей Видно, кто к богатству падкий, Кто простак, а кто злодей. 21
Литературная страничка Называем в честь металлов Иногда наперебой Если нервы, то стальные, А характер – золотой. Золотой у солнца лучик, Снег – скопленье серебра, Из свинцовой мрачной тучи Дождик льет, как из ведра. А у рыжих - медный волос Или просто медный блеск. Золотой пленяет голос, Золотой проходит век. Золотая лихорадка Губит душу у людей Видно, кто к богатству падкий, Кто простак, а кто злодей. 21
 Домашнее задание § 13, 14 Ответить на вопросы 1. Что такое аллотропия, аллотропные модификации (видоизиенения)? 2. В чем причина аллотропии? 3. Перечислить аллотропные модификации (с указанием их основных физических свойств) химических элементов: кислород, углерод, фосфор, сера, олово.
Домашнее задание § 13, 14 Ответить на вопросы 1. Что такое аллотропия, аллотропные модификации (видоизиенения)? 2. В чем причина аллотропии? 3. Перечислить аллотропные модификации (с указанием их основных физических свойств) химических элементов: кислород, углерод, фосфор, сера, олово.


