e912f9d55b172b45cc8c47435350ed68.ppt
- Количество слайдов: 71

Промышленное получение антибитиков. Антибиотики — это не просто вещества, которые действуют против болезнетворных м/о (например, йод не антибиотик), но это еще и вещества, получаемые с помощью микроорганизмов продуцентов. В 1929 г. английский ученый Александр Флеминг обратил внимание на то, что вблизи плесени не растут многие болезнетворные м/о. Позднее было выделено вещество, синтезируемое плесенью, и названо оно пенициллином. Во время Второй мировой войны было начато его производство и применение для лечения раненых. Только в 1940 е и 1950 е годы с помощью пенициллина было спасено от смерти более 15 миллионов человек. Обычно антибиотик не действует на все подряд м/о, да это и нежелательно: ведь наряду с болезнетворными будут уничтожаться полезные микробы, которые всегда есть в человеческом организме. Поэтому должен быть набор различных антибиотиков, пригодных для разных болезней. Но есть и другая сторона: болезнетворные м/о «привыкают» к действию антибиотиков; возникают микробы, которые вызывают заболевание, но нечувствительны к «старому» антибиотику. Такое привыкание происходит не быстро — в течение 10— 15 лет. Но раз это происходит, ученым необходимо искать все новые и новые антибиотики и продуцирующие их микроорганизмы. Сейчас существует более 4500 различных антибиотиков, все время ищут более продуктивные м/о. Например, плесень Флеминга в военные годы давала активность по пенициллину не более 10 ед/мл. А современные штаммы м/о дают 50000 ед/мл того же пенициллина.
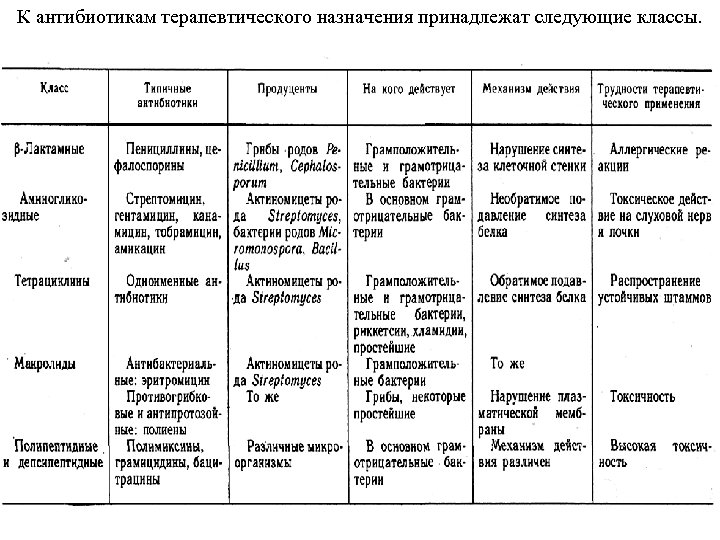
К антибиотикам терапевтического назначения принадлежат следующие классы.

Причины поиска новых антибиотиков связано с токсичностью существующих, аллергическими реакциями, вызываемыми ими, нарастанием устойчивости патогенных м/о к применяемым препаратам. Значительных результатов удалось добиться за десятилетия селекции штаммов продуцентов с применением индуцированного мутагенеза и ступенчатого отбора. Многообещающим подходом служит инкапсулирование антибиотиков, в частности их включение в липосомы, что позволяет прицельно доставлять препарат только к определенным органам и тканям, повышает его эффективность и снижает побочное действие. Вместо антибиотика в организм человека может вводиться его продуцент, антагонист возбудителя заболевания. Этот подход берет начало с работ И. Мечникова о подавлении гнилостной микрофлоры в толстом кишечнике человека посредством молочнокислых бактерий. Важнейшая характерная черта антибиотиков — их избирательность действия на метаболизм. Обычно из нескольких тысяч метаболических реакций антибиотик подавляет только одну или несколько. В этом отношении антибиотики противопоставляются антисептикам, активность которых значительно ниже. К антибиотикам относятся только низкомолекулярные вещества — с молекулярной массой не более нескольких тысяч дальтон. Антибиотики высокоэффективны при инфекционных заболеваниях, вызываемых большинством грамположительных и грамотрицательных бактерий, многими патогенными грибами. Они с успехом используются при некоторых инфекциях простейших, риккетсий и крупных вирусов.

В отличие от первичных метаболитов антибиотики за редкими исключениями вообще не обнаруживаются во время первых часов роста культуры. Так, образуемые грибами или актиномицетами антибиотики можно выявить в культуральной жидкости или мицелии продуцента только на вторые —третьи сутки роста, причем в незначительных количествах. Максимум их накопления наступает на пятые —шестые сутки. Несмотря на то, что при синтезе или «сборке» молекулы антибиотика используются первичные метаболиты (аминокислоты, сахара, жирные кислоты, пурины и т. д. ), образование антибиотика подчиняется общим законам внутриклеточной регуляции он становится необходимым для своего продуцента. Существует несколько предположений о биологической роли антибиотиков. Наиболее распространенной считается гипотеза, что антибиотики являются средством преодоления «стрессовых» ситуаций для продуцента, независимо от того, чем вызвана такая ситуация — исчерпанием питательных веществ в результате роста культуры конкурента или результатом размножения клеток своей же культуры. В лабораториях разных стран мира выделены и охарактеризованы десятки тысяч продуцентов антибиотиков. Как правило, продуцентами антибиотиков являются такие почвенные микроорганизмы как плесневые грибы, актиномицеты и спорообразующие бактерии.

Популяция обеспечивается питательной средой и в ней создаются оптимальные условия для роста. Если в процессе культивирования не вносить дополнительных питательных компонентов и не выводить из него биомассу и продукты метаболизма вместе со средой, то рост популяции будет протекать по S образной кривой. Это и есть так называемая периодическая или статическая культура. На рис. изображена S образная логарифмическая кривая роста популяции и условно определены границы между фазами роста, постепенно переходящими одна в другую. Лаг фаза (начальная фаза) относится к промежутку времени, в течение которого плотность популяции или концентрация биомассы, внесенной в свежую питательную среду, не изменяется. В некоторых случаях наблюдается даже некоторое снижение концентрации биомассы. В период лаг фазы размер клеток увеличивается, и в них активно протекают биохимические процессы, связанные с подготовкой к началу размножения. Длительность лаг фазы зависит от доброкачественности питательной среды, условий культивирования, свойств и физиологической активности микроорганизмов, количества посевного материала и ряда других факторов. Фаза ускорения роста относится к небольшому периоду увеличения удельной скорости роста популяции от нулевой до максимальной удельной скорости μmax.
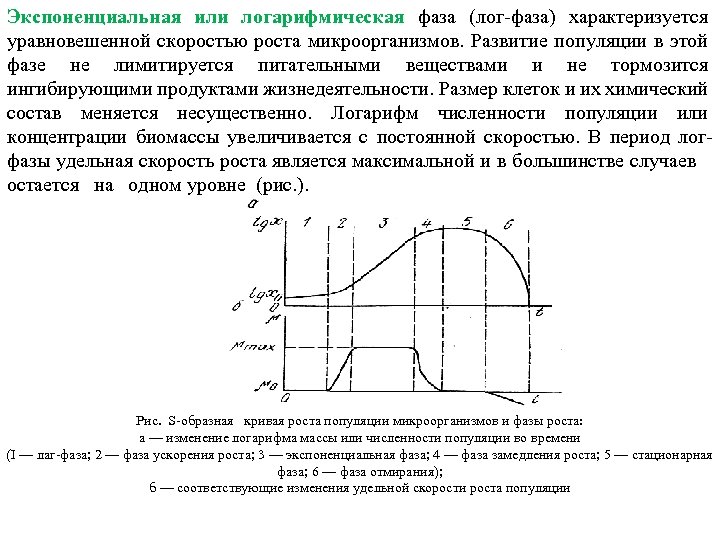
Экспоненциальная или логарифмическая фаза (лог фаза) характеризуется уравновешенной скоростью роста микроорганизмов. Развитие популяции в этой фазе не лимитируется питательными веществами и не тормозится ингибирующими продуктами жизнедеятельности. Размер клеток и их химический состав меняется несущественно. Логарифм численности популяции или концентрации биомассы увеличивается с постоянной скоростью. В период лог фазы удельная скорость роста является максимальной и в большинстве случаев остается на одном уровне (рис. ). Рис. S образная кривая роста популяции микроорганизмов и фазы роста: а — изменение логарифма массы или численности популяции во времени (I — лаг фаза; 2 — фаза ускорения роста; 3 — экспоненциальная фаза; 4 — фаза замедления роста; 5 — стационарная фаза; 6 — фаза отмирания); б — соответствующие изменения удельной скорости роста популяции

Рост плотности популяции или увеличение концентрации биомассы в этой фазе описывается уравнением: x = x 0×eμmax×t. При логарифмировании этой формулы получается следующее выражение: lnx = μmaxt + lnx 0, где x 0 — концентрация биомассы в начале лог фазы. На S образной кривой это выражение в координатах. Igx и t дает прямую линию, угол наклона которой зависит от свойств культуры, качества питательной среды, условий культивирования и других факторов. В связи с тем, что в период лог фазы μmax практически не изменяется, ее легко найти в любой промежуток времени в этой фазе по формуле μmax = (lnx 2 – lnx 1)/(t 2 – t 1) где х1 и x 2 — концентрации биомасс (находятся экспериментально) соответственно в моменты времени t 1 и t 2. В периодической культуре лог фаза не может быть бесконечной вследствие снижения концентрации питательных веществ в среде и накопления продуктов метаболизма, ингибирующих развитие популяции. Поэтому популяция переходит в фазу замедленного или отрицательного ускорения роста. В этой фазе небольшая часть особей прекращает развитие, другая часть продолжает рост, но медленнее по сравнению с лог фазой. По мере потребления питательных веществ концентрация биомассы продолжает расти, однако удельная скорость роста популяции снижается и популяция переходит в стационарную фазу развития. В этой фазе скорость роста всех клеток популяции постепенно снижается до нуля, концентрация биомассы не возрастает и к концу фазы уменьшается.

Популяция постепенно переходит в фазу ускоренного (логарифмического) отмирания. Эта фаза сопровождается уменьшением общего числа особей и концентрации биомассы вследствие автолиза клеток. Все фазы развития микробной популяции необходимо рассматривать как постепенно переходящие одна в другую, границы которых определены условно. Существует несколько предположений о биологической роли антибиотиков. Наиболее распространенной считается гипотеза, что антибиотики являются средством преодоления «стрессовых» ситуаций для продуцента, независимо от того, чем вызвана такая ситуация — исчерпанием питательных веществ в результате роста культуры конкурента или результатом размножения клеток своей же культуры. В лабораториях разных стран мира выделены и охарактеризованы десятки тысяч продуцентов антибиотиков. Как правило, продуцентами антибиотиков являются такие почвенные микроорганизмы как плесневые грибы, актиномицеты и спорообразующие бактерии.

Биотехнология антибиотиков. Фактически ни один продуцент, выделенный из природного источника, непосредственно в производстве использован быть не может. Природный штамм образует лишь незначительные количества антибиотиков. Обработкой мутагенами и многоступенчатым отбором (селекцией) активных вариантов удается повысить активность штамма, так количество образуемого им антибиотика увеличивается в тысячи и даже десятки тысяч раз. Например, у продуцента пенициллина активность повысилась от десятков микрограммов до десятых долей грамма антибиотика в миллилитре среды. У промышленных мутантных штаммов (суперпродуценты) антибиотик, образуемый в огромном количестве, не должен влиять: • на собственный биосинтез; • жизнедеятельность своего продуцента. Как известно, избыточное образование метаболита ведет к прекращению его биосинтеза по принципу обратной связи. В случае суперпродуцентов механизм обратной связи исключен. Однако свойство образовывать избыточные количества антибиотиков нестойко. Оно легко теряется полностью или частично, поэтому промышленные продуценты хранят в особых условиях, периодически проверяя их активность. При необходимости их рассевают на отдельные колонии, из которых затем отбираются наиболее активные.

Продуценты большинства антибиотиков являются аэробами или (реже) факультативными анаэробами. Очень скоро поверхностная ферментация была заменена на глубинную. Только глубинная ферментация создала возможность современного биотехнологического производства с выпуском конечного продукта в большом количестве. Кривые накопления биомассы продуцента и антибиотика в культуральной жидкости, а также и в мицелии продуцента, не совпадают во времени. Вторая кривая значительно запаздывает (рис. ). Это относится к продуцентам всех важнейших антибиотиков: грибам, актиномицетам, споровым бактериям. Первая фаза развития культуры продуцента была названа «трофофаза» — фаза сбалансированного роста. Вторая — «идиофаза» или фаза несбалансированного роста. В течение трофофазы антибиотик в культуральной жидкости практически не обнаруживается. Во время идиофазы прирост биомассы замедляется. Наступает быстрое накопление антибиотика в культуральной жидкости. В трофофазе источники углерода и азота в среде быстро потребляются, и количество их в среде уменьшается. В идиофазе их потребление замедляется, а в конце идиофазы происходит частичный лизис густой культуры мицелия. Одновременно в культуре можно обнаружить и некоторое количество новых нитей молодого мицелия, который находится уже в условиях среды, обедненной питательными веществами, и участвует в биосинтезе антибиотика.
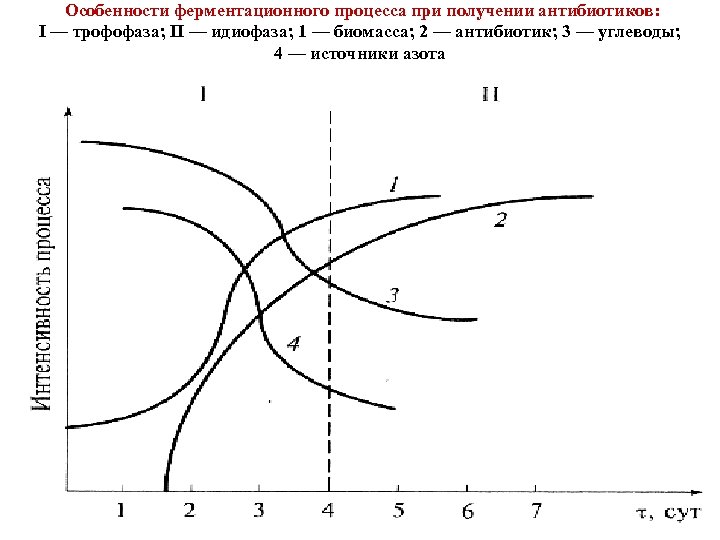
Особенности ферментационного процесса при получении антибиотиков: I — трофофаза; II — идиофаза; 1 — биомасса; 2 — антибиотик; 3 — углеводы; 4 — источники азота

Таким образом, интенсивному биосинтезу антибиотика способствует значительное уменьшение в среде источников углерода и азота, особенно легко усваиваемых. Происходит дерепрессия ферментов синтеза антибиотика. Однако выращивание продуцентов с самого начала ферментации на обедненных средах нецелесообразно, так как незначительное накопление биомассы в течение трофофазы ведет в конечном счете и к незначительному накоплению антибиотика малым количеством клеток продуцента. Для каждого штамма продуцента состав оптимальной для биосинтеза антибиотика среды подбирается отдельно. После ферментации культуральная жидкость содержит растворенный антибиотик, мицелий продуцента, продукты его лизиса, ряд компонентов неиспользованной питательной среды, в том числе высоко и низкомолекулярные органические вещества и неорганические соли. Иногда антибиотик содержится не только в культуральной жидкости, но и в мицелии. Культуральная жидкость нередко отличается высокой вязкостью. Поэтому выделить антибиотик из столь сложной гетерогенной системы непросто. Используемые в настоящее время методы выделения и очистки разрабатываются применительно к конкретному антибиотику и определяются его физико химическими свойствами: локализацией, составом культуральной жидкости, ее реологическими и другими характеристиками.

На стадии предварительной обработки культуральной жидкости отделяют растворенный антибиотик от суспензии мицелия и компонентов культуральной жидкости, находящихся в коллоидном состоянии. Если часть антибиотика находится в мицелии, его переводят в водную фазу, например, изменяя р. Н культуральной жидкости (в случае тетрациклинов). Иногда, наоборот, растворенный и связанный с мицелием антибиотик объединяют в общем осадке, из которого антибиотик затем экстрагируют. Отделяют нативный раствор от мицелия и коллоидных частиц методами фильтрации или центрифугирования, для чего используют барабанные вакуумфильтры, фильтр прессы, сепараторы разных конструкций и т. д. На следующей стадии ставится задача получения антибиотика в виде индивидуального вещества. При этом необходимо учитывать довольно высокую лабильность многих антибиотиков, что ограничивает условия их выделения. Принцип экстракции органическим растворителем используется при очистке таких важнейших антибиотиков, как пенициллин, эритромицин и некоторых других. При переходе в органический растворитель соответствующие антибиотики освобождаются сразу от многих примесей. Варьируя р. Н и меняя таким образом растворимость антибиотика в воде (точнее, в буферном растворе), можно многократно переводить антибиотик из одной фазы в другую, освобождаясь каждый раз от определенного количества примесей.

Также при очистке антибиотиков используются ионообменные смолы (катиониты и аниониты). Особое значение эти сорбционные методы сыграли в решении проблемы получения в высокоочищенном виде аминогликозидных антибиотиков — стрептомицина и других, имеющих свойства оснований. Аминогликозиды слаборастворимы в органических растворителях, и вследствие этого экстракционный метод применительно к ним не может быть использован. Помимо традиционных экстракционных и сорбционных методов при выделении и очистке антибиотиков все большее значение приобретают мембранные технологии. При обезвоживании препаратов антибиотиков используют лиофильную или распылительную сушку. В последнем случае раствор антибиотика распыляется из форсунок до частиц диаметром 5 — 25 мкм в токе нагретого до 1600 С воздуха. Сушка происходит в течение долей секунды. Затем препарат фасуют в стерильные флаконы с соблюдением условий, гарантирующих стерильность. Так как биосинтез антибиотиков ведется в асептических условиях, то при выделении, очистке и получении лекарственных форм также соблюдаются максимально возможные предосторожности против контаминации. Тем не менее проблема стерильности инъекционных препаратов и обсемененности препаратов для наружного применения остается одной из самых сложных для производства как антибиотиков, так и лекарственных средств в целом.

Механизм действия антибиотиков. Применяемые в медицине антибиотики по дифференцируются на следующие основные группы: механизму действия • ингибиторы образования клеточной стенки бактерий; (цефалоспорины и другие вещества беталактамной структуры). • ингибиторы белкового синтеза из бактерий. К ним относятся все аминогликозиды (стрептомицин, гентамицин и др. ), а также тетрациклины, эритромицин, левомицетин и некоторые другие антибиотики. • ингибиторы синтеза нуклеиновых кислот. К этой группе (антрациклины, блеомицин, оливомицин и др. ) относится ряд ДНК тропных противоопухолевых веществ. Они подавляют синтез РНК, а некоторые из них — синтез и ДНК, и РНК. Такие антибиотики всегда заметно токсичны, потому что связываются с ДНК любого происхождения — бактериального, вирусного, растительного, животного. Возможность их применения как цитостатиков в онкологической практике обусловлена тем, что клетки опухолей растут (размножаются) быстрее клеток нормальной ткани, и антибиотический эффект на опухоли выражается сильнее. • ингибиторы функций цитоплазматической мембраны микробной клетки. Наиболее известны противогрибковые антибиотики полиеновой (т. е. с сопряженными двойными связями) структуры: нистатин, амфотерицин В, леворин.

Производство антибиотиков. Глубинное культивирование микроорганизмов. При глубинном способе культивирования более рационально используются питательные вещества сред, что дает возможность значительно сократить отходы производства в виде нерастворимых осадков твердой питательной среды, получать препараты антибиотиков с меньшим содержанием примесей и большей удельной активностью. Основное требование к ферментеру возможность проведения процесса культивирования продуцента в асептических условиях при интенсивном аэрировании среды. В процессе культивирования приходится иметь дело со сложной трехфазной системой жидкость твердая взвесь газ. В такой системе затруднены массообменные процессы и поэтому усложняется аппаратурное оформление всей стадии выращивания. Промышленные ферментеры по способу подвода энергии на аэрирование и перемешивание можно подразделить на три группы: аппараты с механическим перемешиванием и барботажем (комбинированные); с эжекционной системой аэрирования (подвод энергии к жидкой фазе) и барботажные (подвод энергии к газовой фазе). Для фармацефтической промышленности наибольший интерес представляет первая группа аппаратов. Эти аппараты имеют цилиндрическую форму и отличаются по объему, конструкции отбойников, перемешивающих устройств, уплотнений вращающегося вала и теплообменным устройствам. Максимальный объем ферментеров с механическим перемешиванием и пеногашением составляет 2 000 м 3. Фирма «Хемап» разработала ферментеры вместимостью до 360 400 м 3

Очень важно убедиться, что в ферментере обеспечиваются асептический режим культивирования, соблюдение всех параметров роста микроорганизма и создаются благоприятные условия биосинтеза ферментов. Для соблюдения этого требования ферментеры должны выдерживать жесткую стерилизацию и работать в течение всего культивирования под небольшим избыточным давлением. Аппараты рассчитаны для работы под избыточным давлением 0, 25 МПа и стерилизации при температуре 130 140°С. Во избежание инфицирования культуры предусмотрены торцовые уплотнения вала перемешивающего устройства с паровой защитой. Торцевые уплотнения позволяют практически полностью предотвратить утечку среды или попадание воздуха в полость аппарата в месте выхода из него вала, что очень важно для обеспечения асептических условий процесса (рис. ). Важным фактором с точки зрения асептики процесса культивирования продуцента является правильная обвязка ферментера. Под обвязкой подразумевают подвод всех коммуникаций с учетом возможности стерилизации острым паром участков, которые могут явиться источником заражения (рис. ). Из рисунка видно, что буквально все входы и выходы в ферментере и в сопутствующих аппаратах находятся под паровой защитой.
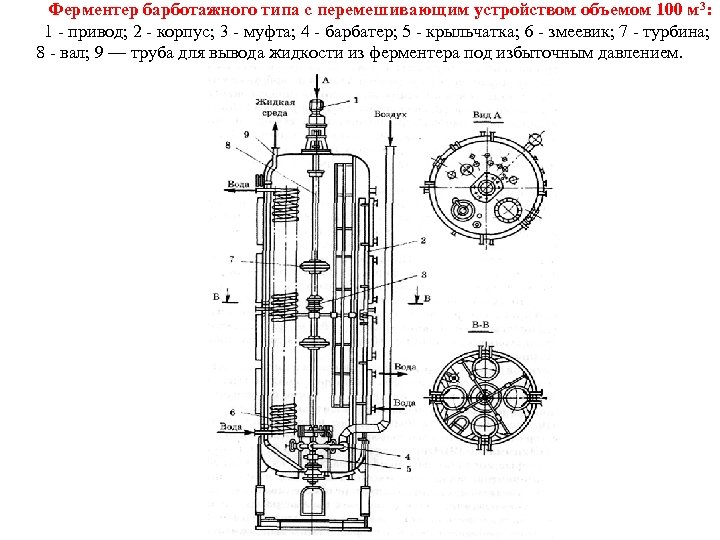
Ферментер барботажного типа с перемешивающим устройством объемом 100 м 3: 1 привод; 2 корпус; 3 муфта; 4 барбатер; 5 крыльчатка; 6 змеевик; 7 турбина; 8 вал; 9 — труба для вывода жидкости из ферментера под избыточным давлением.
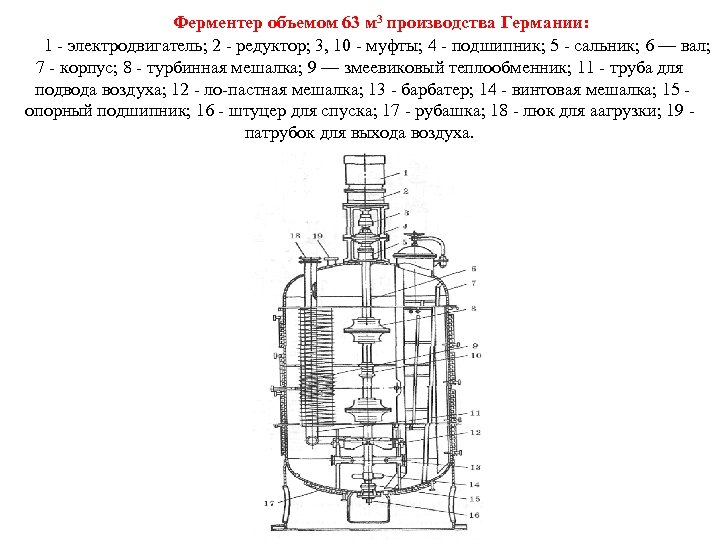
Ферментер объемом 63 м 3 производства Германии: 1 электродвигатель; 2 редуктор; 3, 10 муфты; 4 подшипник; 5 сальник; 6 — вал; 7 корпус; 8 турбинная мешалка; 9 — змеевиковый теплообменник; 11 труба для подвода воздуха; 12 ло пастная мешалка; 13 барбатер; 14 винтовая мешалка; 15 опорный подшипник; 16 штуцер для спуска; 17 рубашка; 18 люк для аагрузки; 19 патрубок для выхода воздуха.
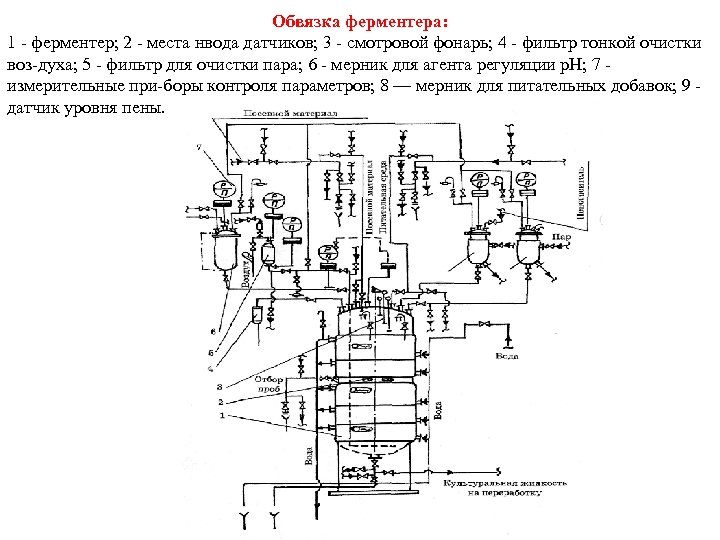
Обвязка ферментера: 1 ферментер; 2 места нвода датчиков; 3 смотровой фонарь; 4 фильтр тонкой очистки воз духа; 5 фильтр для очистки пара; 6 мерник для агента регуляции р. Н; 7 измерительные при боры контроля параметров; 8 — мерник для питательных добавок; 9 датчик уровня пены.

Технологическая схема глубинного культивирования. На рис. приведена технологическая схема культивирования микроорганизмов глубинным методом. Сухие компоненты среды подаются в складское помещение завода по пневмотранспорту. Из циклона 1 с помощью трубоконвейера 2 они поступают в бункера 3, а из них по трубоконвейеру 4 на автоматические весы 5. Если требуется ввести в состав среды соли или какие то иные компоненты в небольшом количестве, то они поступают в шнек 6, транспортирующий сыпучие материалы в норию 7. Из нории компоненты среды поступают в смеситель 8 для приготовления питательной среды. Сюда же поступают вода и жидкие компоненты через дозирующие и мерные устройства. Для растворения солей и клейстеризации крахмала среду подогревают. Подготовленная подогретая среда с помощью насоса 30 поступает в нагреватель 22 системы непрерывной стерилизации питательной среды и затем подается и теплообменник 23 для выдерживания при температуре 140°С. Стерильная питательная среда охлаждается в теплообменнике 24 и направляется в чистый стерильный ферментер 25, который заполняют на 65 75% в зависимости от степени пенообразования при росте культуры. Посевной материал получают в посевном отделении. Среду для него готовят в специальной небольшой емкости 9, нагревают, перемешивают и насосом 10 направляют в инокуляторы первой 16 и второй 19 ступеней, где проводятся стерилизация, охлаждение и засев среды.

Суспензия исходной культуры пересевается вначале в колбы на качалке, затем подается в инокулятор первой ступени 16, выращивается в нем и полностью передавливается в инокулятор второй ступени 19 со стерильной охлажденной средой. Выращенный посевной материал из инокулятора 19 передается в ферментер 25. В процессе культивирования проводится пеногашение. Пеногаситель стерилизуют в специальном аппарате периодического действия 12, затем он охлаждается и поступает через мерник 14 в ферментер. В процессе культивирования в инокуляторах и ферментере культура аэрируется стерильным воздухом. Сжатый в компрессоре воздух после удаления влаги поступает в головной фильтр 11, заполненный стекловатой. Далее очищенный воздух поступает в индивидуальные фильтры тонкой очистки 13, 15, 17, 20, 26 и подается для охлаждения пеногасителя и аэрирования растущей культуры в инокуляторах 16, 19 и ферментере 25. Отходящий воздух из инокуляторов и ферментера перед выбросом в атмосферу очищается в фильтрах 18, 21 и 27. Готовая культуральная жидкость насосом 30 или самотеком при перемешивании поступает в теплообменник 28 для охлаждения перед поступлением в сборник 29. Необходимость охлаждения вызвана тем, что сразу всю культуральную жидкость обработать невозможно, а при длительном хранении в сборнике может произойти инактивация ферментов. Из сборника 29 охлажденная жидкость по мере необходимости подается на фильтрацию или на другую обработку.
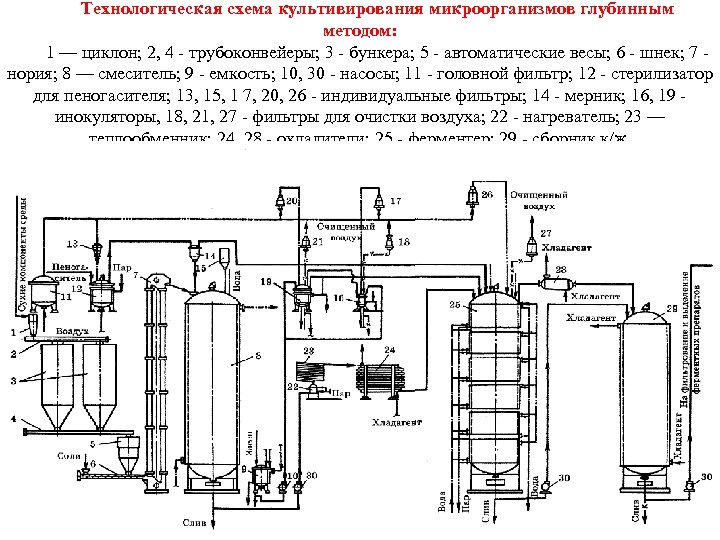
Технологическая схема культивирования микроорганизмов глубинным методом: 1 — циклон; 2, 4 трубоконвейеры; 3 бункера; 5 автоматические весы; 6 шнек; 7 нория; 8 — смеситель; 9 емкость; 10, 30 насосы; 11 головной фильтр; 12 стерилизатор для пеногасителя; 13, 15, 1 7, 20, 26 индивидуальные фильтры; 14 мерник; 16, 19 инокуляторы, 18, 21, 27 фильтры для очистки воздуха; 22 нагреватель; 23 — теплообменник; 24, 28 охладители; 25 ферментер; 29 сборник к/ж.

Послеферментационные стадии выделения антибиотиков. Отделение биомассы от культуральной жидкости. Для отделения взвешенных биологических частиц от кулътуральной жидкости используются различные физико химические свойства: плотность частиц; размер частиц; поверхностные свойства частиц. При разделении суспензий по плотности частиц используют следующие методы: 1) седиментация (отстаивание) — для крупных частиц размером от 2, 3 мкм до 1 мм, по плотности отличающихся от окружающего раствора; 2) гидроциклонирование — от 5 до 700 мкм; 3) центрифугирование — от 400 до 900 нм; 4) ультрацентрифугирование — от 10 нм до 1 мкм. По размеру частиц методы разделения могут быть следующими: 1) фильтрация через тканевые фильтры — для частиц размером от 10 мкм до 1 мм; 2) микрофильтрация — для частиц размером от 200 нм до 10 мкм; 3) ультрафильтрация, позволяющая отделять частицы размером от 10 нм до 5 мкм. Для сведения: размеры микроорганизмов следующие: вирусы — чуть больше 10 нм, бактерии — 0, 3— 1, 0 мкм, дрожжи — 3— 5 мкм, мицелий грибов и эритроциты — до 10 мкм. Мицелиальные грибы имеют размеры микроколоний до 1 мм, что упрощает их отделение от жидкости. Макромолекулы имеют размеры частиц в диапазоне 10— 120 нм, микрочастицы — от 120 нм до 10 мкм, тонкие взвеси — от 10 до 100 мкм и грубые взвеси — от 100 мкм до 1 мм. Поверхностные свойства частиц используются в процессе флотации. За основу в этом методе принимается не размер, а способность клеток удерживаться пузырьками воздуха. Ориентировочный диапазон размеров флотируемых частиц варьирует от 1 до 200

Отстаивание и осаждение. Этот метод наиболее часто используют в процессах очистки стоков — отстаивание активного ила. Используется он также для отделения животных и растительных клеток, мицелиальных грибов и пивных дрожжей. Для успешного проведения процесса отстаивания не обязательно чтобы сами микроорганизмы быть крупными: они могут концентрироваться на хлопьях, агломератах. Часто процесс отстаивания комбинируется с предварительной коагуляцией или флокуляцией. В обоих случаях к суспензии добавляется реагент (соли алюминия или железа при коагуляции и полиэлектролиты при флокуляции). Прикрепленные к длинным молекулам коагулянтов или флокулянтов несколько клеток создают основу агломерата, который в результате имеет больший вес и меньшую подвижность, что приводит к седиментации осадка. Недостатками метода являются: большая продолжительность процесса (порядка нескольких часов) и не очень хорошее разделение (в осадке концентрация биомассы не превышает 1— 3 %). Скорость отстаивания зависит от размеров и плотности хлопьев, а также от их поверхностных свойств. Еще чаще клетки с какого то момента перестают осаждаться. Это связано с тем, что мелкие клетки имеют поверхностные свойства, удерживающие их от осаждения. Многие мелкие клетки не осаждаются вовсе.

Центрифугирование и сепарация. Для преодоления трудностей осаждения помещают суспензию в поле центробежных сил. Центрифуги и сепараторы, которые это поле создают, часто называют осадительными. На частицу в центробежном поле действует центробежная сила где r — радиус частиц; ρч и ρж — плотность частицы и жидкости соответственно; ω — угловая скорость; R — радиус вращения частицы вокруг оси центрифуги. Сила сопротивления среды Fc определяется согласно закону Стокса: где η — динамическая вязкость жидкости; v — скорость движения частицы относительно жидкости. Приравнивая эти силы, получаем:

Итак, чем больше скорость вращения центрифуги и ее радиус и чем больше разность плотностей жидкости и частицы, тем быстрее происходит осаждение. Вязкость жидкости снижает скорость осаждения. Разные типы центрифуг оценивают по так называемому фактору разделения ФР, показывающему, во сколько раз ускорение центробежного поля больше ускорения свободного падения У обычных центрифуг этот фактор составляет до 3500, а у суперцентрифуг выше — 5000 — 7000. Ультрацентрифуги могут иметь ФР до 20 000. Скорость вращения барабана варьируется от 3000 до 30 000 об/мин. Существенным показателем работы центрифуги является индекс производительности Σ: Σ = Fос. Фр где Fос — площадь цилиндрической поверхности осаждения. Скорость свободного осаждения v 0 связана со скоростью осаждения в центробежном поле соотношением v 0 = v/Фр или v 0 = 2/9(ρч – ρж)r 2 g/η

Общая производительность центрифуги определяется соотношением Qx = v 0 Σ В этом уравнении член Σ характеризует свойства центрифуги (суммарную поверхность осаждения, умноженную на суммарный фактор разделения). Его следует определять экспериментально для заданной скорости вращения центрифуги. Величина v 0 характеризует приведенную скорость свободного осаждения и зависит только от свойств жидкости. Ее лучше определять экспериментально на центрифуге с известной величиной Σ. Рассмотрим теперь конструкцию наиболее распространенного в биотехнологии тарельчатого сепаратора (рис. ). Этот сепаратор изобрел шведский ученый Густав де Лаваль в 1896 г. Сепараторы выпускает известная в биотехнологической промышленности фирма, которая так и называется — «Альфа Лаваль» . Сепаратор имеет полый вал, неподвижный корпус с размещенным в нем пакетом вращающихся с валом конических тарелок, находящихся одна над другой так, что образуется коническое пространство. Жидкость входит по полому валу под нижней тарелкой и доходит до внешнего цилиндрического края корпуса. Далее она движется между коническими тарелками к центробежному коллектору, из которого осуществляется выход жидкости.

В процессе этого движения частицы биомассы отбрасываются по направлению от центра вращения и сползают по коническим поверхностям тарелок к боковой стенке корпуса, создавая в конечном счете возле нее слой сгущенной биомассы. В корпусе расположены сопла, из которых под большим давлением происходит выгрузка сгущенной биомассы. Существуют различные модификации подобных сепараторов, в том числе с ручной, а также механизированной циклической и непрерывной выгрузкой осадка. Преимущества центробежных сепараторов: высокая производительность; хорошая степень концентрирования (до 10— 15); достигается концентрация биомассы 5— 15 % по сухой массе; возможность повышения скорости сепарирования предварительной обработкой жидкости флокулянтами. Недостатки: сложность оборудования; энергоемкость процесса (хотя по сравнению с выпаркой затра ты энергии все же меньше). Фильтрация — это задержание взвешенных частиц сетчатой (тканевой) или пористой перегородкой. Движущей силой является разность давлений, вызывающая протекание жидкости (рис. ). При обычной фильтрации задерживаются частицы, величина которых больше размеров пор. Такая фильтрация называется «ситовой» , и используется она при малом количестве взвешенных частиц, для осветления жидкости. Через какое то время вся поверхность «сита» закрывается микроорганизмами, и фильтрация прекращается. Обычно же при фильтрации микроорганизмов используют фильтры, размер пор которых больше размера микроорганизмов. В этом случае фильтрация происходит через слой осадка (рис. ).

Рис. Схема фильтрации культуральной жидкости через ситовую перегородку: 1 — клетки и агломераты микроорганизмов; 2— ситовая фильтрующая перегородка; I— культуральная жидкость; II — фильтрат. Рис. Схема фильтрации культуральной жидкости через слой осадка: 1 — слой осадка; 2 — фильтрующая перегородка; I — культуральная жидкость; II — фильтрат. Уравнение Пуазейля определяет основные закономерности фильтрации: где F — поверхность фильтрации; V — объем суспензии, подаваемой на фильтрацию; ΔР — перепад давления на фильтровальной перегородке; η — динамическая вязкость жидкости; rос — коэффициент сопротивления осадка; mос — концентрация осадка во входящей на фильтр суспензии; rфп — коэффициент сопротивления фильтровальной перегородки.

В ходе фильтрования возрастает объем жидкости, прошедшей через фильтр, знаменатель выражения возрастает, а скорость фильтрации падает. Из уравнения видно, что скорость фильтрации можно увеличить путем повышения перепада давления. Однако для биологических суспензий это не так. Дело в том, что рыхлая структура слоя осадка даже при незначительном превышении оптимального перепада давления нарушается и образуется плотная «лепешка» , плохо пропускающая жидкость. Такие системы называются системами со сжимаемым осадком. Для улучшения скорости фильтрации в биотехнологии часто используют фильтровальные порошки для организации фильтрования через намывной слой порошки (рис. ). Частицы порошка (кизельгур, перлит, диатомит) имеют размеры больше клеток микроорганизмов, но после «намывки» создают объемный слой с системой пор. Суспензия, проходя через этот слой, оставляет биомассу микроорганизмов на частицах порошка. Коэффициент сопротивления осадка при этом снижается и десятки раз, что позволяет фильтровать труднофильтруемые жидкости.

Экстракционные методы выделения продуктов метаболизма. Экстракционные методы выделения продуктов, используемые в биотехнологии, подразделяются на две основные группы: методы экстрагирования, когда целевой продукт извлекается жидкостью (экстрагентом) из твердой фазы (рафината) — чаще всего биомассы микроорганизмов, и методы жидкостной двухфазной экстракции, в которой продукт, растворенный в жидкой фазе (рафинате), извлекается другой жидкостью (экстрагентом) — обычно это органический растворитель. В обоих случаях фаза, из которой выделяется продукт, называется рафинат, жидкая фаза, служащая агентом процесса экстракции, называется экстрагент, эта же фаза после перехода в нее растворенного вещества называется экстракт. Твердую фазу (рафинат) после извлечения из нее растворенного вещества называют шрот. Традиционные методы экстрагирования продуктов из биомассы. Экстрагирование из биомассы клеток. Некоторые из продуктов метаболизма можно выделить из биомассы без разрушения клеточных стенок (липиды, некоторые ферменты). В большинстве же случаев сначала разрушают клетки затем экстрагируют дезинтеграт. Экстрагирование применяется для извлечения ферментов из культур грибов, выращенных твердофазной ферментацией, микробного жира или липидов из биомассы дрожжей, антибиотиков и полипептидов, локализованных на клетках микроорганизмов, при выделении внутриклеточных биополимеров типа белков, нуклеиновых кислот, полисахаридов и т. д.

За экстрагированием следует стадия отделения твердой фазы, в результате чего извлекаемое вещество переводится в жидкую фазу — экстракт, из которого в дальнейшем и выделяют продукт. В качестве экстрагентов используются: вода, водные растворы кислот или щелочей, органические растворители — спирты, ацетон, нефрас (смесь легких углеводородов). Существует несколько способов осуществления экстрагирования; с перемешиванием, в неподвижном слое, одно- и многоступенчатое, прямоточное и противоточное. Экстрагирование с перемешиванием является наиболее простым способом экстрагирования. В аппарат с мешалкой загружается твердая фаза (биомасса после сгущения или отделения на фильтре) и жидкая фаза (экстрагент). Процесс далее протекает при перемешивании. Концентрация извлекаемого вещества в экстрагенте изменяется во времени в соответствии с уравнением. где Vж — объем жидкой фазы в аппарате; Сж — концентрация растворенного вещества в экстракте в момент времени t; Ку — коэффициент массоотдачи жидкость—твердое тело в пересчете на объем жидкой фазы. Величина С pж в формуле обозначает концентрацию растворенного вещества в жидкости, равновесную с его содержанием в твердой фазе Ст.
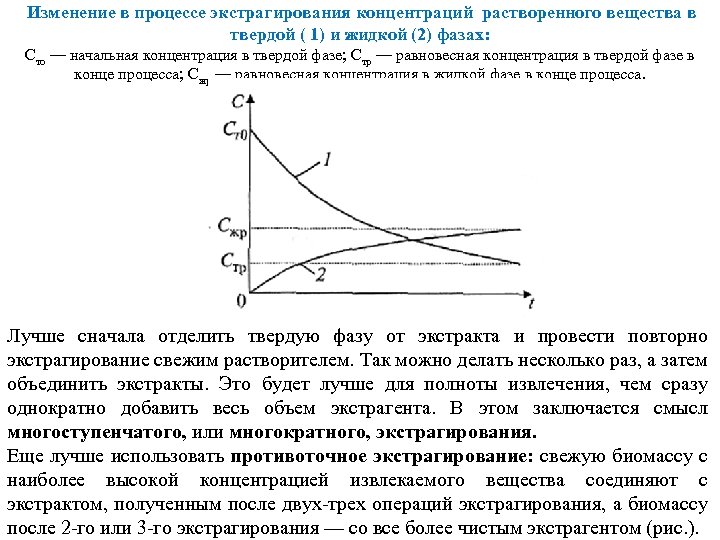
Изменение в процессе экстрагирования концентраций растворенного вещества в твердой ( 1) и жидкой (2) фазах: Сто — начальная концентрация в твердой фазе; Стр — равновесная концентрация в твердой фазе в конце процесса; Сжр — равновесная концентрация в жидкой фазе в конце процесса. Лучше сначала отделить твердую фазу от экстракта и провести повторно экстрагирование свежим растворителем. Так можно делать несколько раз, а затем объединить экстракты. Это будет лучше для полноты извлечения, чем сразу однократно добавить весь объем экстрагента. В этом заключается смысл многоступенчатого, или многократного, экстрагирования. Еще лучше использовать противоточное экстрагирование: свежую биомассу с наиболее высокой концентрацией извлекаемого вещества соединяют с экстрактом, полученным после двух трех операций экстрагирования, а биомассу после 2 го или 3 го экстрагирования — со все более чистым экстрагентом (рис. ).

Схема противоточного 3 ступенчатого экстрагирования: I— свежая биомасса; II — отработанная биомасса (шрот); III — промежуточно экстрагированная биомасса; IV — чистый экстрагент; V — насыщенный экстрагент; VI — экстрагент промежуточного насыщения. Экстрагирование в неподвижном слое используется в том случае, когда биомасса уже предварительно высушена. Она загружается в колонны или патроны (диффузоры), через которые проходит жидкий экстрагент. Обычно используют батарею из 20 или более последовательно соединенных диффузоров (рис). По мере исчерпания веществ в диффузорах производят переключение патронов и их перезагрузку. Свежий патрон (по биомассе) является последним по ходу потока экстрагента. Происходит как бы ступенчатое движение биомассы (без ее отделения от жидкости, как в экстрагировании с перемешиванием).

Схема экстрагирования в каскаде диффузоров: 1 — диффузор; 2 — добавляемые диффузоры со свежей биомассой; I — свежий экстрагент; II — насыщенный экстрагент Организация межфазной поверхности. Массоотдача от порошка биомассы к жидкости в аппарате — не лучший способ экстрагирования. Образуются агломераты биомассы, в результате не все клетки оказываются доступными для экстрагента. Для улучшения структуры межфазной поверхности из биомассы формируют специальной формы гранулы, называемые «лепесток» . Так поступают при экстракции липидов (жиров) из микробной биомассы. Для этого сначала гранулируют биомассу. Затем эти гранулы пропускают через вальцы, получая сплющенные лепешки толщиной 0, 2— 0, 3 мм — «лепестки» . Далее уже эти «лепестки» загружают в аппарат для экстрагирования, и при этом обеспечивается более эффективная массоотдача.

Сорбционные методы выделения продуктов биосинтеза. Сорбционные методы - выделение растворенного в жидкой фазе компонента с помощью твердофазного сорбента. Этот процесс по смыслу противоположен экстрагированию. При сорбции растворенное вещество из раствора переводится в твердую фазу (сорбент). На этом, однако, сорбционный метод не заканчивается. Далее следует отделение твердой фазы от рафината — раствора, из которого извлечен растворенный компонент, и последующая десорбция этого компонента из сорбента в новую жидкость, отличающуюся от исходного раствора какими то свойствами или просто более чистую, не содержащую посторонних примесей, которые есть в исходном растворе. Эта вторая операция (десорбция) уже точно практически ничем не отличается от экстрагирования, разве что при экстрагировании твердой фазой является сама биомасса, а при десорбции — промежуточный рабочий агент, специально вносимый в жидкую фазу извне. Твердая фаза — «временное пристанище» растворенного вещества. Рассмотрим 4 различных модификации сорбционных методов: ионный обмен; адсорбция микропористыми сорбентами; хроматография; биосорбция. Во всех случаях мы будем подразумевать, что сорбционный метод включает в себя как собственно сорбцию, так и десорбцию, и рассматривать метод выделения как совокупность этих двух процессов.

Ионный обмен. Ионообменный метод основан на способности специальных сорбентов — ионообменных смол сорбировать биологически активные вещества, имеющие ионную природу (т. е, являющиеся кислотой, основанием или солью), благодаря эквивалентному обмену между ионами вещества, находящегося в растворе, и ионами сорбента. Ионообменные смолы, или иониты, представляют собой синтетические высокомолекулярные органические вещества, практически нерастворимые в воде. Они содержат обменные ионы, один из которых связан с твердым носителем и называется фиксированным, или анкерным ионом. С ним электростатически связан противоположно заряженный ион, называемый подвижным ионом, или противоионом. По этому подвижному ионообменные смолы подразделяются на катионообменники и анионообменники: Тв. — Н+ (катионообменник); Тв. — ОН― или Тв. — С 1― (анионообменник). Кроме того, существуют и амфотерные иониты, которые содержат и катионо , и анионообменные группы, обладая, таким обрзом, двойственными свойствами. При введении ионита в жидкость он немного набухает, так как в его поры проникает вода. Но структура ионита построена не из линейных, а из пространственных трехмерных полимеров, что ограничивает способность к набуханию.

Процесс ионного обмена имеет обратимый характер. Высвобождающийся противоион диффундирует далее через поры ионита в жидкость. Движение ионов растворенного вещества внутрь гранулы ионита и, наоборот, вывод противоионов в окружающую жидкость происходят за счет диффузии. Как и в любом массообменном процессе, в какой то момент наступает равновесие между скоростями сорбции и десорбции (раз это обратимый процесс). Для жидкофазной экстракции связь между концентрациями растворенного вещества в условиях равновесия в разных фазах определяется коэффициентом распределения. Для твердой фазы в условиях сорбции существует определенная особенность. Количество активных центров ионообменника ограничено (числом анкерных ионов), в связи с этим максимальное количество ионов растворенного вещества, связанных ионитом (т. е. сорбированных), не может быть больше определенного предела. Поэтому связь между равновесными концентрациями растворенного вещества в жидкости и в ионообменной смоле определяется соотношением, называемым изотермой Ленгмюра. Движущей силой процесса массопередачи является разность между равновесной концентрацией С* (определяемой по изотерме Ленгмюра или по коэффициенту распределения, если концентрация находится в зоне малых значений) и текущей концентрацией Ст:

где Kv — объемный коэффициент массоотдачи между жидкостью и ионитом, учитывающий, в частности, и концентрацию гранул ионита в системе, и поверхность массообмена в каждой грануле, и истинный коэффициент массоотдачи растворенного вещества; С*m — концентрация, равновесная с той, которая есть в жидкости, Сж. В зависимости от знака выражения в скобках ( С*m Сm ) будет происходить либо процесс сорбции, либо процесс десорбции. Кстати, в процессах ионооомена процесс десоробции имеет специфическое название элюция, а десорбирующая жидкость называется элюентом. Наиболее прост статический способ. В аппарат с мешалкой загружают ионит и обрабатываемый раствор. Затем при перемешивании ионит суспендируется и дается время для установления равновесия. Далее раствор сливают или фильтруют (если гранулы ионита слишком мелкие). Раствор обычно направляют в канализацию (так как он обеднен по целевому продукту) или повторно используют на стадии ферментации. Ионит же возвращают в аппарат, заливают элюентом, т. е. водным раствором, часто с измененным значением р. Н или с добавлением противоиоиа (иона хлора). Происходит обратный процесс (десорбция, элюция) — противоион сорбируется в ионите, а сорбированное ранее вещество переходит в элюент. При этом продукт освобождается от примесей, которые не сорбируются и уходят с исходным раствором.

Однократная сорбция—десорбция имеет недостаток: сорбент не полностью поглощает растворенное вещество, а затем вещество не полностью переходит в элюент. Поэтому процесс иногда повторяют. Чаще же используют динамический способ. Ионит загружается в аппарат и обрабатываемый раствор непрерывно протекает через слой ионита. Назвать этот процесс полностью непрерывным нельзя, так как ионит загружается и выгружается периодически, поэтому процесс нестационарный. Аппарат с загруженным ионитом называется ионитовым фильтром, или ионообменной колонной. После насыщения слоя ионита раствор переключается на другую колонну, затем на третью, четвертую и т. д. Обычно существует батарея ионообменных колонн, работающих в различных режимах. На отключенной колонне сначала проводят вытеснение рабочего раствора обессоленной водой, затем промывают ионит раствором антисептика. Далее осуществляется процесс извлечения полезного вещества из сорбента — элюция. Элюат (чистый раствор, содержащий десорбированное вещество) поступает на дальнейшие стадии концентрирования. После элюции проводится процесс регенерации ионита. Для этого через слой ионита пропускают раствор противоиона, который сорбируется на ионите, занимая там свое «законное место» .

Поскольку в рассмотренной схеме слой ионита остается неподвижным, приходится иметь батареи аппаратов, постепенно переключая их на тот или иной режим работы. Главное в этом методе — отделение продукта от примесей, «грязи» . Способность ионообменных смол сорбировать именно целевой продукт называется селективностью. При помощи ионитов с очень высокой селективностью делались попытки выделения растворенного компонента (например, антибиотиков) прямо из культуральной жидкости, содержащей биомассу микроорганизмов. Хотя при этом исключается стадия фильтрации, это не всегда хорошо остатки сред и микрооргаизмы забивают поры ионита, способствуют обрастанию его гранул. Ионообменным способом выделяют многие антибиотики, аминокислоты, ферменты. Несколько слов о самих ионообменных смолах. Есть много типов ионитов, имеющих размеры гранул от 300 мкм до 2 мм и более. При этом очень важен их равномерный дисперсный состав (чтобы не было уноса). Иногда делают смолы с непористым внутренним ядром, внешний слой смолы занимает лишь 30— 50 мкм, что способствует более быстрой сорбции — десорбции. В качестве матриц в смолах используют: полистирол (поливинилбензол); полиакрилат, полиметакрилат; полиамин; целлюлозу, декстран и др. В качестве функциональных групп применяются: карбоксильные; сульфоновые.

Преимущества метода: простота аппаратурного оформления; многократное использование ионообменных смол; возможность полной механизации и автоматизации процесса; протекание процесса в водных растворах, без использования вредных органических растворителей. Недостатки метода: нельзя использовать для извлечения неполярных веществ; селективность метода не всегда достаточна для разделения смеси веществ; наличие твердой фазы затрудняет возможность использования противотока для создания равномерной движущей силы процесса; довольно велико гидравлическое сопротивление колонн при малых размерах гранул ионита. Жидкие ионообменники. Использование твердофазных ионитов связано с одним противоречием. С одной стороны, для быстрой сорбции следует снижать размер гранул. С другой стороны, это технологически неудобно: создается большое гидравлическое сопротивление, увеличивается возможность уноса ионитов, затрудняется отделение гранул от раствора. Часть этих недостатков исключается при использовании жидких ионообменников, представляющих собой амины или органические кислоты или алкилфосфаты с молекулярной массой 250— 500. В этих случаях ионный обмен протекает быстро, а для его аппаратурного оформления используются аппараты для экстракции жидкость—жидкость. Собственно говоря, и сам процесс очень напоминает экстракцию, хотя в обмене участвуют ионы, а не молекулы.

Адсорбция микропористыми сорбентами. Процесс адсорбции по существу ничем не отличается от ионного обмена, с той лишь разницей, что на микропористых сорбентах обычно сорбируются не ионы, а целиком молекулы, чаще неполярных веществ. Соответственно в качестве сорбентов выступают не ионообменные смолы, а материалы без функциональных групп или микропористые адсорбционные смолы. Связывание субстанций на этих сорбентах происходит не по стехиометрическим соотношениям, как в ионитах, например, а под воздействием сил Ван дер Ваальса. Важнейшими характеристиками этих сорбентов являются: объем пор; удельная поверхность; средний диаметр пор; распределение пор по размерам. Наиболее типичным и первым из такого рода сорбентов является активный уголь. Сейчас выпускаются полимерные сорбенты, которые по качеству превосходят активный уголь. Химический состав этих сорбентов: неполярные — стирол; полуполярные — акриловые эфиры; полярные — сульфоксиды, амиды. Физические свойства: внутренняя поверхность 20— 800 м 2/г (для сравнения: у активного угля — около 60 м 2/г); объем пор 0, 5— 1, 2 мл/г; средний диаметр пор 5— 130 нм (у активного угля — около 13 нм). Практически любое вещество, которое можно экстрагировать органическим растворителем, можно связать специально подобранным сорбентом.

Хроматография. Сорбция в двух изложенных ранее модификациях — ионный обмен и адсорбция микропористыми сорбентами — предполагает высокую селективность сорбентов или отсутствие в обрабатываемом растворе веществ, имеющих близкие характеристики по селективности. Между тем в биологических растворах часто оказывается смесь близких по природе веществ, имеющих в то же время различную биологическую активность. Сорбенты при этом адсорбируют всю эту смесь, да и при десорбции в конечном счете все эти вещества выделяются вместе, хотя и очищенными от других загрязняющих веществ. Возникает задача разделения этих близких по природе веществ. Эту задачу выполняет процесс хроматографии. Хроматография известна больше в измерительной технике, где с ее помощью решают задачу количественного определения вещества, находящегося в сложной смеси близких по составу веществ (например, углеводороды нефти или углеводы в сложных природных смесях сахаров). Между тем в технологии на тех же принципах основан процесс, который более точно называют препаративная хроматография. По существу, это специфический способ десорбции сорбированной любым способом смеси веществ, чаще всего на микропористых сорбентах. При хроматографии поток элюента, выходящий из слоя сорбента, не собирается весь в одну емкость, а фракционируется по времени пропускания элюента через колонку.
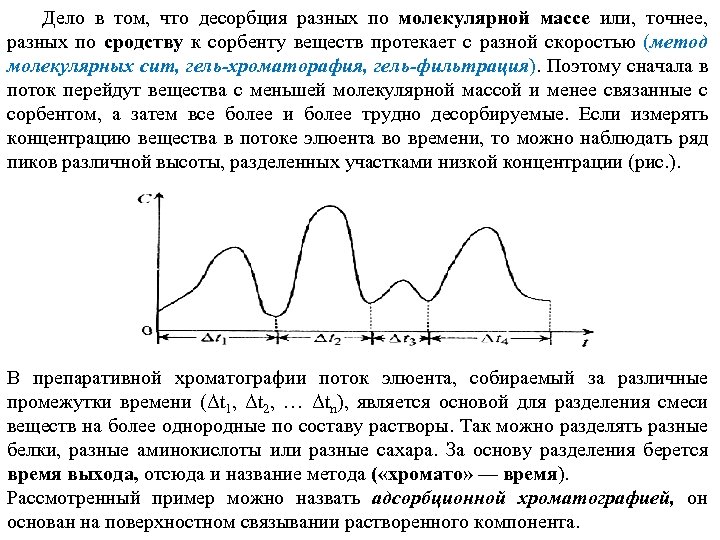
Дело в том, что десорбция разных по молекулярной массе или, точнее, разных по сродству к сорбенту веществ протекает с разной скоростью (метод молекулярных сит, гель-хроматорафия, гель-фильтрация). Поэтому сначала в поток перейдут вещества с меньшей молекулярной массой и менее связанные с сорбентом, а затем все более и более трудно десорбируемые. Если измерять концентрацию вещества в потоке элюента во времени, то можно наблюдать ряд пиков различной высоты, разделенных участками низкой концентрации (рис. ). В препаративной хроматографии поток элюента, собираемый за различные промежутки времени (Δt 1, Δt 2, … Δtn), является основой для разделения смеси веществ на более однородные по составу растворы. Так можно разделять разные белки, разные аминокислоты или разные сахара. За основу разделения берется время выхода, отсюда и название метода ( «хромато» — время). Рассмотренный пример можно назвать адсорбционной хроматографией, он основан на поверхностном связывании растворенного компонента.
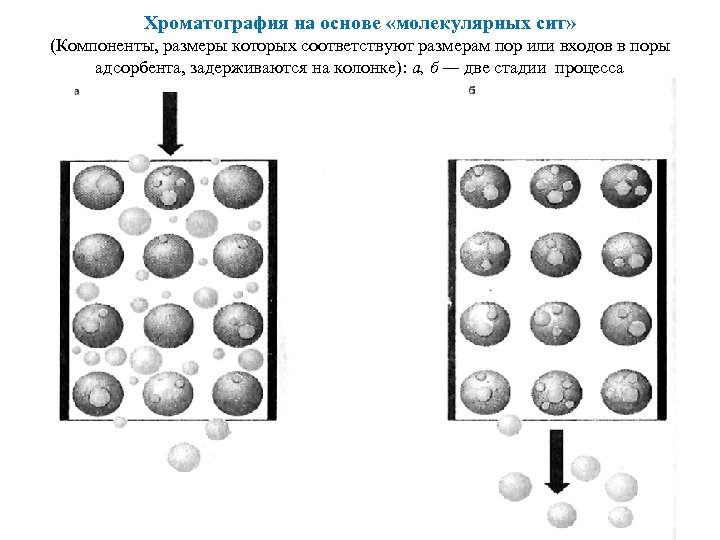
Хроматография на основе «молекулярных сит» (Компоненты, размеры которых соответствуют размерам пор или входов в поры адсорбента, задерживаются на колонке): а, б — две стадии процесса
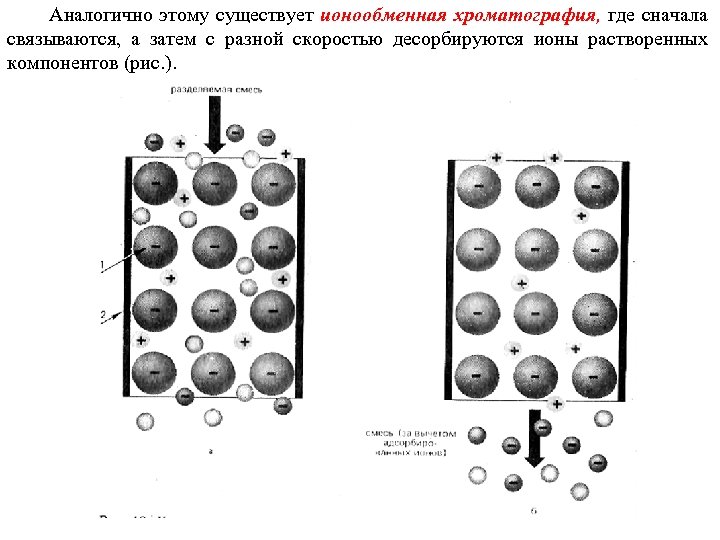
Аналогично этому существует ионообменная хроматография, где сначала связываются, а затем с разной скоростью десорбируются ионы растворенных компонентов (рис. ).

Интересной разновидностью хроматографии в биотехнологии является так называемая «аффинная хроматография» . В ней для сорбции и десорбции используют биоспецифичное вещество, которое подходит к выделяемой молекуле, как ключ к замку. Это могут быть ферменты или иммуносорбенты. Сначала практически полностью происходит связывание специфичного вещества, а потом путем изменения элюента оно выделяется с довольно четким фронтом. Рис. Аффинная хроматография (В виде частиц различной формы изображены молекулы с различными химическими структурами, из которых только одна вступает в специфическое взаимодействие с частицами геля. Показано, что в выемки на частицах геля входят лишь молекулы комплементарной формы): а, б — две стадии процесса

Так можно разделять и ферменты, если в качестве сорбента использовать закрепленный на носителе «лиганд» — вещество, подобное субстрату, на который фермент действует. Разное сродство ферментов к субстрату может являться основой для их разделения по скорости образования и распада фермент субстратного комплекса; Е 1 + S ↔ E 1 S; Е 2 + S ↔E 2 S; Е 3 + S ↔ E 3 S. Важную роль в отделении и очистке белковых и небелковых веществ играют взаимодействия антигенов и антител. Основанная на этих взаимодействиях хроматография получила название иммунноаффинной. Новые горизонты открыло перед иммунноаффинной хроматографией использование моноклональных антител, позволяющих провести за один этап 500 кратную, очистку человеческого интерферона. В аффинной хроматографии используют также групповые лиганды, связывающие, например, целую группу сходных по структуре ферментов. К таким лигандам относятся кофакторы ферментов и их аналоги. В этом случае разделение и очистка индивидуальных веществ основана на их различном сродстве к лиганду, что позволяет собрать их порознь в виде отдельных фракций. Могут применяться и еще менее специфичные лиганды, связывающие целые классы веществ, например алкильные и арильные группы или лиганды, представляющие собой текстильные красители.

Аффинная хроматография может обеспечить полную очистку продукта из сложной многокомпонентной смеси — культуральной жидкости, экстракта клеток — в одну стадию, в то время как более традиционные методы осаждения и ионообменной хроматографии требуют многоэтапной очистки, сопряженной с большими затратами труда и времени. Определенные неудобства вызывает дороговизна материалов для аффинной хроматографии, в частности, веществ, используемых в качестве лигандов. Проблемой является также быстрый выход колонки из строя при пропускании через нее смесей, компоненты которых забивают промежутки между гелевыми частицами. Преимущества хроматографии: высокая селективность; возможность разделения веществ с близкими свойствами; мягкие условия проведения процесса. Недостатки: более низкая скорость десорбции, необходимая для улавливания разных «пиков» выделения веществ; обычно более разбавленные растворы; более сложное аппаратурное оформление процесса. Биосорбция. Биосорбцией обычно называют такие процессы, в которых в качестве сорбента используются сами микроорганизмы, клетки или их компоненты. Наиболее известно применение биосорбентов для извлечения металлов из растворов.

Микроорганизмы обладают биохимическими механизмами сорбции металлов, позволяющими достигать концентраций металлов, в тысячи и даже в миллионы раз больших по сравнению с их концентрацией в жидкости, из которой металл извлекается. Некоторые из таких сорбируемых металлов входят в состав ферментов и нужны клеткам. Поэтому сорбция железа, магния, цинка, меди, молибдена — нормальная физиологическая функция клеток. Но эти же пути связывания клетки используют и для совсем чужеродных металлов, таких, как серебро, ртуть, уран, которые клетке для нормального развития не нужны. Но клетка сорбирует эти металлы как бы «по привычке» . Механизмы связывания металлов. Металлы могут связываться как растущими, так и нерастущими и даже мертвыми или разрушенными клетками. Сначала металл связывается поверхностью клетки, а затем медленно проникает внутрь. Бактерии связывают металлы лучше, чем дрожжи. Известно, например, накопление урана или свинца клетками бактерий рода Micrococcus. Кадмий, никель, кобальт, рубидий сорбируются клетками родов Bacillus и Esherichia coli. Клетки бактерий рода Pseudomonas использовали даже для извлечения урана из морской воды, где он содержится в очень низких концентрациях. Описано также выделение золота, серебра, других драгоценных металлов платиновой группы с помощью биосорбции. Общая схема биосорбции металлов. В раствор с металлами добавляется суспензия микроорганизмов. Происходит поверхностное связывание металлов, образование комплекса металл—микроорганизмы. Биомасса с сорбированным металлом отделяется от суспензии одним из методов разделения.

Выделение металла осуществляется: либо десорбцией в мягких условиях, после чего освобожденная от металла биомасса вновь отделяется от раствора и может быть многократно использована в процессах биосорбции; либо деструктурированием биомассы путем добавления к ней крепкой кислоты, щелочи или даже в пирометалургическом процессе. Такое жесткое обращение с биомассой возможно в случаях, когда ее получение дешево или сама она является отходом какого либо производства. В некоторых технологиях в качестве биосорбента используют дезинтегрированные клетки микроорганизмов, часто высушенные.

Мембранные методы в биотехнологии. Мембранные методы используют в биотехнологии для выделения, очистки и концентрирования продуктов. Все они внешне похожи на фильтрацию (поскольку схема процесса включает в себя полупроницаемую перегородку), но предназначены для разделения частиц разного размера и несколько отличаются по движущей силе процесса и аппаратурному оформлению. При микрофильтрации основной задачей является отделение микроорганизмов и взвешенных частиц. В процессах выделения и очистки продукта чаще используют мембранные методы другого типа: диализ, ультрафильтрация и обратный осмос, которые позволяют «фильтровать» уже не только твердую фазу, но и просто растворенные в жидкости молекулы, причем не обязательно очень большие по размеру. Ультрафильтрация проводится обычно при размерах частиц или молекул 10 нм — 10 мкм, обратный осмос и диализ — при размерах 0, 5 нм — 0, 5 мкм.

Микрофильтрация является наиболее близкой к обычной фильтрации системой, связанной с отделением биомассы от культуральной жидкости. Размер пор микрофильтрационных мембран варьируется от 0, 1 до 3 мкм. Это позволяет задерживать бактерии, дрожжи, грибы и высокомолекулярные вещества, такие, как жиры. Наиболее известно использование микрофильтрации как средства деконтаминации питательных сред, дозируемых подпиток, жидких пеногасителей и титрующих агентов для поддержания величины р. Н, подготовки воздуха перед его подачей в ферментер. Это позволяет избежать теплового воздействия на стерилизуемые растворы. В связи с этим важно, чтобы сами микрофильтры могли стерилизоваться паром перед началом операции и регенерироваться после длительной эксплуатации. Такими свойствами в наилучшей степени обладают металлокерамические трубчатые мембранные элементы, которые могут регенерироваться обратным током пара. Мембранная фильтрация позволяет только концентрировать выделяемые частицы в меньшем по сравнению с первоначальным объеме жидкости (т. е. сгущать суспензию), в то время как обычная фильтрация может отделять биомассу от жидкости практически полностью. Мембранная фильтрация имеет «ситовой» характер, т. е. это обычно тонкая мембрана с контролируемым размером пор.

При обычной фильтрации поток фильтруемой среды направлен перпендикулярно поверхности фильтра. При мембранной поток идет параллельно поверхности фильтра ( «тангенциально» ), а та его часть, которая проходит через поры мембраны, движется перпендикулярно поверхности фильтра. Иначе говоря, это так называемая «фильтрация в поперечном потоке» . Такая фильтрация обычно проводится в замкнутой системе, в которой осуществляется непрерывная циркуляция фильтруемой суспензии с непрерывной подпиткой для компенсации убыли объема за счет фильтрата (пермеата). С помощью микрофильтрации отделяют бактерии, дрожжи, жировые шарики молока и крупные мицеллы белков (например, казеина). По мере проведения микрофильтрации концентрация биомассы в фильтруемой жидкости (концентрате) возрастает, а растворенные вещества уходят с пермеатом. Нефильтруемые частицы за счет высокой скорости циркуляции как бы смываются с поверхности мембраны, что позволяет иметь довольно высокую скорость фильтрации, не снижающуюся из за образования слоя осадка, который, как и при обычной фильтрации, может быть сжимаемым. Обычно скорость движения циркулирующего потока составляет 1— 2 м/с для полимерных мембран и 4— 7 м/с для керамических. С целью удаления из фильтруемой суспензии растворенных веществ после концентрирования КЖ проводят промывку концентрата водой. Для этого вместо подпитки исходным раствором подают воду в 2— 3 объема циркулирующей КЖ.

Фильтрат после промывки присоединяют к основному потоку пермеата или обрабатывают отдельно. Целью такой промывки является либо снижение потерь, если целевой продукт — растворенное вещество, либо очистка биомассы от загрязняющих растворенных примесей. Такую операцию называют еще диафильтрацией. В некоторых случаях вместо воды при диафилътрации используют растворы солей, кислот или щелочей, совмещая процесс концентрирования с процессом экстракции продуктов из биомассы. Для ускорения процесса микрофильтрации часто повышают температуру, чтобы снизить вязкость жидкости. Микрофильтрация часто используется для стерилизации сред. В этом случае поры должны быть не более 0, 2 мкм, чтобы исключить проскок микроорганизмов очень маленьких размеров. Такое использование микрофильтрации позволяет предотвратить потери ценных компонентов и образование нежелательных соединений во время тепловой стерилизации. Но при этом важно иметь возможность тепловой стерилизации самих микрофильтрационных элементов. Это трудно осуществить с полимерными мембранами, но при использовании металлокерамических элементов (трубок) вполне возможно.

Диализ. В этом процессе (рис. ) раствор, содержащий высокомолекулярные соединения, отделен полупроницаемой мембраной от камеры, содержащей чистый растворитель (обычно воду или водные растворы солей). Рис Схема диализной установки: 1 — корпус; 2 — полупроницаемая диализная мембрана; I — раствор со взвешенными или растворенными высокомолекулярными соединениями или микроорганизмами; II — свежая вода; III— диализованный раствор; IV— отработанный пермеат. Содержащиеся в растворе низкомолекулярные вещества за счет диффузии через поры мембраны проходят в камеру пермеата, через которую непрерывно протекает вода. Высокомолекулярные вещества остаются в растворе, и таким образом происходит их очистка от низкомолекулярных. Так, например, происходит обессоливание растворов ферментов или вакцин. Мембраны для диализа изготавливают из пергамента, целлофана и других материалов. Часто мембраны выполняют в виде трубок. Новое поколение диализующих мембран представляет собой кассеты из большого количества микротрубок, заделываемых в так называемый модуль с общим входом и общим выходом.

Преимущества: работа в мягких условиях температуры и р. Н; отсутствие органических растворителей; возможность высокой степени очистки высокомолекулярных веществ от примесей низкомолекулярных соединений, солей и металлов. Недостатки: низкая скорость диализа, определяемая молекулярной диффузией, поскольку движущая сила в этих случаях — разность концентраций веществ, ее нечем повысить; возможность обрастания диализных мембран и забивания их пор. Некоторых недостатков диализа удается избежать за счет применения электродиализа. В этом случае, если задачей является обессоливание ферментов или других биополимеров, перпендикулярно мембранам и потоку диализуемого раствора накладывается электрическое поле, в результате чего анионы и катионы из раствора диффундируют через диализные мембраны к аноду и к катоду, а биополимеры остаются в растворе. Схема электродиализа: 1 — корпус; 2 — полупроницаемые пере городки; 3 — катод; 4 — анод; I— обрабатываемый раствор; II— диализованный раствор; III — свежая вода; IV— диализованный пермеат.

В простейшем случае электродиализатор состоит из трех камер: для обрабатываемого раствора, для пермеата в зоне катода и для пермеата в зоне анода. Движущей силой в этом случае, как и в процессе диализа, является разность концентраций ионов. Электрический ток лишь ускоряет процесс диффузии. Ультрафильтрация. В процессе ультрафильтрации используют селективные полупроницаемые мембраны, пропускающие низкомолекулярные и задерживающие высокомолекулярные соединения. Движущей силой процесса ультрафильтрации является перепад давления на мембране, как и при обычной фильтрации. Применительно к ультрафильтрации высокомолекулярные соединения — это те соединения, у которых молекулярная масса растворенного вещества превосходит молекулярную массу растворителя более чем в 500 раз. При ультрафильтрации происходит не разделение фаз, а перераспределение растворенных в жидкости веществ. По существу здесь используется ситовой эффект. Полимерные мембраны, используемые при ультрафильтрации, обычно являются двухслойными. Фильтрующий слой имеет толщину менее 1 нм. Такой слой не может быть механически прочным, и поэтому он дублируется со вторым слоем толщиной от 20 мкм до 2 мм, который к тому же имеет и значительно больший размер пор. Выполнены оба слоя как единое целое, но мембрана является анизотропной. Давление должно быть приложено со стороны тонкого слоя, а не наоборот. (рис. )

Структура двухслойной ани зотропной полупроницаемой мембраны: 1 — полупроницаемый слой; 2 дренажная подложка. Ясно, что для создания прочности мембраны дополнительно должна использоваться и более жесткая (металлическая или пластмассовая) арматура: ведь перепад давления для процессов ультрафильтрации достигает 0, 3— 1 МПа. Обычный материал мембран — полиуретаны, сложные эфиры целлюлозы, полисульфон. В последнее время научились делать и металлокерамические (наиболее прочные) мембраны. Обычно не существует мембран с совершенно одинаковым размером пор. Среди пор попадаются и такие, которые по размеру больше молекул растворенного вещества. Поэтому частично оно все же проходит в пермеат. Важной характеристикой мембраны является так называемый коэффициент удержания R: где Ск и Сп — концентрации растворенного вещества соответственно в концентрате и в пермеате (фильтрате).
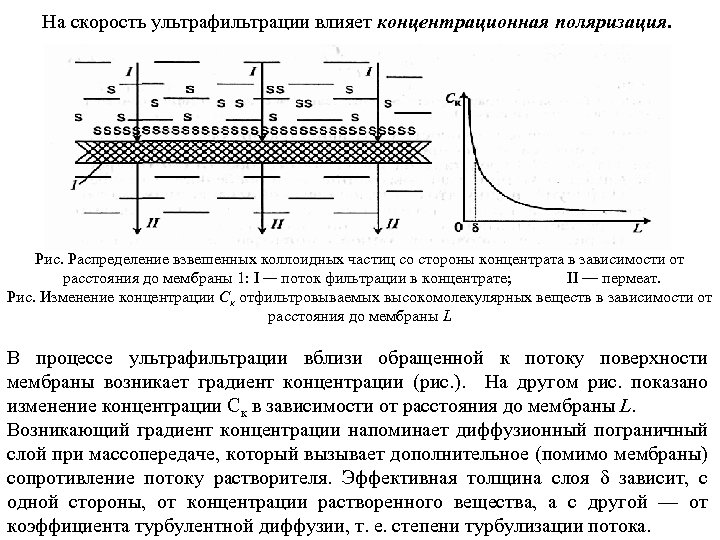
На скорость ультрафильтрации влияет концентрационная поляризация. Рис. Распределение взвешенных коллоидных частиц со стороны концентрата в зависимости от расстояния до мембраны 1: I — поток фильтрации в концентрате; II — пермеат. Рис. Изменение концентрации Ск отфильтровываемых высокомолекулярных веществ в зависимости от расстояния до мембраны L В процессе ультрафильтрации вблизи обращенной к потоку поверхности мембраны возникает градиент концентрации (рис. ). На другом рис. показано изменение концентрации Ск в зависимости от расстояния до мембраны L. Возникающий градиент концентрации напоминает диффузионный пограничный слой при массопередаче, который вызывает дополнительное (помимо мембраны) сопротивление потоку растворителя. Эффективная толщина слоя δ зависит, с одной стороны, от концентрации растворенного вещества, а с другой — от коэффициента турбулентной диффузии, т. е. степени турбулизации потока.

Образуется что то похожее на «динамическую мембрану» . Но в дальнейшем за счет полимеризации белков возможно образование не просто динамической мембраны, но и геля, «лепешки» , которая практически закупоривает реальную мембрану. Борьба с концентрационной поляризацией. Для этого кроме повышения скорости потока над мембраной используют следующие приемы: предварительная обработка раствора (создание подходящей температуры, р. Н, ионной силы); предварительная фильтрация через мембрану определенных растворов полимеров, создающих на поверхности мембраны слой, препятствующий осаждению растворенного вещества на поверхности мембраны; покрытие мембраны ферментом, способствующим разжижению геля; создание на поверхности мембраны отрицательно заряженных ионогенных групп, предотвращающих осаждение белков; очистка мембраны. И другие.
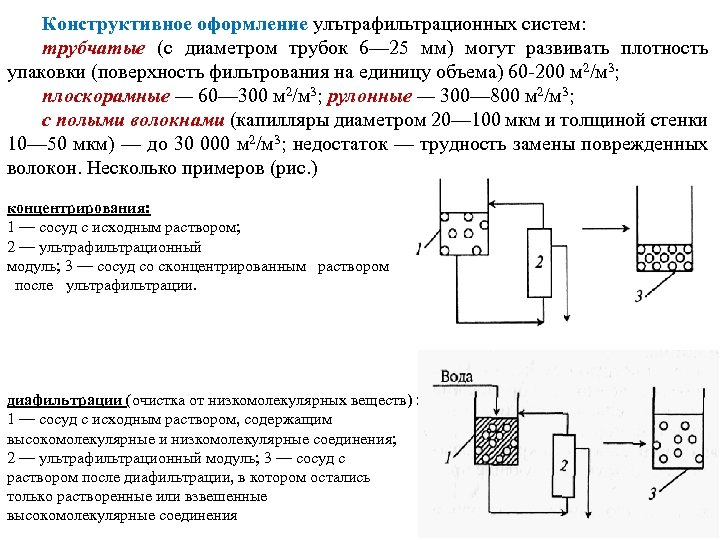
Конструктивное оформление улътрафильтрационных систем: трубчатые (с диаметром трубок 6— 25 мм) могут развивать плотность упаковки (поверхность фильтрования на единицу объема) 60 200 м 2/м 3; плоскорамные — 60— 300 м 2/м 3; рулонные — 300— 800 м 2/м 3; с полыми волокнами (капилляры диаметром 20— 100 мкм и толщиной стенки 10— 50 мкм) — до 30 000 м 2/м 3; недостаток — трудность замены поврежденных волокон. Несколько примеров (рис. ) концентрирования: 1 — сосуд с исходным раствором; 2 — ультрафильтрационный модуль; 3 — сосуд со сконцентрированным раствором после ультрафильтрации. диафильтрации (очистка от низкомолекулярных веществ) : 1 — сосуд с исходным раствором, содержащим высокомолекулярные и низкомолекулярные соединения; 2 — ультрафильтрационный модуль; 3 — сосуд с раствором после диафильтрации, в котором остались только растворенные или взвешенные высокомолекулярные соединения

очистка от высокомолекулярных соединений в которой продуктом является низкомолекулярное соединение (например, антибиотик пенициллин): 1 — исходный раствор, содержащий низкомолекулярные и высокомолекулярные растворенные вещества; 2— ультрафильтрационный модуль; 3 — сборник пермеата с низкомолекулярными веществами. Общая оценка процессов ультрафильтрации. Преимущества: мягкие технологические режимы, нет перехода выделяемого вещества ни в жидкую органическую фазу, ни в твердую; возможность одновременно осуществлять очистку и концентрирование растворов; мембранные установки не имеют движущихся элементов, невелики по габаритам; из за несжимаемости жидкостей энергетические затраты малы. Недостатки: необходимость тщательной подготовки и очистки растворов; наличие концентрационной поляризации; значительные объемы пермеатов, требующих утилизации или очистки; трудности эксплуатации мембранных элементов в течение длительного времени без нарушения их целостности.

Обратный осмос. Процесс обратного осмоса представляет собой фильтрование раствора через мембраны с порами меньшего по сравнению с ультрафильтрацией диаметра (до 0, 5 нм). При этом со стороны раствора должно быть приложено давление более высокое, чем осмотическое давление, обычно до 7— 10 МПа. Обратный осмос используют либо для концентрирования растворов биологически активных веществ, либо для получения чистого растворителя (например, для опреснения воды). Несмотря на влияние перепада давления на скорость процесса, в обратном осмосе разделяются молекулы растворителя и растворенного вещества, близкие по размеру. Здесь срабатывает не эффект пористой мембраны, а растворение в мембране и затем выделение из нее растворенного вещества. Иначе говоря, здесь важна различная растворимость вещества и растворителя в мембране и различная диффузия, создающая концентрационный градиент растворителя. В табл. представлены различия между обратным осмосом и ультрафильтрацией. Для обратного осмоса выпускают различные мембраны, среди них: для обессоливания (молекулярная масса растворенных веществ более 150); для нанофильтрации (лактоза, фармацевтические препараты, красители), молекулярная масса задерживаемых веществ более 220.


Вопросы для практических занятий. 1. Что такое антибиотики? 2. Биотехнология антибиотиков 3. Особенности ферментационного процесса при получении антибиотиков. Трофофаза, идиофаза. 4. Назовите термины, обозначающие основные материальные компоненты, участвующие в процессе экстрагирования, — жидкую и твердую фазу до и после процесса экстрагирования. 5. В чем различие между одноступенчатым и многоступенчатым процессами экстрагирования биомассы микроорганизмов? 6. Каковы способы организации противотока и увеличения средней движущей силы при экстрагировании биомассы микроорганизмов? 7. В чем заключается метод создания эффективной межфазной поверхности при экстрагировании компонентов из биомассы микроорганизмов? 8. Какие вещества можно экстрагировать, используя «суперкритические» жидкости? 9. Назовите границы использования различных методов разделения суспензий по размеру частиц. 10. В чем состоят особенности методов отстаивания для отделения биомассы микроорганизмов? 11. Чем отличается коагуляция от флокуляции? 12. Какую роль играют процессы коагуляции и флокуляции при отделении биомассы микроорганизмов от культуральной жидкости? 13. Какова движущая сила процессов сепарирования и центрифугирования биомассы микроорганизмов?

14. По какому показателю сравнивают между собой сепараторы и центрифуги? 15. Поясните различие между ситовым и объемным принципами фильтрации суспензий. 16 В чем суть фильтрации с намывным слоем фильтровального порошка? 17 Какие материалы используются в биотехнологии в качестве фильтровальных порошков? 18. Осветляющие фильтры — в чем их отличие? 19. На чем основана флотация микроорганизмов? 20. Назовите основные разновидности сорбционных методов выделения продуктов микробиологического синтеза. 21. Что является движущей силой процесса ионного обмена? 22. По каким принципам выбирают размер гранул ионообменной смолы? 23. Назовите термины, используемые для участвующих в процессе ионного обмена веществ на стадиях сорбции и десорбции. 24. Можно ли использовать ионообменное выделение продукта непосредственно из суспензии микроорганизмов? Укажите преимущества и недостатки такого процесса. 25. Чем отличается адсорбция микропористыми сорбентами от ионного обмена? 26. Какая основная характеристика используется для оценки качества микропористых сорбентов? 27. Чем хроматография отличается от десорбции? 28. Какие существуют разновидности хроматографии? 29. Перечислите преимущества и недостатки хроматографии при выделении продуктов микробиологического синтеза. 30. Назовите основные механизмы биосорбции металлов. 31. Расскажите о разновидностях биосорбции металлов: с деструкцией и с регенерацией клеток микроорганизмов.

32. Назовите основные мембранные методы, используемые в биотехнологии. 33. В чем состоят особенности использования процессов микрофильтрации для стерилизации сред жидкофазных компонентов? 34. Расскажите о тангенциальной фильтрации — основном приеме при использовании мембранных методов. Что он дает? 35. Что такое диафильтрация, какие задачи решаются с помощью этого процесса? 36. Что является движущей силой процесса диализа? 37. Какие мембраны используют при диализе? 38. Перечислите недостатки процесса диализа. 39. Электродиализ: для каких целей этот процесс предназначен? 40. Ультрафильтрация: движущая сила процесса, для каких задач используется? 41. Какое давление используют при ультрафильтрации? 42. Назовите причины концентрационной поляризации при ультрафильтрации. Перечислите факторы, влияющие на скорость процесса ультрафильтрации. 43. Каковы способы борьбы с концентрационной поляризацией? 44. Приведите варианты технического оформления ультафильтрационных систем. Каковы плотности упаковки поверхности фильтрации для разных вариантов? 45. Приведите примеры использования процессов ультрафильтрации при очистке и концентрировании растворов. 46. Перечислите преимущества и недостатки процесса ультрафильтрации. 47. Какой принцип используют в процессе обратного осмоса? 48. При каких давлениях происходят процессы нанофильтрации и обратного осмоса?

Тестовые вопросы. Промышленное получение антибиотиков. 1. На какой стадии ферментации образуется антибиотик? в первые часы роста культуры. на вторые – третьи сутки роста. на пятые – шестые сутки роста. * 2. Какова основная причина поиска новых антибиотиков? токсичность существующих антибиотиков. нарастание устойчивости патогенных микрооганизмов. * расширение действия антибиотиков на метаболические реакции. 3. Что способствует интенсификации биосинтеза антибиотиков? увеличение в питательной среде витаминов. уменьшение в питательной среде кислорода. уменьшение в питательной среде углерода и азота. * 4. Как дифференцируются по механизму действия антибиотики? являются ингибиторами образования клеточной стенки. * являются ингибиторами элементов питательной среды. являются разрушителями кислорода. 5. Чем в основном отличаются антибиотики от антисептиков? избиратель ностью и силой действия на метаболизм клетки. * размерами молекул антибиотиков и антисептиков. молекулярной массой антибиотиков и антисептиков.
e912f9d55b172b45cc8c47435350ed68.ppt