Ч.4. Пром. водоподготовка Microsoft PowerPoint.ppt
- Количество слайдов: 28
 ПРОМЫШЛЕННАЯ ВОДОПОДГОТОВКА
ПРОМЫШЛЕННАЯ ВОДОПОДГОТОВКА
 ХАРАКТЕРИСТИКА ПРИРОДНЫХ ВОД И ИХ ПРИМЕСЕЙ • Вода является одним из самых распространенных соединений на Земле. Общая масса воды на поверхности Земли оценивается в 1, 39. 1018 т. Большая часть ее содержится в морях и океанах. Стационарные запасы пресных вод, пригодных для использования, составляют всего 0, 3% объема гидросферы. • Химическая промышленность является крупнейшим потребителем воды. Современные химические предприятия расходуют до 1 млн. м 3 воды в сутки. Расходные коэффициенты по воде в (м³/т) в производстве: • азотной кислоты – до 200, • аммиака – 1500, • вискозного шелка – 2500 и т. д. .
ХАРАКТЕРИСТИКА ПРИРОДНЫХ ВОД И ИХ ПРИМЕСЕЙ • Вода является одним из самых распространенных соединений на Земле. Общая масса воды на поверхности Земли оценивается в 1, 39. 1018 т. Большая часть ее содержится в морях и океанах. Стационарные запасы пресных вод, пригодных для использования, составляют всего 0, 3% объема гидросферы. • Химическая промышленность является крупнейшим потребителем воды. Современные химические предприятия расходуют до 1 млн. м 3 воды в сутки. Расходные коэффициенты по воде в (м³/т) в производстве: • азотной кислоты – до 200, • аммиака – 1500, • вискозного шелка – 2500 и т. д. .
 • Годовой сток: • • • Волги - 250 км 3/год; Амура - 350 км 3/год; Оби - 396 км 3/год; Лены - 508 км 3/год; Енисея - 623 км 3/год. • • Солесодержание в различных морях: Балтийское - 11 г/л; Каспийское - 12 -13 г/л; Черное - 19 г/л; Северное - 33 г/л; Атлантический океан - 35, 9 г/л; Средиземное море - 37, 3 г/л; Мертвое море - 240 г/л;
• Годовой сток: • • • Волги - 250 км 3/год; Амура - 350 км 3/год; Оби - 396 км 3/год; Лены - 508 км 3/год; Енисея - 623 км 3/год. • • Солесодержание в различных морях: Балтийское - 11 г/л; Каспийское - 12 -13 г/л; Черное - 19 г/л; Северное - 33 г/л; Атлантический океан - 35, 9 г/л; Средиземное море - 37, 3 г/л; Мертвое море - 240 г/л;
 • Используемая в производстве техническая вода делится на охлаждающую, технологическую и энергетическую. • Приблизительно 75% воды, используемой в химической промышленности, расходуется на охлаждение или нагрев технологической аппаратуры.
• Используемая в производстве техническая вода делится на охлаждающую, технологическую и энергетическую. • Приблизительно 75% воды, используемой в химической промышленности, расходуется на охлаждение или нагрев технологической аппаратуры.
 Классификация примесей воды • по химическому составу: на органические (гуминовые кислоты, лигнин, бактерии и др. ) и неорганические (минеральные соли, газы N, O, CO 2, H 2 S, CH 4, NH 3 и др. ). • по дисперсности. Различают четыре группы. • К первой группе относятся нерастворимые вещества от тонких взвесей до крупных частиц, размером до 10 -5÷ 10 -4 см (песок, глина, некоторые бактерии). • К второй группе относятся коллоидные системы, высокомолекулярные вещ-ва с величиной частиц 10 -5÷ 10 -6 см. • К третьей группе относятся молекулярные растворы в воде газов и органических веществ с величиной частиц 10 -6÷ 10 -7 см. Эти вещества находятся в воде в виде недиссоциированных молекул. • К четвертой группе относятся истинно растворенные вещества, диссоциирующие в воде на ионы и имеющие величину частиц менее 10 -7 см.
Классификация примесей воды • по химическому составу: на органические (гуминовые кислоты, лигнин, бактерии и др. ) и неорганические (минеральные соли, газы N, O, CO 2, H 2 S, CH 4, NH 3 и др. ). • по дисперсности. Различают четыре группы. • К первой группе относятся нерастворимые вещества от тонких взвесей до крупных частиц, размером до 10 -5÷ 10 -4 см (песок, глина, некоторые бактерии). • К второй группе относятся коллоидные системы, высокомолекулярные вещ-ва с величиной частиц 10 -5÷ 10 -6 см. • К третьей группе относятся молекулярные растворы в воде газов и органических веществ с величиной частиц 10 -6÷ 10 -7 см. Эти вещества находятся в воде в виде недиссоциированных молекул. • К четвертой группе относятся истинно растворенные вещества, диссоциирующие в воде на ионы и имеющие величину частиц менее 10 -7 см.
 По происхождению различают: • Атмосферные воды – воды дождевых и снеговых осадков – характеризуются сравнительно небольшим содержанием примесей. • Поверхностные воды – это воды открытых водоемов: рек, озер, морей, каналов, водохранилищ. • Морская вода отличается высоким солесодержанием и содержит практически все элементы, имеющиеся в земной коре. Больше всего в морской воде содержится хлорида натрия (до 2, 6 % от всех солей). • Подземные воды – воды артезианских скважин, колодцев, ключей, гейзеров.
По происхождению различают: • Атмосферные воды – воды дождевых и снеговых осадков – характеризуются сравнительно небольшим содержанием примесей. • Поверхностные воды – это воды открытых водоемов: рек, озер, морей, каналов, водохранилищ. • Морская вода отличается высоким солесодержанием и содержит практически все элементы, имеющиеся в земной коре. Больше всего в морской воде содержится хлорида натрия (до 2, 6 % от всех солей). • Подземные воды – воды артезианских скважин, колодцев, ключей, гейзеров.
 В зависимости от солесодержания природные воды подразделяют на: • пресную воду – солесодержание до 1 г солей/л; • пресные воды подразделяются на: воды малой минерализованности (до 0, 2 г/л), средней минерализованности (0, 2 – 0, 5 г/л) повышенной минерализованности (0, 5 – 1 г/л). • солоноватую – 1 ÷ 10 г солей/л воды; • соленую – 10 - 50 г/л. • рассолы (более 50 г/л).
В зависимости от солесодержания природные воды подразделяют на: • пресную воду – солесодержание до 1 г солей/л; • пресные воды подразделяются на: воды малой минерализованности (до 0, 2 г/л), средней минерализованности (0, 2 – 0, 5 г/л) повышенной минерализованности (0, 5 – 1 г/л). • солоноватую – 1 ÷ 10 г солей/л воды; • соленую – 10 - 50 г/л. • рассолы (более 50 г/л).
 ОСНОВНЫЕ ПОКАЗАТЕЛИ КАЧЕСТВА ВОДЫ • • • • Прозрачность. Цвет. Содержание взвешенных веществ. Сухой остаток. Окисляемость. Активная реакция. Щелочность. Жесткость. Солесодержание. Содержание тяжелых металлов. Бактериологические показатели. Запах. Вкус и т. д.
ОСНОВНЫЕ ПОКАЗАТЕЛИ КАЧЕСТВА ВОДЫ • • • • Прозрачность. Цвет. Содержание взвешенных веществ. Сухой остаток. Окисляемость. Активная реакция. Щелочность. Жесткость. Солесодержание. Содержание тяжелых металлов. Бактериологические показатели. Запах. Вкус и т. д.
 ОСНОВНЫЕ МЕТОДЫ ВОДОПОДГОТОВКИ • ОСВЕТЛЕНИЕ ВОДЫ • Осветление воды – это ряд операций (отстаивание, фильтрация, коагуляция), выполняемых для удаления из воды механических примесей. • Используемые аппараты: • Песколовки • Отстойники: горизонтальные; вертикальные и радиальные. • Фильтры •
ОСНОВНЫЕ МЕТОДЫ ВОДОПОДГОТОВКИ • ОСВЕТЛЕНИЕ ВОДЫ • Осветление воды – это ряд операций (отстаивание, фильтрация, коагуляция), выполняемых для удаления из воды механических примесей. • Используемые аппараты: • Песколовки • Отстойники: горизонтальные; вертикальные и радиальные. • Фильтры •
 Песколовка • Песколовка разработана для отделения твердых, легко осаждающихся веществ.
Песколовка • Песколовка разработана для отделения твердых, легко осаждающихся веществ.
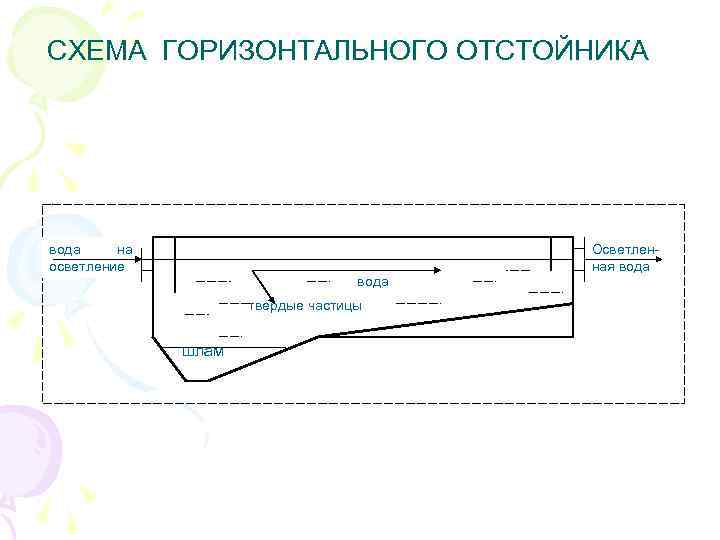 СХЕМА ГОРИЗОНТАЛЬНОГО ОТСТОЙНИКА вода на осветление вода твердые частицы шлам Осветленная вода
СХЕМА ГОРИЗОНТАЛЬНОГО ОТСТОЙНИКА вода на осветление вода твердые частицы шлам Осветленная вода
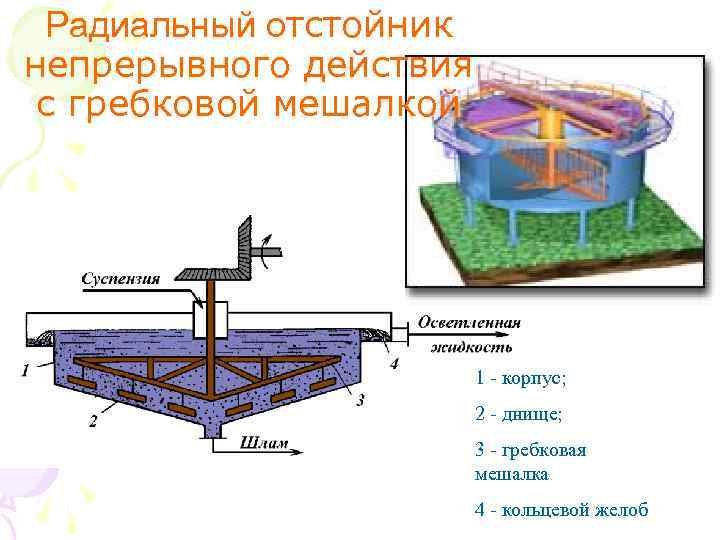 Радиальный отстойник непрерывного действия с гребковой мешалкой 1 - корпус; 2 - днище; 3 - гребковая мешалка 4 - кольцевой желоб
Радиальный отстойник непрерывного действия с гребковой мешалкой 1 - корпус; 2 - днище; 3 - гребковая мешалка 4 - кольцевой желоб
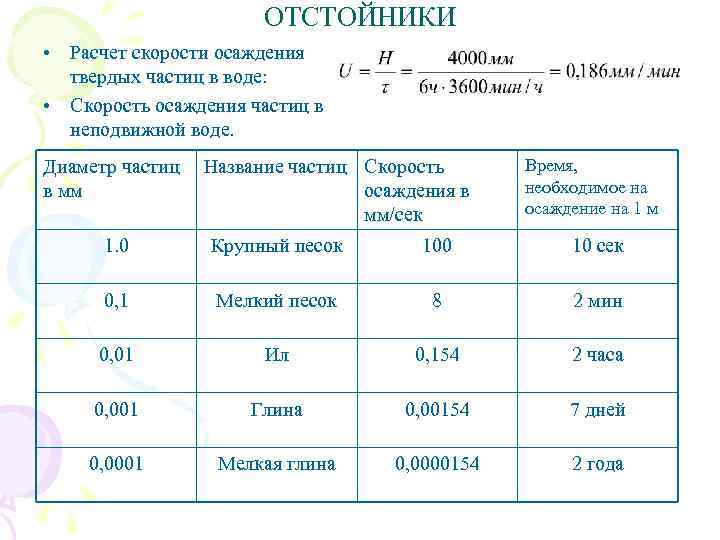 ОТСТОЙНИКИ • Расчет скорости осаждения твердых частиц в воде: • Скорость осаждения частиц в неподвижной воде. Диаметр частиц в мм Название частиц Скорость осаждения в мм/сек Время, необходимое на осаждение на 1 м 1. 0 Крупный песок 100 10 сек 0, 1 Мелкий песок 8 2 мин 0, 01 Ил 0, 154 2 часа 0, 001 Глина 0, 00154 7 дней 0, 0001 Мелкая глина 0, 0000154 2 года
ОТСТОЙНИКИ • Расчет скорости осаждения твердых частиц в воде: • Скорость осаждения частиц в неподвижной воде. Диаметр частиц в мм Название частиц Скорость осаждения в мм/сек Время, необходимое на осаждение на 1 м 1. 0 Крупный песок 100 10 сек 0, 1 Мелкий песок 8 2 мин 0, 01 Ил 0, 154 2 часа 0, 001 Глина 0, 00154 7 дней 0, 0001 Мелкая глина 0, 0000154 2 года
 КОАГУЛЯЦИОННАЯ ОЧИСТКА ВОДЫ • Коагуляционная и злектрокоагуляционная очистка применяются в тех случаях, когда примеси, находящиеся в воде не удаляются отстаиванием и фильтрацией без дополнительной обработки. • Коагуляцией примесей воды называется процесс разрушения и укрупнения мельчайших коллоидных и диспергированных частиц, происходящий вследствие их взаимного слипания под действием сил молекулярного притяжения. • В качестве коагулянтов используют различные соли алюминия и железа, чаще всего Al 2(SO 4)3, Fe. SO 4 и Fe. Cl 3. • Выбор реагента зависит от концентрации примесей, р. Н, температуры и солевого состава воды.
КОАГУЛЯЦИОННАЯ ОЧИСТКА ВОДЫ • Коагуляционная и злектрокоагуляционная очистка применяются в тех случаях, когда примеси, находящиеся в воде не удаляются отстаиванием и фильтрацией без дополнительной обработки. • Коагуляцией примесей воды называется процесс разрушения и укрупнения мельчайших коллоидных и диспергированных частиц, происходящий вследствие их взаимного слипания под действием сил молекулярного притяжения. • В качестве коагулянтов используют различные соли алюминия и железа, чаще всего Al 2(SO 4)3, Fe. SO 4 и Fe. Cl 3. • Выбор реагента зависит от концентрации примесей, р. Н, температуры и солевого состава воды.
 КОРРЕКТИРОВКА СОЛЕВОГО СОСТАВА (умягчение и деминерализация воды) • Задача умягчения воды. Частичное или полное удаление солей жесткости из воды. Задача деминерализации воды – уменьшение солесодержания, изменение солевого состава или полное устранение всех солей из воды.
КОРРЕКТИРОВКА СОЛЕВОГО СОСТАВА (умягчение и деминерализация воды) • Задача умягчения воды. Частичное или полное удаление солей жесткости из воды. Задача деминерализации воды – уменьшение солесодержания, изменение солевого состава или полное устранение всех солей из воды.
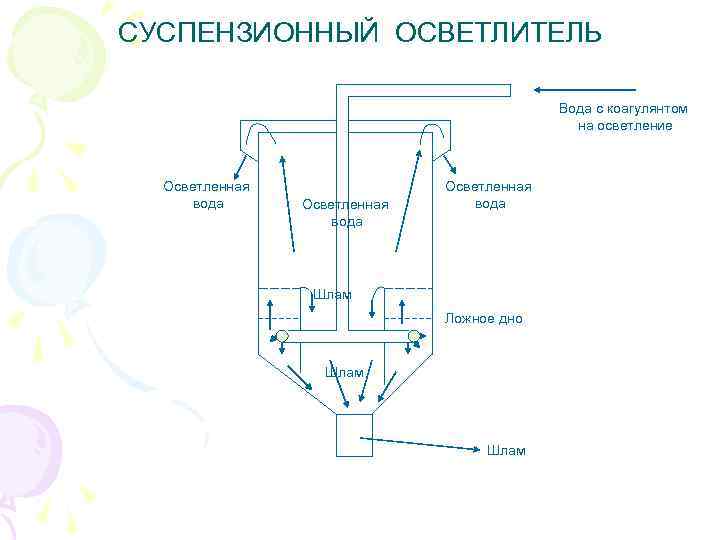 СУСПЕНЗИОННЫЙ ОСВЕТЛИТЕЛЬ Вода с коагулянтом на осветление Осветленная вода Шлам Ложное дно Шлам
СУСПЕНЗИОННЫЙ ОСВЕТЛИТЕЛЬ Вода с коагулянтом на осветление Осветленная вода Шлам Ложное дно Шлам
 УМЯГЧЕНИЕ ВОДЫ • Физические методы: • Кипячение • Ca(HCO 3)2 = Ca. CO 3↓ + CO 2 + H 2 O • 2 Mg(HCO 3)2 = Mg. CO 3·Mg(OH)2↓ + 3 CO 2 + H 2 O • Химические методы • Магнитная обработка • Ионообменная обработка воды
УМЯГЧЕНИЕ ВОДЫ • Физические методы: • Кипячение • Ca(HCO 3)2 = Ca. CO 3↓ + CO 2 + H 2 O • 2 Mg(HCO 3)2 = Mg. CO 3·Mg(OH)2↓ + 3 CO 2 + H 2 O • Химические методы • Магнитная обработка • Ионообменная обработка воды
 ХИМИЧЕСКИЕ (РЕАГЕНТНЫЕ) МЕТОДЫ УМЯГЧЕНИЯ ВОДЫ • 1. Известкование воды (устраняется только временная жесткость) • Ca(HCO 3)2 + Ca(OH)2 = 2 Ca. CO 3 + 2 H 2 O Mg(HCO 3)2+Ca(OH)2 =Mg(OH)2 +2 Ca. CO 3 +H 2 O+CO 2 • Fe. SO 4 + Ca(OH)2 = Fe(OH)2 + Ca. SO 4 • CO 2 + Ca(OH)2 = Ca. CO 3 +H 2 O • Обработка кальцинированной содой • Ca(HCO 3)2 + Na 2 CO 3 = Ca. CO 3 +2 Na. HCO 3 • Mg. Cl 2 + Na 2 CO 3 = Mg. CO 3 + 2 Na. Cl • Устраняется общая жесткость
ХИМИЧЕСКИЕ (РЕАГЕНТНЫЕ) МЕТОДЫ УМЯГЧЕНИЯ ВОДЫ • 1. Известкование воды (устраняется только временная жесткость) • Ca(HCO 3)2 + Ca(OH)2 = 2 Ca. CO 3 + 2 H 2 O Mg(HCO 3)2+Ca(OH)2 =Mg(OH)2 +2 Ca. CO 3 +H 2 O+CO 2 • Fe. SO 4 + Ca(OH)2 = Fe(OH)2 + Ca. SO 4 • CO 2 + Ca(OH)2 = Ca. CO 3 +H 2 O • Обработка кальцинированной содой • Ca(HCO 3)2 + Na 2 CO 3 = Ca. CO 3 +2 Na. HCO 3 • Mg. Cl 2 + Na 2 CO 3 = Mg. CO 3 + 2 Na. Cl • Устраняется общая жесткость
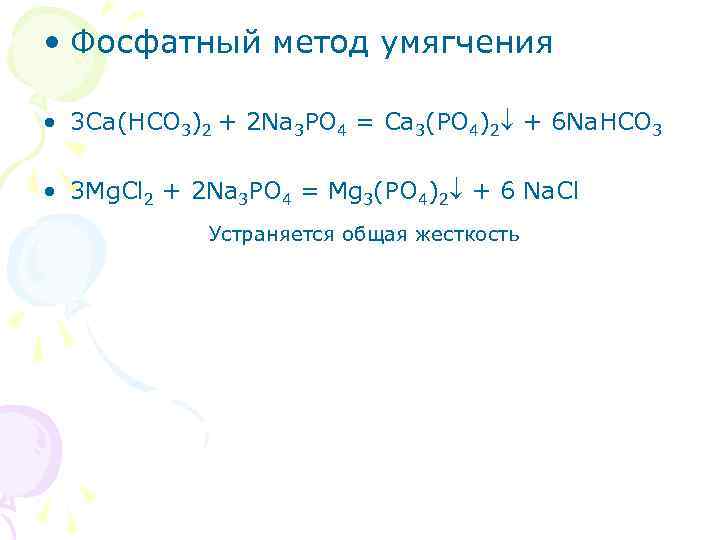 • Фосфатный метод умягчения • 3 Ca(HCO 3)2 + 2 Na 3 PO 4 = Ca 3(PO 4)2 + 6 Na. HCO 3 • 3 Mg. Cl 2 + 2 Na 3 PO 4 = Mg 3(PO 4)2 + 6 Na. Cl Устраняется общая жесткость
• Фосфатный метод умягчения • 3 Ca(HCO 3)2 + 2 Na 3 PO 4 = Ca 3(PO 4)2 + 6 Na. HCO 3 • 3 Mg. Cl 2 + 2 Na 3 PO 4 = Mg 3(PO 4)2 + 6 Na. Cl Устраняется общая жесткость
 ДЕМИНЕРАЛИЗАЦИЯ ВОДЫ • Физические методы: • Дистиляция и вымораживание; • Мембранные методы. • Электрохимические методы • Ионообменный метод • Задачи, решаемые ионным обменом в водоподготовке • 1. Умягчение воды • 2. Получение умягченной и нейтральной воды • 3. Корректировка солевого состава и деминерализация воды
ДЕМИНЕРАЛИЗАЦИЯ ВОДЫ • Физические методы: • Дистиляция и вымораживание; • Мембранные методы. • Электрохимические методы • Ионообменный метод • Задачи, решаемые ионным обменом в водоподготовке • 1. Умягчение воды • 2. Получение умягченной и нейтральной воды • 3. Корректировка солевого состава и деминерализация воды
 • В водоподготовке используются катионообменные смолы RNa, RH, RNH 4 и анионообменные An. OH РЕАКЦИИ 1. Ca. Cl 2 + 2 RNa ⇄ R 2 Ca + 2 Na. Cl 2. Ca(HCO 3)2+ 2 RNa ⇄ R 2 Ca + 2 Na. HCO 3 p. H > 7 вода слабо щелочная 3. Ca. Cl 2 + 2 RH ⇄ R 2 Ca + 2 HCl p. H < 7 вода кислая 4. Mg(HCO 3)2+ 2 RH ⇄ R 2 Mg + H 2 O + CO 2 Для умягчения воды используются катионообменные смолы RNa и RNH 4
• В водоподготовке используются катионообменные смолы RNa, RH, RNH 4 и анионообменные An. OH РЕАКЦИИ 1. Ca. Cl 2 + 2 RNa ⇄ R 2 Ca + 2 Na. Cl 2. Ca(HCO 3)2+ 2 RNa ⇄ R 2 Ca + 2 Na. HCO 3 p. H > 7 вода слабо щелочная 3. Ca. Cl 2 + 2 RH ⇄ R 2 Ca + 2 HCl p. H < 7 вода кислая 4. Mg(HCO 3)2+ 2 RH ⇄ R 2 Mg + H 2 O + CO 2 Для умягчения воды используются катионообменные смолы RNa и RNH 4
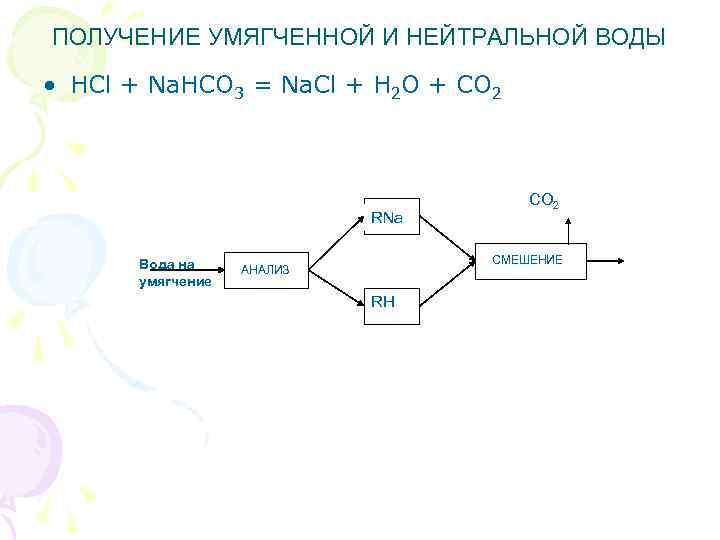 ПОЛУЧЕНИЕ УМЯГЧЕННОЙ И НЕЙТРАЛЬНОЙ ВОДЫ • HCl + Na. HCO 3 = Na. Cl + H 2 O + CO 2 RNa Вода на умягчение СО 2 СМЕШЕНИЕ АНАЛИЗ RH
ПОЛУЧЕНИЕ УМЯГЧЕННОЙ И НЕЙТРАЛЬНОЙ ВОДЫ • HCl + Na. HCO 3 = Na. Cl + H 2 O + CO 2 RNa Вода на умягчение СО 2 СМЕШЕНИЕ АНАЛИЗ RH
 ПОЛУЧЕНИЕ ДЕМИНЕРАЛИЗОВАННОЙ ВОДЫ 1. Обработка воды катионообменной смолой RH Ca. Cl 2 + 2 RH ⇄ R 2 Ca + 2 HCl Mg(HCO 3)2+ 2 RH ⇄ p. H < 7 вода кислая R 2 Mg + H 2 O + CO 2 2. Обработка кислой воды анионообменной смолой An. OH HCl + An. OH ⇄ An. Cl + H 2 O Основные характеристики ионообменных смол: обменная способность и набухаемость.
ПОЛУЧЕНИЕ ДЕМИНЕРАЛИЗОВАННОЙ ВОДЫ 1. Обработка воды катионообменной смолой RH Ca. Cl 2 + 2 RH ⇄ R 2 Ca + 2 HCl Mg(HCO 3)2+ 2 RH ⇄ p. H < 7 вода кислая R 2 Mg + H 2 O + CO 2 2. Обработка кислой воды анионообменной смолой An. OH HCl + An. OH ⇄ An. Cl + H 2 O Основные характеристики ионообменных смол: обменная способность и набухаемость.
 РЕГЕНЕРАЦИЯ ИОНООБМЕННЫХ СМОЛ Регенерация катионообменных смол осуществляется 1 -1, 5%-м раствором соляной или (осторожно) серной кислотой или раствором Na. Cl. R 2 Ca + 2 HCl ⇄ Ca. Cl 2 + 2 RН Регенерация анионообменных смол осуществляется 4%-м раствором Na. OH.
РЕГЕНЕРАЦИЯ ИОНООБМЕННЫХ СМОЛ Регенерация катионообменных смол осуществляется 1 -1, 5%-м раствором соляной или (осторожно) серной кислотой или раствором Na. Cl. R 2 Ca + 2 HCl ⇄ Ca. Cl 2 + 2 RН Регенерация анионообменных смол осуществляется 4%-м раствором Na. OH.
 ДЕГАЗАЦИЯ ВОДЫ • Физические методы • Кипячение • Применение пленочных (градирни), насадочных, барботажных (пенные аппараты) и вакуумных дегазаторов. • Химические методы • Известкование – удаление СО 2 • 2 Na 2 SO 3 + O 2 = 2 Na 2 SO 4 • N 2 H 4 + O 2 = 2 H 2 O + N 2 , но гидразин – очень опасен! • N 2 H 4·H 2 SO 4 + O 2 = 2 H 2 O + H 2 SO 4 + N 2 • и др.
ДЕГАЗАЦИЯ ВОДЫ • Физические методы • Кипячение • Применение пленочных (градирни), насадочных, барботажных (пенные аппараты) и вакуумных дегазаторов. • Химические методы • Известкование – удаление СО 2 • 2 Na 2 SO 3 + O 2 = 2 Na 2 SO 4 • N 2 H 4 + O 2 = 2 H 2 O + N 2 , но гидразин – очень опасен! • N 2 H 4·H 2 SO 4 + O 2 = 2 H 2 O + H 2 SO 4 + N 2 • и др.
 Градирни
Градирни

 ДЕЗИНФЕКЦИЯ ВОДЫ • Физические методы • Кипячение • УФ Облучение λ 290 нм • Химические методы • Хлорирование: Cl 2 + H 2 O = HCl + HCl. O • Применение гипохлоритов: Na. Cl. O, Ca(Cl. O)2 • Озонирование: O 3 → O 2 + O
ДЕЗИНФЕКЦИЯ ВОДЫ • Физические методы • Кипячение • УФ Облучение λ 290 нм • Химические методы • Хлорирование: Cl 2 + H 2 O = HCl + HCl. O • Применение гипохлоритов: Na. Cl. O, Ca(Cl. O)2 • Озонирование: O 3 → O 2 + O


