 производство серной кислоты
производство серной кислоты
 Исторические сведения первое упоминание о кислых газах, получаемых при прокаливании железного купороса «зеленого камня» , встречается в сочинениях, приписываемых арабскому алхимику Джабир ибн Хайяну. В IX веке персидский алхимик Ар-Рази, прокаливая смесь железного и медного купороса (Fe. SO 4 • 7 H 2 O и Cu. SO 4 • 5 H 2 O), также получил раствор серной кислоты. Этот способ усовершенствовал европейский алхимик Альберт Магнус, живший в XIII веке. В XV веке алхимики обнаружили, что серную кислоту можно получить, сжигая смесь серы и селитры, или из пирита — серного колчедана.
Исторические сведения первое упоминание о кислых газах, получаемых при прокаливании железного купороса «зеленого камня» , встречается в сочинениях, приписываемых арабскому алхимику Джабир ибн Хайяну. В IX веке персидский алхимик Ар-Рази, прокаливая смесь железного и медного купороса (Fe. SO 4 • 7 H 2 O и Cu. SO 4 • 5 H 2 O), также получил раствор серной кислоты. Этот способ усовершенствовал европейский алхимик Альберт Магнус, живший в XIII веке. В XV веке алхимики обнаружили, что серную кислоту можно получить, сжигая смесь серы и селитры, или из пирита — серного колчедана.
 способы Контактный нитрозный Сырье: Самородная сера S Пирит (серный колчедан) Fe. S 2 Сероводород H 2 S Сульфиды цветных металлов Zns, Cu 2 S
способы Контактный нитрозный Сырье: Самородная сера S Пирит (серный колчедан) Fe. S 2 Сероводород H 2 S Сульфиды цветных металлов Zns, Cu 2 S
 ПЕРВАЯ СТАДИЯ - обжиг пирита в печи для . обжига в «кипящем слое» Уравнение реакции первой стадии 4 Fe. S 2 + 11 O 2 = 2 Fe 2 O 3 + 8 SO 2 + Q Температура достигает 800
ПЕРВАЯ СТАДИЯ - обжиг пирита в печи для . обжига в «кипящем слое» Уравнение реакции первой стадии 4 Fe. S 2 + 11 O 2 = 2 Fe 2 O 3 + 8 SO 2 + Q Температура достигает 800
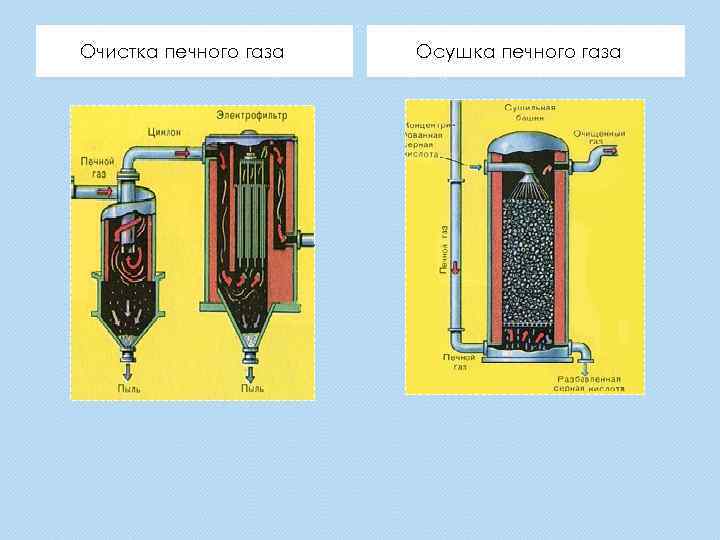 Очистка печного газа Осушка печного газа
Очистка печного газа Осушка печного газа
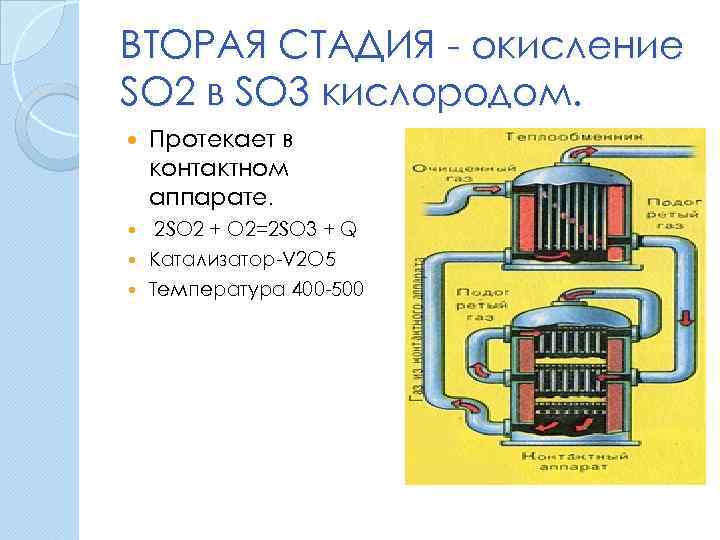 ВТОРАЯ СТАДИЯ - окисление SO 2 в SO 3 кислородом. Протекает в контактном аппарате. 2 SO 2 + O 2=2 SO 3 + Q Катализатор-V 2 O 5 Температура 400 -500
ВТОРАЯ СТАДИЯ - окисление SO 2 в SO 3 кислородом. Протекает в контактном аппарате. 2 SO 2 + O 2=2 SO 3 + Q Катализатор-V 2 O 5 Температура 400 -500
 ТРЕТЬЯ СТАДИЯ - поглощение SO 3 серной кислотой. Протекает в поглотительной башне. n. SO 3 + H 2 SO 4= H 2 SO 4·n. SO 3 Образуется олеум H 2 SO 4·n. SO 3
ТРЕТЬЯ СТАДИЯ - поглощение SO 3 серной кислотой. Протекает в поглотительной башне. n. SO 3 + H 2 SO 4= H 2 SO 4·n. SO 3 Образуется олеум H 2 SO 4·n. SO 3
 Нитрозный способ производства серной кислоты Ca. SO 4. 2 H 2 O SO 2 H 2 SO 4, 2 NO + O 2 = 2 NO 2 NO + NO 2 + 2 H 2 SO 4 =2 NO(HSO 4) + H 2 O Нитрозиллерная кислота NO(HSO 4) + H 2 O=H 2 SO 4 + HNO 2 SO 2 + 2 HNO 2=H 2 SO 4 + 2 NO Серная кислота концентрацией 75%
Нитрозный способ производства серной кислоты Ca. SO 4. 2 H 2 O SO 2 H 2 SO 4, 2 NO + O 2 = 2 NO 2 NO + NO 2 + 2 H 2 SO 4 =2 NO(HSO 4) + H 2 O Нитрозиллерная кислота NO(HSO 4) + H 2 O=H 2 SO 4 + HNO 2 SO 2 + 2 HNO 2=H 2 SO 4 + 2 NO Серная кислота концентрацией 75%