Л 3 Серная к-та.ppt
- Количество слайдов: 45
 ПРОИЗВОДСТВО СЕРНОЙ КИСЛОТЫ
ПРОИЗВОДСТВО СЕРНОЙ КИСЛОТЫ
 Физические свойства серной кислоты Серная кислота – система оксида серы (VI) и воды: n. SO 3∙m. H 2 O при n=m=1 Моногидрат (безводная) 100% – бесцветная маслянистая жидкость с Ткр = 10, 37 Сº, Тк = 296, 2 Сº, ρ = 1, 85 г/см 3, H 2 SO 4; m ˃ n - водные растворы моногидрата; m < n - растворы оксида серы (VI) в моногидрате, т. е 100% серной кислоте (олеум). Олеум – раствор SO 3 в моногидрате
Физические свойства серной кислоты Серная кислота – система оксида серы (VI) и воды: n. SO 3∙m. H 2 O при n=m=1 Моногидрат (безводная) 100% – бесцветная маслянистая жидкость с Ткр = 10, 37 Сº, Тк = 296, 2 Сº, ρ = 1, 85 г/см 3, H 2 SO 4; m ˃ n - водные растворы моногидрата; m < n - растворы оксида серы (VI) в моногидрате, т. е 100% серной кислоте (олеум). Олеум – раствор SO 3 в моногидрате
 Товарные сорта серной кислоты
Товарные сорта серной кислоты
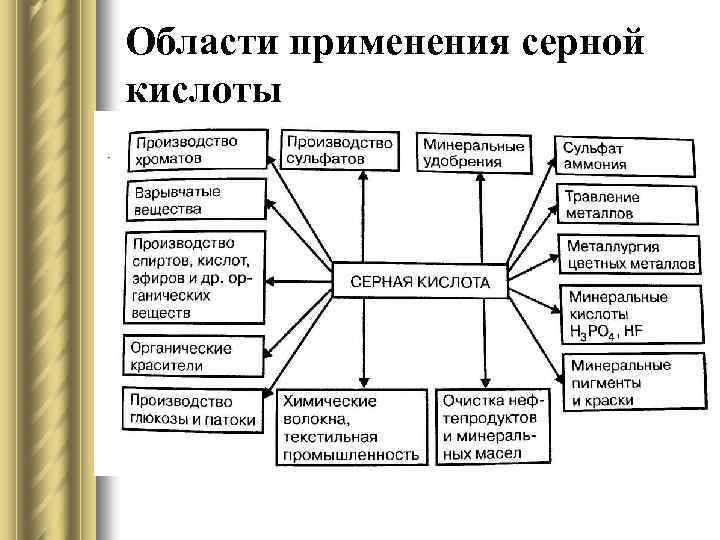 Области применения серной кислоты
Области применения серной кислоты
 Способы производства H 2 SO 4 l Нитрозный (более 200 лет) (75%) SO 2 + NO 2 + H 2 O = H 2 SO 4 + NO 2 NO + O 2 = 2 NO 2 l Контактный (конец ХIХ и начало ХХ века). l Самый первый – разложение Fe. SO 4∙ 7 Н 2 О – купоросное масло
Способы производства H 2 SO 4 l Нитрозный (более 200 лет) (75%) SO 2 + NO 2 + H 2 O = H 2 SO 4 + NO 2 NO + O 2 = 2 NO 2 l Контактный (конец ХIХ и начало ХХ века). l Самый первый – разложение Fe. SO 4∙ 7 Н 2 О – купоросное масло
 Сырье – сера и серосодержащие вещества
Сырье – сера и серосодержащие вещества
 Железный колчедан (пирит) l сульфиды железа и сульфиды других металлов (меди, цинка, свинца, кобальта, никеля) – рядовой колчедан l Содержание серы – 30 -50 %
Железный колчедан (пирит) l сульфиды железа и сульфиды других металлов (меди, цинка, свинца, кобальта, никеля) – рядовой колчедан l Содержание серы – 30 -50 %
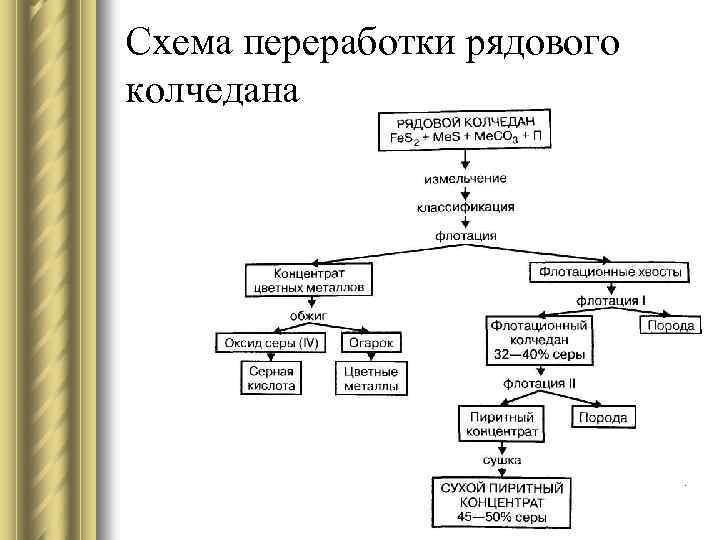 Схема переработки рядового колчедана
Схема переработки рядового колчедана
 Свободная сера l Самородная l Газовая (комовая) – газоконденсатные месторождения и месторождения попутного газа
Свободная сера l Самородная l Газовая (комовая) – газоконденсатные месторождения и месторождения попутного газа
 Извлечение самородной серы из руд Выплавка: l В печах l В автоклавах l В подземных залежах (метод Фраша): серу расплавляют под землей, перегретой водой, выдавливают расплавленную серу на поверхность сжатым воздухом
Извлечение самородной серы из руд Выплавка: l В печах l В автоклавах l В подземных залежах (метод Фраша): серу расплавляют под землей, перегретой водой, выдавливают расплавленную серу на поверхность сжатым воздухом
 Общая схема получения серы из руды
Общая схема получения серы из руды
 Получение газовой серы l неполным окислением H 2 S над твердым катализатором (бокситы) H 2 S + 1, 5 О 2 = SO 2 + Н 2 О 2 H 2 S + SO 2 = 2 H 2 O + 3 S Суммарно: 2 H 2 S + O 2 = 2 H 2 O + 2 S l Из продуктов медеплавильного производства в процессе плавки 2 Fe. S 2 = 2 Fe. S + 2 S, SO 2 + С = S + СО 2, CS 2 + SO 2 = 3 S + CO 2, 2 COS + SO 2 = 3 S + 2 CO 2.
Получение газовой серы l неполным окислением H 2 S над твердым катализатором (бокситы) H 2 S + 1, 5 О 2 = SO 2 + Н 2 О 2 H 2 S + SO 2 = 2 H 2 O + 3 S Суммарно: 2 H 2 S + O 2 = 2 H 2 O + 2 S l Из продуктов медеплавильного производства в процессе плавки 2 Fe. S 2 = 2 Fe. S + 2 S, SO 2 + С = S + СО 2, CS 2 + SO 2 = 3 S + CO 2, 2 COS + SO 2 = 3 S + 2 CO 2.
 Сероводород Побочный продукт при переработке нефти, коксовый, генераторный, попутный газы l Улавливание l Концентрация l Сжигание с образованием SO 2
Сероводород Побочный продукт при переработке нефти, коксовый, генераторный, попутный газы l Улавливание l Концентрация l Сжигание с образованием SO 2
 Основные стадии производства H 2 SO 4 1. Получение сернистого ангидрида SO 2 путем обжига сырья. 2. Очистка SO 2 (особенно в случае контактного метода) 3. Окисление SO 2 до триоксида серы SO 3 (каталитически) 4. Абсорбция SO 3 водой с образованием серной кислоты.
Основные стадии производства H 2 SO 4 1. Получение сернистого ангидрида SO 2 путем обжига сырья. 2. Очистка SO 2 (особенно в случае контактного метода) 3. Окисление SO 2 до триоксида серы SO 3 (каталитически) 4. Абсорбция SO 3 водой с образованием серной кислоты.
 Общая схема производства серной кислоты Сырье подготовка сырья обжиг сырья очистка печного газа контактирование абсорбция контактного газа серная кислота Конкретная схема зависит от: 1. Применяемого сырья 2. Особенности окисления SO 2 3. Наличие/отсутствие стадии абсорбции SO 3
Общая схема производства серной кислоты Сырье подготовка сырья обжиг сырья очистка печного газа контактирование абсорбция контактного газа серная кислота Конкретная схема зависит от: 1. Применяемого сырья 2. Особенности окисления SO 2 3. Наличие/отсутствие стадии абсорбции SO 3
 Производство серной кислоты из колчедана Химическая схема производства серной кислоты из железного колчедана 1) окисление дисульфида железа кислородом воздуха: 4 Fe. S 2 + 11 O 2 = 2 Fe 2 O 3 + 8 SO 2 + Q (экзо) 2) каталитическое окисление оксида серы (IV) избытком кислорода: 2 SO 2 + O 2 = 2 SO 3 + Q (экзо) 3) абсорбция оксида серы (IV) с образованием серной кислоты: SO 3 + H 2 O = H 2 SO 4 (экзо)
Производство серной кислоты из колчедана Химическая схема производства серной кислоты из железного колчедана 1) окисление дисульфида железа кислородом воздуха: 4 Fe. S 2 + 11 O 2 = 2 Fe 2 O 3 + 8 SO 2 + Q (экзо) 2) каталитическое окисление оксида серы (IV) избытком кислорода: 2 SO 2 + O 2 = 2 SO 3 + Q (экзо) 3) абсорбция оксида серы (IV) с образованием серной кислоты: SO 3 + H 2 O = H 2 SO 4 (экзо)
 Принципиальная схема производства серной кислоты l I-я стадия - получение обжигового газа (оксида серы (IV) из колчедана: 1) операция - обжиг колчедана в печи кипящего слоя; 2) операция - охлаждение газа в котле утилизаторе; 3) операция - общая очистка газа в центробежных пылеуловителях и сухих электрофильтрах; 4) операция - специальная очистка газа в промывных башнях и мокрых электрофильтрах. l II-я стадия – контактирование: 5) операция - подогрев газа в теплообменнике; 6) операция – контактирование (окисление) в контактном аппарате. l III-стадия - абсорбция 7) операция - абсорбция оксида серы и образование серной кислоты в абсорбционной башне с насадкой.
Принципиальная схема производства серной кислоты l I-я стадия - получение обжигового газа (оксида серы (IV) из колчедана: 1) операция - обжиг колчедана в печи кипящего слоя; 2) операция - охлаждение газа в котле утилизаторе; 3) операция - общая очистка газа в центробежных пылеуловителях и сухих электрофильтрах; 4) операция - специальная очистка газа в промывных башнях и мокрых электрофильтрах. l II-я стадия – контактирование: 5) операция - подогрев газа в теплообменнике; 6) операция – контактирование (окисление) в контактном аппарате. l III-стадия - абсорбция 7) операция - абсорбция оксида серы и образование серной кислоты в абсорбционной башне с насадкой.
 I стадия: получение обжигового газа из колчедана гетерогенный (газ – твёрдое), высокотемпературный (до 900˚С), необратимый, некаталитический процесса, идущий через ряд стадий: 1. Разложение сульфида железа 2 Fe. S 2 = 2 Fe. S + S 2 (эндо) 2. Горение паров серы и окисление Fe. S (экзо) S 2 + 2 O 2 = 2 SO 2↑; 4 Fe. S + 7 O 2 = 2 Fe 2 O 3 + 4 SO 2↑.
I стадия: получение обжигового газа из колчедана гетерогенный (газ – твёрдое), высокотемпературный (до 900˚С), необратимый, некаталитический процесса, идущий через ряд стадий: 1. Разложение сульфида железа 2 Fe. S 2 = 2 Fe. S + S 2 (эндо) 2. Горение паров серы и окисление Fe. S (экзо) S 2 + 2 O 2 = 2 SO 2↑; 4 Fe. S + 7 O 2 = 2 Fe 2 O 3 + 4 SO 2↑.
 Типы печей для обжига колчедана l механические полочные l вращающиеся цилиндрические l пылевидного обжига l обжига в кипящем слое (наиболее совершенные)
Типы печей для обжига колчедана l механические полочные l вращающиеся цилиндрические l пылевидного обжига l обжига в кипящем слое (наиболее совершенные)
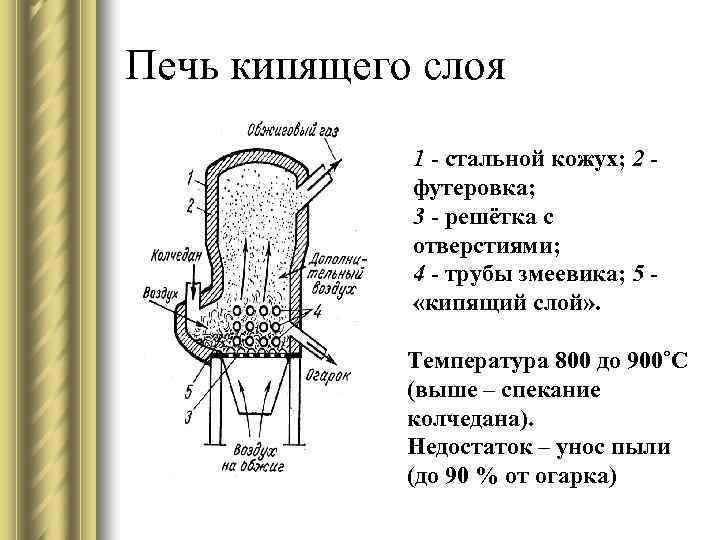 Печь кипящего слоя 1 - стальной кожух; 2 - футеровка; 3 - решётка с отверстиями; 4 - трубы змеевика; 5 - «кипящий слой» . Температура 800 до 900˚C (выше – спекание колчедана). Недостаток – унос пыли (до 90 % от огарка)
Печь кипящего слоя 1 - стальной кожух; 2 - футеровка; 3 - решётка с отверстиями; 4 - трубы змеевика; 5 - «кипящий слой» . Температура 800 до 900˚C (выше – спекание колчедана). Недостаток – унос пыли (до 90 % от огарка)
 Состав обжигового газа l SO 2 - 14 -15%; l SO 3 – 0, 1% (катализатор – Fe. O) l водяные пары; l газообразные окислы мышьяка и селена – каталитические яды; l большое количество огарковой пыли (до 300 г/см 3).
Состав обжигового газа l SO 2 - 14 -15%; l SO 3 – 0, 1% (катализатор – Fe. O) l водяные пары; l газообразные окислы мышьяка и селена – каталитические яды; l большое количество огарковой пыли (до 300 г/см 3).
 Состав огарка До 50 % железа, состоит из оксидов и сульфидов железа и меди Подвергается агломерации и используется для выплавки чугуна и получения пигментов
Состав огарка До 50 % железа, состоит из оксидов и сульфидов железа и меди Подвергается агломерации и используется для выплавки чугуна и получения пигментов
 Очистка обжигового газа от пыли и каталитических ядов l Общая - Циклон (грубая очистка) - Сухой электрофильтр (тонкая очистка) l Специальная - Промывные башни - Мокрые электрофильтры
Очистка обжигового газа от пыли и каталитических ядов l Общая - Циклон (грубая очистка) - Сухой электрофильтр (тонкая очистка) l Специальная - Промывные башни - Мокрые электрофильтры
 Общая очистка обжигового газа Циклон (центробежная сила) Сухой электрофильтр (электростатическая сила) Содержание пыли снижается до 0, 05 -0, 1 г/см 3
Общая очистка обжигового газа Циклон (центробежная сила) Сухой электрофильтр (электростатическая сила) Содержание пыли снижается до 0, 05 -0, 1 г/см 3
 Специальная очистка обжигового газа Основные каталитические яды: l оксид мышьяка As 2 O 5 Тразл ˃ 300 °С l оксид селена Se. O 2 Твозг ок. 340 °С (запах гнилой редьки)
Специальная очистка обжигового газа Основные каталитические яды: l оксид мышьяка As 2 O 5 Тразл ˃ 300 °С l оксид селена Se. O 2 Твозг ок. 340 °С (запах гнилой редьки)
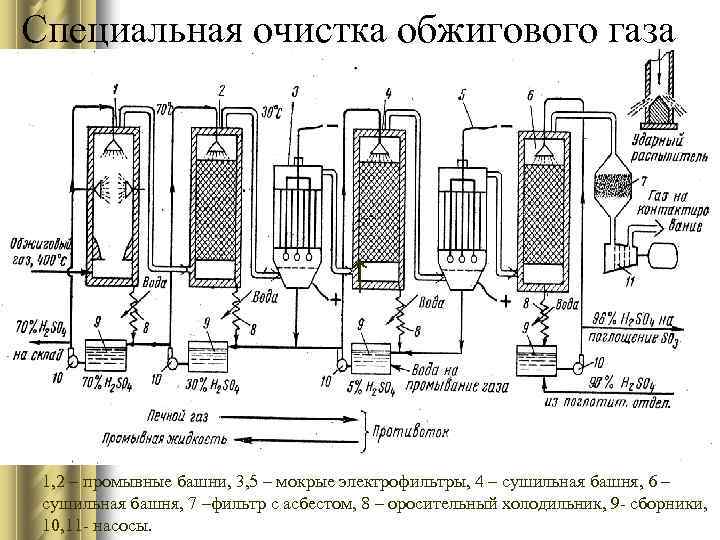 Специальная очистка обжигового газа ↑ 1, 2 – промывные башни, 3, 5 – мокрые электрофильтры, 4 – сушильная башня, 6 – сушильная башня, 7 –фильтр с асбестом, 8 – оросительный холодильник, 9 - сборники, 10, 11 - насосы.
Специальная очистка обжигового газа ↑ 1, 2 – промывные башни, 3, 5 – мокрые электрофильтры, 4 – сушильная башня, 6 – сушильная башня, 7 –фильтр с асбестом, 8 – оросительный холодильник, 9 - сборники, 10, 11 - насосы.
 Специальная очистка обжигового газа 1. Охлаждение обжигового газа (300 -400ºС) 1. Промывная башня без насадок. 50 % Н 2 SO 4 до 70 °С. Результат – 75% загрязненная башенная кислота, и сернокислый туман, содержащий примеси 2. Промывная башня с насадками 20% Н 2 SO 4 до 30ºС. Результат: сернокислотный туман укрупняется, 30% загрязненная башенная кислота.
Специальная очистка обжигового газа 1. Охлаждение обжигового газа (300 -400ºС) 1. Промывная башня без насадок. 50 % Н 2 SO 4 до 70 °С. Результат – 75% загрязненная башенная кислота, и сернокислый туман, содержащий примеси 2. Промывная башня с насадками 20% Н 2 SO 4 до 30ºС. Результат: сернокислотный туман укрупняется, 30% загрязненная башенная кислота.
 Конструкция промывной башни с насадками 1 - корпус; 2 - разбрызгиватель жидкости; 3 - колосниковая решётка; 4 - насадки (кольца)
Конструкция промывной башни с насадками 1 - корпус; 2 - разбрызгиватель жидкости; 3 - колосниковая решётка; 4 - насадки (кольца)
 Специальная очистка обжигового газа 3. Мокрый электрофильтр –полное удаление тумана 4. Осушка газа – в сушильной башне с насадкой при орошении 95% серной кислотой 5. Электрофильтр 6. Сушильная башня (удаление SO 3 96% H 2 SO 4) 7. Фильтр с асбестом Температура газа на выходе из системы очистки – 140 -150 °С.
Специальная очистка обжигового газа 3. Мокрый электрофильтр –полное удаление тумана 4. Осушка газа – в сушильной башне с насадкой при орошении 95% серной кислотой 5. Электрофильтр 6. Сушильная башня (удаление SO 3 96% H 2 SO 4) 7. Фильтр с асбестом Температура газа на выходе из системы очистки – 140 -150 °С.
 Контактное окисление оксида серы (IV) Контактирование: 2 SO 2 + O 2 ↔ 2 SO 3 + Q Особенности реакции: l обратимая, l экзотермическая, l каталитическая реакция, l протекает с уменьшением объёма газа
Контактное окисление оксида серы (IV) Контактирование: 2 SO 2 + O 2 ↔ 2 SO 3 + Q Особенности реакции: l обратимая, l экзотермическая, l каталитическая реакция, l протекает с уменьшением объёма газа
 Выбор условий проведения контактирования Принцип Ле-Шателье 1. увеличение О 2 в обжиговом газе (+ воздух) l SO 2 – 7% l O 2 – 11% l N 2 - 82%
Выбор условий проведения контактирования Принцип Ле-Шателье 1. увеличение О 2 в обжиговом газе (+ воздух) l SO 2 – 7% l O 2 – 11% l N 2 - 82%
 Выбор условий проведения контактирования l Снижение температуры – 400 °С l Увеличение давления – не применяется l Применение катализаторов (контактных масс) БАВ Тзаж = 400 -500 о. С (носитель аморфный кремнезем Si. O 2) l Температура зажигания - минимальная температура, при которой катализатор имеет активность, достаточную для автотермической работы в промышленных условиях при экзотермических реакциях.
Выбор условий проведения контактирования l Снижение температуры – 400 °С l Увеличение давления – не применяется l Применение катализаторов (контактных масс) БАВ Тзаж = 400 -500 о. С (носитель аморфный кремнезем Si. O 2) l Температура зажигания - минимальная температура, при которой катализатор имеет активность, достаточную для автотермической работы в промышленных условиях при экзотермических реакциях.
 Контактные массы - БАВ: барий, алюминий, ванадий l Носитель - аморфный кремнезём (Si. O 2) с развитой поверхностью, гранулы диаметром 5 -12 мм l Оксид ванадия V 2 O 5, l Активаторы: сульфаты калия, бария и алюминия V 2 O 5∙ 12 Si. O 2∙ 0, 5 Al 2 O 3∙ 2 K 2 O∙ 3 Ba. O∙n. KCl Перед эксплуатацией при высокой температуре насыщают SO 2 (активируют)
Контактные массы - БАВ: барий, алюминий, ванадий l Носитель - аморфный кремнезём (Si. O 2) с развитой поверхностью, гранулы диаметром 5 -12 мм l Оксид ванадия V 2 O 5, l Активаторы: сульфаты калия, бария и алюминия V 2 O 5∙ 12 Si. O 2∙ 0, 5 Al 2 O 3∙ 2 K 2 O∙ 3 Ba. O∙n. KCl Перед эксплуатацией при высокой температуре насыщают SO 2 (активируют)
 Каталитическое действие оксида ванадия 1. Адсорбция SO 2 на поверхности и окисление до SO 3 V 2 O 5 + SO 2 = V 2 O 4 + SO 3 (Топт 400 о. С) 2. Десорбция SO 3 3. Окисление V 2 O 4 (катализатор – переносчик кислорода) V 2 O 4 + O 2 = V 2 O 5 Противоречие: окисление (1) нужно проводить при более низкой температуре, что приводит к снижению скорости реакции. Контактирование проводят в несколько стадий с оптимально подобранными условиями
Каталитическое действие оксида ванадия 1. Адсорбция SO 2 на поверхности и окисление до SO 3 V 2 O 5 + SO 2 = V 2 O 4 + SO 3 (Топт 400 о. С) 2. Десорбция SO 3 3. Окисление V 2 O 4 (катализатор – переносчик кислорода) V 2 O 4 + O 2 = V 2 O 5 Противоречие: окисление (1) нужно проводить при более низкой температуре, что приводит к снижению скорости реакции. Контактирование проводят в несколько стадий с оптимально подобранными условиями
 Контактный узел 1 - наружный кожухотрубный теплообменник (а - кожух, б - трубные решётки, в - трубы); 2 -4 - промежуточные теплообменники; 5 -8 газовые задвижки. Иллюстрация принципа автотермичности и принципа противотока
Контактный узел 1 - наружный кожухотрубный теплообменник (а - кожух, б - трубные решётки, в - трубы); 2 -4 - промежуточные теплообменники; 5 -8 газовые задвижки. Иллюстрация принципа автотермичности и принципа противотока
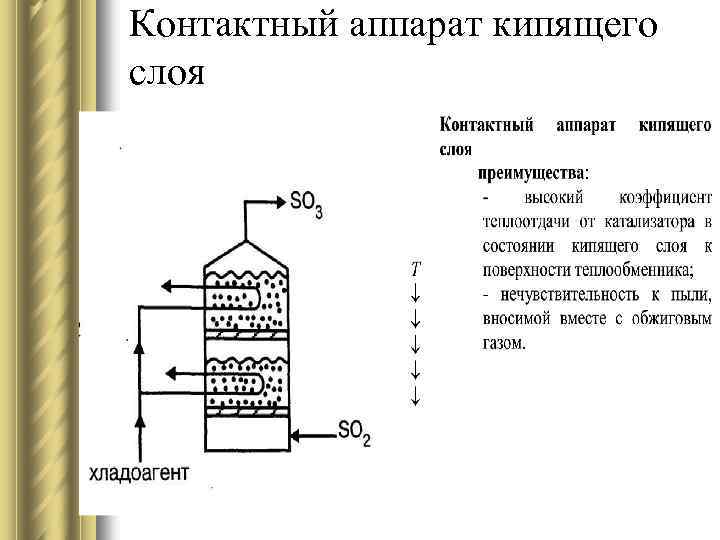 Контактный аппарат кипящего слоя
Контактный аппарат кипящего слоя
 Поглощение (абсорбция) оксида серы (VI) n. SO 2 + H 2 O ↔ H 2 SO 4 + (n-1) SO 3 + Q - Обратимая - Экзотермичная Продукты l при n > 1, олеум; l при n = 1, моногидрат (100%-ная серная кислота, в технике 98. 8 %); l при n < 1, разбавленная серная кислота
Поглощение (абсорбция) оксида серы (VI) n. SO 2 + H 2 O ↔ H 2 SO 4 + (n-1) SO 3 + Q - Обратимая - Экзотермичная Продукты l при n > 1, олеум; l при n = 1, моногидрат (100%-ная серная кислота, в технике 98. 8 %); l при n < 1, разбавленная серная кислота
 Условия проведения процесса абсорбции l Поглощающая жидкость должна иметь минимальное давление паров воды и SO 3 над поверхностью. Применяют 98, 3% H 2 SO 4 а) Использование серной кислоты более низкой концентрации приводит к интенсивному образованию тумана. б) Применение 100%-ной серной кислоты или олеума приводит к снижению степени абсорбции. l абсорбция оксида серы (VI) – сильно экзотермичная реакция а) газ и абсорбент охлаждают до 80ºС; б) используют аппараты с большим абсорбционным объёмом; в) процесс абсорбции ведут в две стадии.
Условия проведения процесса абсорбции l Поглощающая жидкость должна иметь минимальное давление паров воды и SO 3 над поверхностью. Применяют 98, 3% H 2 SO 4 а) Использование серной кислоты более низкой концентрации приводит к интенсивному образованию тумана. б) Применение 100%-ной серной кислоты или олеума приводит к снижению степени абсорбции. l абсорбция оксида серы (VI) – сильно экзотермичная реакция а) газ и абсорбент охлаждают до 80ºС; б) используют аппараты с большим абсорбционным объёмом; в) процесс абсорбции ведут в две стадии.
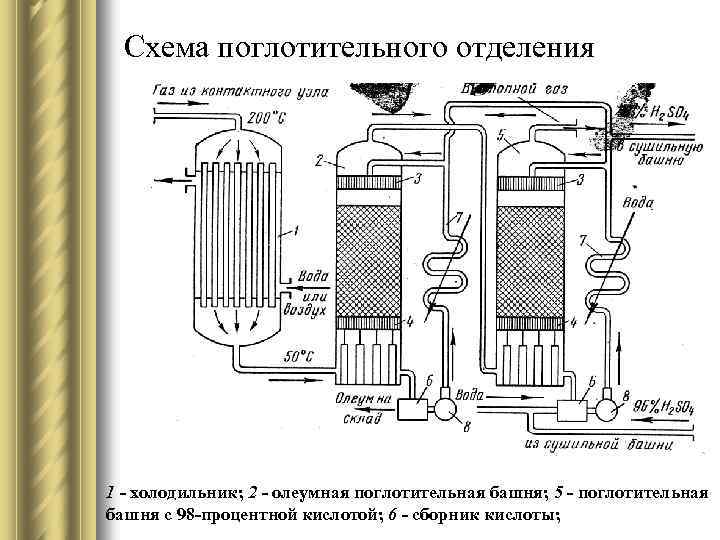 Схема поглотительного отделения 1 - холодильник; 2 - олеумная поглотительная башня; 5 - поглотительная башня с 98 -процентной кислотой; 6 - сборник кислоты;
Схема поглотительного отделения 1 - холодильник; 2 - олеумная поглотительная башня; 5 - поглотительная башня с 98 -процентной кислотой; 6 - сборник кислоты;
 Получение серной кислоты из серы – короткая схема l Плавление серы l сжигание серы в избыточном токе воздуха, l охлаждение газа SO 2, l контактирование, l адсорбция SO 3
Получение серной кислоты из серы – короткая схема l Плавление серы l сжигание серы в избыточном токе воздуха, l охлаждение газа SO 2, l контактирование, l адсорбция SO 3
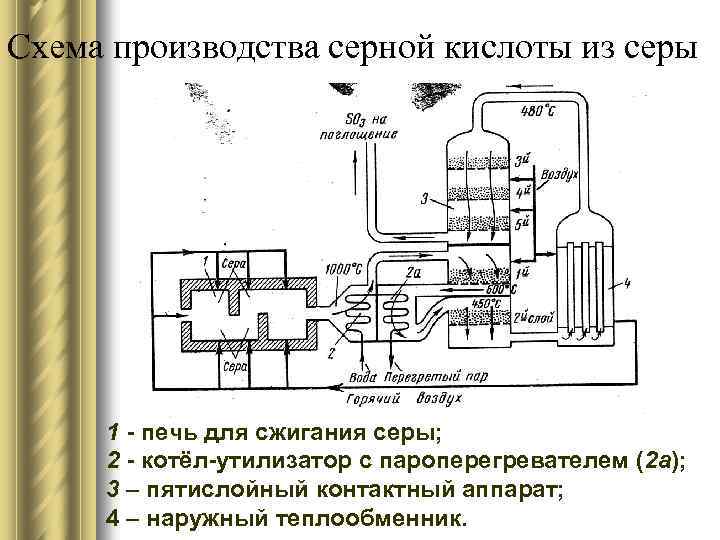 Схема производства серной кислоты из серы 1 - печь для сжигания серы; 2 - котёл-утилизатор с пароперегревателем (2 а); 3 – пятислойный контактный аппарат; 4 – наружный теплообменник.
Схема производства серной кислоты из серы 1 - печь для сжигания серы; 2 - котёл-утилизатор с пароперегревателем (2 а); 3 – пятислойный контактный аппарат; 4 – наружный теплообменник.
 Отличия от метода получения из колчедана l особая конструкция печей для получения обжигового газа; l повышенное содержание оксида серы в обжиговом газе; l отсутствие стадии предварительной очистки обжигового газа.
Отличия от метода получения из колчедана l особая конструкция печей для получения обжигового газа; l повышенное содержание оксида серы в обжиговом газе; l отсутствие стадии предварительной очистки обжигового газа.
 Горение серы 1 стадия – испарение серы Sтв. → Sжидк. → Sпар 2 стадия – горение (гомогенная экзотермическая реакция) S 2 + 2 O 2 = 2 SO 2 + Q Состав обжигового газа зависит от соотношения S и О 2
Горение серы 1 стадия – испарение серы Sтв. → Sжидк. → Sпар 2 стадия – горение (гомогенная экзотермическая реакция) S 2 + 2 O 2 = 2 SO 2 + Q Состав обжигового газа зависит от соотношения S и О 2
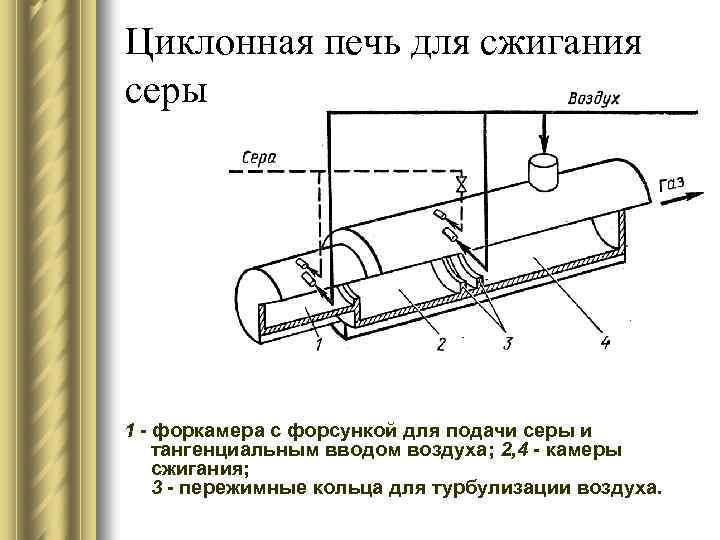 Циклонная печь для сжигания серы 1 - форкамера с форсункой для подачи серы и тангенциальным вводом воздуха; 2, 4 - камеры сжигания; 3 - пережимные кольца для турбулизации воздуха.
Циклонная печь для сжигания серы 1 - форкамера с форсункой для подачи серы и тангенциальным вводом воздуха; 2, 4 - камеры сжигания; 3 - пережимные кольца для турбулизации воздуха.
 СОВЕРШЕНСТВОВАНИЕ СЕРНОКИСЛОТНОГО ПРОИЗВОДСТВА l l l l Расширение сырьевой базы Повышение единичной мощности установок Интенсификация процесса обжига сырья путем использования кислорода или воздуха, обогащенного кислородом Применение новых катализаторов с повышенной активностью и низкой температурой зажигания Повышение концентрации SO 3 в печном газе, подаваемом на контактирование. Внедрение реакторов кипящего слоя на стадиях обжига сырья и контактирования Использование тепловых эффектов химических реакций на всех стадиях производства, в том числе для выработки технологического пара. Создание энерготехнологических схем, в которых комбинируются технологические (получение серной кислоты) и энергетические (выработка электроэнергии) процессы переработки одного и того же сырья.
СОВЕРШЕНСТВОВАНИЕ СЕРНОКИСЛОТНОГО ПРОИЗВОДСТВА l l l l Расширение сырьевой базы Повышение единичной мощности установок Интенсификация процесса обжига сырья путем использования кислорода или воздуха, обогащенного кислородом Применение новых катализаторов с повышенной активностью и низкой температурой зажигания Повышение концентрации SO 3 в печном газе, подаваемом на контактирование. Внедрение реакторов кипящего слоя на стадиях обжига сырья и контактирования Использование тепловых эффектов химических реакций на всех стадиях производства, в том числе для выработки технологического пара. Создание энерготехнологических схем, в которых комбинируются технологические (получение серной кислоты) и энергетические (выработка электроэнергии) процессы переработки одного и того же сырья.


