серная кислота1.ppt
- Количество слайдов: 23
 Производство серной кислоты 1 ЗАО СТК "ЦЕОСИТ"
Производство серной кислоты 1 ЗАО СТК "ЦЕОСИТ"
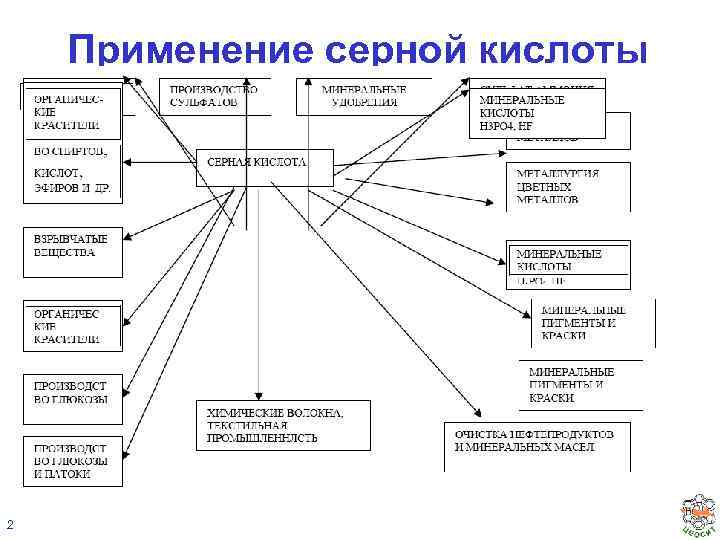 Применение серной кислоты 2
Применение серной кислоты 2
 Технологические свойства серной кислоты • • 3 Н 2 SО 4*(n-1) SО 3 Эти гидраты и соединения с оксидом серы имеют различные температуры кристаллизации и образуют ряд эвтектик. Некоторые из этих эвтектик имеют температуру кристаллизации ниже нуля или близкие к нулю. Эти особенности растворов серной кислоты учитываются при выборе еетоварных сортов, которые по условиям производства и хранения должны иметь низкую температуру кристаллизации. Для транспортировки, применения серной кислоты большое значение имеет изменение температуры плавления и температуры ее кипения в зависимости от концентрации. При возрастании концентрации от 0% Н 2 SО 4 до 64. 35% SО 3(своб) последовательно образуется шесть гидратов, являющихся индивидуальными химическими соединениями, которые взаимно нерастворимы в твердом виде. В области концентраций SО 3 от 64. 36% до 100% при кристаллизации образуются твердые растворы. В зимнее время при низких температурах нельзя производить и применять кислоту с концентрацией, близкой к чистому SО 3; 2 SО 3 * Н 2 О; SО 3 *Н 2 О, так как из этих растворов могут выпадать кристаллы, которые забъют кислотопроводы между цехами, хранилища, насосы. Все товарные сорта серной кислоты имеют концентрации, близкие к эвтектическим смесям. Олеум Н 2 SО 4 * (m – 1) Н 2 О моногидрат водная кислота При m = n =1 это моногидрат, при m >n – водные растворы, при m
Технологические свойства серной кислоты • • 3 Н 2 SО 4*(n-1) SО 3 Эти гидраты и соединения с оксидом серы имеют различные температуры кристаллизации и образуют ряд эвтектик. Некоторые из этих эвтектик имеют температуру кристаллизации ниже нуля или близкие к нулю. Эти особенности растворов серной кислоты учитываются при выборе еетоварных сортов, которые по условиям производства и хранения должны иметь низкую температуру кристаллизации. Для транспортировки, применения серной кислоты большое значение имеет изменение температуры плавления и температуры ее кипения в зависимости от концентрации. При возрастании концентрации от 0% Н 2 SО 4 до 64. 35% SО 3(своб) последовательно образуется шесть гидратов, являющихся индивидуальными химическими соединениями, которые взаимно нерастворимы в твердом виде. В области концентраций SО 3 от 64. 36% до 100% при кристаллизации образуются твердые растворы. В зимнее время при низких температурах нельзя производить и применять кислоту с концентрацией, близкой к чистому SО 3; 2 SО 3 * Н 2 О; SО 3 *Н 2 О, так как из этих растворов могут выпадать кристаллы, которые забъют кислотопроводы между цехами, хранилища, насосы. Все товарные сорта серной кислоты имеют концентрации, близкие к эвтектическим смесям. Олеум Н 2 SО 4 * (m – 1) Н 2 О моногидрат водная кислота При m = n =1 это моногидрат, при m >n – водные растворы, при m
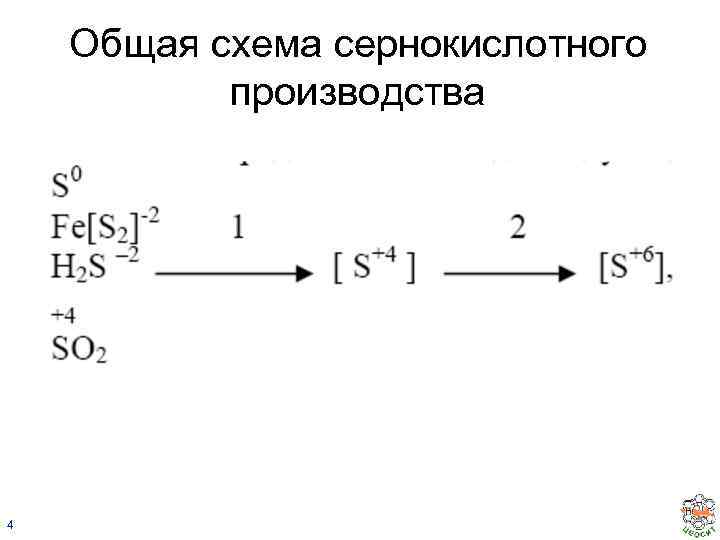 Общая схема сернокислотного производства 4
Общая схема сернокислотного производства 4
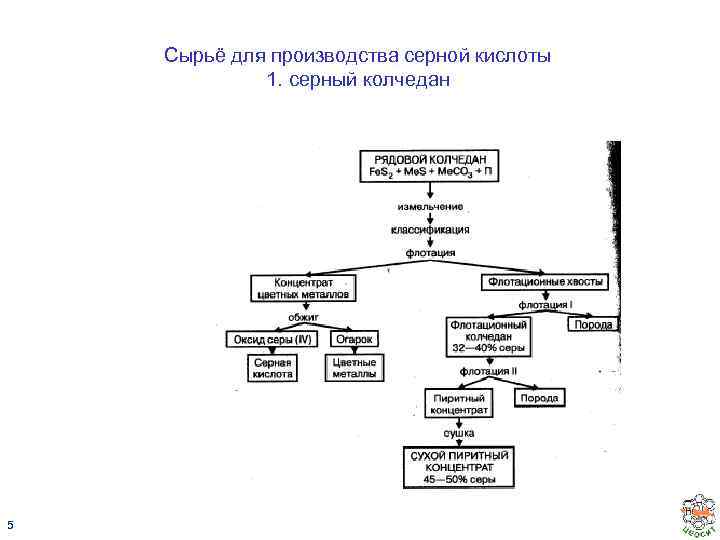 Сырьё для производства серной кислоты 1. серный колчедан 5
Сырьё для производства серной кислоты 1. серный колчедан 5
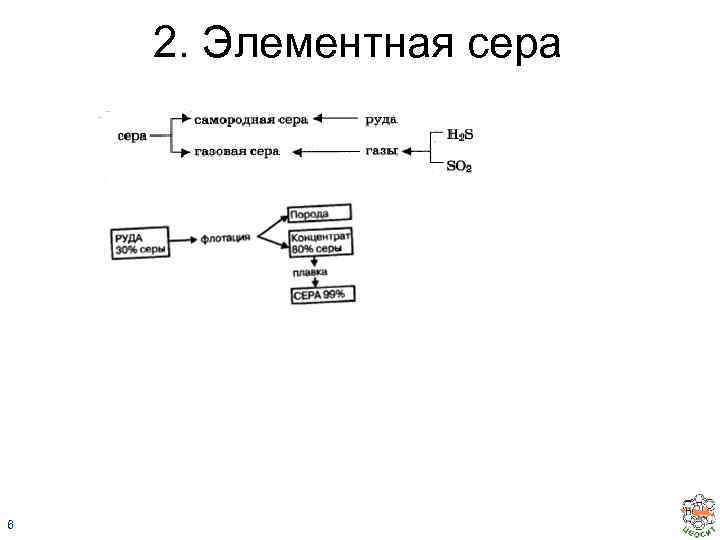 2. Элементная сера 6
2. Элементная сера 6
 3. сероводород 7
3. сероводород 7
 Основные товарные сорта серной кислоты • • : 1. Контактная кислота 92, 5 % H 2 SO 4 2. башенная 75% 3. олеум 30% свободной трехокиси серы в моногидрате • 4. аккомуляторная и реактивная 92, 5%, но с минимальным содержанием вредных примесей. 8
Основные товарные сорта серной кислоты • • : 1. Контактная кислота 92, 5 % H 2 SO 4 2. башенная 75% 3. олеум 30% свободной трехокиси серы в моногидрате • 4. аккомуляторная и реактивная 92, 5%, но с минимальным содержанием вредных примесей. 8
 9
9
 Нитрозный способ получения Реакцию окисления двуокиси серы ускоряют окислы азота, которые выступают переносчиками кислорода. Упрощенно процесс можно выразить схемой: • 1. SO 2 + NO 2 → SO 3 + NO + Q 1 • 2. 2 NO + O 2 ↔ 2 NO 2 + Q 2. 10
Нитрозный способ получения Реакцию окисления двуокиси серы ускоряют окислы азота, которые выступают переносчиками кислорода. Упрощенно процесс можно выразить схемой: • 1. SO 2 + NO 2 → SO 3 + NO + Q 1 • 2. 2 NO + O 2 ↔ 2 NO 2 + Q 2. 10
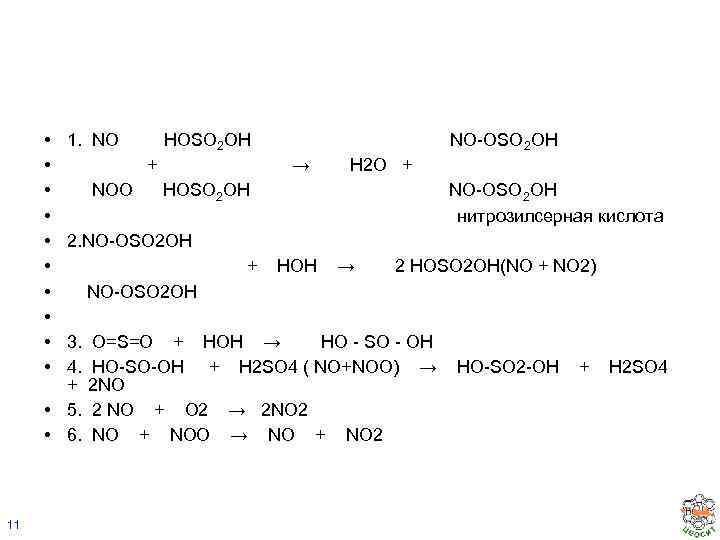 • • • 1. NO + NOO NO-OSO 2 OH → H 2 O + HOSO 2 OH NO-OSO 2 OH нитрозилсерная кислота 2. NO-OSO 2 OH 3. 4. + • 5. • 6. 11 HOSO 2 OH + HOH → 2 HOSO 2 OH(NO + NO 2) NO-OSO 2 OH O=S=O + HOH → HO - SO - OH HO-SO-OH + H 2 SO 4 ( NO+NOO) → 2 NO 2 NO + O 2 → 2 NO 2 NO + NOO → NO + NO 2 HO-SO 2 -OH + H 2 SO 4
• • • 1. NO + NOO NO-OSO 2 OH → H 2 O + HOSO 2 OH NO-OSO 2 OH нитрозилсерная кислота 2. NO-OSO 2 OH 3. 4. + • 5. • 6. 11 HOSO 2 OH + HOH → 2 HOSO 2 OH(NO + NO 2) NO-OSO 2 OH O=S=O + HOH → HO - SO - OH HO-SO-OH + H 2 SO 4 ( NO+NOO) → 2 NO 2 NO + O 2 → 2 NO 2 NO + NOO → NO + NO 2 HO-SO 2 -OH + H 2 SO 4
 12
12
 кинетика 13
кинетика 13
 14
14
 Термодинамика качественно Задача термодинамики – сдвинуть равновесие системы направо, в сторону образования продукта реакции – серного ангидрида. На качественном уровне влияние условий проведения реакции на равновесие определяется принципом Ле-Шателье. • Если на систему, находящуюся в равновесии, оказывается внешнее воздействие, то в системе происходят процессы, уменьшающие это внешнее воздействие. • Равновесие направо смещают: 1. Отвод тепла – Q → + Q Понижение температуры, которое связано с отводом тепла: -Т→+Т 2. В результате реакции объем газов уменьшается вдвое. При проведении реакции в замкнутом объеме реактора Vр = Const. Это равнозначно уменьшению давления в системе. Поэтому повышение давления смещает равновесие направо: + P → - P 3. Теоретически можно было бы взять избыток азота или водорода против стехиометрии. Но так как у нас нет источника для получения отдельно азота и водорода, а сразу при конверсии метана получается азотоводородная смесь, приходится соотношение реагентов поддерживать строго стехиометрическим 15
Термодинамика качественно Задача термодинамики – сдвинуть равновесие системы направо, в сторону образования продукта реакции – серного ангидрида. На качественном уровне влияние условий проведения реакции на равновесие определяется принципом Ле-Шателье. • Если на систему, находящуюся в равновесии, оказывается внешнее воздействие, то в системе происходят процессы, уменьшающие это внешнее воздействие. • Равновесие направо смещают: 1. Отвод тепла – Q → + Q Понижение температуры, которое связано с отводом тепла: -Т→+Т 2. В результате реакции объем газов уменьшается вдвое. При проведении реакции в замкнутом объеме реактора Vр = Const. Это равнозначно уменьшению давления в системе. Поэтому повышение давления смещает равновесие направо: + P → - P 3. Теоретически можно было бы взять избыток азота или водорода против стехиометрии. Но так как у нас нет источника для получения отдельно азота и водорода, а сразу при конверсии метана получается азотоводородная смесь, приходится соотношение реагентов поддерживать строго стехиометрическим 15
 Термодинамика количественно • Из изобары Вант-Гоффа в интегральной форме • По термодинамической системе присвоения знаков для экзотермической реакции ∆H отрицательно, поэтому выражение константы равновесия принимает вид: • Отсюда: 1. С понижением температуры константа равновесия увеличивается, т. е. равновесие смещается направо. 2. Отвод тепла, связанного с температурой, также смещает равновесие направо. 3. Концентрационyю зависимость константы равновесия можно представить уравнением: • • При t=const, Kp =Const. • 1 С увеличением аммиака увеличивается. • 2 С повышением общего давления в системе равновесная мольная доля аммиака увеличивается в квадрате. Поэтому рекцию проводят при давлении около 30 МПа • 16 т. е. с увеличением чистоты азото-водородной смеси равновесная доля
Термодинамика количественно • Из изобары Вант-Гоффа в интегральной форме • По термодинамической системе присвоения знаков для экзотермической реакции ∆H отрицательно, поэтому выражение константы равновесия принимает вид: • Отсюда: 1. С понижением температуры константа равновесия увеличивается, т. е. равновесие смещается направо. 2. Отвод тепла, связанного с температурой, также смещает равновесие направо. 3. Концентрационyю зависимость константы равновесия можно представить уравнением: • • При t=const, Kp =Const. • 1 С увеличением аммиака увеличивается. • 2 С повышением общего давления в системе равновесная мольная доля аммиака увеличивается в квадрате. Поэтому рекцию проводят при давлении около 30 МПа • 16 т. е. с увеличением чистоты азото-водородной смеси равновесная доля
 кинетика В отсуствие катализатора формальное уравнение скорости реакции выражается: Суммарный порядок по реагентам n = 1 + 3 = 4. Реакции 4 -го порядка мало вероятны, кроме того очень высокой является энергия активации реакции. Поэтому в отсутствие катализатора реакция не протекает. В присутствии промышленного железного катализатора снижается суммарный порядок по реагентам до полуторного и энергия активации снижается до Е = 39, 6 ккал/моль или 165 к. Дж/моль. • • , • где: k 1 k -константа скорости каталитической реакции, • X N 2 –мольная доля азота в смеси, • X H 2 - мольная доля водорода в смеси, • Po - общее давление в смеси, • F- удельная поверхность катализатора. 17
кинетика В отсуствие катализатора формальное уравнение скорости реакции выражается: Суммарный порядок по реагентам n = 1 + 3 = 4. Реакции 4 -го порядка мало вероятны, кроме того очень высокой является энергия активации реакции. Поэтому в отсутствие катализатора реакция не протекает. В присутствии промышленного железного катализатора снижается суммарный порядок по реагентам до полуторного и энергия активации снижается до Е = 39, 6 ккал/моль или 165 к. Дж/моль. • • , • где: k 1 k -константа скорости каталитической реакции, • X N 2 –мольная доля азота в смеси, • X H 2 - мольная доля водорода в смеси, • Po - общее давление в смеси, • F- удельная поверхность катализатора. 17
 катализаторы Катализатор ГИАП 18
катализаторы Катализатор ГИАП 18
 • Катализатор получают при добавке в расплав Fe 3 O 4 при температуре 1500 град. Цельсия промоторов Al 2 O 3 и K 2 O. • Al 2 O 3 - предохраняет от спекания Fe 2 O 3 и Fe O. • K 2 O– дезактивирует кислотные центры Al 2 O 3 и облегчает десорбцию NH 3 с катализатора. При реакции с азота с водородом окислы железа восстанавливаются до металлического состояния. Таким образом, синтез аммиака происходит на поверхности металлического железа. • Катализатор применяют в виде гранул размером от 2 до 10 мм, и удельной поверхностью Sуд = 10 – 20 м 2 / г. • Катализатор отравляется влагой и CO. Поэтому азото-водородную смесь очищают от паров воды и оксида углерода. 19
• Катализатор получают при добавке в расплав Fe 3 O 4 при температуре 1500 град. Цельсия промоторов Al 2 O 3 и K 2 O. • Al 2 O 3 - предохраняет от спекания Fe 2 O 3 и Fe O. • K 2 O– дезактивирует кислотные центры Al 2 O 3 и облегчает десорбцию NH 3 с катализатора. При реакции с азота с водородом окислы железа восстанавливаются до металлического состояния. Таким образом, синтез аммиака происходит на поверхности металлического железа. • Катализатор применяют в виде гранул размером от 2 до 10 мм, и удельной поверхностью Sуд = 10 – 20 м 2 / г. • Катализатор отравляется влагой и CO. Поэтому азото-водородную смесь очищают от паров воды и оксида углерода. 19
 • • Из кинетического уравнения видно, что увеличения скорости реакции можно добиться : • С увеличением общего давления в реакторе Po скорость реакции увеличивается в степени 1, 5. Увеличением мольных долей азота и водорода за счет тщательной очистки азото – водородной смеси от углекислоты щелочью или содой. Увеличением константы скорости реакции : • • – С увеличением температуры логарифм константы скорости увеличивается, а следовательно константа скорости увеличивается в еще большей степени. – С понижением энергии активации Ек константа скорости существенно увеличивается. Понижение энергии активации достигается применением катализатора. • 20 В уравнении скорости реакции в знаменателе дроби присутствует мольная доля аммиака. Это говорит о том, что аммиак сильнее адсорбируется на катализаторе по сравнению с исходными азотом и водородом, поэтому уменьшает скорость химической реакции.
• • Из кинетического уравнения видно, что увеличения скорости реакции можно добиться : • С увеличением общего давления в реакторе Po скорость реакции увеличивается в степени 1, 5. Увеличением мольных долей азота и водорода за счет тщательной очистки азото – водородной смеси от углекислоты щелочью или содой. Увеличением константы скорости реакции : • • – С увеличением температуры логарифм константы скорости увеличивается, а следовательно константа скорости увеличивается в еще большей степени. – С понижением энергии активации Ек константа скорости существенно увеличивается. Понижение энергии активации достигается применением катализатора. • 20 В уравнении скорости реакции в знаменателе дроби присутствует мольная доля аммиака. Это говорит о том, что аммиак сильнее адсорбируется на катализаторе по сравнению с исходными азотом и водородом, поэтому уменьшает скорость химической реакции.
 Выбор условий проведения реакции • Противоречие требований термодинамики и кинетики Температура выбирается из требований кинетики. Для повышения константы скорости до приемлимых значений необходимо повысить температуру до 420 град. С. При этом равновесие смещается налево и равновесная степень превращения ограничивается значением Xp=15% • Повышение давления способствует сдвигу равновесия в сторону образования аммиака и увеличению скорости реакции. Поэтому реакцию проводят при максимально возможном высоком давлении P=300 -600 Атмосфер. Величина давления ограничивается только техническими возможностями. Выше 600 ат. резко возрастает цена аппарата. • Увеличение чистоты азото-водородной смеси выгодно как с точки зрения термодинамики , так и кинетики. Поэтому смесь тщательно очищают от CO 2 щелочью или содой. • Катализатор применяют для увеличения скорости реакции. Является чисто кинетическим фактором воздействия на реакцию. 21
Выбор условий проведения реакции • Противоречие требований термодинамики и кинетики Температура выбирается из требований кинетики. Для повышения константы скорости до приемлимых значений необходимо повысить температуру до 420 град. С. При этом равновесие смещается налево и равновесная степень превращения ограничивается значением Xp=15% • Повышение давления способствует сдвигу равновесия в сторону образования аммиака и увеличению скорости реакции. Поэтому реакцию проводят при максимально возможном высоком давлении P=300 -600 Атмосфер. Величина давления ограничивается только техническими возможностями. Выше 600 ат. резко возрастает цена аппарата. • Увеличение чистоты азото-водородной смеси выгодно как с точки зрения термодинамики , так и кинетики. Поэтому смесь тщательно очищают от CO 2 щелочью или содой. • Катализатор применяют для увеличения скорости реакции. Является чисто кинетическим фактором воздействия на реакцию. 21
 Технологические приемы • • 22 Степень превращения азото-водородной смеси за один проход через ректор ограничивается равновесием и составляет 15 -20%. Поэтому применяется возврат азото-водородной смеси после выделения полученного аммиака. Реакция идет с выделением тепла, тепловой эффект 14, 2 ккал/моль или 60 к. Дж/моль. Поэтому требуется применение реакционного устройства с отводом тепла. В слой катализатора помещаются двойные трубки, играющие роль теплообменников. По трубкам проходит холодный синтез-газ, на нагрев которого расходуется тепло реакции.
Технологические приемы • • 22 Степень превращения азото-водородной смеси за один проход через ректор ограничивается равновесием и составляет 15 -20%. Поэтому применяется возврат азото-водородной смеси после выделения полученного аммиака. Реакция идет с выделением тепла, тепловой эффект 14, 2 ккал/моль или 60 к. Дж/моль. Поэтому требуется применение реакционного устройства с отводом тепла. В слой катализатора помещаются двойные трубки, играющие роль теплообменников. По трубкам проходит холодный синтез-газ, на нагрев которого расходуется тепло реакции.
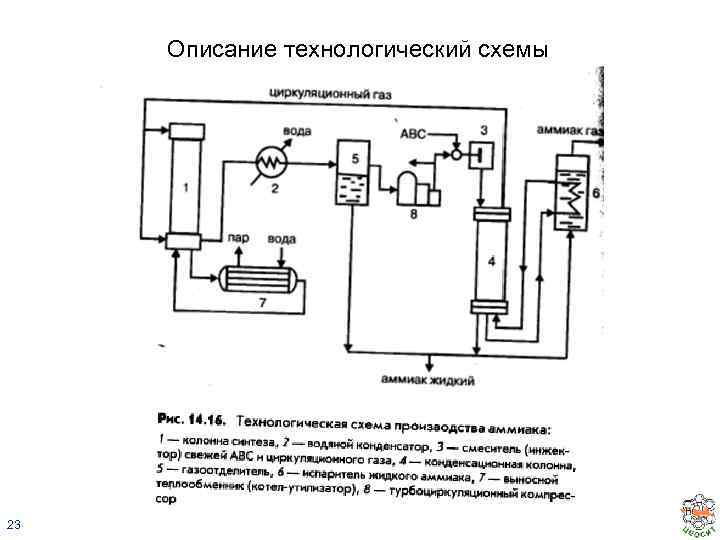 Описание технологический схемы 23
Описание технологический схемы 23


