ХТ5-СВЯЗЫВАНИЕ АЗОТА.ppt
- Количество слайдов: 41
 Производство неорганических веществ СВЯЗЫВАНИЕ АЗОТА: СИНТЕЗ АММИМАКА 1. Промышленные методы связывания азота 2. Сырьё. Производство азото-водородной смеси (АВС) 3. Физико-химические основы процесса синтеза аммиака 4. Технологическое оформление процесса синтеза аммиака
Производство неорганических веществ СВЯЗЫВАНИЕ АЗОТА: СИНТЕЗ АММИМАКА 1. Промышленные методы связывания азота 2. Сырьё. Производство азото-водородной смеси (АВС) 3. Физико-химические основы процесса синтеза аммиака 4. Технологическое оформление процесса синтеза аммиака
 Применение производных азота Полиурентаны Полиамиды Полиакрилонитрил Карбонат аммония Утропин Холодильная техника Гербициды Нитраты и нитриты Гидразин Мочевиноформальдегидные смолы Нитролаки Аммиак 150 млн. т Колоксилин Циануровая кислота Карбамид Азотная кислота 100 млн. т ~700 млн. т Меламин Тротил Жидкие удобрения Аммиачная селитра Пироксилин Аммониты Аммофос Сульфат аммония Нитрофоска Нитробензол
Применение производных азота Полиурентаны Полиамиды Полиакрилонитрил Карбонат аммония Утропин Холодильная техника Гербициды Нитраты и нитриты Гидразин Мочевиноформальдегидные смолы Нитролаки Аммиак 150 млн. т Колоксилин Циануровая кислота Карбамид Азотная кислота 100 млн. т ~700 млн. т Меламин Тротил Жидкие удобрения Аммиачная селитра Пироксилин Аммониты Аммофос Сульфат аммония Нитрофоска Нитробензол
 Промышленные методы связывания азота • Дуговой метод • Цианамидный метод • Аммиачный метод
Промышленные методы связывания азота • Дуговой метод • Цианамидный метод • Аммиачный метод
 Электродуговой метод Реакция азота с кислородом в дуге: N 2+O 2 ↔ 2 NO ΔH 298= - 179, 2 к. Дж/моль Температура 2000 о. С Смесь газов на выходе из печи быстро охлаждают, NO окисляют до NO 2 и поглощают водой или гашёной известью. Расход энергии 60 000 к. Вт∙ч/т Применялся в Норвегии, Германии и США, в настоящее время не применяется, ведутся работы по плазменному синтезу NO
Электродуговой метод Реакция азота с кислородом в дуге: N 2+O 2 ↔ 2 NO ΔH 298= - 179, 2 к. Дж/моль Температура 2000 о. С Смесь газов на выходе из печи быстро охлаждают, NO окисляют до NO 2 и поглощают водой или гашёной известью. Расход энергии 60 000 к. Вт∙ч/т Применялся в Норвегии, Германии и США, в настоящее время не применяется, ведутся работы по плазменному синтезу NO
 Цианамидный метод Взаимодействие азота с карбидом кальция при высоких температурах: Ca. C 2+N 2 ↔ Ca. CN 2 + C ΔH 298= + 301, 5 к. Дж/моль Технология получения цианамида кальция сводится к пропусканию струи азота над нагреваемым до температуры 1000°С карбидом кальция. Далее цианамид кальция используется как удобрение или подвергается гидролизу при обработке водяным паром с образованием аммиака и Ca. CO 3. Расход энергии ~10 000 к. Вт∙ч/т В настоящее время применяется исключительно для производства цианамида для удобрений.
Цианамидный метод Взаимодействие азота с карбидом кальция при высоких температурах: Ca. C 2+N 2 ↔ Ca. CN 2 + C ΔH 298= + 301, 5 к. Дж/моль Технология получения цианамида кальция сводится к пропусканию струи азота над нагреваемым до температуры 1000°С карбидом кальция. Далее цианамид кальция используется как удобрение или подвергается гидролизу при обработке водяным паром с образованием аммиака и Ca. CO 3. Расход энергии ~10 000 к. Вт∙ч/т В настоящее время применяется исключительно для производства цианамида для удобрений.
 Аммиачный метод Взаимодействие азота с водородом: N 2+3 H 2 ↔ 2 NH 3 ΔH 298= - 91, 96 к. Дж/моль Сырьё для синтеза аммиака – смесь азота и водорода 1: 3. Источник азота – воздух. Расход энергии 3200 к. Вт∙ч/т Основной метод связывания азота. Разработан Ф. Габером в университете Карлсруэ (патент 1908 года). Пилотная установка была построена Робером Россиньолем (1909 г. ), патент куплен К. Бошем в 1910 году для промышденного применения (процесс Габера-Боша). биофиксация атмосферного азота микрорганизмами: для ассимиляции 1 молекулы азота требуется не менее 12 молекул АТФ, что эквивалентно 5000 к. Вт∙ч/т аммиака – для использования 1 мг азота анаэробным микроорганизмам требуется около 500 мг сахарозы.
Аммиачный метод Взаимодействие азота с водородом: N 2+3 H 2 ↔ 2 NH 3 ΔH 298= - 91, 96 к. Дж/моль Сырьё для синтеза аммиака – смесь азота и водорода 1: 3. Источник азота – воздух. Расход энергии 3200 к. Вт∙ч/т Основной метод связывания азота. Разработан Ф. Габером в университете Карлсруэ (патент 1908 года). Пилотная установка была построена Робером Россиньолем (1909 г. ), патент куплен К. Бошем в 1910 году для промышденного применения (процесс Габера-Боша). биофиксация атмосферного азота микрорганизмами: для ассимиляции 1 молекулы азота требуется не менее 12 молекул АТФ, что эквивалентно 5000 к. Вт∙ч/т аммиака – для использования 1 мг азота анаэробным микроорганизмам требуется около 500 мг сахарозы.
 Сырьё. Производство азото-водородной смеси (АВС) Сырьё: азот и водород Получение азота: 1. Дробная конденсация воздуха 2. Совместное получение с водородом при конверсии с водяным паром различных видов топлива или СО (угарный газ) сырьевая база азотной промышленности в основном определяется вторым видом сырья - топливом, применяемым для получения водорода или водородсодержащего газа.
Сырьё. Производство азото-водородной смеси (АВС) Сырьё: азот и водород Получение азота: 1. Дробная конденсация воздуха 2. Совместное получение с водородом при конверсии с водяным паром различных видов топлива или СО (угарный газ) сырьевая база азотной промышленности в основном определяется вторым видом сырья - топливом, применяемым для получения водорода или водородсодержащего газа.
 Сырьё. Производство азото-водородной смеси (АВС) Получение водорода: 1. Конверсия СО с водяным паром 2. Крекинг метана 3. Конверсия природного или попутного газа 4. Разделение коксового газа 5. Электролиз воды или раствора Na. Cl 6. Железо-паровой способ В настоящее время в основном используется метод 3, реже 1 и 4. Во всех способах, кроме 5, попутно с водородом получают азот, т. е. производится готовая азото-водородная смесь
Сырьё. Производство азото-водородной смеси (АВС) Получение водорода: 1. Конверсия СО с водяным паром 2. Крекинг метана 3. Конверсия природного или попутного газа 4. Разделение коксового газа 5. Электролиз воды или раствора Na. Cl 6. Железо-паровой способ В настоящее время в основном используется метод 3, реже 1 и 4. Во всех способах, кроме 5, попутно с водородом получают азот, т. е. производится готовая азото-водородная смесь
 Сырьё. Производство азото-водородной смеси (АВС) Конверсия СО с водяным паром CO+H 2 O ↔ CO 2+H 2 ΔH 298= - 36, 6 к. Дж/моль Источники СО: Генераторный (воздушный) газ - может быть получен при взаимодействии углерода с кислородом воздуха по экзотермической реакции 2 С + 02 ↔ 2 СО состав: СО 34, 5 %; N 2 65, 5 % Водяной газ - продукт взаимодействия углерода с водяным паром по эндотермической реакции С + Н 2 Опар ↔ 2 СО + Н 2, состав: СО 50, 0 %; Н 2 50, 0 % Полуводяной газ - получают на паровоздушном дутье, обеспечивая одновременное протекание реакций, состав: СО 40, 1 %; Н 2 18, 1 %; N 2 41, 8 %, газ требует очистки от серы с помощью смеси гидрата окиси железа, извести и опилок (регенерируется продувкой кислородом) мышьяково-содового раствора – Na 4 As 2 S 5 O 2+H 2 S= Na 4 As 2 S 6 O+H 2 O (регенерируется продувкой воздухом с выделением элементарной серы) растворов моно-, ди- и триэтаноламина (регенерируются повышением температуры свыше 100 о. С с выделением сероводорода))
Сырьё. Производство азото-водородной смеси (АВС) Конверсия СО с водяным паром CO+H 2 O ↔ CO 2+H 2 ΔH 298= - 36, 6 к. Дж/моль Источники СО: Генераторный (воздушный) газ - может быть получен при взаимодействии углерода с кислородом воздуха по экзотермической реакции 2 С + 02 ↔ 2 СО состав: СО 34, 5 %; N 2 65, 5 % Водяной газ - продукт взаимодействия углерода с водяным паром по эндотермической реакции С + Н 2 Опар ↔ 2 СО + Н 2, состав: СО 50, 0 %; Н 2 50, 0 % Полуводяной газ - получают на паровоздушном дутье, обеспечивая одновременное протекание реакций, состав: СО 40, 1 %; Н 2 18, 1 %; N 2 41, 8 %, газ требует очистки от серы с помощью смеси гидрата окиси железа, извести и опилок (регенерируется продувкой кислородом) мышьяково-содового раствора – Na 4 As 2 S 5 O 2+H 2 S= Na 4 As 2 S 6 O+H 2 O (регенерируется продувкой воздухом с выделением элементарной серы) растворов моно-, ди- и триэтаноламина (регенерируются повышением температуры свыше 100 о. С с выделением сероводорода))
 Сырьё. Производство азото-водородной смеси (АВС) Конверсия СО с водяным паром CO+H 2 O ↔ CO 2+H 2 ΔH 298= - 36, 6 к. Дж/моль Повышение давления увеличивает скорость не меняя равновесия, повышение содержания воды сдвигает равновесие вправо, повышение температуры – влево, однако при низких температурах реакция идёт с малой скоростью. Катализаторы: Железо-хромовый c добавлением оксидов алюминия, калия и кальция, температура зажигания 450 о. С, остаточное содержание СО 2 -4% Цинк-хромово-медный, температура зажигания 200 о. С, остаточное содержание СО 0, 2 -0, 4%. ЧУВСТВИТЕЛЕН К СОДЕРЖАНИЮ СЕРЫ.
Сырьё. Производство азото-водородной смеси (АВС) Конверсия СО с водяным паром CO+H 2 O ↔ CO 2+H 2 ΔH 298= - 36, 6 к. Дж/моль Повышение давления увеличивает скорость не меняя равновесия, повышение содержания воды сдвигает равновесие вправо, повышение температуры – влево, однако при низких температурах реакция идёт с малой скоростью. Катализаторы: Железо-хромовый c добавлением оксидов алюминия, калия и кальция, температура зажигания 450 о. С, остаточное содержание СО 2 -4% Цинк-хромово-медный, температура зажигания 200 о. С, остаточное содержание СО 0, 2 -0, 4%. ЧУВСТВИТЕЛЕН К СОДЕРЖАНИЮ СЕРЫ.
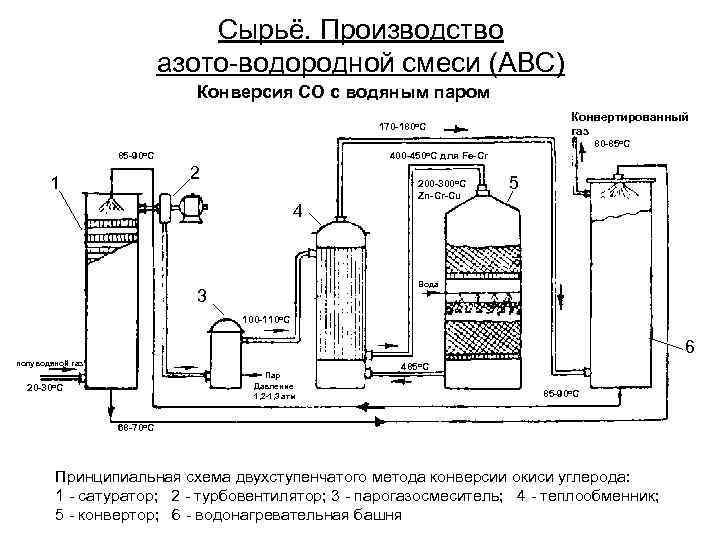 Сырьё. Производство азото-водородной смеси (АВС) Конверсия СО с водяным паром Конвертированный газ 170 -180 о. С 80 -85 о. С 85 -90 о. С 400 -450 о. С для Fe-Cr 2 1 200 -300 о. С Zn-Cr-Cu 5 4 Вода 3 100 -110 о. С 6 полуводяной газ Пар Давление 1, 2 -1, 3 атм 20 -30 о. С 485 о. С 85 -90 о. С 68 -70 о. С Принципиальная схема двухступенчатого метода конверсии окиси углерода: 1 - сатуратор; 2 - турбовентилятор; 3 - парогазосмеситель; 4 - теплообменник; 5 - конвертор; 6 - водонагревательная башня
Сырьё. Производство азото-водородной смеси (АВС) Конверсия СО с водяным паром Конвертированный газ 170 -180 о. С 80 -85 о. С 85 -90 о. С 400 -450 о. С для Fe-Cr 2 1 200 -300 о. С Zn-Cr-Cu 5 4 Вода 3 100 -110 о. С 6 полуводяной газ Пар Давление 1, 2 -1, 3 атм 20 -30 о. С 485 о. С 85 -90 о. С 68 -70 о. С Принципиальная схема двухступенчатого метода конверсии окиси углерода: 1 - сатуратор; 2 - турбовентилятор; 3 - парогазосмеситель; 4 - теплообменник; 5 - конвертор; 6 - водонагревательная башня
 Сырьё. Производство азото-водородной смеси (АВС) Конверсия природного или попутного газа CH 4+0, 5 O 2 ↔ CO+2 H 2; ΔH=-35, 6 к. Дж CH 4+H 2 O ↔ CO+3 H 2; ΔH=+206, 4 к. Дж CH 4+CO 2 ↔ 2 CO+2 H 2; ΔH=+248, 3 к. Дж Получаемая СО далее реагирует с водяным паром CO+H 2 O ↔ CO 2+H 2
Сырьё. Производство азото-водородной смеси (АВС) Конверсия природного или попутного газа CH 4+0, 5 O 2 ↔ CO+2 H 2; ΔH=-35, 6 к. Дж CH 4+H 2 O ↔ CO+3 H 2; ΔH=+206, 4 к. Дж CH 4+CO 2 ↔ 2 CO+2 H 2; ΔH=+248, 3 к. Дж Получаемая СО далее реагирует с водяным паром CO+H 2 O ↔ CO 2+H 2
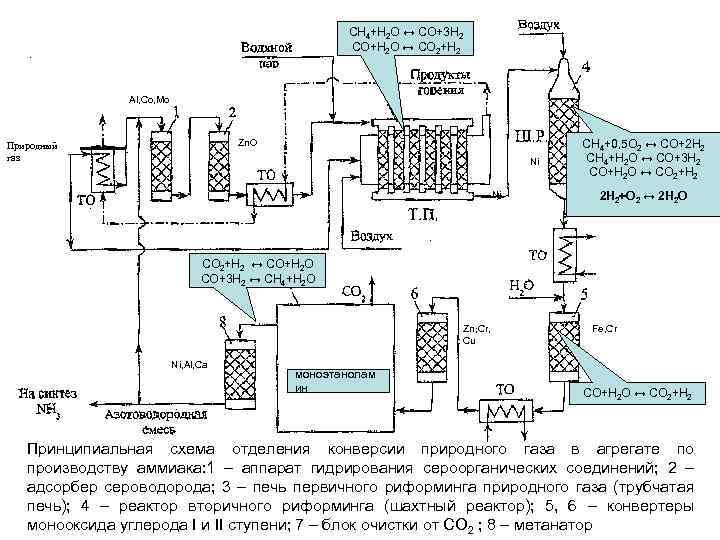 CH 4+H 2 O ↔ CO+3 H 2 CO+H 2 O ↔ CO 2+H 2 Al, Co, Mo Zn. O Природный газ Ni Ni CH 4+0, 5 O 2 ↔ CO+2 H 2 CH 4+H 2 O ↔ CO+3 H 2 CO+H 2 O ↔ CO 2+H 2 2 Н 2+О 2 ↔ 2 Н 2 О CO 2+H 2 ↔ CO+H 2 O CO+3 H 2 ↔ CH 4+H 2 O Zn, Cr, Cu Ni, Al, Ca моноэтанолам ин Fe, Cr CO+H 2 O ↔ CO 2+H 2 Принципиальная схема отделения конверсии природного газа в агрегате по производству аммиака: 1 – аппарат гидрирования сероорганических соединений; 2 – адсорбер сероводорода; 3 – печь первичного риформинга природного газа (трубчатая печь); 4 – реактор вторичного риформинга (шахтный реактор); 5, 6 – конвертеры монооксида углерода I и II ступени; 7 – блок очистки от СО 2 ; 8 – метанатор
CH 4+H 2 O ↔ CO+3 H 2 CO+H 2 O ↔ CO 2+H 2 Al, Co, Mo Zn. O Природный газ Ni Ni CH 4+0, 5 O 2 ↔ CO+2 H 2 CH 4+H 2 O ↔ CO+3 H 2 CO+H 2 O ↔ CO 2+H 2 2 Н 2+О 2 ↔ 2 Н 2 О CO 2+H 2 ↔ CO+H 2 O CO+3 H 2 ↔ CH 4+H 2 O Zn, Cr, Cu Ni, Al, Ca моноэтанолам ин Fe, Cr CO+H 2 O ↔ CO 2+H 2 Принципиальная схема отделения конверсии природного газа в агрегате по производству аммиака: 1 – аппарат гидрирования сероорганических соединений; 2 – адсорбер сероводорода; 3 – печь первичного риформинга природного газа (трубчатая печь); 4 – реактор вторичного риформинга (шахтный реактор); 5, 6 – конвертеры монооксида углерода I и II ступени; 7 – блок очистки от СО 2 ; 8 – метанатор
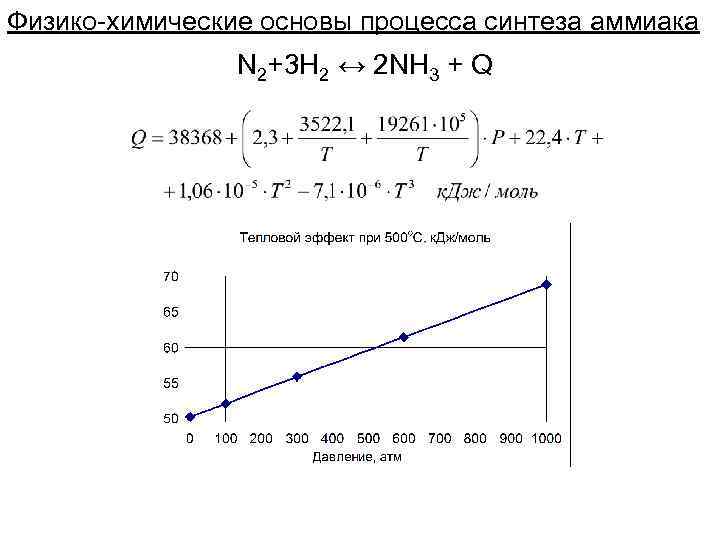 Физико-химические основы процесса синтеза аммиака N 2+3 H 2 ↔ 2 NH 3 + Q
Физико-химические основы процесса синтеза аммиака N 2+3 H 2 ↔ 2 NH 3 + Q
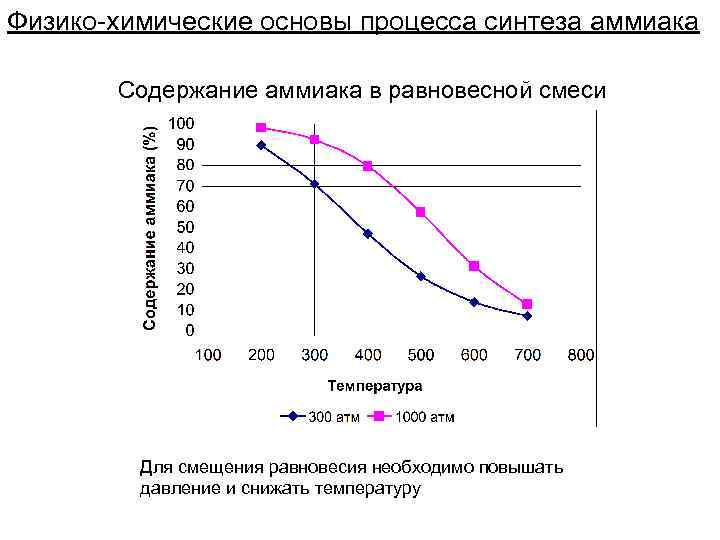 Физико-химические основы процесса синтеза аммиака Содержание аммиака в равновесной смеси Для смещения равновесия необходимо повышать давление и снижать температуру
Физико-химические основы процесса синтеза аммиака Содержание аммиака в равновесной смеси Для смещения равновесия необходимо повышать давление и снижать температуру
 Физико-химические основы процесса синтеза аммиака Из-за инертности азота синтез аммиака без катализатора идёт медленно Катализаторы: Fe, Pt, Os, Re, Mn, Zn, W, U, Rh Наиболее активные катализаторы: Fe, Os, Re, U Наиболее распространённые: Fe c промоторами (Al 2 О 3, К 2 О, Ca. O) Каталитические яды: соединения серы – необратимо соединения кислорода - обратимо Синтез аммиака на катализаторе – типичный гетерогенный процесс. Стадии: 1. Диффузия азота и водорода из объёма к поверхности катализатора 2. Химическая адсорбция газов 3. ДИССОЦИАЦИЯ молекул (лимитирующая стадия) 4. Взаимодействие азота и водорода на поверхности катализатора 5. Десорбция аммиака Выход аммиака зависит от температуры, давления, времени контактирования, состава смеси, активности катализатора, конструкционных особенностей
Физико-химические основы процесса синтеза аммиака Из-за инертности азота синтез аммиака без катализатора идёт медленно Катализаторы: Fe, Pt, Os, Re, Mn, Zn, W, U, Rh Наиболее активные катализаторы: Fe, Os, Re, U Наиболее распространённые: Fe c промоторами (Al 2 О 3, К 2 О, Ca. O) Каталитические яды: соединения серы – необратимо соединения кислорода - обратимо Синтез аммиака на катализаторе – типичный гетерогенный процесс. Стадии: 1. Диффузия азота и водорода из объёма к поверхности катализатора 2. Химическая адсорбция газов 3. ДИССОЦИАЦИЯ молекул (лимитирующая стадия) 4. Взаимодействие азота и водорода на поверхности катализатора 5. Десорбция аммиака Выход аммиака зависит от температуры, давления, времени контактирования, состава смеси, активности катализатора, конструкционных особенностей
 Стадии синтеза аммиака на поверхности железного катализатора: а – адсорбция; б – диссоциация с образованием радикалов; в, г, д – присоединение атомов водорода к атому азота; е – отделение молекулы аммиака от поверхности катализатора
Стадии синтеза аммиака на поверхности железного катализатора: а – адсорбция; б – диссоциация с образованием радикалов; в, г, д – присоединение атомов водорода к атому азота; е – отделение молекулы аммиака от поверхности катализатора
 Химические волны на поверхности катализатора Нобелевская премия по химии 1918 года (Ф. Габер за открытие синтеза). Нобелевская премия по химии 1931 года (К. Бош за заслуги по введению и развитию методов высокого давления в химии) Нобелевская премия по химии 2007 года (Г. Эртль - за изучение химических процессов на поверхностях твёрдых тел - детально исследовал молекулярный механизм каталитического синтеза аммиака на железе)
Химические волны на поверхности катализатора Нобелевская премия по химии 1918 года (Ф. Габер за открытие синтеза). Нобелевская премия по химии 1931 года (К. Бош за заслуги по введению и развитию методов высокого давления в химии) Нобелевская премия по химии 2007 года (Г. Эртль - за изучение химических процессов на поверхностях твёрдых тел - детально исследовал молекулярный механизм каталитического синтеза аммиака на железе)
 Физико-химические основы процесса синтеза аммиака Скорость процесса (уравнение Тёмкина) Содержание аммиака на выходе из аппарата
Физико-химические основы процесса синтеза аммиака Скорость процесса (уравнение Тёмкина) Содержание аммиака на выходе из аппарата
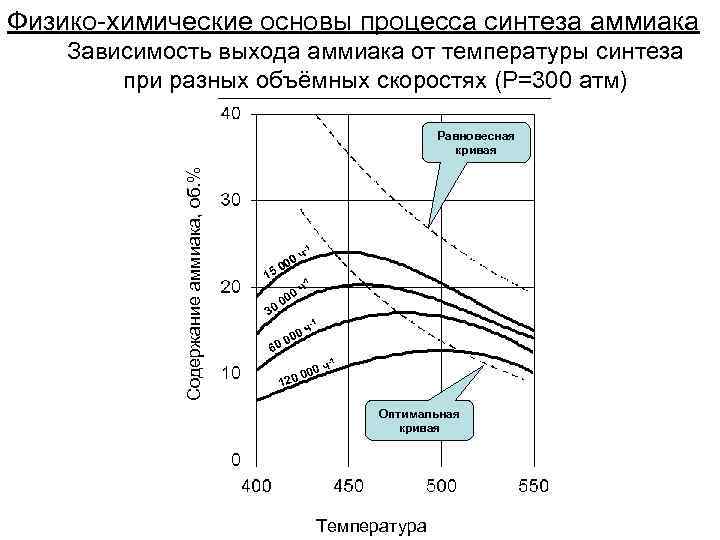 Физико-химические основы процесса синтеза аммиака Зависимость выхода аммиака от температуры синтеза при разных объёмных скоростях (Р=300 атм) Содержание аммиака, об. % Равновесная кривая -1 15 30 0 ч 00 -1 0 ч 00 0 6 -1 120 ч 000 Оптимальная кривая Температура
Физико-химические основы процесса синтеза аммиака Зависимость выхода аммиака от температуры синтеза при разных объёмных скоростях (Р=300 атм) Содержание аммиака, об. % Равновесная кривая -1 15 30 0 ч 00 -1 0 ч 00 0 6 -1 120 ч 000 Оптимальная кривая Температура
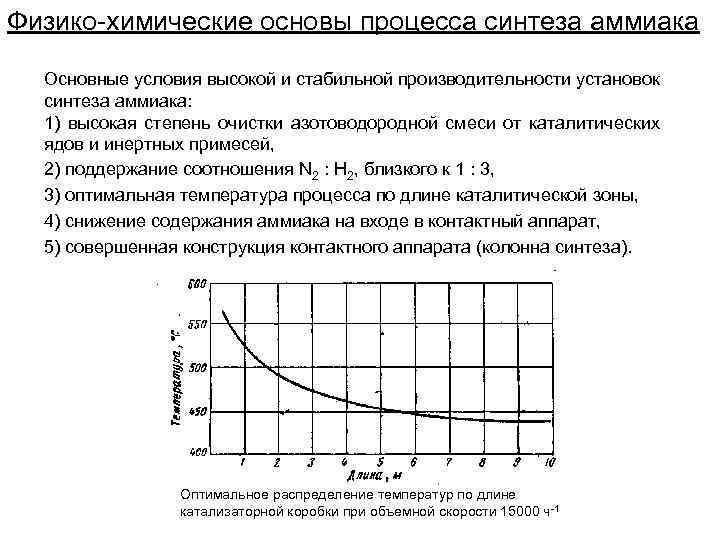 Физико-химические основы процесса синтеза аммиака Основные условия высокой и стабильной производительности установок синтеза аммиака: 1) высокая степень очистки азотоводородной смеси от каталитических ядов и инертных примесей, 2) поддержание соотношения N 2 : Н 2, близкого к 1 : 3, 3) оптимальная температура процесса по длине каталитической зоны, 4) снижение содержания аммиака на входе в контактный аппарат, 5) совершенная конструкция контактного аппарата (колонна синтеза). Оптимальное распределение температур по длине катализаторной коробки при объемной скорости 15000 ч-1
Физико-химические основы процесса синтеза аммиака Основные условия высокой и стабильной производительности установок синтеза аммиака: 1) высокая степень очистки азотоводородной смеси от каталитических ядов и инертных примесей, 2) поддержание соотношения N 2 : Н 2, близкого к 1 : 3, 3) оптимальная температура процесса по длине каталитической зоны, 4) снижение содержания аммиака на входе в контактный аппарат, 5) совершенная конструкция контактного аппарата (колонна синтеза). Оптимальное распределение температур по длине катализаторной коробки при объемной скорости 15000 ч-1
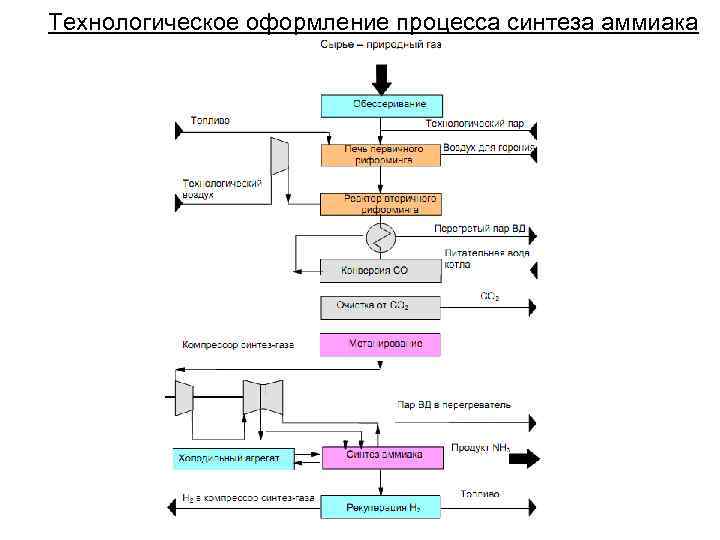 Технологическое оформление процесса синтеза аммиака
Технологическое оформление процесса синтеза аммиака
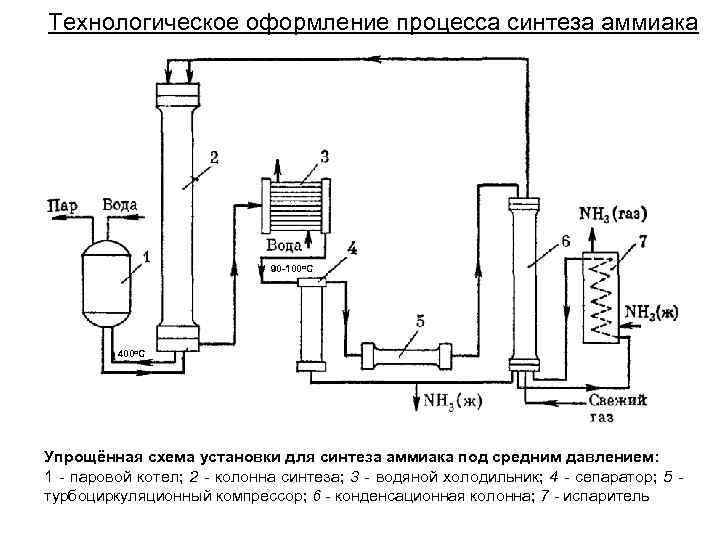 Технологическое оформление процесса синтеза аммиака 90 -100 о. С 400 о. С Упрощённая схема установки для синтеза аммиака под средним давлением: 1 - паровой котел; 2 - колонна синтеза; 3 - водяной холодильник; 4 - сепаратор; 5 турбоциркуляционный компрессор; 6 - конденсационная колонна; 7 - испаритель
Технологическое оформление процесса синтеза аммиака 90 -100 о. С 400 о. С Упрощённая схема установки для синтеза аммиака под средним давлением: 1 - паровой котел; 2 - колонна синтеза; 3 - водяной холодильник; 4 - сепаратор; 5 турбоциркуляционный компрессор; 6 - конденсационная колонна; 7 - испаритель
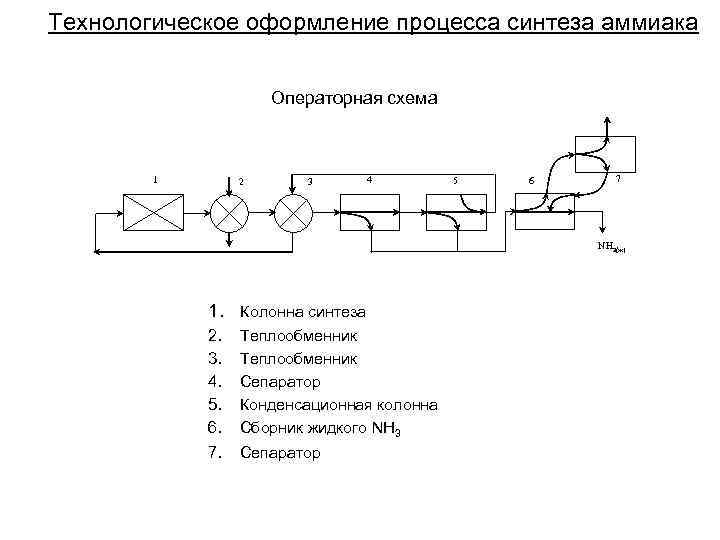 Технологическое оформление процесса синтеза аммиака Операторная схема 1 2 3 4 5 6 7 NH 3(ж) 1. Колонна синтеза 2. 3. 4. 5. 6. Теплообменник Сепаратор Конденсационная колонна Сборник жидкого NH 3 7. Сепаратор
Технологическое оформление процесса синтеза аммиака Операторная схема 1 2 3 4 5 6 7 NH 3(ж) 1. Колонна синтеза 2. 3. 4. 5. 6. Теплообменник Сепаратор Конденсационная колонна Сборник жидкого NH 3 7. Сепаратор
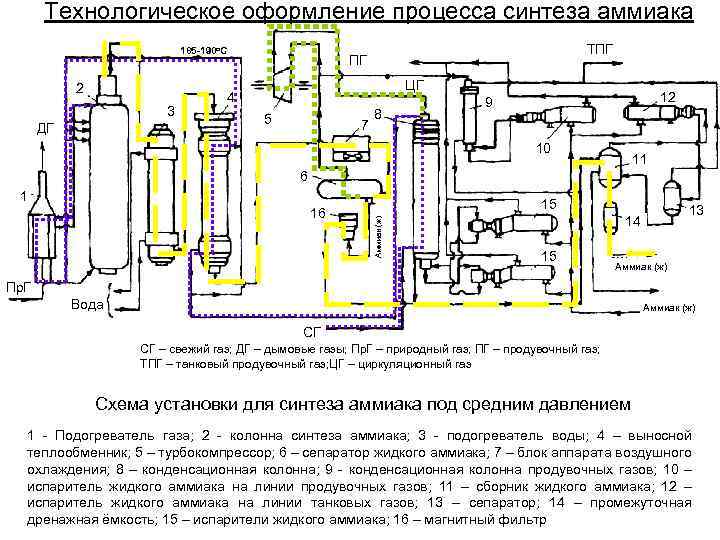 Технологическое оформление процесса синтеза аммиака 185 -190 о. С 2 3 ДГ ТПГ ПГ ЦГ 4 5 7 8 12 9 10 11 6 1 15 Аммиак (ж) 16 13 14 15 Аммиак (ж) Пр. Г Вода Аммиак (ж) СГ СГ – свежий газ; ДГ – дымовые газы; Пр. Г – природный газ; ПГ – продувочный газ; ТПГ – танковый продувочный газ; ЦГ – циркуляционный газ Схема установки для синтеза аммиака под средним давлением 1 - Подогреватель газа; 2 - колонна синтеза аммиака; 3 - подогреватель воды; 4 – выносной теплообменник; 5 – турбокомпрессор; 6 – сепаратор жидкого аммиака; 7 – блок аппарата воздушного охлаждения; 8 – конденсационная колонна; 9 - конденсационная колонна продувочных газов; 10 – испаритель жидкого аммиака на линии продувочных газов; 11 – сборник жидкого аммиака; 12 – испаритель жидкого аммиака на линии танковых газов; 13 – сепаратор; 14 – промежуточная дренажная ёмкость; 15 – испарители жидкого аммиака; 16 – магнитный фильтр
Технологическое оформление процесса синтеза аммиака 185 -190 о. С 2 3 ДГ ТПГ ПГ ЦГ 4 5 7 8 12 9 10 11 6 1 15 Аммиак (ж) 16 13 14 15 Аммиак (ж) Пр. Г Вода Аммиак (ж) СГ СГ – свежий газ; ДГ – дымовые газы; Пр. Г – природный газ; ПГ – продувочный газ; ТПГ – танковый продувочный газ; ЦГ – циркуляционный газ Схема установки для синтеза аммиака под средним давлением 1 - Подогреватель газа; 2 - колонна синтеза аммиака; 3 - подогреватель воды; 4 – выносной теплообменник; 5 – турбокомпрессор; 6 – сепаратор жидкого аммиака; 7 – блок аппарата воздушного охлаждения; 8 – конденсационная колонна; 9 - конденсационная колонна продувочных газов; 10 – испаритель жидкого аммиака на линии продувочных газов; 11 – сборник жидкого аммиака; 12 – испаритель жидкого аммиака на линии танковых газов; 13 – сепаратор; 14 – промежуточная дренажная ёмкость; 15 – испарители жидкого аммиака; 16 – магнитный фильтр
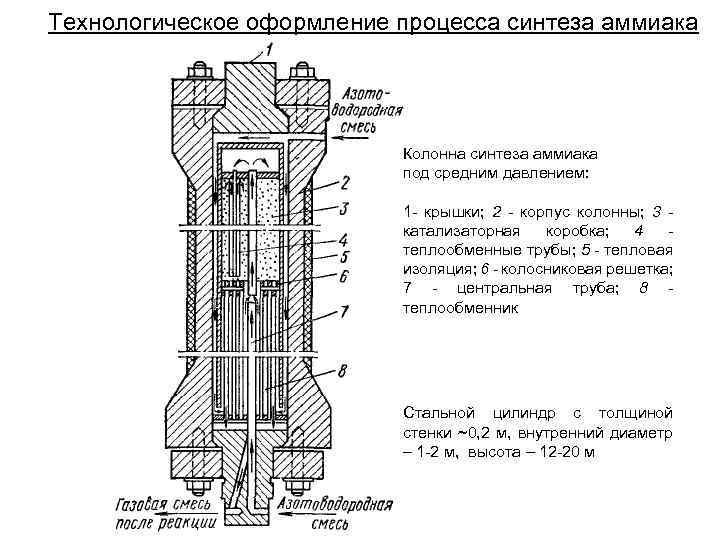 Технологическое оформление процесса синтеза аммиака Колонна синтеза аммиака под средним давлением: 1 - крышки; 2 - корпус колонны; 3 катализаторная коробка; 4 теплообменные трубы; 5 - тепловая изоляция; 6 - колосниковая решетка; 7 - центральная труба; 8 теплообменник Стальной цилиндр с толщиной стенки ~0, 2 м, внутренний диаметр – 1 -2 м, высота – 12 -20 м
Технологическое оформление процесса синтеза аммиака Колонна синтеза аммиака под средним давлением: 1 - крышки; 2 - корпус колонны; 3 катализаторная коробка; 4 теплообменные трубы; 5 - тепловая изоляция; 6 - колосниковая решетка; 7 - центральная труба; 8 теплообменник Стальной цилиндр с толщиной стенки ~0, 2 м, внутренний диаметр – 1 -2 м, высота – 12 -20 м
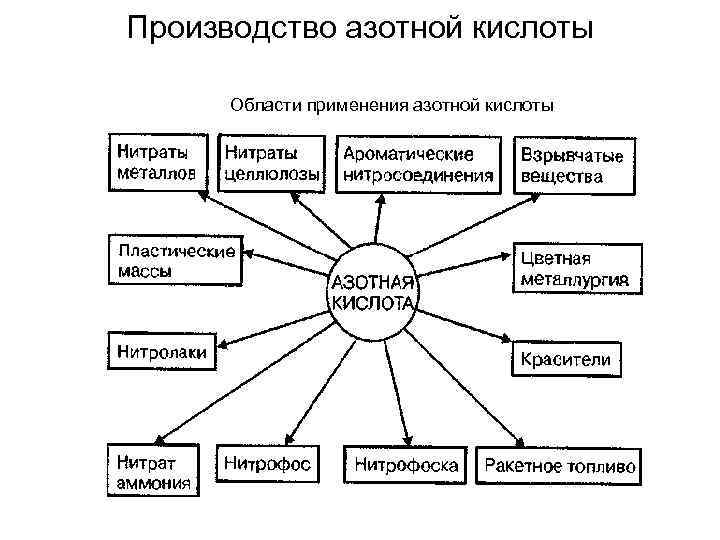 Производство азотной кислоты Области применения азотной кислоты
Производство азотной кислоты Области применения азотной кислоты
 Производство азотной кислоты Способы производства азотной кислоты: • получение разбавленной кислоты с последующим концентрированием ее в случае необходимости • непосредственное получение концентрированной кислоты. Сырьё для производства азотной кислоты: В настоящее время – только синтетический аммиак В 19 -20 веке – чилийская селитра (Na. NO 3) В начале 20 века ещё аммиак из ПКГ (1916 г. , Юзовка)
Производство азотной кислоты Способы производства азотной кислоты: • получение разбавленной кислоты с последующим концентрированием ее в случае необходимости • непосредственное получение концентрированной кислоты. Сырьё для производства азотной кислоты: В настоящее время – только синтетический аммиак В 19 -20 веке – чилийская селитра (Na. NO 3) В начале 20 века ещё аммиак из ПКГ (1916 г. , Юзовка)
 Физико-химические основы синтеза азотной кислоты из аммиака Стадии процесса: 1. Окисление аммиака до оксида азота (II) 2. Окисление оксида азота (II) до оксида азота (IV) 3. Абсорбция оксида азота (IV)
Физико-химические основы синтеза азотной кислоты из аммиака Стадии процесса: 1. Окисление аммиака до оксида азота (II) 2. Окисление оксида азота (II) до оксида азота (IV) 3. Абсорбция оксида азота (IV)
 Физико-химические основы синтеза азотной кислоты из аммиака 1. Окисление аммиака до оксида азота (II) Реакции: 4 NH 3 + 5 O 2 = 4 NO + 6 Н 2 O ΔН=-907, 3 к. Дж/моль (1) 4 NH 3 + 4 O 2 = 2 N 2 O + 6 Н 2 O ΔН = -1104, 9 к. Дж/моль (2) 4 NH 3 + 3 O 2 = 2 N 2 + 6 Н 2 O ΔН = -1269, 1 к. Дж/моль (3) а также реакция с участием образующегося оксида азота (II): 4 NH 3 + 6 NO = 5 N 2 + 6 H 2 O ΔН = -110 к. Дж/моль (4) Все реакции практически необратимы, поэтому направление процесса окисления определяется соотношением скоростей реакций 1— 4. При отсутствии катализатора окисление аммиака идет преимущественно до элементарного азота.
Физико-химические основы синтеза азотной кислоты из аммиака 1. Окисление аммиака до оксида азота (II) Реакции: 4 NH 3 + 5 O 2 = 4 NO + 6 Н 2 O ΔН=-907, 3 к. Дж/моль (1) 4 NH 3 + 4 O 2 = 2 N 2 O + 6 Н 2 O ΔН = -1104, 9 к. Дж/моль (2) 4 NH 3 + 3 O 2 = 2 N 2 + 6 Н 2 O ΔН = -1269, 1 к. Дж/моль (3) а также реакция с участием образующегося оксида азота (II): 4 NH 3 + 6 NO = 5 N 2 + 6 H 2 O ΔН = -110 к. Дж/моль (4) Все реакции практически необратимы, поэтому направление процесса окисления определяется соотношением скоростей реакций 1— 4. При отсутствии катализатора окисление аммиака идет преимущественно до элементарного азота.
 Физико-химические основы синтеза азотной кислоты из аммиака 1. Окисление аммиака до оксида азота (II) Катализатор: Pt (Pt/Rh)-сетки или таблетированная смесь оксидов Fe и Cr Каталитические яды: гидриды P, As, соединения фтора, минеральные масла, оксиды серы, сероводород, ацетилен Стадии каталитического процесса: 1. диффузия молекул аммиака и кислорода из газовой фазы к поверхности катализатора; 2. активированная адсорбция молекул кислорода на поверхности катализатора с образованием промежуточного соединения; 3. хемосорбция молекул аммиака и образование комплекса; 4. разложение комплекса с регенерацией катализатора и образованием молекул оксида азота (II) и воды; 5. диффузия продуктов реакции с поверхности катализатора в газовую фазу. каталитическое окисление аммиака на платиновом катализаторе протекает преимущественно в диффузионной области, на окисном катализаторе - в кинетической области
Физико-химические основы синтеза азотной кислоты из аммиака 1. Окисление аммиака до оксида азота (II) Катализатор: Pt (Pt/Rh)-сетки или таблетированная смесь оксидов Fe и Cr Каталитические яды: гидриды P, As, соединения фтора, минеральные масла, оксиды серы, сероводород, ацетилен Стадии каталитического процесса: 1. диффузия молекул аммиака и кислорода из газовой фазы к поверхности катализатора; 2. активированная адсорбция молекул кислорода на поверхности катализатора с образованием промежуточного соединения; 3. хемосорбция молекул аммиака и образование комплекса; 4. разложение комплекса с регенерацией катализатора и образованием молекул оксида азота (II) и воды; 5. диффузия продуктов реакции с поверхности катализатора в газовую фазу. каталитическое окисление аммиака на платиновом катализаторе протекает преимущественно в диффузионной области, на окисном катализаторе - в кинетической области
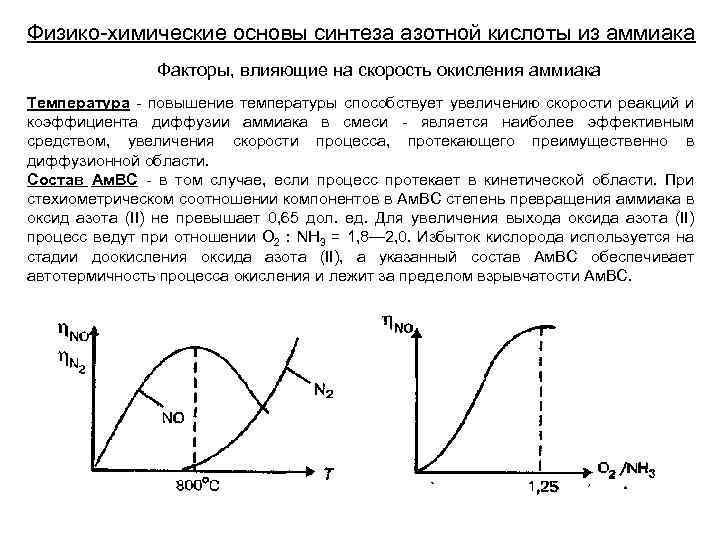 Физико-химические основы синтеза азотной кислоты из аммиака Факторы, влияющие на скорость окисления аммиака Температура - повышение температуры способствует увеличению скорости реакций и коэффициента диффузии аммиака в смеси - является наиболее эффективным средством, увеличения скорости процесса, протекающего преимущественно в диффузионной области. Состав Ам. ВС - в том случае, если процесс протекает в кинетической области. При стехиометрическом соотношении компонентов в Ам. ВС степень превращения аммиака в оксид азота (II) не превышает 0, 65 дол. ед. Для увеличения выхода оксида азота (II) процесс ведут при отношении О 2 : NH 3 = 1, 8— 2, 0. Избыток кислорода используется на стадии доокисления оксида азота (II), а указанный состав Ам. ВС обеспечивает автотермичность процесса окисления и лежит за пределом взрывчатости Ам. ВС.
Физико-химические основы синтеза азотной кислоты из аммиака Факторы, влияющие на скорость окисления аммиака Температура - повышение температуры способствует увеличению скорости реакций и коэффициента диффузии аммиака в смеси - является наиболее эффективным средством, увеличения скорости процесса, протекающего преимущественно в диффузионной области. Состав Ам. ВС - в том случае, если процесс протекает в кинетической области. При стехиометрическом соотношении компонентов в Ам. ВС степень превращения аммиака в оксид азота (II) не превышает 0, 65 дол. ед. Для увеличения выхода оксида азота (II) процесс ведут при отношении О 2 : NH 3 = 1, 8— 2, 0. Избыток кислорода используется на стадии доокисления оксида азота (II), а указанный состав Ам. ВС обеспечивает автотермичность процесса окисления и лежит за пределом взрывчатости Ам. ВС.
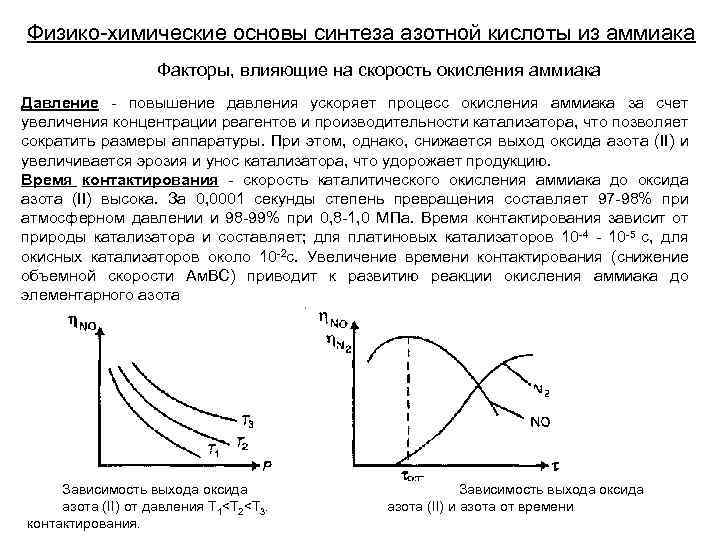 Физико-химические основы синтеза азотной кислоты из аммиака Факторы, влияющие на скорость окисления аммиака Давление - повышение давления ускоряет процесс окисления аммиака за счет увеличения концентрации реагентов и производительности катализатора, что позволяет сократить размеры аппаратуры. При этом, однако, снижается выход оксида азота (II) и увеличивается эрозия и унос катализатора, что удорожает продукцию. Время контактирования - скорость каталитического окисления аммиака до оксида азота (II) высока. За 0, 0001 секунды степень превращения составляет 97 -98% при атмосферном давлении и 98 -99% при 0, 8 -1, 0 МПа. Время контактирования зависит от природы катализатора и составляет; для платиновых катализаторов 10 -4 - 10 -5 с, для окисных катализаторов около 10 -2 с. Увеличение времени контактирования (снижение объемной скорости Ам. ВС) приводит к развитию реакции окисления аммиака до элементарного азота Зависимость выхода оксида азота (II) от давления Т 1
Физико-химические основы синтеза азотной кислоты из аммиака Факторы, влияющие на скорость окисления аммиака Давление - повышение давления ускоряет процесс окисления аммиака за счет увеличения концентрации реагентов и производительности катализатора, что позволяет сократить размеры аппаратуры. При этом, однако, снижается выход оксида азота (II) и увеличивается эрозия и унос катализатора, что удорожает продукцию. Время контактирования - скорость каталитического окисления аммиака до оксида азота (II) высока. За 0, 0001 секунды степень превращения составляет 97 -98% при атмосферном давлении и 98 -99% при 0, 8 -1, 0 МПа. Время контактирования зависит от природы катализатора и составляет; для платиновых катализаторов 10 -4 - 10 -5 с, для окисных катализаторов около 10 -2 с. Увеличение времени контактирования (снижение объемной скорости Ам. ВС) приводит к развитию реакции окисления аммиака до элементарного азота Зависимость выхода оксида азота (II) от давления Т 1
 Физико-химические основы синтеза азотной кислоты из аммиака 2. Окисление оксида азота (II) до оксида азота (IV) 2 NO + O 2 ↔ 2 NO 2 ΔН=-112, 3 к. Дж/моль Ниже 150 о. С положение равновесия сильно смещено в сторону NO 2, выше 800 о. С практически прекращается, скорость реакции уменьшается с повышением температуры Побочные реакции 2 NO 2 ↔ N 2 O 4 ΔН=-57, 0 к. Дж/моль NO + NO 2 ↔ N 2 O 3 ΔН=-40, 3 к. Дж/моль В результате окисления аммиака образуется смесь нитрозных газов: NO 2 , N 2 O 4, N 2 O 3 , NO, N 2 O, H 2 O, N 2 Состав смеси зависит от условий окисления, однако основной компонент - NO 2
Физико-химические основы синтеза азотной кислоты из аммиака 2. Окисление оксида азота (II) до оксида азота (IV) 2 NO + O 2 ↔ 2 NO 2 ΔН=-112, 3 к. Дж/моль Ниже 150 о. С положение равновесия сильно смещено в сторону NO 2, выше 800 о. С практически прекращается, скорость реакции уменьшается с повышением температуры Побочные реакции 2 NO 2 ↔ N 2 O 4 ΔН=-57, 0 к. Дж/моль NO + NO 2 ↔ N 2 O 3 ΔН=-40, 3 к. Дж/моль В результате окисления аммиака образуется смесь нитрозных газов: NO 2 , N 2 O 4, N 2 O 3 , NO, N 2 O, H 2 O, N 2 Состав смеси зависит от условий окисления, однако основной компонент - NO 2
 Физико-химические основы синтеза азотной кислоты из аммиака 3. Абсорбция оксида азота (IV) Оксиды азота, входящие в состав нитрозных газов, нерастворимы в воде, но (за исключением оксида азота (II)) взаимодействуют с ней. Поглощение водой сопровождается химической реакцией хемосорбции, протекающей в системе «газ-жидкость» : ΔН=-116 к. Дж/моль ΔН=-59 к. Дж/моль ΔН=+76 к. Дж/моль Суммарные уравнения поглощения оксидов азота водой: ΔН=-136 к. Дж/моль ΔН=-101 к. Дж/моль Скорость процесса абсорбции оксида азота (IV) водой описывается уравнением: При понижении температуры и концентрации кислоты и повышения давления степень абсорбции оксида азота (IV) водной азотной кислотой возрастает, притом тем интенсивнее, чем выше концентрация его в нитрозных газах.
Физико-химические основы синтеза азотной кислоты из аммиака 3. Абсорбция оксида азота (IV) Оксиды азота, входящие в состав нитрозных газов, нерастворимы в воде, но (за исключением оксида азота (II)) взаимодействуют с ней. Поглощение водой сопровождается химической реакцией хемосорбции, протекающей в системе «газ-жидкость» : ΔН=-116 к. Дж/моль ΔН=-59 к. Дж/моль ΔН=+76 к. Дж/моль Суммарные уравнения поглощения оксидов азота водой: ΔН=-136 к. Дж/моль ΔН=-101 к. Дж/моль Скорость процесса абсорбции оксида азота (IV) водой описывается уравнением: При понижении температуры и концентрации кислоты и повышения давления степень абсорбции оксида азота (IV) водной азотной кислотой возрастает, притом тем интенсивнее, чем выше концентрация его в нитрозных газах.
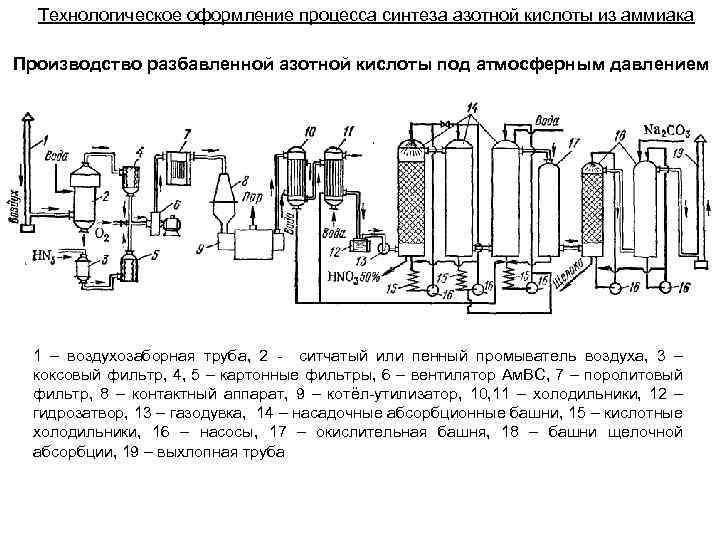 Технологическое оформление процесса синтеза азотной кислоты из аммиака Производство разбавленной азотной кислоты под атмосферным давлением 1 – воздухозаборная труба, 2 - ситчатый или пенный промыватель воздуха, 3 – коксовый фильтр, 4, 5 – картонные фильтры, 6 – вентилятор Ам. ВС, 7 – поролитовый фильтр, 8 – контактный аппарат, 9 – котёл-утилизатор, 10, 11 – холодильники, 12 – гидрозатвор, 13 – газодувка, 14 – насадочные абсорбционные башни, 15 – кислотные холодильники, 16 – насосы, 17 – окислительная башня, 18 – башни щелочной абсорбции, 19 – выхлопная труба
Технологическое оформление процесса синтеза азотной кислоты из аммиака Производство разбавленной азотной кислоты под атмосферным давлением 1 – воздухозаборная труба, 2 - ситчатый или пенный промыватель воздуха, 3 – коксовый фильтр, 4, 5 – картонные фильтры, 6 – вентилятор Ам. ВС, 7 – поролитовый фильтр, 8 – контактный аппарат, 9 – котёл-утилизатор, 10, 11 – холодильники, 12 – гидрозатвор, 13 – газодувка, 14 – насадочные абсорбционные башни, 15 – кислотные холодильники, 16 – насосы, 17 – окислительная башня, 18 – башни щелочной абсорбции, 19 – выхлопная труба
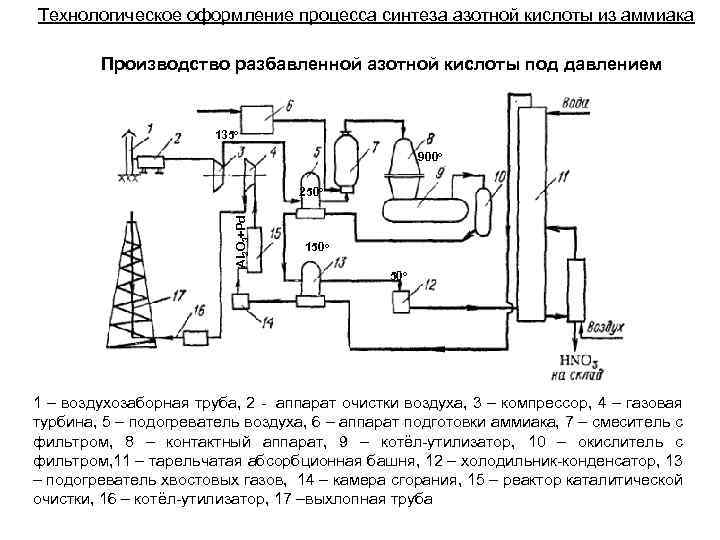 Технологическое оформление процесса синтеза азотной кислоты из аммиака Производство разбавленной азотной кислоты под давлением 135 о 900 о Al 2 O 3+Pd 250 о 150 о 1 – воздухозаборная труба, 2 - аппарат очистки воздуха, 3 – компрессор, 4 – газовая турбина, 5 – подогреватель воздуха, 6 – аппарат подготовки аммиака, 7 – смеситель с фильтром, 8 – контактный аппарат, 9 – котёл-утилизатор, 10 – окислитель с фильтром, 11 – тарельчатая абсорбционная башня, 12 – холодильник-конденсатор, 13 – подогреватель хвостовых газов, 14 – камера сгорания, 15 – реактор каталитической очистки, 16 – котёл-утилизатор, 17 –выхлопная труба
Технологическое оформление процесса синтеза азотной кислоты из аммиака Производство разбавленной азотной кислоты под давлением 135 о 900 о Al 2 O 3+Pd 250 о 150 о 1 – воздухозаборная труба, 2 - аппарат очистки воздуха, 3 – компрессор, 4 – газовая турбина, 5 – подогреватель воздуха, 6 – аппарат подготовки аммиака, 7 – смеситель с фильтром, 8 – контактный аппарат, 9 – котёл-утилизатор, 10 – окислитель с фильтром, 11 – тарельчатая абсорбционная башня, 12 – холодильник-конденсатор, 13 – подогреватель хвостовых газов, 14 – камера сгорания, 15 – реактор каталитической очистки, 16 – котёл-утилизатор, 17 –выхлопная труба
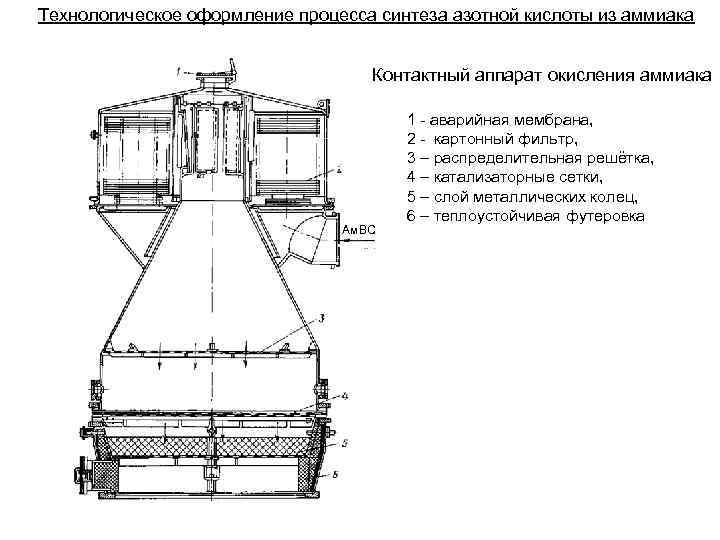 Технологическое оформление процесса синтеза азотной кислоты из аммиака Контактный аппарат окисления аммиака Ам. ВС 1 - аварийная мембрана, 2 - картонный фильтр, 3 – распределительная решётка, 4 – катализаторные сетки, 5 – слой металлических колец, 6 – теплоустойчивая футеровка
Технологическое оформление процесса синтеза азотной кислоты из аммиака Контактный аппарат окисления аммиака Ам. ВС 1 - аварийная мембрана, 2 - картонный фильтр, 3 – распределительная решётка, 4 – катализаторные сетки, 5 – слой металлических колец, 6 – теплоустойчивая футеровка
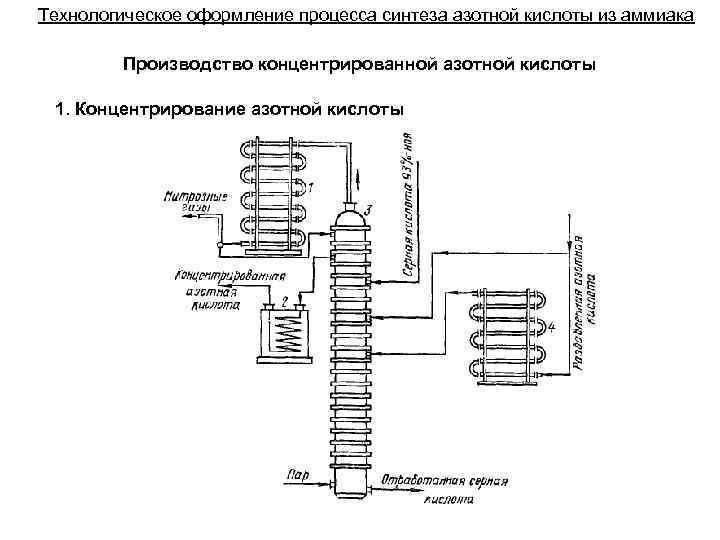 Технологическое оформление процесса синтеза азотной кислоты из аммиака Производство концентрированной азотной кислоты 1. Концентрирование азотной кислоты
Технологическое оформление процесса синтеза азотной кислоты из аммиака Производство концентрированной азотной кислоты 1. Концентрирование азотной кислоты
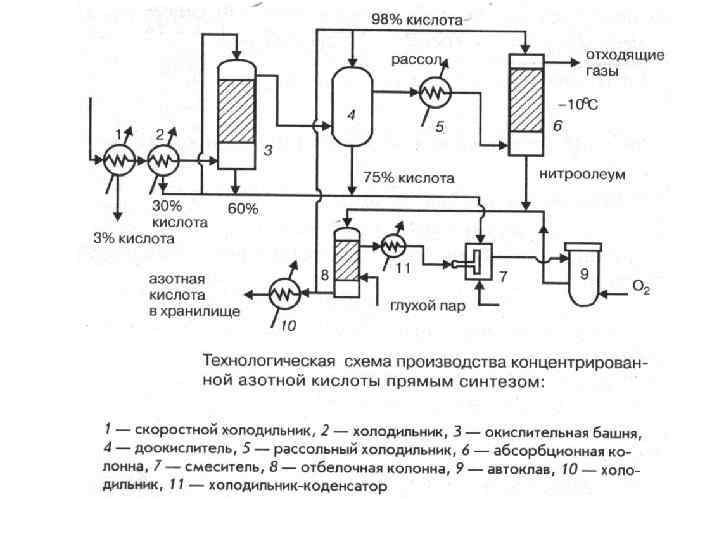
 Технологическое оформление процесса синтеза азотной кислоты из аммиака Производство концентрированной азотной кислоты 2. Прямой синтез азотной кислоты 2 N 2 O 4(ж) + 2 H 2 O(ж) + О 2 ↔ 4 HNO 3 ΔΗ=-59, 5 к. Дж/моль Проводится в автоклавах при 75 о. С под давлением 50 атм. Основная проблема – получение чистого N 2 O 4. Способы получения: 1. Конденсация при низкой температуре (-8 o. C) из нитрозных газов 2. Абсорбция концентрированной азотной кислотой (нитроолеум) Основные стадии: 1. Получение нитрозных газов 2. Отделение избытка воды 3. Окисление NO до NO 2 4. Доокисление остатков NO концентрированной азотной кислотой 5. Охлаждение газов и кислоты до -10 о. С 6. Абсорбция NO 2 концентрированной азотной кислотой (нитроолеум) 7. Десорбция NO 2 из кислоты при нагревании 8. Получение жидкой N 2 O 4 при охлаждении газа NO 2 9. Синтез азотной кислотым (концентрация 98 -99%) 10. Отгонка избыточной NO 2 при нагревании кислоты
Технологическое оформление процесса синтеза азотной кислоты из аммиака Производство концентрированной азотной кислоты 2. Прямой синтез азотной кислоты 2 N 2 O 4(ж) + 2 H 2 O(ж) + О 2 ↔ 4 HNO 3 ΔΗ=-59, 5 к. Дж/моль Проводится в автоклавах при 75 о. С под давлением 50 атм. Основная проблема – получение чистого N 2 O 4. Способы получения: 1. Конденсация при низкой температуре (-8 o. C) из нитрозных газов 2. Абсорбция концентрированной азотной кислотой (нитроолеум) Основные стадии: 1. Получение нитрозных газов 2. Отделение избытка воды 3. Окисление NO до NO 2 4. Доокисление остатков NO концентрированной азотной кислотой 5. Охлаждение газов и кислоты до -10 о. С 6. Абсорбция NO 2 концентрированной азотной кислотой (нитроолеум) 7. Десорбция NO 2 из кислоты при нагревании 8. Получение жидкой N 2 O 4 при охлаждении газа NO 2 9. Синтез азотной кислотым (концентрация 98 -99%) 10. Отгонка избыточной NO 2 при нагревании кислоты