11 - Производство комплексных удобрений.pptx
- Количество слайдов: 61

Производство комплексных удобрений

Комплексное удобрение – это удобрение с гарантированным содержанием не менее двух питательных макроэлементов Комплексные удобрения классифицируются: 1. по составу двойные: азотно-фосфорные NP (аммофос, нитрофос); азотно-калийные NK (калиевая селитра); фосфорно-калийные РК (фосфаты калия). тройные: азотно-фосфорно-калийные NPK (аммофоска, нитрофоска).

Комплексные удобрения классифицируются: 2. по способу производства Сложные удобрения получают при химическом взаимодействии исходных компонентов. В состав сложных в процессе их производства могут быть введены и микроэлементы, а также гербициды и ядохимикаты. К сложным удобрениям промышленного производства относятся калиевая селитра, аммофос, диаммофос. Смешанные удобрения - это смеси простых удобрений, получаемые в заводских условиях либо на тукосмесительных установках на местах исполь -зования удобрений путем сухого смешивания.

Комплексные удобрения классифицируются: 2. по способу производства Сложносмешанные (комбинированные) удобрения получают в едином технологическом процессе и содержат в одной грануле два или три основных элемента питания растений, хотя и в виде различных химических соединений. Они производятся путем специальной как химической, так и физической обработки первичного сырья или различных одно- и двухкомпонентных удобрений. К ним относятся: нитрофос и нитрофоска, нитроаммофос и нитроаммофоска, полифосфаты аммония и калия, карбоаммофосы, фосфорно-калийные прессованные удобрения, жидкие комплексные удобрения. Соотношение между элементами питания в этих удобрениях определяется количеством исходных материалов при их получении.

Сложные и сложно-смешанные удобрения характеризуются высокой концентрацией питательных веществ, поэтому применение таких удобрений обеспечивает значительное сокращение расходов хозяйст -ва на их транспортировку, смешивание, хранение и внесение. К числу недостатков комплексных удобрений относится то, что пропорции в содержании NPK в них варьируют в нешироких пределах. Поэтому при внесении, например, необходимого количества азота, других питательных элементов вносится меньше или больше, чем требуется. В небольшом количестве применяют и многофункциональные удобрения, содержащие, кроме основных питательных элементов, микроэлементы и биостимуляторы, оказывающие специфическое влияние на почву и растения.

Тукосмеси – это механически смешанные, совместимые между собой виды удобрений. Комбинируя их состав, можно подобрать оптимальный вариант для любых культур и регионов. 1 – нитрат аммония 2 – карбамид 3 – сульфат аммония 4 – суперфосфаты 5 – дикальцийфосфат 6 – фосфоритная мука 7 – металлургические шлаки 8 – аммофос 9 – хлорид калия 10 – сульфат калия + – допустимо заблаговременное смешение О – допустимо смешение незадолго до применения – – смешение недопустимо

Производство нитрата калия

Свойства и применение калиевой селитры Нитрат калия (калийная селитра) КNО 3 – кристаллический бесцветный порошок, плавится при 334 0 С. Выше 338 0 С разлагается на нитрит калия КNО 2 и кислород. В 100 г воды при 20 0 С растворяется 31, 5 г, при 114 0 С – 312 г КNО 3. Нитрат калия используется в производстве дымного пороха, в пиротехнике, в пищевой и стекольной промышленности. Он является ценным безбалластным удобрением, содержащим два питательных элемента – азот и калий. Другими преимуществами этого удобрения является его малая гигроскопичность и физиологическая щелочность.

Способы производства калиевой селитры Прямые способы получения калиевой селитры основаны на взаимодействии хлорида калия с азотной кислотой, жидкими или газообразными оксидами азота: KCl + HNO 3 KNO 3 + HCl 2 KCl + 4 HNO 3 = 3 KNO 3 + NOCl + Cl 2 + 2 H 2 O KCl + N 2 O 4 = KNO 3 + NOCl Способы не имеют широкого распространения, так как связаны со значительной коррозией оборудования и низким качеством готового продукта.

Способы производства калиевой селитры Получение калиевой селитры нейтрализацией калийных щелочей Вследствие необходимости затраты дорого сырья – едкого кали или поташа и азотной кислоты – этот способ осуществляют довольно редко. Для нейтрализации берется 30 – 35 % раствора КОН и 50 %-ная кислота или сухой поташ, содержащий 85 – 87 % К 2 СО 3 и около 5 % КНСО 3, и 25 – 30 %-ная азотная кислота. Полученный раствор, содержащий около 30 % KNO 3, выпаривают при 110 – 120 0 С, отфильтровывают от примесей на фильтрпрессе и направляют на кристаллизацию. Кристаллы отфуговывают и высушивают.

Способы производства калиевой селитры Получение калиевой селитры абсорбцией нитрозных газов Этот способ также применяется в ограниченных масштабах из-за дефицитности едкого кали и поташа. Процесс аналогичен процессу получения нитрата натрия. При подаче на абсорбцию раствора едкого кали, отбираемый из первой абсорбционной башни щелок содержит 350 – 400 г/л KNO 2, 80 – 100 г/л KNO 3 и 2 – 3 г/л КОН. Инверсия проводится при 70 – 80 0 С избытком азотной кислоты.

Способы производства калиевой селитры Получение калиевой селитры конверсионными способами Наиболее распространён способ, основанный на обменном разложении: KCl + Na. NO 3 = Na. Cl + KNO 3 Рассмотрим диаграмму растворимости в водной системе: KCl + Na. NO 3 = Na. Cl + KNO 3 при 5, 25, 50 и 100 0 С. При температуре 5 – 25 0 С растворимость солей калия значительно меньше, чем солей натрия (поле кристаллизации КNO 3 занимает большую часть площади квадрата). При 100 0 С резко увеличивается поле кристаллизации Na. Cl.

Способы производства калиевой селитры Получение калиевой селитры конверсионными способами Если приготовить раствор эквимолекулярной смеси KCl и Na. NO 3 при 100 0 С, то фигуративная точка а солевой массы такого раствора, лежащая на пересечении диагоналей квадрата, окажется в поле кристаллизации Na. Cl. При выпаривании из этого раствора воды при 100 0 С, когда будет достигнуто насыщение, начнётся кристаллизация Na. Cl, и состав солевой массы раствора будет изменяться по линии ab. В точке b раствор станет насыщенным также и KCl. Если выделившиеся к этому моменту кристаллы Na. Cl отделить и затем охладить раствор, то точка b окажется в поле кристаллизации KNO 3 – эта соль и будет выделяться в осадок при охлаждении, причём состав раствора будет изменяться по линии bc.

Способы производства калиевой селитры Получение калиевой селитры конверсионными способами Так как расстояние между точками a и b невелико, то при выпаривании воды из раствора, содержащего эквимолекулярные количества Na. NO 3 и KCl, в осадок выделяется лишь небольшое количество Na. Cl и раствор становится насыщенным также и KCl. Это уменьшает и выход кристаллического KNO 3 при охлаждении раствора. Чтобы увеличить количество отделяемого Na. Cl и повысить выход KNO 3 следует вводить в исходный раствор избыток Na. NO 3. Наибольший выход получается, если к концу выделения Na. Cl раствор насыщен тремя солями – Na. Cl, KCl и KNO 3 (точка Е 2). После отделения выделившегося Na. Cl кристаллизация KNO 3 при охлаждении раствора идёт по наиболее длинному пути E 2 d, что обеспечивает наибольший выход продукта.

Способы производства калиевой селитры Получение калиевой селитры конверсионными способами Наиболее рациональным и экономичным является осуществление обменного разложения Na. NO 3 и KCl в циклическом процессе, когда кристаллизация Na. Cl идёт во время выпаривания из системы воды при постоянном давлении и переменной температуре. Описание и расчёт такого оптимального цикла могут быть произведены с помощью комбинации изотермического и изобарического сечений диаграммы. Рассмотрим пример оптимального цикла для случая, когда кристаллизация KNO 3 завершается при 50 0 С.

Способы производства калиевой селитры Получение калиевой селитры конверсионными способами Точка а на изотермическом сечении характеризует состав маточного раствора после кристаллизации KNO 3 на отрезке ba в процессе охлаждения. В начале кристаллизации солевому составу раствора соответствует точка b. Перед кристаллизацией к нему добавляют такое количество воды, чтобы он насытился Na. Cl лишь при заданной температуре конца кристаллизации. Раствор b получается в результате выпаривания воды и кристаллизации Na. Cl из кипящего раствора с. Точка с принадлежит к изобарическому сечению диаграммы и лежит на луче выпаривания Bcb. Исходный раствор для выпаривания с получается при смешении маточного раствора а с эквимолекулярной смесью KCl и Na. NO 3.

Способы производства калиевой селитры Получение калиевой селитры конверсионными способами Таким образом, цикл осуществляется по треугольнику cba. Чем выше солевой коэффициент цикла (т. е. отношение массы полученного KNO 3 к массе выпаренной воды), тем меньше расход энергии на выпаривание. Чем выше конечная температура кристаллизации KNO 3, тем меньше затраты на охлаждение раствора. Наиболее экономичными являются циклы с температурными интервалами от точки кипения до конечной температуры кристаллизации, находящейся в пределах 50 – 25 0 С. При этом для луча выпаривания Bb оптимальные соотношения K+ : NO 3– находятся в пределах 0, 69 – 0, 96; они обеспечивают сравнительно высокие солевые коэффициенты и небольшие объёмы циркулирующих растворов.

Производство аммофоса
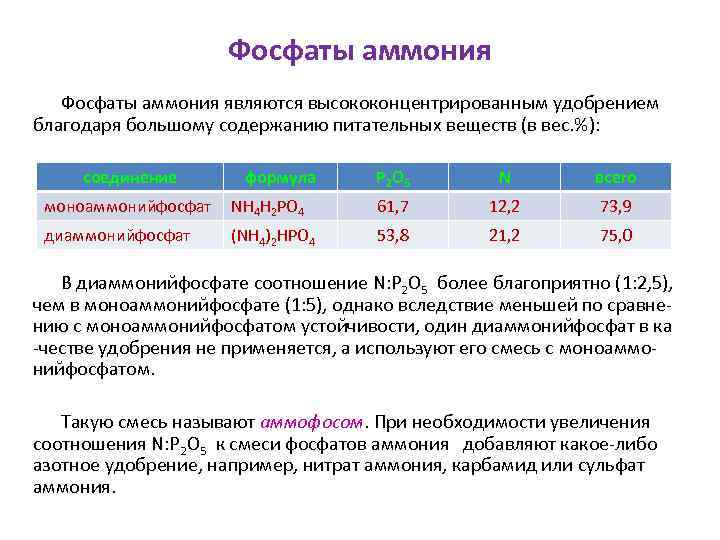
Фосфаты аммония являются высококонцентрированным удобрением благодаря большому содержанию питательных веществ (в вес. %): соединение формула P 2 O 5 N всего моноаммонийфосфат NH 4 H 2 PO 4 61, 7 12, 2 73, 9 диаммонийфосфат (NH 4)2 HPO 4 53, 8 21, 2 75, 0 В диаммонийфосфате соотношение N: Р 2 О 5 более благоприятно (1: 2, 5), чем в моноаммонийфосфате (1: 5), однако вследствие меньшей по сравнению с моноаммонийфосфатом устойчивости, один диаммонийфосфат в ка -честве удобрения не применяется, а используют его смесь с моноаммонийфосфатом. Такую смесь называют аммофосом. При необходимости увеличения соотношения N: Р 2 О 5 к смеси фосфатов аммония добавляют какое-либо азотное удобрение, например, нитрат аммония, карбамид или сульфат аммония.
Применение фосфатов аммония Фосфаты аммония Сельское хозяйство Пищевая промышленность Фармацевтическая промышленность Производство антипиренов

Фосфаты аммония Сырьем для производства фосфатов аммония являются аммиак и ортофосфорная кислота, как экстракционная, так и термическая. Фосфорная кислота нейтрализуется по реакциям: H 3 PO 4 + NH 3 = NH 4 H 2 PO 4 H 3 PO 4 + 2 NH 3 = (NH 4)2 HPO 4 H 3 PO 4 + 3 NH 3 = (NH 4)3 PO 4 При нейтрализации экстракционной фосфорной кислоты содержащиеся примеси переходят в готовый продукт, загрязняют его и снижают содержание основных компонентов.

Свойства аммофоса Аммофос – высококонцентрированное гранулированное азотно-фосфорное удобрение. Состоит из моноаммонийфосфата NH 4 H 2 PO 4 (не менее 80 %), диаммонийфосфата (NН 4)2 НРО 4 (около 5 %) и примесей – сульфата аммония (NH 4)2 SO 4, фосфатов Mg, Fe, Al и др. В зависимости от вида сырья, из которого производят Н 3 РО 4 (апатит, фосфориты), содержание питательных веществ в аммофосе составляет: 10 – 12 % азота, 42 – 52 % усвояемого Р 2 О 5, в том числе 34 – 48 % водорастворимого. Влажность готового продукта не более 1 %, количество в нем гранул размерами 1 – 4 мм – не менее 90 %. Аммофос – универсальное удобрение для всех сельскохозяйственных культур на любых почвах при различных способах внесения; лучше усваивается растениями, чем суперфосфат.
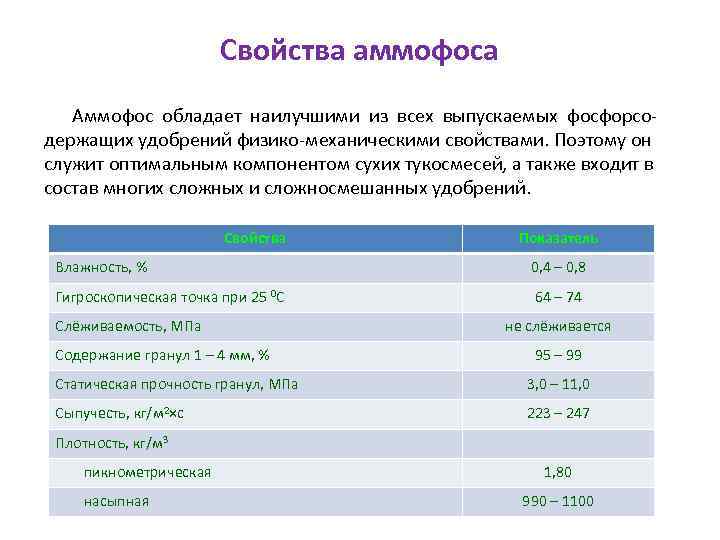
Свойства аммофоса Аммофос обладает наилучшими из всех выпускаемых фосфорсодержащих удобрений физико-механическими свойствами. Поэтому он служит оптимальным компонентом сухих тукосмесей, а также входит в состав многих сложных и сложносмешанных удобрений. Свойства Показатель Влажность, % 0, 4 – 0, 8 Гигроскопическая точка при 25 0 С 64 – 74 Слёживаемость, МПа Содержание гранул 1 – 4 мм, % не слёживается 95 – 99 Статическая прочность гранул, МПа 3, 0 – 11, 0 Сыпучесть, кг/м 2×с 223 – 247 Плотность, кг/м 3 пикнометрическая насыпная 1, 80 990 – 1100
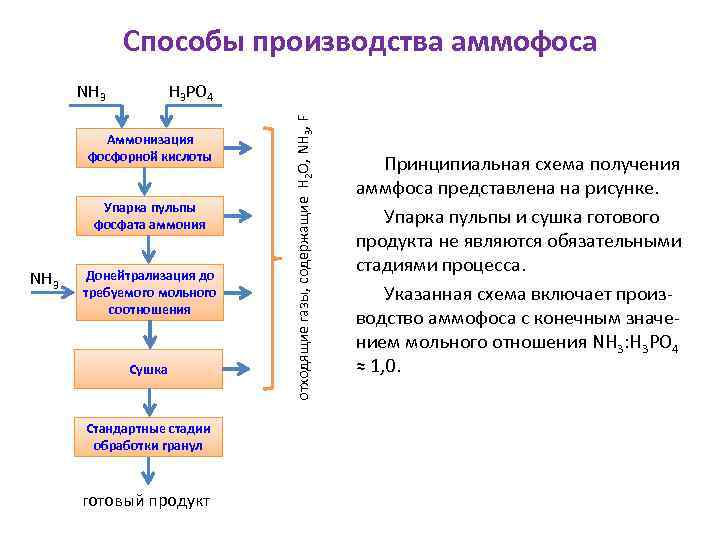
Способы производства аммофоса H 3 PO 4 Аммонизация фосфорной кислоты Упарка пульпы фосфата аммония NH 3 Донейтрализация до требуемого мольного соотношения Сушка Стандартные стадии обработки гранул готовый продукт отходящие газы, содержащие H 2 O, NH 3, F NH 3 Принципиальная схема получения аммфоса представлена на рисунке. Упарка пульпы и сушка готового продукта не являются обязательными стадиями процесса. Указанная схема включает производство аммофоса с конечным значением мольного отношения NН 3: Н 3 РО 4 ≈ 1, 0.
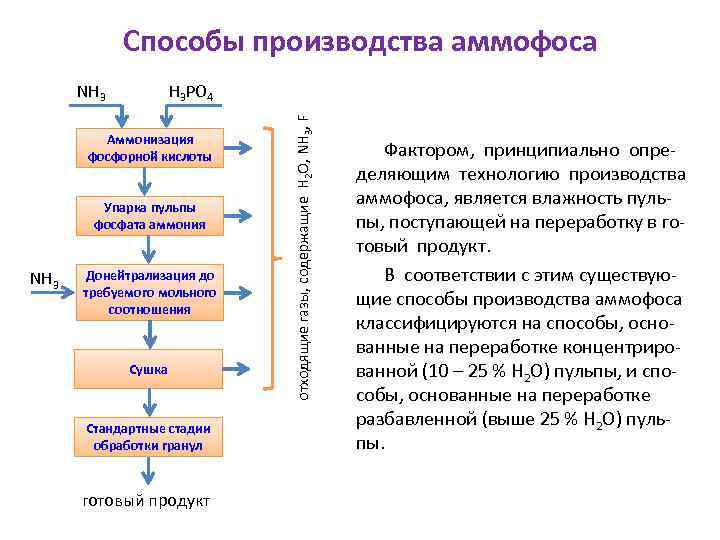
Способы производства аммофоса H 3 PO 4 Аммонизация фосфорной кислоты Упарка пульпы фосфата аммония NH 3 Донейтрализация до требуемого мольного соотношения Сушка Стандартные стадии обработки гранул готовый продукт отходящие газы, содержащие H 2 O, NH 3, F NH 3 Фактором, принципиально определяющим технологию производства аммофоса, является влажность пульпы, поступающей на переработку в готовый продукт. В соответствии с этим существующие способы производства аммофоса классифицируются на способы, основанные на переработке концентрированной (10 – 25 % Н 2 О) пульпы, и способы, основанные на переработке разбавленной (выше 25 % Н 2 О) пульпы.

Способы производства аммофоса В способах, основанных на переработке концентрированной пульпы, лимитирующие факторы технологии определяются реологическими характеристиками системы, поэтому для таких процессов предпочтительнее использовать аппараты, позволяющие перерабатывать вязкие среды (струйный реактор, аммонизатор-гранулятор (АГ) и др). Лимитирующим фактором технологии при переработке разбавленных пульп является процесс удаления влаги для получения кондиционного продукта, поэтому в данном случае целесообразно использовать эффективные тепло-массовые аппараты (барабанный гранулятор-сушилка (БГС), распылительная сушилка-гранулятор кипящего слоя (РКСГ) и др).

Способы производства аммофоса переработка концентрированных пульп Удаление воды для получения концентрированной пульпы может осуществляться или из кислоты (полученной на базе апатитового концентрата), или из кислой пульпы при мольном отношении NН 3: Н 3 РО 4 ≈ 0, 4 ≤ 0, 6 (при переработке любого вида фосфатного сырья). Чаще способы первой группы основаны на двухступенчатой нейтрализации фосфорной кислоты (концентрирование кислых пульп само по себе подразумевает двухступенчатый метод нейтрализации): Ø аммонизация до NН 3: Н 3 РО 4 = 0, 5 – 0, 7 или 1, 3 – 1, 4 для обеспечения достаточной текучести пульпы; Ø нейтрализация до NН 3: Н 3 РО 4 = 1, 05 для получения готового продукта.

Способы производства аммофоса переработка концентрированных пульп На существующих производствах стадию концентрирования фосфорной кислоты выделяют в самостоятельное отделение; стадия концентрирования аммофосной пульпы является составной частью технологической схемы производства аммофоса. Если используется одноступенчатая нейтрализация, то влажность пульпы не может быть ниже 20 %, за исключением нейтрализации в струйном реакторе (например, для получения порошковидного аммофоса). Процесс получения гранулированного аммофоса одноступенчатым методом может быть основан на применении смесителя-гранулятора и двухвального смесителя. Однако в подавляющем большинстве производств используют схемы с аппаратом типа БГС (барабанный гранулятор-сушилка).

Способы производства аммофоса переработка концентрированных пульп При производстве аммофоса по схеме с аппаратом БГС возможна: Ø одноступенчатая нейтрализация, когда пульпа после аммонизации в скоростном аммонизаторе-испарителе (САИ) поступает в БГС. При одноступенчатой аммонизации концентрация кислоты, подаваемой в аппарат БГС, не может быть более 42 %, что необходимо для обеспечения текучести пульпы при NН 3: Н 3 РО 4 ≈ 1, 0. Для разбавления кислоты при одноступенчатой аммонизации в сборник кислоты помимо стоков абсорбции подают свежую воду.

Способы производства аммофоса переработка концентрированных пульп При производстве аммофоса по схеме с аппаратом БГС возможна: Ø двухступенчатая нейтрализация, когда продукт после аммонизации в САИ до мольного отношения NН 3: Н 3 РО 4 = 1, 2 – 1, 3 нейтрализуют фосфорной кислотой. При этом текучесть пульпы на I ступени аммонизации обеспечивается без разбавления исходной кислоты свежей водой, поэтому концентрация кислоты, поступающей в систему, повышается до 47 % Р 2 О 5. Двухступенчатый метод за счет использования более концентрированной кислоты позволяет сократить энергозатраты. Уменьшение расхода аммиака объясняется понижением мольного отношения NН 3: Н 3 РО 4 до 1, 00 – 1, 05 перед БГС.
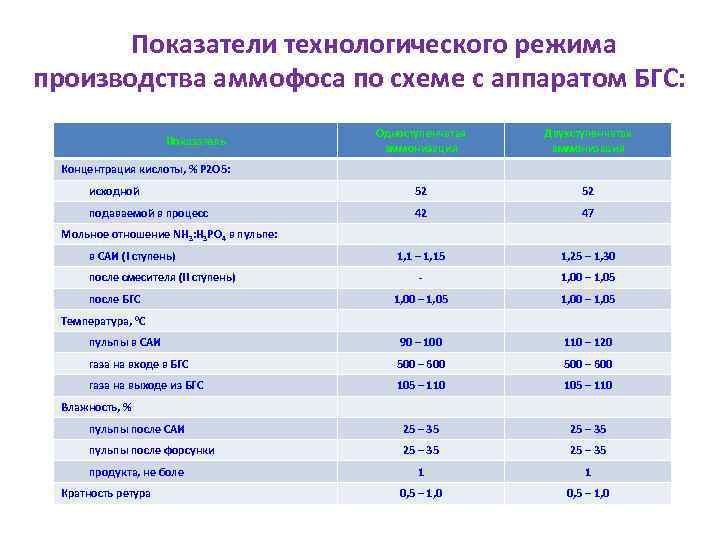
Показатели технологического режима производства аммофоса по схеме с аппаратом БГС: Одноступенчатая аммонизация Двухступенчатая аммонизация исходной 52 52 подаваемой в процесс 42 47 1, 1 – 1, 15 1, 25 – 1, 30 - 1, 00 – 1, 05 пульпы в САИ 90 – 100 110 – 120 газа на входе в БГС 500 – 600 газа на выходе из БГС 105 – 110 пульпы после САИ 25 – 35 пульпы после форсунки 25 – 35 1 1 0, 5 – 1, 0 Показатель Концентрация кислоты, % Р 2 О 5: Мольное отношение NH 3: H 3 PO 4 в пульпе: в САИ (I ступень) после смесителя (II ступень) после БГС Температура, 0 С Влажность, % продукта, не боле Кратность ретура

Способы производства аммофоса переработка концентрированных пульп Производство аммофоса по схеме с аппаратом АГ позволяет достичь наибольшей единичной мощности системы. Фосфорную кислоту нейтрализуют газообразным аммиаком до мольного отношения NН 3: Н 3 РО 4 = 0, 7. Полученная в нейтрализаторах пульпа самотеком поступает в аммонизатор-гранулятор, где доаммонизируется жидким аммиаком до NН 3: Н 3 РО 4 = 1, 0 – 1, 05. Здесь же происходит смешение пульпы с ретуром и укрупнение гранул аммофоса за счет кристаллизации на их поверхности солей, растворимость которых меняется в зависимости от р. Н пульпы.

Способы производства аммофоса переработка концентрированных пульп Влажность материала в грануляторе поддерживают в пределах 1 – 2 % при помощи ретура. Для сушки гранулированного аммофоса используют барабанные сушилки. Высушенные гранулы рассеивают на вибрационных грохотах. Мелкую фракцию в качестве ретура возвращают в аммонизатор-гранулятор. Крупную фракцию направляют в валковую дробилку; измельченный продукт возвращают в процесс вместе с мелочью.
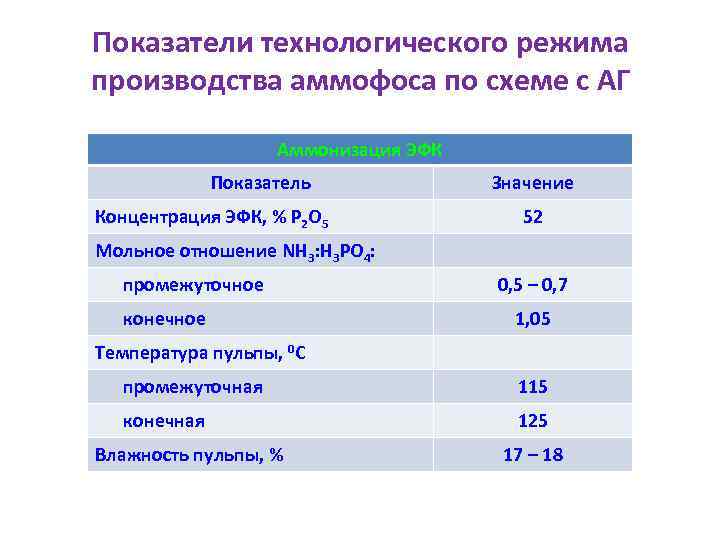
Показатели технологического режима производства аммофоса по схеме с АГ Аммонизация ЭФК Показатель Концентрация ЭФК, % Р 2 О 5 Значение 52 Мольное отношение NH 3: H 3 PO 4: промежуточное конечное 0, 5 – 0, 7 1, 05 Температура пульпы, 0 С промежуточная 115 конечная 125 Влажность пульпы, % 17 – 18
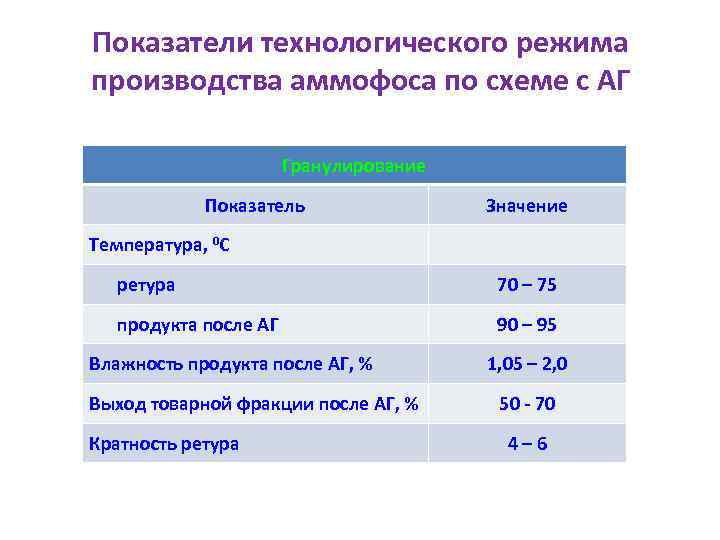
Показатели технологического режима производства аммофоса по схеме с АГ Гранулирование Показатель Значение Температура, 0 С ретура 70 – 75 продукта после АГ 90 – 95 Влажность продукта после АГ, % Выход товарной фракции после АГ, % Кратность ретура 1, 05 – 2, 0 50 - 70 4– 6

Сопоставление способов с использованием БГС и АГ При переработке концентрированных пульп целесообразнее использовать двухступенчатый метод нейтрализации, что позволяет сохранить текучесть концентрированной пульпы и избежать ее разбавления. Сопоставим процессы получения фосфатов аммония по двухступенчатому методу с использованием аппаратов БГС и АГ: Ø достоинство схем с аппаратом БГС – в значительно меньшем количестве ретура; Ø схема с аппаратом АГ является более универсальной и позволяет производить любые формы фосфатов аммония, в схеме же с аппаратом БГС получение фосфатов аммония при NН 3: Н 3 РО 4 > 1, 0 связано с резким уменьшением производительности; Ø в схемах с аппаратами БГС процесс остается устойчивым (его легко регулировать) при колебаниях концентрации исходной кислоты; уменьшение концентрации исходной кислоты в схемах с аппаратом АГ приводит к резкому увеличению ретурности и остановке системы; Ø на основе схем с аппаратом АГ возможно создание значительно больших единичных мощностей, чем с аппаратом БГС.
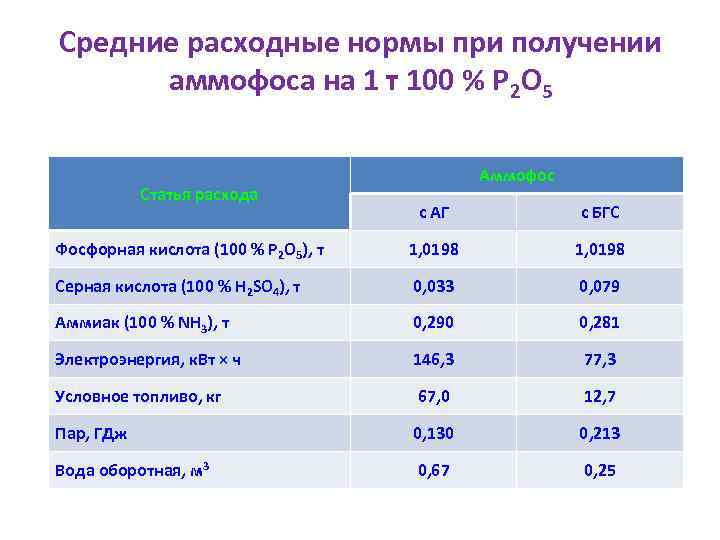
Средние расходные нормы при получении аммофоса на 1 т 100 % Р 2 О 5 Статья расхода Аммофос с АГ с БГС Фосфорная кислота (100 % Р 2 О 5), т 1, 0198 Серная кислота (100 % H 2 SO 4), т 0, 033 0, 079 Аммиак (100 % NH 3), т 0, 290 0, 281 Электроэнергия, к. Вт × ч 146, 3 77, 3 Условное топливо, кг 67, 0 12, 7 Пар, ГДж 0, 130 0, 213 Вода оборотная, м 3 0, 67 0, 25

Оборудование для переработки концентрированных пульп
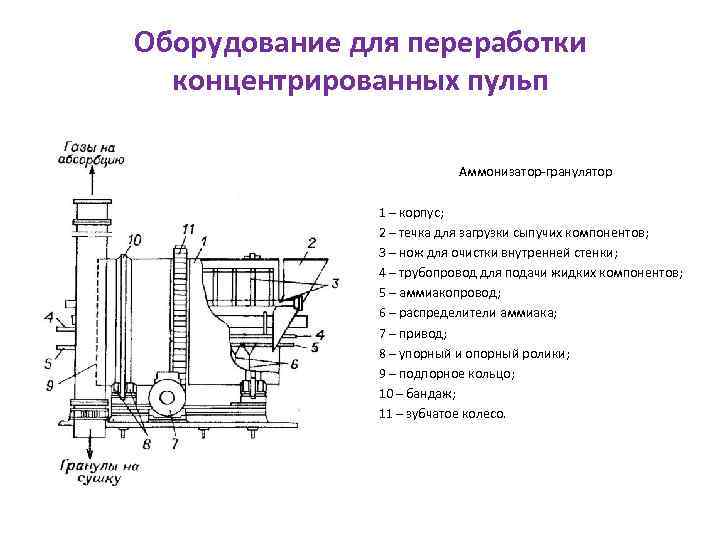
Оборудование для переработки концентрированных пульп Аммонизатор-гранулятор 1 – корпус; 2 – течка для загрузки сыпучих компонентов; 3 – нож для очистки внутренней стенки; 4 – трубопровод для подачи жидких компонентов; 5 – аммиакопровод; 6 – распределители аммиака; 7 – привод; 8 – упорный и опорный ролики; 9 – подпорное кольцо; 10 – бандаж; 11 – зубчатое колесо.

Способы производства аммофоса переработка разбавленных пульп Первоначально процессы производства аммофоса с использованием разбавленных пульп применяли для получения порошковидного аммофоса в распылительной сушилке с последующим его гранулированием. Однако ввиду низкой надежности и громоздкости схемы от такого процесса отказались и перешли к процессам без промежуточного выделения порошковидного аммофоса. Ø Производство аммофоса по схеме с аппаратом РКСГ (распылительная сушилка-гранулятор кипящего слоя). Ø Производство аммофоса по схеме с аппаратом БГС и упаркой пульпы.

Способы производства аммофоса Процесс получения фосфатов аммония, основанный на переработке концентрированной пульпы имеет следующие преимущества: Ø сокращаются суммарные энергозатраты; Ø повышается производительность сушильного оборудования; Ø сокращаются объемы отходящих на очистку газов.

Виды технологических схем производства аммофоса Ø схемы, основанные на нейтрализации неупаренной (20 -30 % Р 2 О 5) экстракционной фосфорной кислоты с последующим обезвоживанием суспензии в сушилках (распылительных, барабанных или с кипящим слоем); Ø схемы, основанные на нейтрализации неупаренной (20 -30 % Р 2 О 5) экстракционной фосфорной кислоты с последующей упаркой аммофосной суспензии, гранулированием и сушкой продукта в БГС; Ø схемы, основанные на нейтрализации концентрированной (48 -54 % Р 2 О 5) упаренной экстракционной фосфорной кислоты. В этом случае нейтрализацию ведут: - в две ступени при атмосферном давлении – сначала в реакторах, затем в барабанных аммонизаторах-грануляторах; - в одну ступень при повышенном давлении с последующей сушкой суспензии при распылении в башнях или в аппаратах БГС.

Производство удобрений на основе азотнокислотного разложения природных фосфатов

Характеристика способа В отличие от сернокислотного метода, при азотнокислотном разложении фосфатного сырья используется не только химическая энергия кислоты, но и азот, который переходит в состав удобрения. Такое комбинированное использование кислоты экономически весьма выгодно. При разложении природных фосфатов азотной кислотой образуется так называемая азотнокислотная вытяжка – раствор, содержащий нитрат кальция и свободную фосфорную кислоту. В зависимости от метода последующей переработки вытяжки можно получать как однокомпонентные азотные и фосфорные, так и сложные, двойные (N–Р) или тройные (N–Р–К) удобрения с самым широким диапазоном соотношения питательных веществ.

Характеристика способа Недостатком этого способа является необходимость удалять из азотнокислотной вытяжки часть кальция или связывать его в нерастворимые соли – в последнем случае приходится выпускать удобрения с пониженной концентрацией питательных веществ из-за присутствия большого количества балласта. Кроме того, наличие в вытяжке кальция не позволяет получать удобрения, в которых фосфор был бы полностью в водорастворимой форме. Переработку азотнокислотной вытяжки можно осуществлять с раздельным получением фосфатов (дикальцийфосфата, монокальцийфосфата) и нитратов (кальциевой или аммиачной селитры) или с получением сложных удобрений.

Характеристика способа Однокомпонентные удобрения могут быть получены, например, путем нейтрализации фосфорной кислоты в азотнокислотной вытяжке известняком. При этом образуется осадок дикальцийфосфата, который отделяют от раствора фильтрацией и высушивают. Остающийся раствор нитрата кальция выпаривают и кристаллизуют. Получение из вытяжки однокомпонентных удобрений требует больших капитальных и эксплуатационных затрат. Поэтому способы раздельного получения фосфорных и азотных удобрений из азотнокислотной вытяжки не нашли широкого применения.

Характеристика способа При производстве сложных удобрений из азотнокислотной вытяжки ее обычно нейтрализуют и полученную суспензию обезвоживают без разделения на компоненты. В применяемых способах вытяжку нейтрализуют аммиаком. Получаемые таким образом сложные удобрения содержат два питательных элемента – азот и фосфор, их называют нитрофосами. Чаще перед гранулированием к ней добавляют соль калия и получают тройное удобрение – нитрофоску, содержащую азот, фосфор, калий.

Характеристика способа В природных фосфатах массовое соотношение Са. О: Р 2 О 5 находится в пределах 1, 3 – 1, 8, то есть значительно выше, чем в дикальцийфосфате – 0, 79. Поэтому при нейтрализации вытяжки аммиаком, после того как вся фосфорная кислота израсходуется на образование дикальцийфосфата, в растворе останется избыточный кальций в виде Са(NО 3)2. При высушивании суспензии полученный продукт будет содержать нитрат кальция, что нежелательно ввиду его гигроскопичности. Этого можно избежать, если удалять из раствора часть кальция, достигнув соотношения Са. О: Р 2 О 5 = 0, 79. В этом случае весь фосфор будет находиться в продукте в цитратнорастворимой форме, в виде дикальцийфосфата.

Характеристика способа Применяют следующие способы уменьшения соотношения Са. О: Р 2 О 5 в перерабатываемой системе: Ø вымораживание нитрата кальция; Ø введение дополнительного количества фосфорной кислоты; Ø осаждение избытка кальция серной кислотой. В зависимости от способа связывания или удаления кальция из азотнокислотной вытяжки получают удобрения разного состава. В нитрофосках, содержащих балласт – сульфат или карбонат кальция, – концентрации питательных веществ (N + Р 2 О 5 + К 2 О) составляет 33 – 36 %, в нитроаммофосках же, получаемых с вымораживанием части нитрата кальция или с введением в процесс фосфорной кислоты, концентрация питательных веществ достигает 45 – 50 %.

Физико-химические основы процесса Химизм процесса азотнокислотной переработки фосфатов вследствие многокомпонентности системы весьма сложен. Полное разложение главных компонентов апатита стехиометрическим количеством азотной кислоты протекает по реакции: Са 5 F(РО 4)3 + 10 НNО 3 = 3 Н 3 РО 4 + 5 Са(NО 3)2 + НF При стехиометрическом соотношении (или избытке азотной кислоты) реакция протекает почти полностью.

Физико-химические основы процесса При уменьшении количества азотной кислоты разложение апатита может происходить с образованием моно- или дикальцийфосфата, нитрата кальция и фтористого водорода: 2 Са 5 F(РО 4)3 + 14 НNО 3 = 3 Са(Н 2 РО 4)2 + 7 Са(NО 3)2 + 2 НF Са 5 F(РО 4)3 + 4 НNО 3 = 3 Са. НРО 4 + 2 Са(NО 3)2 + НF При недостатке азотной кислоты в продуктах разложения одновременно с фосфатами кальция может присутствовать и свободная фосфорная кислота. Обычно при разложении фосфатов азотной кислотой (47 – 55 %) в количестве 40 – 100 % от стехиометрической нормы степень извлечения Р 2 О 5 из исходного сырья практически равна норме кислоты.

Физико-химические основы процесса Имеющиеся в сырье карбонаты кальция и магния разлагаются азотной кислотой с образованием нитратов и выделением СО 2: Са. СО 3 + 2 НNО 3 = Са(NО 3)2 + СО 2 + Н 2 О Выделяющийся СО 2 приводит к пенообразованию раствора и способствует ускорению процесса разложения фосфата. Оксиды алюминия и железа взаимодействуют с выделяющейся фосфорной кислотой с образованием нерастворимых в воде фосфатов, что приводит к потере фосфора: Fе 2 О 3 + 2 Н 3 РО 4 = 2 Fе. РО 4 + 3 Н 2 О Поэтому фосфаты, содержащие более 12 % Fе 2 О 3 по отношению к Р 2 О 5, считаются пригодными для химической переработки только после их обогащения.

Физико-химические основы процесса В азотнокислотном растворе фосфатов фтор находится в виде кремнефтористоводородной кислоты Н 2 Si. F 6, которая может оказывать отрицательное влияние при дальнейшей переработке продукта. Таким образом, азотнокислотный раствор фосфатов представляет собой сложную систему, содержащую в основном фосфорную кислоту, нитрат кальция, а также нитраты магния и полуторных окислов, кремниевую кислоту, кремнефтористоводородную кислоту и другие соединения.

Физико-химические основы процесса Поскольку разложение фосфатов осуществляется с избытком азотной кислоты, в растворе присутствует и свободная кислота. При нейтрализации данных растворов высокое содержание в них нитрата кальция способствует образованию более основных фосфатов. Часть нитрата кальция конвертируется в фосфаты, в том числе неусваиваемые, часть остается в готовой продукции, ухудшая её физические свойства. Снижение соотношения кальция и фосфора достигается вымораживанием нитрата кальция.

Физико-химические основы процесса На степень разложения фосфатов азотной кислотой оказывают влияние следующие факторы: 1. Концентрация и норма азотной кислоты Ø при стехиометрической норме расхода азотной кислоты извлечение Р 2 О 5 составляет 98, 1 %; Ø при избытке азотной кислоты + 5 % от стехиометрии 98, 3 %; Ø при пониженной норме азотной кислоты 90% от стехиометрии 93, 2 %. Норма азотной кислоты значительно влияет на коэффициент извлечения Р 2 О 5 из фосфатов.

Физико-химические основы процесса На степень разложения фосфатов азотной кислотой оказывают влияние следующие факторы: 1. Концентрация и норма азотной кислоты Концентрация азотной кислоты оказывает незначительное влияние на степень разложения: Ø при концентрации 55 % НNО 3 степень извлечения – 95 %; Ø при концентрации 50 % – 95 %; Ø при концентрации 40 % – 97 %; Ø при концентрации 32 % – 96 %. При уменьшении количества азотной кислоты ниже стехиометрического процесс разложения будет протекать до тех пор, пока не израсходуется азотная кислота, дальнейшее растворение фосфатов невозможно.

Физико-химические основы процесса На степень разложения фосфатов азотной кислотой оказывают влияние следующие факторы: 1. Концентрация и норма азотной кислоты Для ускорения разложения и достижения высокой степени извлечения целесообразно увеличить избыток кислоты по отношению к стехиометрии. Обычно держат избыток 5 % от стехиометрического для полного разложения фосфатов и обеспечения постоянной скорости процесса. Однако для осуществления последующей стадии кристаллизации нитрата кальция в оптимальных условиях избыток кислоты увеличивают до 10 – 20 %.
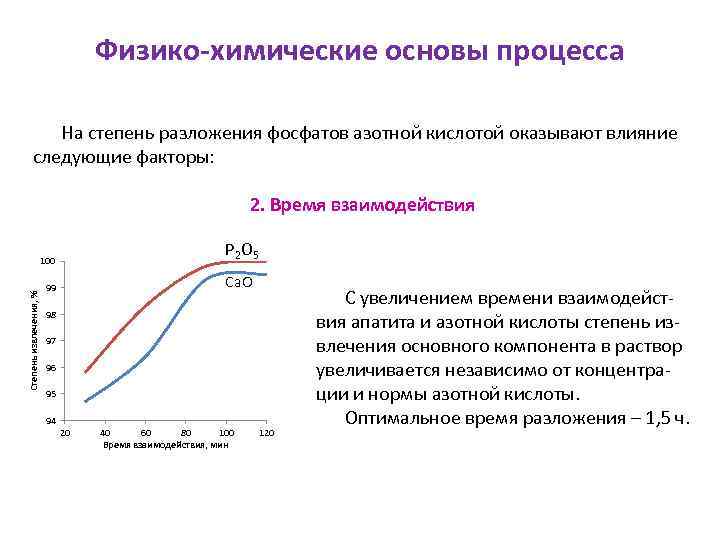
Физико-химические основы процесса На степень разложения фосфатов азотной кислотой оказывают влияние следующие факторы: 2. Время взаимодействия Р 2 О 5 Степень извлечения, % 100 Са. О 99 98 97 96 95 94 20 40 60 80 100 Время взаимодействия, мин 120 С увеличением времени взаимодействия апатита и азотной кислоты степень извлечения основного компонента в раствор увеличивается независимо от концентрации и нормы азотной кислоты. Оптимальное время разложения – 1, 5 ч.

Физико-химические основы процесса На степень разложения фосфатов азотной кислотой оказывают влияние следующие факторы: 3. Температура Обычно разложение ведут при температуре 45 – 50 0 С. При уменьшении температуры менее 45 0 С разложение замедляется; с повышением температуры увеличивается, так как при этом уменьшается вязкость раствора, и улучшаются условия массообмена. Повышение температуры более 60 0 С нецелесообразно, так как при этом увеличиваются потери азотной кислоты, и усиливается коррозия оборудования. Требуемая температура разложения поддерживается главным образом благодаря тепловому эффекту реакции и регулированию температуры све-жей азотной кислоты, поступающей на разложение, которая должна состав-лять 30 – 40 0 С.

Физико-химические основы процесса Разложение фосфатов азотной кислотой является гетерогенным процессом, и скорость этого процесса в значительной степени определяется площадью поверхности соприкосновения реагентов. Степень измельчения фосфатов установлена ГОСТ. Существенное влияние на скорость разложения фосфатов оказывает консистенция азотнокислотной вытяжки и концентрация реагирующих компонентов. Оптимальную концентрацию раствора разложения характеризует его плотность, которая не должна превышать 1, 55 г/см 3. Чтобы избежать изменения установившихся концентраций раствор хорошо перемешивают. По окончании разложения апатита остается некоторое количество твердой фазы, состоящей в основном из нерастворимого остатка, количество которого определяется качеством исходного сырья.
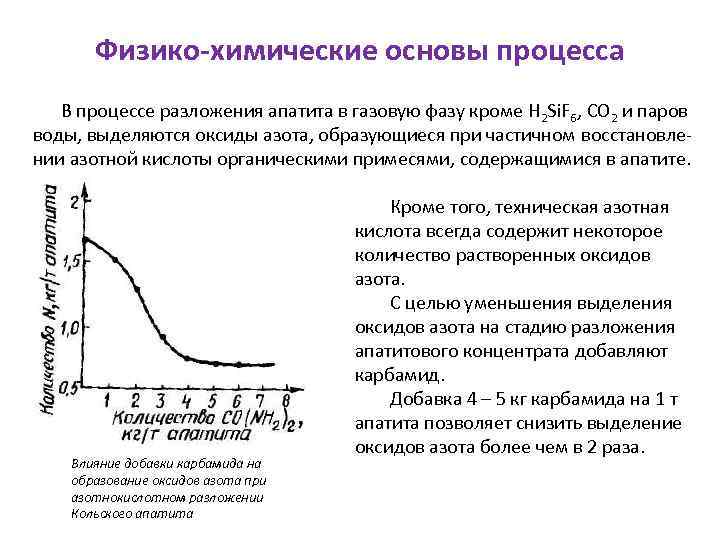
Физико-химические основы процесса В процессе разложения апатита в газовую фазу кроме Н 2 Si. F 6, СО 2 и паров воды, выделяются оксиды азота, образующиеся при частичном восстановлении азотной кислоты органическими примесями, содержащимися в апатите. Влияние добавки карбамида на образование оксидов азота при азотнокислотном разложении Кольского апатита Кроме того, техническая азотная кислота всегда содержит некоторое количество растворенных оксидов азота. С целью уменьшения выделения оксидов азота на стадию разложения апатитового концентрата добавляют карбамид. Добавка 4 – 5 кг карбамида на 1 т апатита позволяет снизить выделение оксидов азота более чем в 2 раза.
11 - Производство комплексных удобрений.pptx