geterotsikly_Dudkini_Irina.pptx
- Количество слайдов: 19
 Производные пяти-, шестичленных и конденсированных гетероциклов. Значение Выполнила : Дудкина Ирина Группа: ФА-12 -004 -01
Производные пяти-, шестичленных и конденсированных гетероциклов. Значение Выполнила : Дудкина Ирина Группа: ФА-12 -004 -01
 План: • • • 1) Производные шестичленных Производные пиридина Производные хинолина и изохинолина Производные бензопирана. Производные хромана. • • 2) Производные пятичленных Производные индола Производные имидазола Производные фурана
План: • • • 1) Производные шестичленных Производные пиридина Производные хинолина и изохинолина Производные бензопирана. Производные хромана. • • 2) Производные пятичленных Производные индола Производные имидазола Производные фурана
 Производные шестичленных Производные пиридина. Алкипиридины. Низшие гомологи пиридина имеют тривиальные названия: метилпиридины называются пиколинами, диметилпиридины – лутидинами, триметилпиридины – коллидинами. Характерным свойством алкилпиридинов является подвижность атомов водорода при атоме углерода, непосредственно связанном с циклом, или, иными словами, СН-кислотность в месте присоединения алкильной группы к кольцу. Их повышенная СН-кислотность объясняется также большей устойчивостью их сопряженных оснований, в которых одна из предельных структур несет заряд на более электроотрицательном атоме азота.
Производные шестичленных Производные пиридина. Алкипиридины. Низшие гомологи пиридина имеют тривиальные названия: метилпиридины называются пиколинами, диметилпиридины – лутидинами, триметилпиридины – коллидинами. Характерным свойством алкилпиридинов является подвижность атомов водорода при атоме углерода, непосредственно связанном с циклом, или, иными словами, СН-кислотность в месте присоединения алкильной группы к кольцу. Их повышенная СН-кислотность объясняется также большей устойчивостью их сопряженных оснований, в которых одна из предельных структур несет заряд на более электроотрицательном атоме азота.
 Реакция с алкилгалогенидами приводит к удлинению боковой цепи пиридина, причем вместе с алкильной группой могут быть введены и некоторые функциональные группы. Взаимодействие аниона с диоксидом углерода позволяет получать пиридилуксусные кислоты.
Реакция с алкилгалогенидами приводит к удлинению боковой цепи пиридина, причем вместе с алкильной группой могут быть введены и некоторые функциональные группы. Взаимодействие аниона с диоксидом углерода позволяет получать пиридилуксусные кислоты.
 • Благодаря наличию СН-кислотного центра 2 - и 4 - алкилпиридины способны реагировать с карбонильными соединениями по типу альдольной конденсации. Конденсация с алифатическими альдегидами, например формальдегидом, приводит к βгидроксиалкильным производным – аналогам альдолей. • С ароматическими альдегидами сразу образуются ненасыщенные производные (аналогия с кротоновой конденсацией. )
• Благодаря наличию СН-кислотного центра 2 - и 4 - алкилпиридины способны реагировать с карбонильными соединениями по типу альдольной конденсации. Конденсация с алифатическими альдегидами, например формальдегидом, приводит к βгидроксиалкильным производным – аналогам альдолей. • С ароматическими альдегидами сразу образуются ненасыщенные производные (аналогия с кротоновой конденсацией. )
 • Гидроксипиридины. Для всех трех изомерных гидроксипиридинов характерно явление таутомерии. 2 - и 4 - Гидроксипиридинам таутомерны их оксоформы, которые называются соответственно пиридон-2 и пиридон-4. 3 -Гидроксипиридин в растворе находится в равновесии со своими диполярным ионом. Несмотря на существенные различия в строении рассмотренных изомеров, их часто объединяют одним названием – гидрокпиридины.
• Гидроксипиридины. Для всех трех изомерных гидроксипиридинов характерно явление таутомерии. 2 - и 4 - Гидроксипиридинам таутомерны их оксоформы, которые называются соответственно пиридон-2 и пиридон-4. 3 -Гидроксипиридин в растворе находится в равновесии со своими диполярным ионом. Несмотря на существенные различия в строении рассмотренных изомеров, их часто объединяют одним названием – гидрокпиридины.
 • Ароматический характер гидроксипиридинов проявляется в том, что они способны вступать в реакции электрофильного замещения, причем с большей легкостью, чем сам пиридин.
• Ароматический характер гидроксипиридинов проявляется в том, что они способны вступать в реакции электрофильного замещения, причем с большей легкостью, чем сам пиридин.
 • Аминопиридины. • Изомерные аминопиридины являются основаниями умеренной силы и образуют с кислотами кристаллическимие соли по кольцевому атому азота. Эти изомеры образуют катионы только с одним эквивалентом кислоты, в которых положительный заряд делокализован между двумя атомами азота, например: 3 – Аминопиридин, подобно первичным ароматическим аминам, образует соль диазония:
• Аминопиридины. • Изомерные аминопиридины являются основаниями умеренной силы и образуют с кислотами кристаллическимие соли по кольцевому атому азота. Эти изомеры образуют катионы только с одним эквивалентом кислоты, в которых положительный заряд делокализован между двумя атомами азота, например: 3 – Аминопиридин, подобно первичным ароматическим аминам, образует соль диазония:
 • В реакции диазотирования 2 - и 4 - аминопиридины ведут себя подобно алифатическим аминам. • Аминопиридины способны вступать в реакции электрофильного замещения по атомам углерода, причем эти реакции как и для гидроксипиридинов, протекают значительно легче, чем для самого пиридина.
• В реакции диазотирования 2 - и 4 - аминопиридины ведут себя подобно алифатическим аминам. • Аминопиридины способны вступать в реакции электрофильного замещения по атомам углерода, причем эти реакции как и для гидроксипиридинов, протекают значительно легче, чем для самого пиридина.
 • Производные хинолина и изохинолина как лекарственные средства. • Оба гетероцикла лежат в основе структуры группы алкалоидов и их синтетических аналогов, применяемых в медицине. Кроме упомянутых выше хинозола и нитроксолина, в качестве противомикробных средств в настоящее время широко применяется фторированные производные хинолона-4 – ципрофлоксацин (цифран) и офлоксацин (таривид).
• Производные хинолина и изохинолина как лекарственные средства. • Оба гетероцикла лежат в основе структуры группы алкалоидов и их синтетических аналогов, применяемых в медицине. Кроме упомянутых выше хинозола и нитроксолина, в качестве противомикробных средств в настоящее время широко применяется фторированные производные хинолона-4 – ципрофлоксацин (цифран) и офлоксацин (таривид).
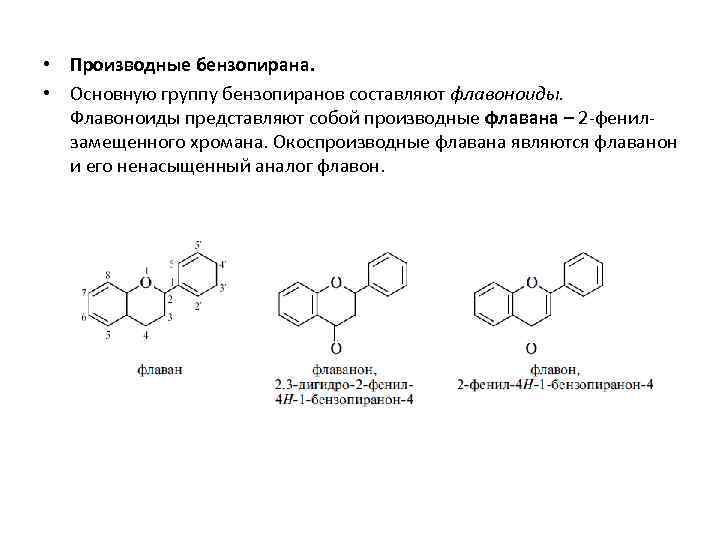 • Производные бензопирана. • Основную группу бензопиранов составляют флавоноиды. Флавоноиды представляют собой производные флавана – 2 -фенилзамещенного хромана. Окоспроизводные флавана являются флаванон и его ненасыщенный аналог флавон.
• Производные бензопирана. • Основную группу бензопиранов составляют флавоноиды. Флавоноиды представляют собой производные флавана – 2 -фенилзамещенного хромана. Окоспроизводные флавана являются флаванон и его ненасыщенный аналог флавон.
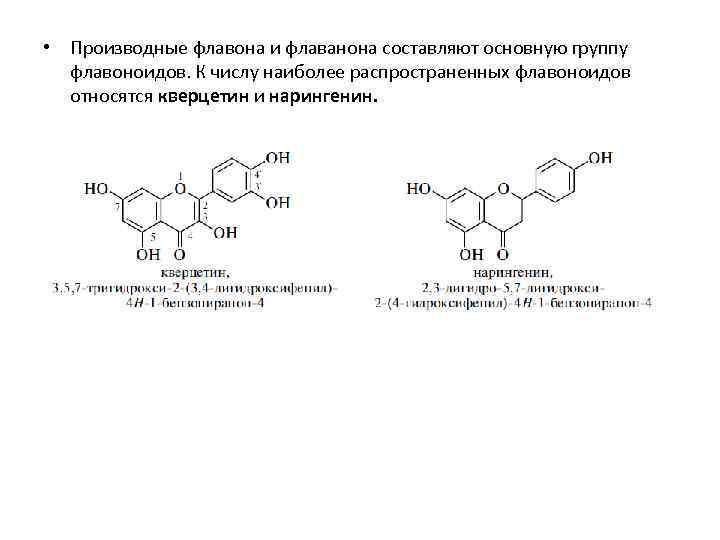 • Производные флавона и флаванона составляют основную группу флавоноидов. К числу наиболее распространенных флавоноидов относятся кверцетин и нарингенин.
• Производные флавона и флаванона составляют основную группу флавоноидов. К числу наиболее распространенных флавоноидов относятся кверцетин и нарингенин.
 • Производные хромана. Гетероциклическая система хромана лежит в основе токоферолов, называемые группы Е. Самый известный из них α-токоферол. Другие представители этой группы содержат разное число метильных групп в бензольном кольце и различаются степенью ненасыщенности боковой цепи. В качестве лекарственного средства применяются ацетат α-токоферола.
• Производные хромана. Гетероциклическая система хромана лежит в основе токоферолов, называемые группы Е. Самый известный из них α-токоферол. Другие представители этой группы содержат разное число метильных групп в бензольном кольце и различаются степенью ненасыщенности боковой цепи. В качестве лекарственного средства применяются ацетат α-токоферола.
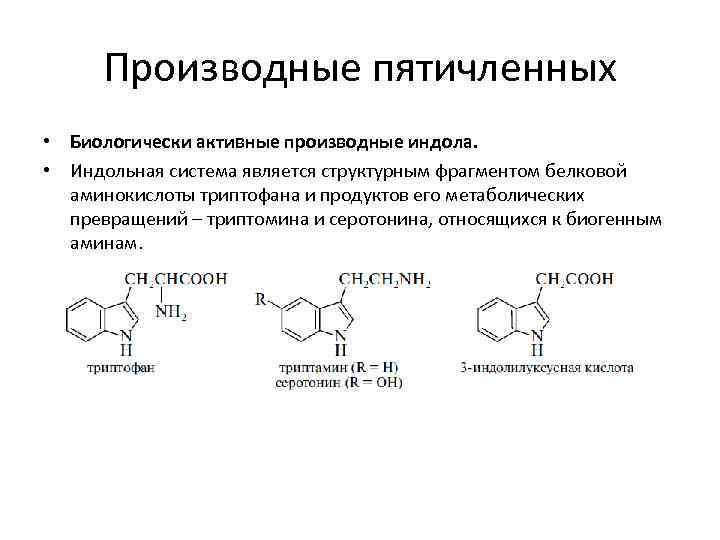 Производные пятичленных • Биологически активные производные индола. • Индольная система является структурным фрагментом белковой аминокислоты триптофана и продуктов его метаболических превращений – триптомина и серотонина, относящихся к биогенным аминам.
Производные пятичленных • Биологически активные производные индола. • Индольная система является структурным фрагментом белковой аминокислоты триптофана и продуктов его метаболических превращений – триптомина и серотонина, относящихся к биогенным аминам.
 • Среди синтетических производных индола – противоспалительное вредство индометацин, диуретическое вредство – индапамид.
• Среди синтетических производных индола – противоспалительное вредство индометацин, диуретическое вредство – индапамид.
 Производные пятичленных гетероциклов на примере имидазола. Гистидин • Гистидин - незаменимая аминокислота. Содержится в разных органах, входит в состав карнозина - азотистого экстрактивного вещества мышц. Применяется при лечении гепатитов, язвенной болезни желудка и двенадцатиперстной кишки. Имеются также данные о благоприятном влиянии препарата на липопротеиновый обмен у больных атеросклерозом.
Производные пятичленных гетероциклов на примере имидазола. Гистидин • Гистидин - незаменимая аминокислота. Содержится в разных органах, входит в состав карнозина - азотистого экстрактивного вещества мышц. Применяется при лечении гепатитов, язвенной болезни желудка и двенадцатиперстной кишки. Имеются также данные о благоприятном влиянии препарата на липопротеиновый обмен у больных атеросклерозом.
 Гистамин Бензимидазол • Примененяется при лечении полиартрита, суставной и мышечный ревматизма, аллергических заболеваний, мигрени, боли, вызванной поражением периферических нервов, а также при диагностики гиперсекреторных состояний желудка. • Бензимидазол - входит в состав ряда природных веществ, в частности витамина В 12, а также лекарственных ср едств, например дибазола ( 2 -бензилбензимидазола), понижающего артериальное давление.
Гистамин Бензимидазол • Примененяется при лечении полиартрита, суставной и мышечный ревматизма, аллергических заболеваний, мигрени, боли, вызванной поражением периферических нервов, а также при диагностики гиперсекреторных состояний желудка. • Бензимидазол - входит в состав ряда природных веществ, в частности витамина В 12, а также лекарственных ср едств, например дибазола ( 2 -бензилбензимидазола), понижающего артериальное давление.
 Производные фурана • Основу химической структуры лекарственных средств, производных фурана, составляет пятичленный кислородсодержащий гетероцикл. В медицинской практике используют ЛС производные 5 нитрофурфурола (фурфураля, 2 -фу-ранкарбальдегида):
Производные фурана • Основу химической структуры лекарственных средств, производных фурана, составляет пятичленный кислородсодержащий гетероцикл. В медицинской практике используют ЛС производные 5 нитрофурфурола (фурфураля, 2 -фу-ранкарбальдегида):
 Используемая литература • Органическая химия: Органическая химия, Книга 1 Основной курс, Под редакцией Тюкавкиной Н. А. , Издательство «Дрофа» , Москва, 2004 год. • Органическая химия, Под редакцией Шабарова Ю. С. , Издательство «Лань» , Москва, 2011 год. • Грандберг И. И. "Органическая химия: Учеб. для студ. вузов, обучающихся по агроном. спец. " 4 -е изд. Издательство «Дрофа» , Москва, 2001 год.
Используемая литература • Органическая химия: Органическая химия, Книга 1 Основной курс, Под редакцией Тюкавкиной Н. А. , Издательство «Дрофа» , Москва, 2004 год. • Органическая химия, Под редакцией Шабарова Ю. С. , Издательство «Лань» , Москва, 2011 год. • Грандберг И. И. "Органическая химия: Учеб. для студ. вузов, обучающихся по агроном. спец. " 4 -е изд. Издательство «Дрофа» , Москва, 2001 год.


