5_proizvodnye_PASK.pptx
- Количество слайдов: 36

ПРОИЗВОДНЫЕ п-АСК, о-АБК, м-АБК, ФЕНИЛУКСУСНОЙ И ФЕНИЛПРОПИОНОВОЙ КИСЛОТ
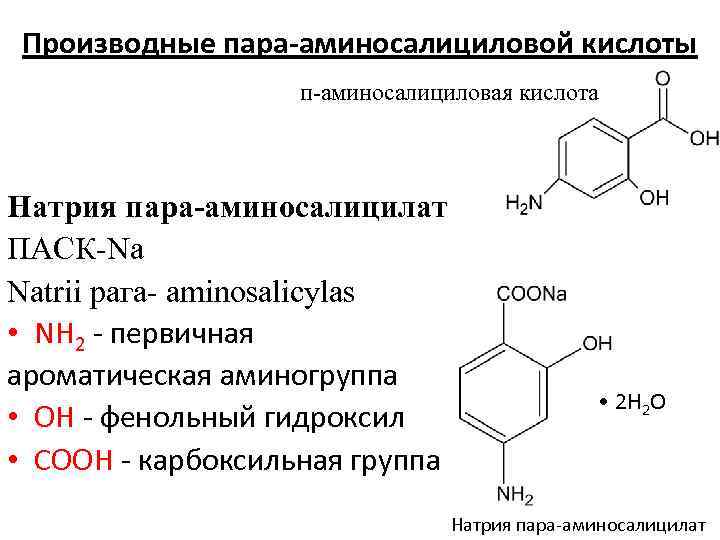
Производные пара-аминосалициловой кислоты п аминосалициловая кислота Натрия пара-аминосалицилат ПАСК Nа Natrii рага aminosalicylas • NН 2 - первичная ароматическая аминогруппа • ОН - фенольный гидроксил • СООН - карбоксильная группа • 2 H 2 O Натрия пара-аминосалицилат
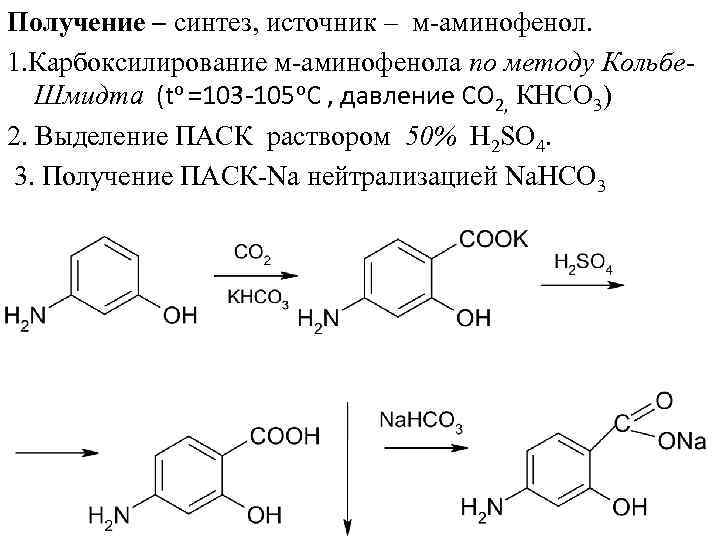
Получение – синтез, источник – м аминофенол. 1. Карбоксилирование м аминофенола по методу Кольбе. Шмидта (to =103 -105 о. С , давление СО 2, КНСО 3) 2. Выделение ПАСК раствором 50% Н 2 SО 4. 3. Получение ПАСК Nа нейтрализацией Nа. НСО 3
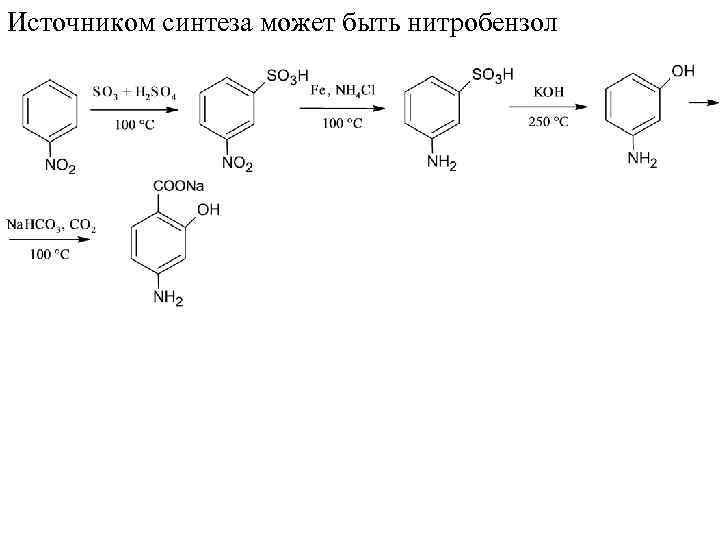
Источником синтеза может быть нитробензол

Подлиннность 1. УФ спектрофотометрия. • УФ-спектр 0, 001% водногораствора 2 максимума поглощения– 265 нм и 299 нм ( наличие фенольного гидроксила и ПАА). • ФС Соотношение оптических плотностей при длинах волн 265 и 299 нм должно быть в пределах 1, 50 1, 56 (указывает на отсутствие поглощающих при данных длинах волн примесей). • Величины удельных показателей поглощения при максимумах поглощения равны соответственно 736 и 483. 2. Т°пл=122 о. С.
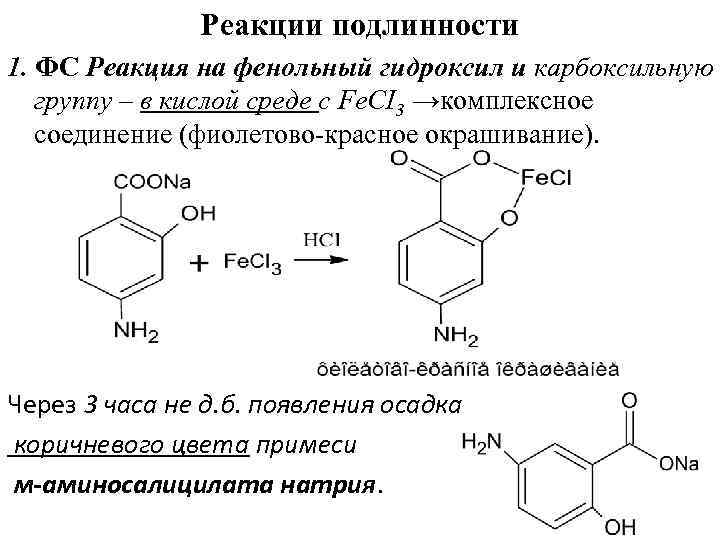
Реакции подлинности 1. ФС Реакция на фенольный гидроксил и карбоксильную группу – в кислой среде с Fе. CI 3 →комплексное соединение (фиолетово красное окрашивание). Через 3 часа не д. б. появления осадка коричневого цвета примеси м-аминосалицилата натрия.
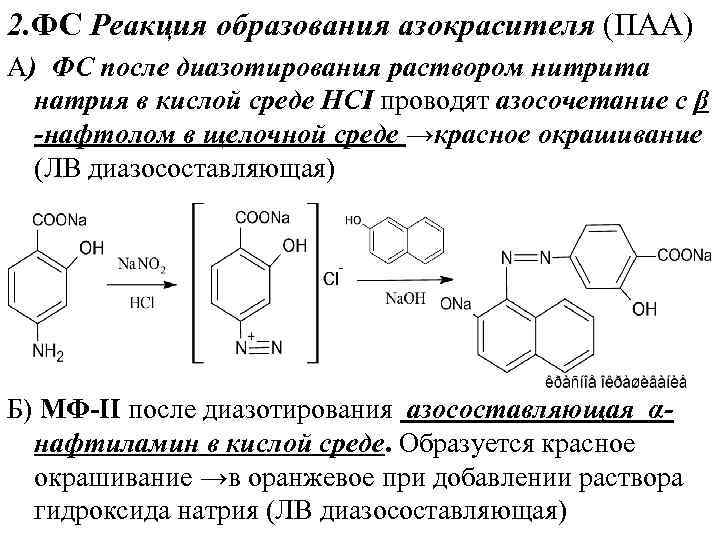
2. ФС Реакция образования азокрасителя (ПАА) А) ФС после диазотирования раствором нитрита натрия в кислой среде НСI проводят азосочетание с β -нафтолом в щелочной среде →красное окрашивание (ЛВ диазоcоставляющая) Б) МФ-II после диазотирования азосоставляющая αнафтиламин в кислой среде. Образуется красное окрашивание →в оранжевое при добавлении раствора гидроксида натрия (ЛВ диазосоставляющая)
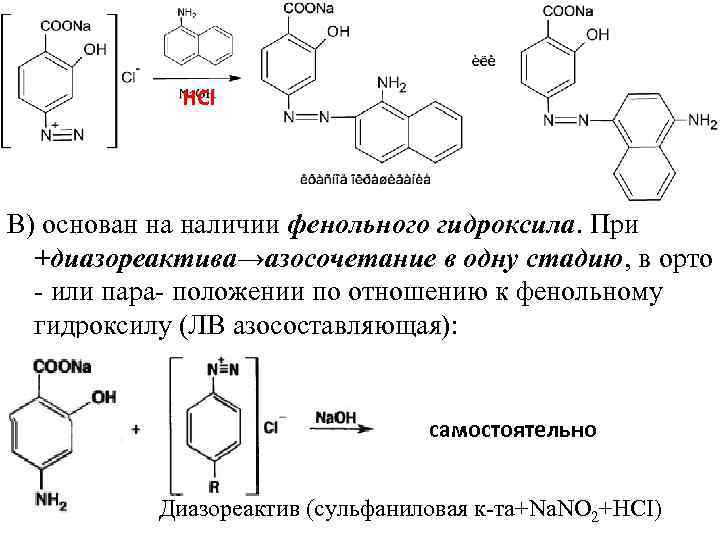
НСI В) основан на наличии фенольного гидроксила. При +диазореактива→азосочетание в одну стадию, в орто или пара положении по отношению к фенольному гидроксилу (ЛВ азосоставляющая): самостоятельно Диазореактив (сульфаниловая к та+Nа. NО 2+НСI)
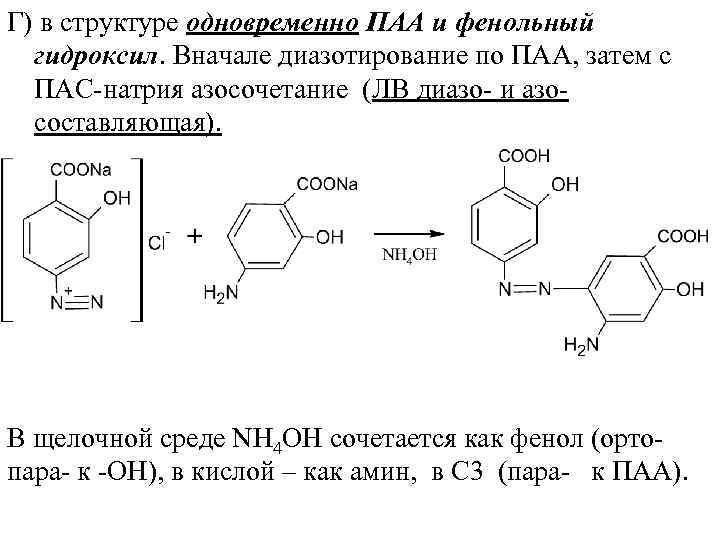
Г) в структуре одновременно ПАА и фенольный гидроксил. Вначале диазотирование по ПАА, затем с ПАС натрия азосочетание (ЛВ диазо и азо составляющая). В щелочной среде NН 4 ОН сочетается как фенол (орто пара к ОН), в кислой – как амин, в С 3 (пара к ПАА).
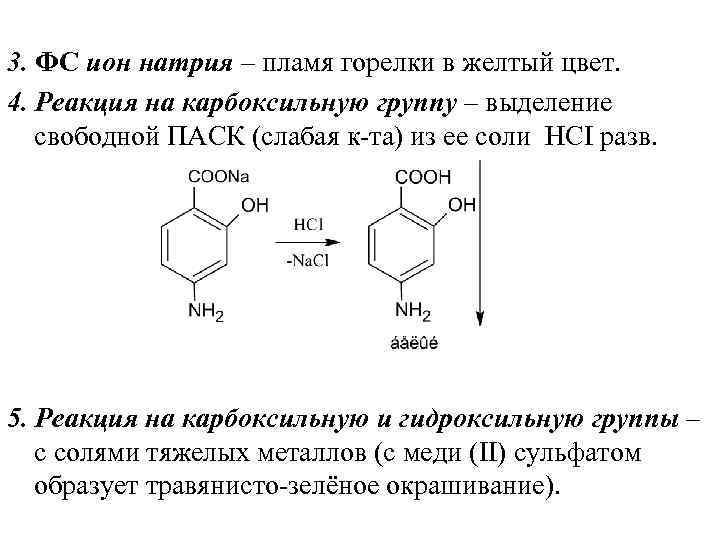
3. ФС ион натрия – пламя горелки в желтый цвет. 4. Реакция на карбоксильную группу – выделение свободной ПАСК (слабая к та) из ее соли НСI разв. 5. Реакция на карбоксильную и гидроксильную группы – с солями тяжелых металлов (с меди (II) сульфатом образует травянисто зелёное окрашивание).
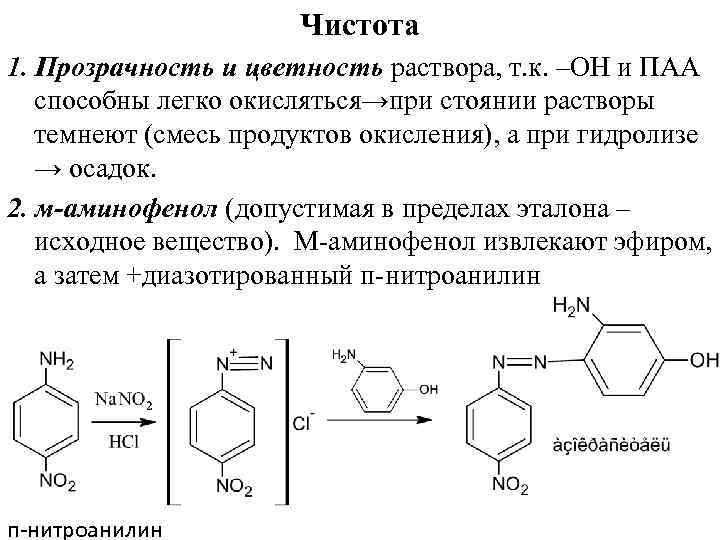
Чистота 1. Прозрачность и цветность раствора, т. к. –ОН и ПАА способны легко окисляться→при стоянии растворы темнеют (смесь продуктов окисления), а при гидролизе → осадок. 2. м-аминофенол (допустимая в пределах эталона – исходное вещество). М аминофенол извлекают эфиром, а затем +диазотированный п нитроанилин п-нитроанилин
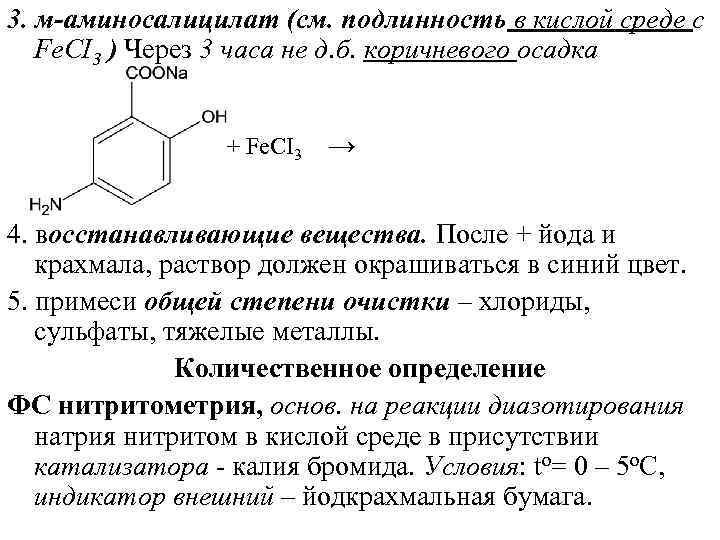
3. м-аминосалицилат (см. подлинность в кислой среде с Fе. CI 3 ) Через 3 часа не д. б. коричневого осадка + Fе. CI 3 → 4. восстанавливающие вещества. После + йода и крахмала, раствор должен окрашиваться в синий цвет. 5. примеси общей степени очистки – хлориды, сульфаты, тяжелые металлы. Количественное определение ФС нитритометрия, основ. на реакции диазотирования натрия нитритом в кислой среде в присутствии катализатора калия бромида. Условия: tо= 0 – 5 о. C, индикатор внешний – йодкрахмальная бумага.
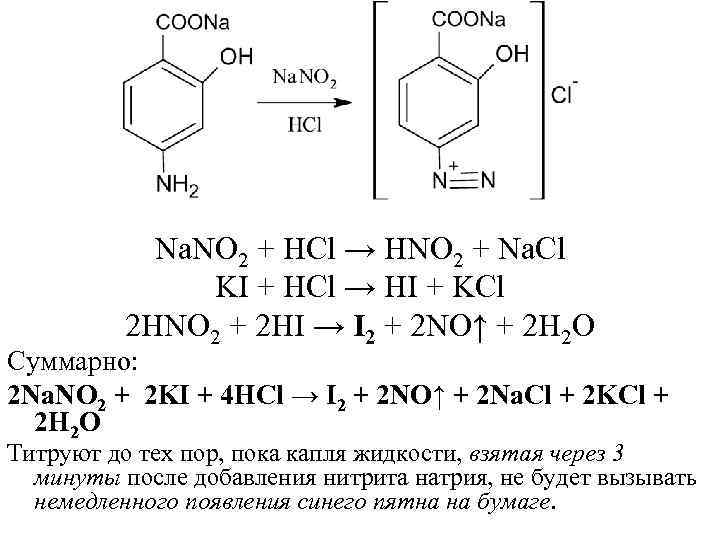
Na. NO 2 + HCl → HNO 2 + Na. Cl KI + HCl → HI + KCl 2 HNO 2 + 2 HI → I 2 + 2 NO↑ + 2 H 2 O Суммарно: 2 Na. NO 2 + 2 KI + 4 HCl → I 2 + 2 NO↑ + 2 Na. Cl + 2 KCl + 2 H 2 O Титруют до тех пор, пока капля жидкости, взятая через 3 минуты после добавления нитрита натрия, не будет вызывать немедленного появления синего пятна на бумаге.
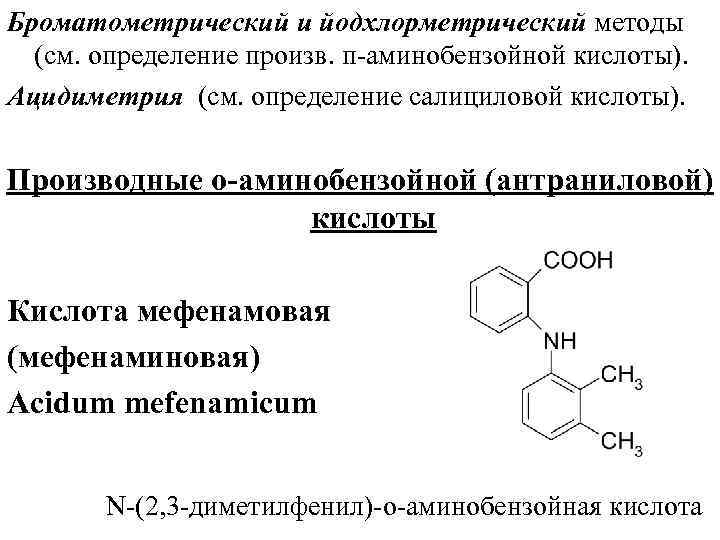
Броматометрический и йодхлорметрический методы (см. определение произв. п аминобензойной кислоты). Ацидиметрия (см. определение салициловой кислоты). Производные о-аминобензойной (антраниловой) кислоты Кислота мефенамовая (мефенаминовая) Аcidum mefenamicum N (2, 3 диметилфенил) о аминобензойная кислота
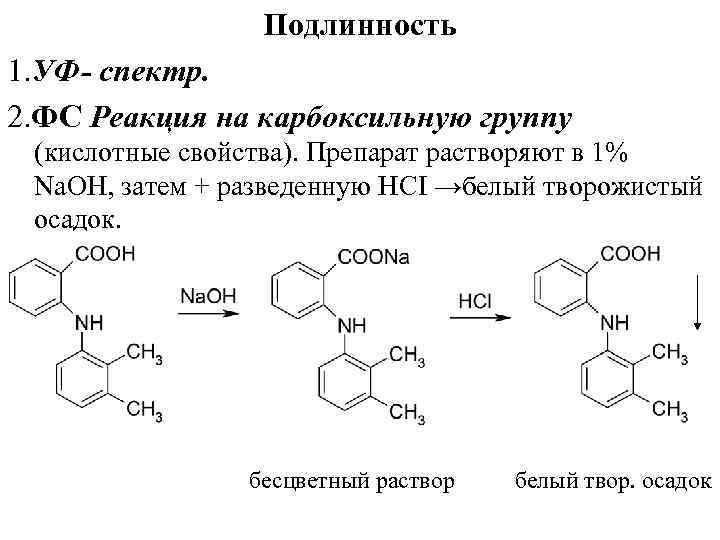
Подлинность 1. УФ- спектр. 2. ФС Реакция на карбоксильную группу (кислотные свойства). Препарат растворяют в 1% Nа. ОН, затем + разведенную НСI →белый творожистый осадок. бесцветный раствор белый твор. осадок
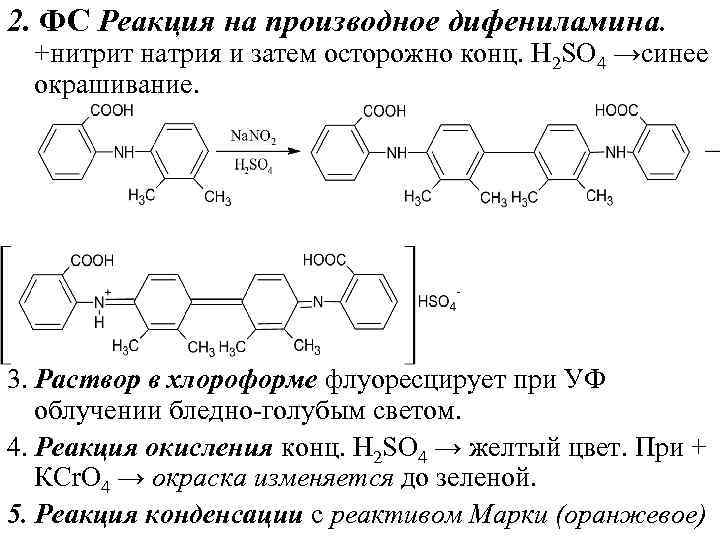
2. ФС Реакция на производное дифениламина. +нитрит натрия и затем осторожно конц. Н 2 SО 4 →синее окрашивание. 3. Раствор в хлороформе флуоресцирует при УФ облучении бледно голубым светом. 4. Реакция окисления конц. Н 2 SО 4 → желтый цвет. При + КСr. О 4 → окраска изменяется до зеленой. 5. Реакция конденсации с реактивом Марки (оранжевое)
6. Как производное ароматических аминокислот, мефенамовая кислота вступает в реакции комплексообразования с солями тяжелых металлов: • С нитратом серебра – белый осадок • С хлоридом железа (III) – желто коричневый осадок • С сульфатом меди – светло зеленый осадок Количественное определение 1. Алкалиметрия в ацетоне, индик. тимоловый синий
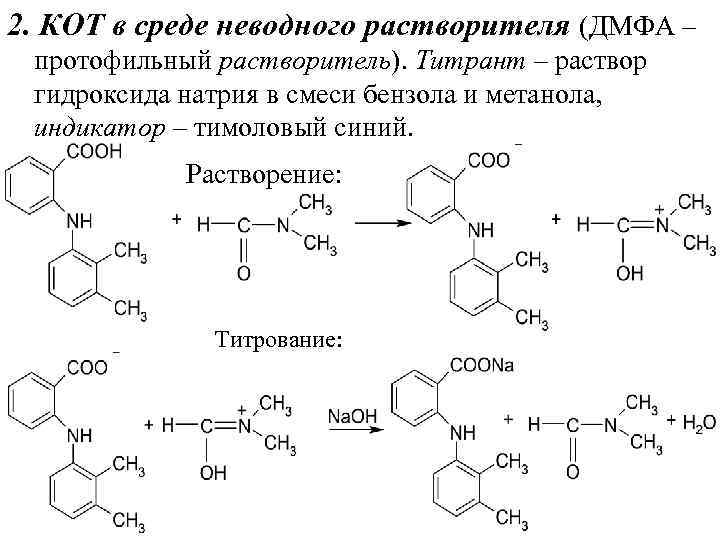
2. КОТ в среде неводного растворителя (ДМФА – протофильный растворитель). Титрант – раствор гидроксида натрия в смеси бензола и метанола, индикатор – тимоловый синий. Растворение: Титрование:
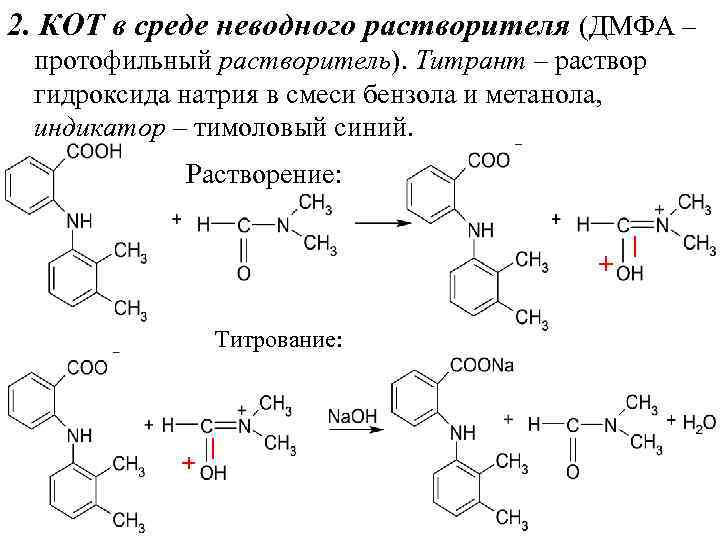
2. КОТ в среде неводного растворителя (ДМФА – протофильный растворитель). Титрант – раствор гидроксида натрия в смеси бензола и метанола, индикатор – тимоловый синий. Растворение: + Титрование: + | |
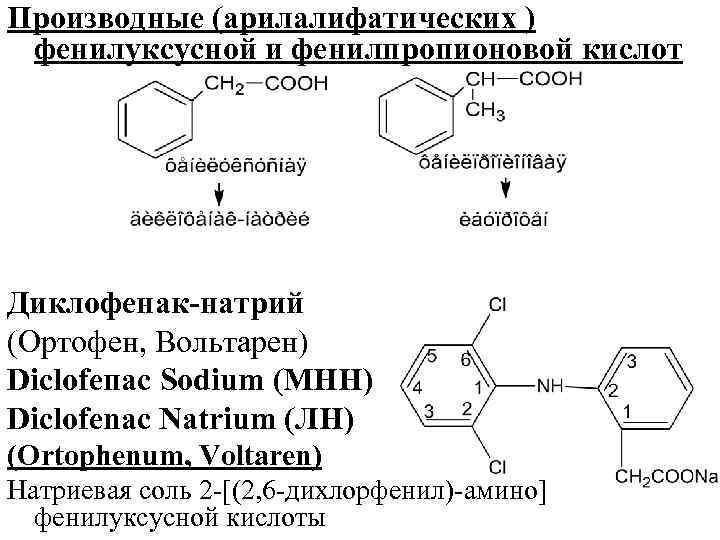
Производные (арилалифатических ) фенилуксусной и фенилпропионовой кислот Диклофенак-натрий (Ортофен, Вольтарен) Diсlоfепас Sodium (МНН) Diclofenac Natrium (ЛН) (Ortophenum, Voltaren) Натриевая соль 2 [(2, 6 дихлорфенил) амино] фенилуксусной кислоты
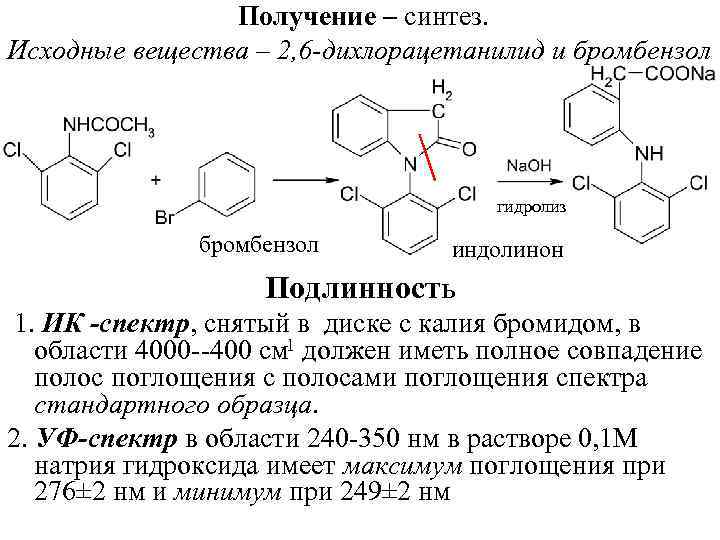
Получение – синтез. Исходные вещества – 2, 6 -дихлорацетанилид и бромбензол гидролиз бромбензол индолинон Подлинность 1. ИК -спектр, снятый в диске с калия бромидом, в 1 области 4000 400 см должен иметь полное совпадение полос поглощения с полосами поглощения спектра стандартного образца. 2. УФ-спектр в области 240 350 нм в растворе 0, 1 М натрия гидроксида имеет максимум поглощения при 276± 2 нм и минимум при 249± 2 нм
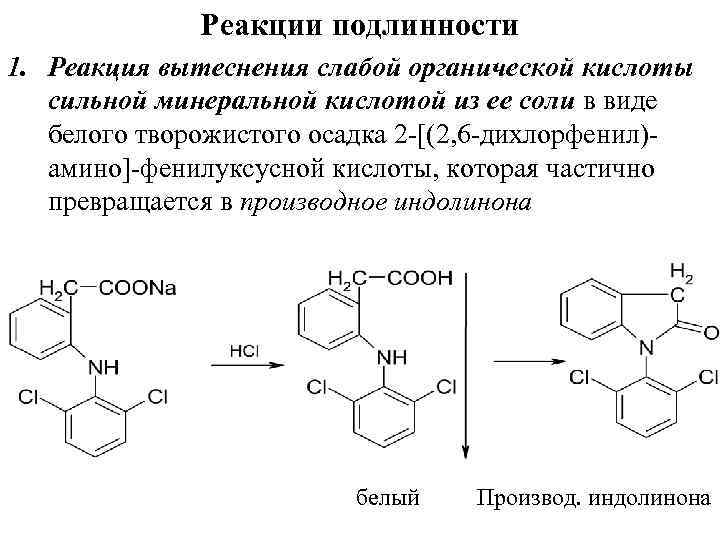
Реакции подлинности 1. Реакция вытеснения слабой органической кислоты сильной минеральной кислотой из ее соли в виде белого творожистого осадка 2 [(2, 6 дихлорфенил) амино] фенилуксусной кислоты, которая частично превращается в производное индолинона белый Производ. индолинона

1. Ион натрия пламя в желтый цвет. 2. Ионы хлора в фильтрате после восстановительной минерализации (прокаливания в тигле и растворения остатка в воде) реакция с серебра нитратом. 3. Реакции окисления: а) Реактив Марки при наслаивании на раствор препарата образует зелено белое кольцо б) При действии окислителей (дихромата калия, перманганата калия, йодата калия, натрия нитрита в среде конц серной кислоты) образуются окрашенные в различные цвета растворы. С нитритом натрия (на фрагмент дифениламина) – синее. в) При обработке кристаллов конц серной кислотой на часовом стекле, они приобретают малиновое окрашивание.
![[O] H 2 O HSO 4 Дифенилбензидин виолет синее окрашивание Реакции соле- и комплексообразования [O] H 2 O HSO 4 Дифенилбензидин виолет синее окрашивание Реакции соле- и комплексообразования](https://present5.com/presentation/58437765_167488567/image-24.jpg)
[O] H 2 O HSO 4 Дифенилбензидин виолет синее окрашивание Реакции соле- и комплексообразования (по карбоксильной группе). С нитратом серебра Аg. NО 3 – белый осадок С хлоридом железа (III) Fе. Сl 3 – жёлто коричневый осадок С сульфатом меди Cu. SО 4 – светло зеленый осадок

Чистота 1. Цветность определяют спектрофотометрическим методом. Оптическая плотность указанного раствора при длине волны λ=440 нм должна быть не более 0, 28. 2. Специфические примеси (продукты синтеза – наличие соответствующей кислоты и индолинона) определяют методом ВЭЖХ. Подвижная фаза: метанол – 0, 1% раствор ортофосфорной кислоты (6: 4). Детектор – спектрофотометр (λ= 254 нм). Количественное определение 1. Ацидuметрия в среде протогенного растворителя (неводное титрование). Титрант – хлорная кислота, среда – ледяная уксусная кислота (субстанция диклофенака-натрия). Т. э. ФС по потенциометрически или по индикатору кристаллическому фиолетовому. f. экв. (диклофенана натрия) = 1
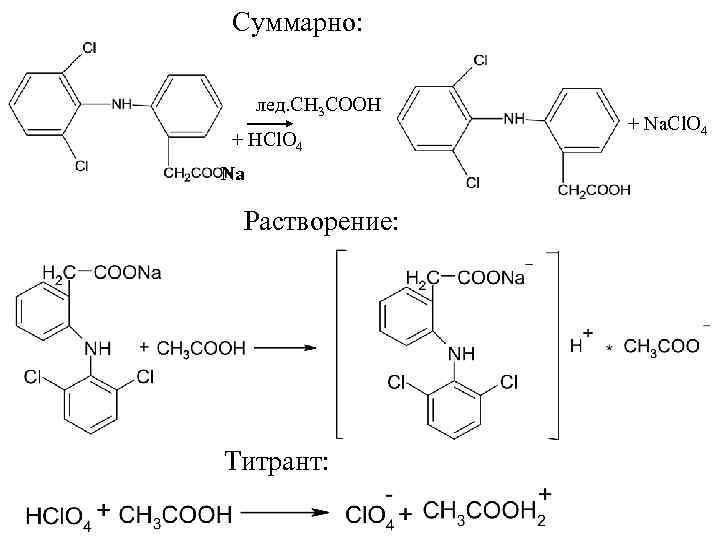
Суммарно: лед. CH 3 COOH + HCl. O 4 Na Растворение: Титрант: + Na. Cl. O 4
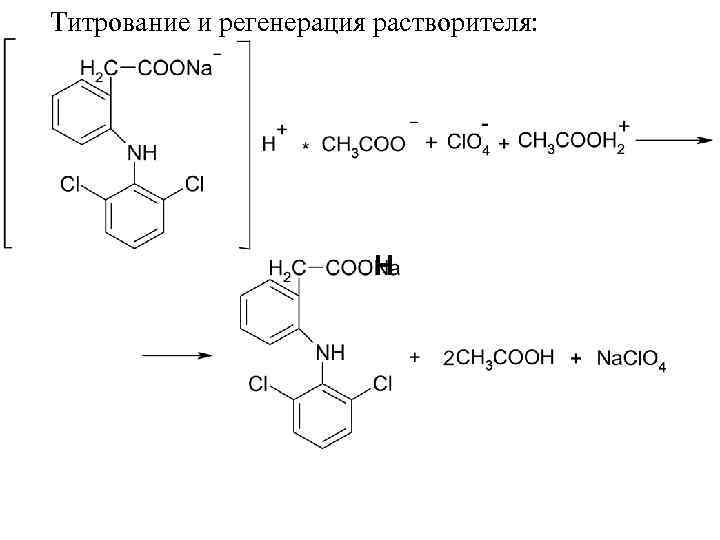
Титрование и регенерация растворителя: Н

2. Спектрофотометрия в УФ-области спектра (лекарственные препараты: мази, таблетки). Метод основан на свойстве препарата поглощать свет в УФ области спектра. Расчёт ведут по рабочему стандартному образцу (РСО). Готовим 2 раствора: Раствор № 1 – исследуемое вещество (Сх); раствор № 2 – стандартный образец иссл. вещества (Со); На спектрофотометре измеряем Dx и Do. Из закона Бугера– Ламберта – Бера следует, что:
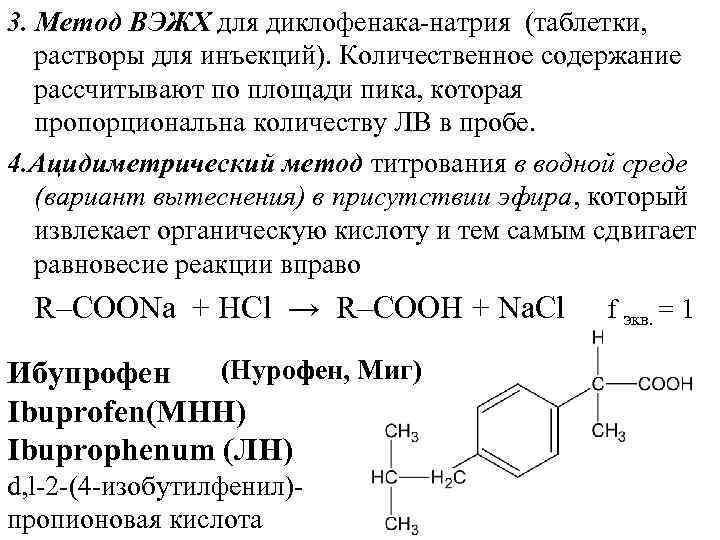
3. Метод ВЭЖХ для диклофенака натрия (таблетки, растворы для инъекций). Количественное содержание рассчитывают по площади пика, которая пропорциональна количеству ЛВ в пробе. 4. Ацuдuметрическuй метод титрования в водной среде (вариант вытеснения) в присутствии эфира, который извлекает органическую кислоту и тем самым сдвигает равновесие реакции вправо R–СООNа + НСl → R–COOH + Na. Cl (Нурофен, Миг) Ибупрофен Ibuprofen(МНН) Ibuprophenum (ЛН) d, l 2 (4 изобутилфенил) пропионовая кислота f экв. = 1

Подлинность 1. ИК-спектр ФС, снятый в диске с калия бромидом, в 1 области 4000 400 см должен иметь полное совпадение полос поглощения с полосами поглощения спектра стандартного образца. 2. УФ-спектр ФС раствора препарата в 0, 1 М натрия гидроксиде имеет максимумы 265 и 273 нм, а также плечо от 257 до 261 нм. 3. ВЭЖХ метод ФС. Время удерживания вещества на хроматограмме испытуемого раствора должно совпадать со временем удерживания на хроматограме раствора ГСО. ТСХ в таблетках – сравнение со стандартом (свидетелем).

Чистота 1. Цветность определяют спектрофотометрическим методом. Оптическая плотность указанного раствора при длине волны λ=440 нм должна быть не более 0, 28. 2. Посторонние примеси определяют: методом ГЖХ (по отношению суммы площадей пиков, обусловленных примесями, к площади пика ибупрофена). методом ТСХ Количественное определение ФС Алкалиметрия, вариант нейтрализации (по карбоксильной группе), растворитель и среда – этанол, индикатор – фенолфталеин. Ставят контрольный опыт (титруют без ЛВ)
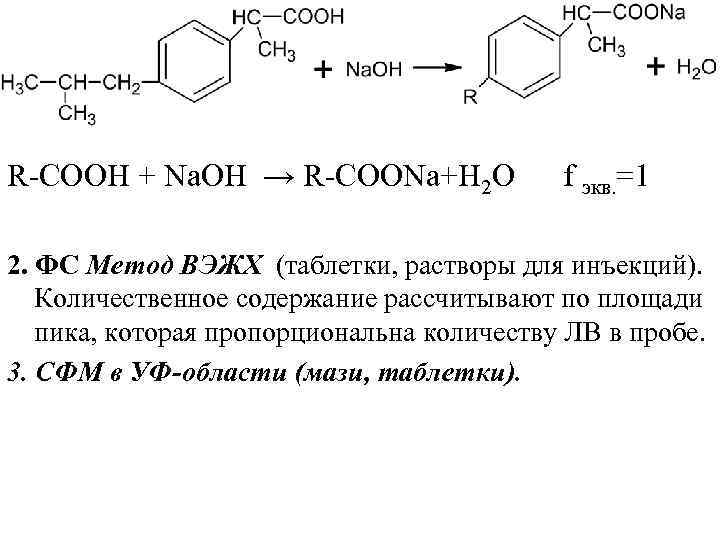
R СООН + Nа. ОН → R СООNа+Н 2 О f экв. =1 2. ФС Метод ВЭЖХ (таблетки, растворы для инъекций). Количественное содержание рассчитывают по площади пика, которая пропорциональна количеству ЛВ в пробе. 3. СФМ в УФ-области (мази, таблетки).

СФМ в УФ-. Формулы расчета концентрации Сх при использовании РСО (раствора стандартного образца) – Если C 0(%) РСО для субстанции (порошка) С% = Dх · C 0(%) D 0 | · Vк 1 · Vк 2 · а· Vпр | 1 2 3 1 часть – основа из закона Бугера– Ламберта – Бера 2 часть – пересчет на разведение (колбы, пипетки), где а – навеска сухого вещества в граммах, порошка таблеток или объем раствора, взятый для анализа Vк 1 и Vк 2 – объем разведения (1 и 2 колб) Vпр –объем пробы (пипетки) взятой из 1 разведения (Vк 1) для приготовления 2 разведения (Vк 2 ) 3 часть –пересчет на лекарственную форму

– Если C 0(г/мл) РСО для субстанции (порошка) С% = Dх · C 0(г/мл) D 0 | · Vк 1 · Vк 2 · а· Vпр | · 100% | · Рср. – Если C 0(%) РСО для таблеток, где Рср. – средний вес таблетки Сг/табл = Dх · C 0(%) D 0 | · Vк 1 · Vк 2 · а· Vпр · 100% – Если C 0(г/мл) РСО для таблеток Сг/табл= | Dх · C 0(г/мл) · Vк 1 · Vк 2 D 0 · а· Vпр | · Рср.

– Если C 0(%) РСО для инъекционных ЛФ заводского производства, Cх считают в граммах на 1 мл р-ра Сг/мл = Dх · C 0(%) D 0 · Vк 1 · Vк 2 | · а· Vпр | ·1 мл · 100% для жидких ЛФ аптечного производства, Cх считают в граммах на объём ЛФ (VЛФ ) = общий объем (Vобщ. ) С г/VЛФ = Dх · C 0(%) | · Vк 1 · Vк 2 D 0 · а· Vпр | · VЛФ · 100% – Если C 0(г/мл) РСО для инъекционных ЛФ зав. пр. Сг/мл= Dх · C 0(г/мл) D 0 | · Vк 1 · Vк 2 · а· Vпр |
производные бутирофенона
5_proizvodnye_PASK.pptx