947a83f15b50a8915de09f52ceb86505.ppt
- Количество слайдов: 52

PROIECT “CAIETUL DE LABORATOR AL SCOLII G. E. PALADE BUZAU” „Chimia nu este importantă doar pentru chimişti ci şi pentru filologi , căci aşa cum chimiştii au nevoie de cuvinte pentru a comunica, aşa şi filologii au nevoie de chimie pentru a trăi” 1

MOTIVAŢIA • Redactarea unui „Caiet de laborator” ce să cuprindă fişe de lucru de chimie experimentală a reprezentat o motivaţie. S-a dorit în special dezvoltarea limbajului specific chimiei, popularizarea activităţilor experimentale desfăşurate în cadrul orelor de chimie şi a rezultatelor obţinute de elevi la orele de curs. Experimentul este un mijloc fundamental al cunoaşterii şi modificării realităţii; în cadrul acestuia prin operaţii mentale şi manuale un proces este declanşat, influenţat şi finalizat, după un plan. • A experimenta înseamnă a-i pune pe elevi în situaţia de a concepe şi a practica ei înşişi un anumit gen de operaţii cu scopul de a observa, a studia, a dovedi, a verifica, a măsura rezultatele, o provocare intenţionată a unui fenomen în condiţii determinate în scopul observării comportamentului, al cercetării raporturilor de cauzalitate, al descoperirii legităţilor care îl guvernează, al verificării unor ipoteze.

• Chimia, fiind o ştiinţă experimentală care îşi bazează procesul teoretic şi îşi găseşte aplicativitatea practică în încercările de laborator, are la bază experimentul atât ca metodă de investigaţie ştiinţifică, cât şi ca metodă de învăţare. • Experimentul de laborator fie că este folosit pentru stimularea interesului faţă de noile informaţii, fie pentru învăţarea noilor noţiuni, fie ca mod de verificare şi consolidare a acestora sau de aplicare a lor (temă pentru acasă), rămâne o formă de activitate independentă a elevilor şi în acelaşi timp o cale de dezvoltare a interesului pentru chimie ca ştiinţă.

• COORDONATOR: prof. Stratone Aurica, prof. Velniceru Cristina • COLABORATOR: prof. Raicu Viorica, laborant Drăgnescu Adriana • PERIODA DERULĂRII: 2 -3 ani LOCUL DESFĂŞURĂRII: Şcoala”G. E. Palade” Buzău • GRUPUL ŢINTĂ: elevii şcolii ”G. E. Palade” Buzău

OBIECTIVE GENERALE: • stimularea creativităţii şi a dorinţei de afirmare; • cultivarea gustului pentru lectură, pentru frumuseţea experimentului chimic; • exersarea limbajului chimic şi a posibilităţilor de intercomunicare; • dezvoltarea gândirii critice; • formarea şi consolidarea deprinderilor practice; • evidenţierea laturii ”verzi” a chimiei şi a vastelor ei implicaţii în viaţa cotidiană.

OBIECTIVE SPECIFICE: • Elevii vor fi puşi în situaţia: • să selecteze materiale specifice chimiei şi nivelului gimnazial; • să imortalizeze în fotografii experimentele mai spectaculoase şi să le insereze în paginile caietului de laborator; • să-şi exprime anumite păreri şi sentimente faţă de implicaţiile chimiei în viaţa de zi cu zi; • să coopereze în diferite situaţii de comunicare; • să manifeste interes faţă de personalităţi din lumea chimiei;

• • RESURSE Umane: elevi, prof. chimie, laborant, bibliotecar (documentare), informatician (sprijin informatic) Materiale: Echipamente: calculator, aparat foto digital, aparat de filmat, videoproiector, imprimantă. Consumabile: hârtie A 3 şi A 4, xerox, scotch, tuş pentru imprimantă. Informaţionale: alte reviste, cărţi de specialitate, filme, înregistrări video, program AEL, enciclopedii ştiinţifice. De timp: 1 oră pe săptămână Financiare: sponsorizări , chirii etc. Susţinere din partea conducerii şcolii

MODALITĂŢI DE PUBLICITATE • Mediatizare pe site-ul şcolii şi în revista şcolii „Aripi de vis” • Prezentare la activităţi specifice în Cercurile Metodice ale profesorilor

Experimente soluţii • • În cadrul capitolului “SOLUŢII”, s-au urmărit 4 obiective –cadru cu un grad ridicat de generalizare şi complexitate, ce se referă la formarea unor capacităţi şi atitudini generate de specificul chimiei ca ştiinţă , precum şi obiective de referinţă ce urmăresc progresul în formarea de capacităţi şi achiziţia de cunoştiinţe ale elevului la orele de curs

1. Cunoaşterea şi înţelegerea fenomenelor chimice, a terminologiei şi a conceptelor specifice chimiei • Obiective de referinţă: La sfârsitul capitolului elevul va fi capabil: - să clasifice soluţiile, după unul sau mai multe criterii • Exemple de activităţi de învăţare • Se realizează următoarele activităţi : - observarea factorilor ce influenţează dizolvarea şi solubilitatea.

2. Dezvoltarea capacităţii de explorare /investigare a realităţii şi de rezolvare de probleme specifice chimiei • Obiective de referinţă: • La sfârşitul capitolului elevul va fi capabil: - să interpreteze rezultatele obţinute în urma unor investigaţii - să aplice regulile necesare în rezolvarea problemelor cantitative • Exemple de activităţi de învăţare • Se realizează urmatoarele activităţi - conducerea unor investigaţii pe tema diferenţierii solvatului de solvent - rezolvarea de probleme referitoare la concentraţia în procente de masă a soluţiilor

3. Dezvoltarea capacităţii de comunicare , utilizând limbajul specific domeniului chimiei • Obiective de referinţă: • La sfârşitul capitolului elevul va fi capabil: - să discute informaţia obţinută, în scopul rezolvării unor probleme de natură ştiinţifică • Fxemple de activităţi de învăţare • Se realizează urmatoarele activităţi - comunicarea sub formă scrisă /orală a informaţiilor, privind aplicaţiile practice ale unor soluţii.

4. Formarea unor valori şi atitudini referitoare la impactul chimiei asupra naturii şi a societăţii • Obiective de referinţă • La sfârşitul capitolului elevul va fi capabil: - să evalueze factorii de risc rezultaţi în urma aplicării în practică a unor soluţii. • Exemple de activităţi de învăţare • Se realizează următoarele activităţi: - identificarea factorilor de risc rezultaţi în urma aplicării în practică a unor soluţii.


• piatră vânătă; Soluţii de apa + alcool; iod + alcool



ZAHĂR BRUN

• Zahăr brun tos zahăr brun pudră

Dizolvarea zahărului pudră în apă

Dizolvarea zahărului tos în apă
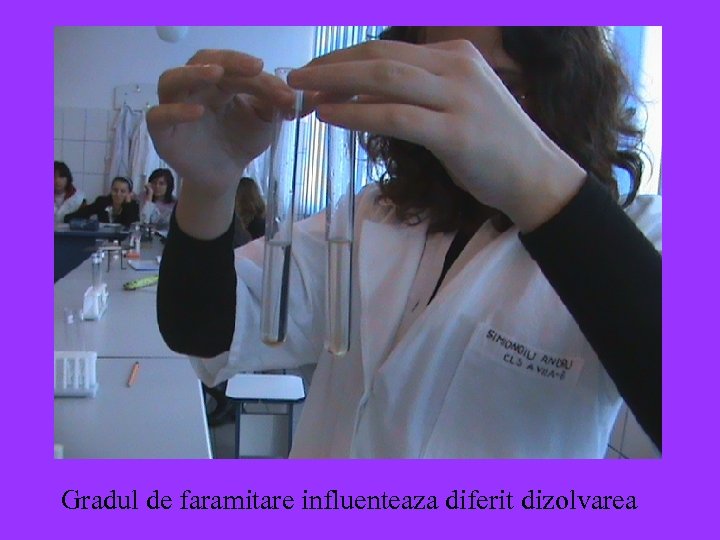
Gradul de faramitare influenteaza diferit dizolvarea



Încălzire solvent (apa)

Temperatura solventului influenţează diferit dizolvarea


Influenţa temperaturii asupra dizolvării gazelor


Agitarea influenţează diferit dizolvarea



Amestec omogen Apa + piatra vânătă amestec eterogen apa + nisip
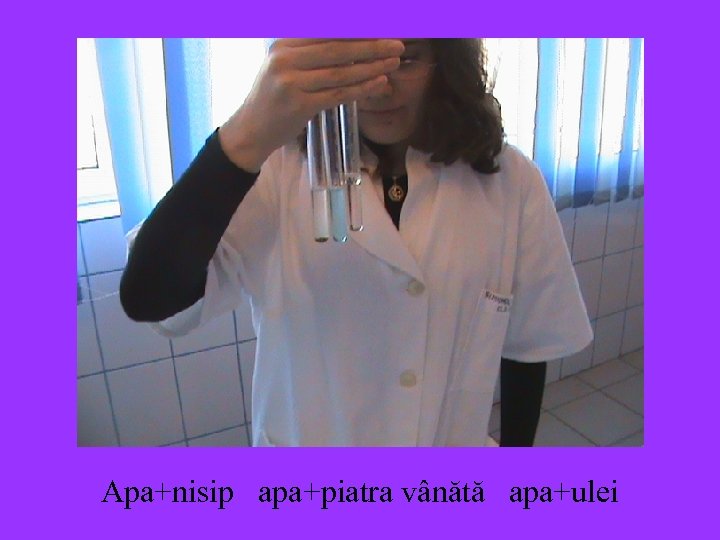
Apa+nisip apa+piatra vânătă apa+ulei



• Amestec eterogen – Apa + oja amestec omogen acetona + oja

• Amestec eterogen apa + lac de unghii • Amestec omogen acetona + lac de unghii



• Influenţa temperaturii asupra apei carbogazoase

• Bule de gaz pe pereţii interiorii ai eprubetei


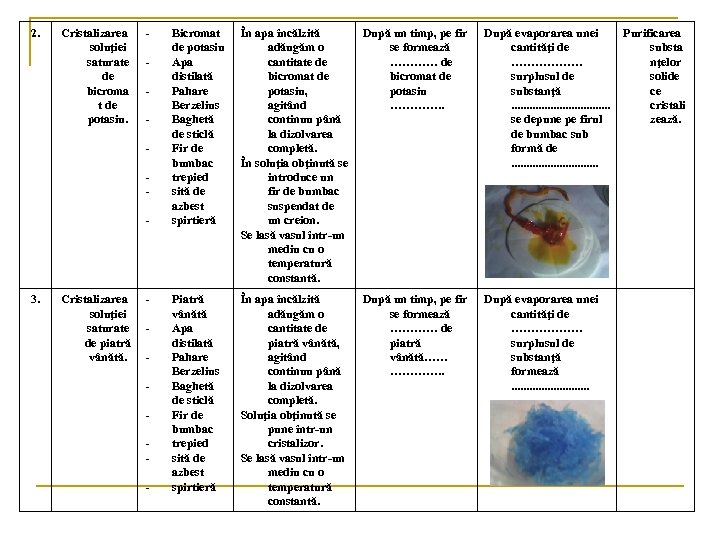
2. Cristalizarea soluţiei saturate de bicroma t de potasiu. - 3. Cristalizarea soluţiei saturate de piatră vânătă. - Bicromat de potasiu Apa distilată Pahare Berzelius Baghetă de sticlă Fir de bumbac trepied sită de azbest spirtieră În apa încălzită adăugăm o cantitate de bicromat de potasiu, agitând continuu până la dizolvarea completă. În soluţia obţinută se introduce un fir de bumbac suspendat de un creion. Se lasă vasul într-un mediu cu o temperatură constantă. După un timp, pe fir se formează ………… de bicromat de potasiu …………. . După evaporarea unei cantităţi de ……………… surplusul de substanţă. . . . se depune pe firul de bumbac sub formă de. . . . Piatră vânătă Apa distilată Pahare Berzelius Baghetă de sticlă Fir de bumbac trepied sită de azbest spirtieră În apa încălzită adăugăm o cantitate de piatră vânătă, agitând continuu până la dizolvarea completă. Soluţia obţinută se pune într-un cristalizor. Se lasă vasul într-un mediu cu o temperatură constantă. După un timp, pe fir se formează ………… de piatră vânătă…… …………. . După evaporarea unei cantităţi de ……………… surplusul de substanţă formează. . . Purificarea substa nţelor solide ce cristali zează.
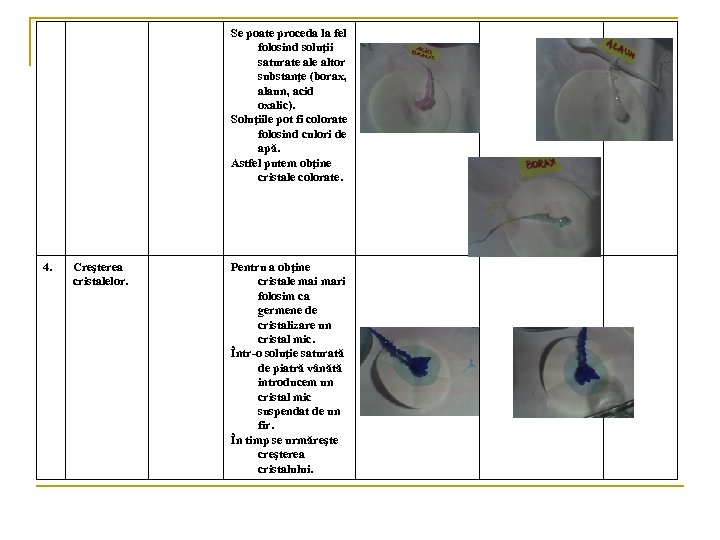
Se poate proceda la fel folosind soluţii saturate altor substanţe (borax, alaun, acid oxalic). Soluţiile pot fi colorate folosind culori de apă. Astfel putem obţine cristale colorate. 4. Creşterea cristalelor. Pentru a obţine cristale mai mari folosim ca germene de cristalizare un cristal mic. Într-o soluţie saturată de piatră vânătă introducem un cristal mic suspendat de un fir. În timp se urmăreşte creşterea cristalului.

5. Îngheţarea soluţiilor. -acetat de sodiu -Apa distilată -Pahare Berzelius -Baghetă de sticlă -trepied -sită de azbest -spirtieră În apa încălzită adăugăm o cantitate de acetat de sodiu, agitănd continuu până la dizolvarea completă. Soluţia se menţine la temperatură constantă până se evaporă o parte din solvent. Se introduce în frigider până a doua zi. Se toarnă soluţia întrun cristalizor în care se aruncă un germene de cristalizare (un cristal mic). Instantaneu se produce cristalizarea (îngheţarea soluţiei).

LUCRARE DE LABORATOR - FIŞA DENSITATEA SOLUŢIEI DE CONCENTRAŢII DIFERITE 1. Enunţul problemei: Arătaţi cum variază densitatea soluţiei de sare de bucătărie în funcţie de concentraţie folosind datele din tabelul de mai jos: 2. Completarea tabelului: Soluţie Dizolvant Componentele soluţiei 1 Masa (grame) 2 C% Densitate (ρ) solutie g/ml Dizolvat 3 1 2 3 200 200 5% 10% 1 15% Volum (ml) 3. Scopul lucrării: VARIAŢIA DENSITĂŢII SOLUŢIEI DE SARE ÎN FUNCŢIE DE CONCENTRAŢIA ÎN PROCENTE DE MASĂ 2 3

4. Aparatura: balanţă electronică, densimetru. 5. Materiale şi substanţe: pahar Berzelius, cilindru gradat, spatulă, pipetă, baghetă de sticlă, sticlă de ceas, apă, sare de bucătărie. 6. Mod de lucru: Determinăm prin cântărire masa sticlei de ceas (ma) ma = …………………. g Se pun cu spatula cu mare atenţie ……………. . g sare de bucătărie. Se cântăreşte paharul Berzelius gol (mb ) mb = ……………. . g • Se măsoară cu cilindrul gradat ……………. . ml apă distilată, aducând nivelul apei până la gradaţia necesară cu ajutorul pipetei (nivelul apei se ia după meniscul de jos, situat la nivelul ochilor). • Se toarnă apa în paharul Berzelius şi se adaugă cele …………………. . grame sare. • Se agită până la dizolvarea completă a sării. • Se toarnă soluţia de sare în cilindrul gradat şi se determină volumul soluţiei. • Prin calcul matematic utilizând formula de calcul a densităţii: ρ = m/V se determină densitatea soluţiei. • Se verifică densitatea soluţiei folosind densimetru. 7. Concluzii: Densitatea soluţiei …………… odată cu …………………. concentraţiei în procente de masă.

4. Aparatura: balanţă electronică, densimetru. 5. Materiale şi substanţe: pahar Berzelius, cilindru gradat, spatulă, pipetă, baghetă de sticlă, sticlă de ceas, apă, sare de bucătărie. 6. Mod de lucru: Determinăm prin cântărire masa sticlei de ceas (ma) ma = …………. g Se pun cu spatula cu mare atenţie 10 g sare de bucătărie. Se cântăreşte paharul Berzelius gol (mb ) mb = …. . ……. . g • Se măsoară cu cilindrul gradat 190 ml apă distilată, aducând nivelul apei până la gradaţia necesară cu ajutorul pipetei (nivelul apei se ia după meniscul de jos, situat la nivelul ochilor). • Se toarnă apa în paharul Berzelius şi se adaugă cele 10 g sare. • Se agită până la dizolvarea completă a sării. • Se toarnă soluţia de sare în cilindrul gradat şi se determină volumul soluţiei. Prin calcul matematic utilizând formula de calcul a densităţii: ρ = m/V se determină densitatea soluţiei. • Se verifică densitatea soluţiei folosind densimetru. (Se pot compara densităţile soluţiei de sare de diferite concentraţii empiric folosind un ou crud. )

• • • 7. Enunţul problemei : Amestecaţi 50 ml soluţie de concentraţie 5% cu 50 ml soluţie de concentraţie 15%. Calculaţi: concentraţia soluţiei nou obţinute şi verificaţi densitatea atât prin calcul matematic cât şi practic; se adaugă 5 g sare peste 50 ml soluţie de la punctul a) ; calculaţi concentraţia şi densitatea soluţiei nou formate; se adaugă 50 ml apă distilată peste 50 ml soluţie de la punctul a); calculaţi concentraţia şi densitatea soluţiei nou formate. Treceţi rezultatele obţinute în următorul tabel: MASA SOLUŢIEI ms a b CONCENTRAŢIA ÎN PROCENTE DE MASĂ C % c a b c DENSITATEA ρ g/ml a b c 8. Scopul lucrării: VARIAŢIA DENSITĂŢII PRIN CONCENTRAREA SAU DILUAREA SOLUŢIEI DE SARE 9. Concluzii: Densitatea soluţiei ………… odată cu ……………. concentraţiei în procente de masă. Concentraţia soluţiei ………………. . prin adăugare de ……………. Diluarea unei soluţii se face prin adăugare de ………………. .
Sfarşit
947a83f15b50a8915de09f52ceb86505.ppt