39e74b39d1e13dde75b1ab08d6ab30f3.ppt
- Количество слайдов: 29
 Программа повышения квалификации «Основы надлежащей практики фармаконадзора. Организация работы уполномоченного лица» 17 -19 мая 2016 Практическая организация качественного документооборота по фармаконадзору Твердохлеб Павел Евгеньевич/Прохорова Татьяна Владимировна
Программа повышения квалификации «Основы надлежащей практики фармаконадзора. Организация работы уполномоченного лица» 17 -19 мая 2016 Практическая организация качественного документооборота по фармаконадзору Твердохлеб Павел Евгеньевич/Прохорова Татьяна Владимировна
 Качественный документооборот. Основные подходы q Фармаконадзор требует тщательного документирования и создания надежной системы документирования q Документация первоисточников (source documents) q Все активности по обработке и анализу случая должны документироваться и отслеживаться q База данных как технический ресурс документирования информации о НЯ q Архивирование и хранение данных: особые условия и требования q Защита персональной информации q Обмен данными между участниками процесса ФН
Качественный документооборот. Основные подходы q Фармаконадзор требует тщательного документирования и создания надежной системы документирования q Документация первоисточников (source documents) q Все активности по обработке и анализу случая должны документироваться и отслеживаться q База данных как технический ресурс документирования информации о НЯ q Архивирование и хранение данных: особые условия и требования q Защита персональной информации q Обмен данными между участниками процесса ФН
 Система документирования. Законодательные аспекты для держателей регистрационного удостоверения 2. 8. Управление документацией 2. 8. 1. Система управления документацией является частью системы качества, распространяется на все документы системы фармаконадзора и обеспечивает возможность поиска данных и прослеживаемость выполняемых процедур, включая процедуры по оценке новых данных по безопасности в отношении времени выполнения оценки и принятых решений. 2. 8. 2. Система управления документацией должна обеспечивать: а) качество данных по фармаконадзору, включая полноту, точность и целостность; б) эффективную внутреннюю и внешнюю передачу данных; в) сохранение документов, имеющих отношение к системам фармаконадзора и осуществления фармаконадзора по каждому из лекарственных препаратов, согласно применимым срокам хранения. 2. 8. 3. Держатель регистрационного удостоверения лекарственного препарата (далее - держатель регистрационного удостоверения) должен обеспечить надлежащее документирование, обращение и хранение всей информации по фармаконадзору с целью выполнения процедур точного репортирования, интерпретации и верификации данных. Держателем регистрационного удостоверения должна быть обеспечена система прослеживаемости и последующей оценки сообщений о нежелательных реакциях. 2. 8. 4. Система управления документацией должна включать в себя комплекс мер по обеспечению безопасности и конфиденциальности данных в целях выполнения требований по защите персональных данных пациентов в соответствии с требованиями законодательства государства-члена. Указанные меры должны включать в себя строгое ограничение, согласно которому доступ к документации и базам данных имеется только у уполномоченных лиц. 2. 8. 5. Система управления документацией должна включать в себя процессы обеспечения защиты информации по фармаконадзору от потери и разрушения. Проект GVP EAU (01 Jan 2016)
Система документирования. Законодательные аспекты для держателей регистрационного удостоверения 2. 8. Управление документацией 2. 8. 1. Система управления документацией является частью системы качества, распространяется на все документы системы фармаконадзора и обеспечивает возможность поиска данных и прослеживаемость выполняемых процедур, включая процедуры по оценке новых данных по безопасности в отношении времени выполнения оценки и принятых решений. 2. 8. 2. Система управления документацией должна обеспечивать: а) качество данных по фармаконадзору, включая полноту, точность и целостность; б) эффективную внутреннюю и внешнюю передачу данных; в) сохранение документов, имеющих отношение к системам фармаконадзора и осуществления фармаконадзора по каждому из лекарственных препаратов, согласно применимым срокам хранения. 2. 8. 3. Держатель регистрационного удостоверения лекарственного препарата (далее - держатель регистрационного удостоверения) должен обеспечить надлежащее документирование, обращение и хранение всей информации по фармаконадзору с целью выполнения процедур точного репортирования, интерпретации и верификации данных. Держателем регистрационного удостоверения должна быть обеспечена система прослеживаемости и последующей оценки сообщений о нежелательных реакциях. 2. 8. 4. Система управления документацией должна включать в себя комплекс мер по обеспечению безопасности и конфиденциальности данных в целях выполнения требований по защите персональных данных пациентов в соответствии с требованиями законодательства государства-члена. Указанные меры должны включать в себя строгое ограничение, согласно которому доступ к документации и базам данных имеется только у уполномоченных лиц. 2. 8. 5. Система управления документацией должна включать в себя процессы обеспечения защиты информации по фармаконадзору от потери и разрушения. Проект GVP EAU (01 Jan 2016)
 Реализация системы документирования на практике. База данных ARGUS Электронная система, позволяющая: - вводить данные отслеживать статус каждого случая НЯ документировать FU информацию осуществлять поиск случая на предмет дублирования (duplicate search) - хранить информацию - анализировать данные - формировать отчеты из массива данных по заданным параметрам - обмениваться данными между участниками ФН процесса (регуляторные органы, исследователи, контрактные агенты и т. п. ) - доступ только у авторизованных лиц
Реализация системы документирования на практике. База данных ARGUS Электронная система, позволяющая: - вводить данные отслеживать статус каждого случая НЯ документировать FU информацию осуществлять поиск случая на предмет дублирования (duplicate search) - хранить информацию - анализировать данные - формировать отчеты из массива данных по заданным параметрам - обмениваться данными между участниками ФН процесса (регуляторные органы, исследователи, контрактные агенты и т. п. ) - доступ только у авторизованных лиц
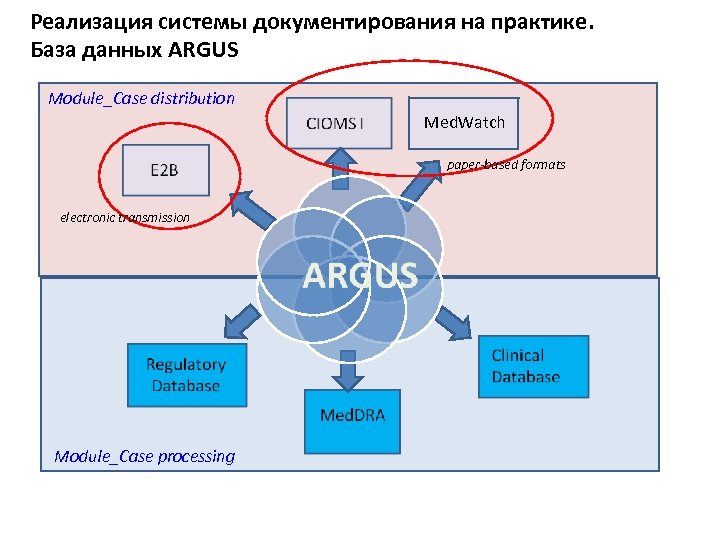 Реализация системы документирования на практике. База данных ARGUS Module_Case distribution Med. Watch paper-based formats electronic transmission Module_Case processing
Реализация системы документирования на практике. База данных ARGUS Module_Case distribution Med. Watch paper-based formats electronic transmission Module_Case processing
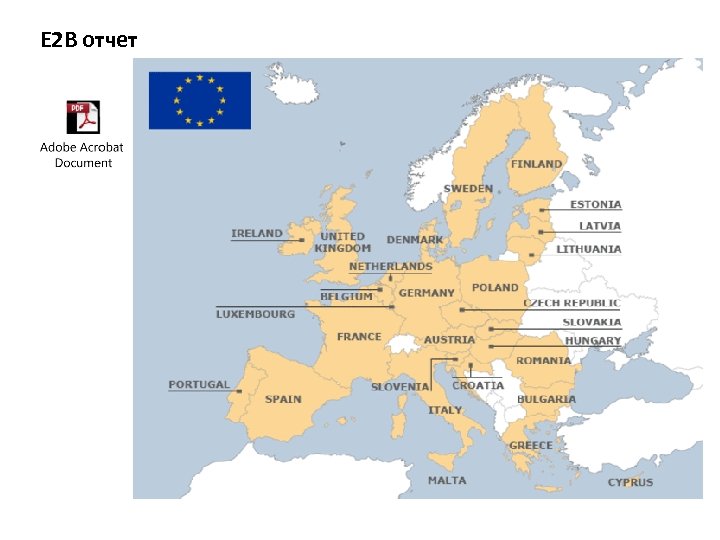
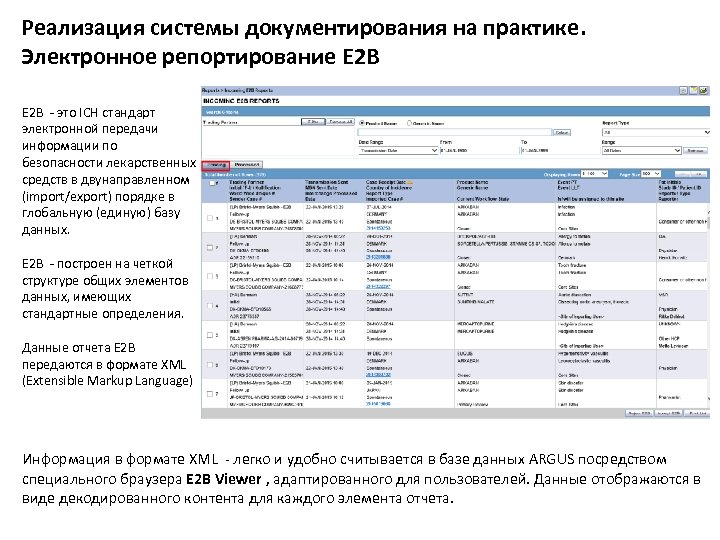 Реализация системы документирования на практике. Электронное репортирование E 2 В E 2 B - это ICH стандарт электронной передачи информации по безопасности лекарственных средств в двунаправленном (import/export) порядке в глобальную (единую) базу данных. E 2 B - построен на четкой структуре общих элементов данных, имеющих стандартные определения. Данные отчета E 2 B передаются в формате XML (Extensible Markup Language) Информация в формате XML - легко и удобно считывается в базе данных ARGUS посредством специального браузера E 2 B Viewer , адаптированного для пользователей. Данные отображаются в виде декодированного контента для каждого элемента отчета.
Реализация системы документирования на практике. Электронное репортирование E 2 В E 2 B - это ICH стандарт электронной передачи информации по безопасности лекарственных средств в двунаправленном (import/export) порядке в глобальную (единую) базу данных. E 2 B - построен на четкой структуре общих элементов данных, имеющих стандартные определения. Данные отчета E 2 B передаются в формате XML (Extensible Markup Language) Информация в формате XML - легко и удобно считывается в базе данных ARGUS посредством специального браузера E 2 B Viewer , адаптированного для пользователей. Данные отображаются в виде декодированного контента для каждого элемента отчета.
 Внедрение E 2 B: история вопроса - на протяжении многих лет существует система обмена данными по медицинской безопасности в формате бумажных носителей (Yellow Cards, CIOMS I forms, Med. Watch forms) или в формате электронных носителей (on-line access, tape, CD) - учитывая тот факт, что количество сообщений (ICSR) и количество участников процесса ФН (репортеры) неукоснительно растет в мировом масштабе, возникала необходимость создать стандартизированный формат обмена сообщениями, который позволял бы осуществлять передачу данных из одной базы данных в другую в едином формате; успешной электронной передаче информации способствует точная и унифицированная интерпретация определений для каждого элемента данных - огромное количество поступивших сообщений о нежелательных явлениях стало важным компонентом глобального фармаконадзора - 1997 – разработан стандарт для электронного репортирования ICH E 2 B (R 2), прошедший в последующие несколько лет несколько пересмотров и апдейтов
Внедрение E 2 B: история вопроса - на протяжении многих лет существует система обмена данными по медицинской безопасности в формате бумажных носителей (Yellow Cards, CIOMS I forms, Med. Watch forms) или в формате электронных носителей (on-line access, tape, CD) - учитывая тот факт, что количество сообщений (ICSR) и количество участников процесса ФН (репортеры) неукоснительно растет в мировом масштабе, возникала необходимость создать стандартизированный формат обмена сообщениями, который позволял бы осуществлять передачу данных из одной базы данных в другую в едином формате; успешной электронной передаче информации способствует точная и унифицированная интерпретация определений для каждого элемента данных - огромное количество поступивших сообщений о нежелательных явлениях стало важным компонентом глобального фармаконадзора - 1997 – разработан стандарт для электронного репортирования ICH E 2 B (R 2), прошедший в последующие несколько лет несколько пересмотров и апдейтов
 Зачем нужен стандартизированный формат и электронный обмен данными о НЯ (ICSR)? • Электронное репортирование ускоряет передачу информации и обеспечивает мгновенный доступ к данным для дальнейшей их обработки и анализа. Это позволяет регуляторам, держателям регистрационных удостоверений, медицинским работникам и потребителям быть своевременно информированными о решениях в отношении использования лекарств. • Гармонизированный стандарт электронного репортирования позволяет добиться максимальной совместимости данных и избежать ряд технических сложностей, связанных с обработкой информации. • В Японии, США, странах Европейского союза гармонизированный стандарт электронного репортирования E 2 B был принят на протяжении последних 10 лет, и на сегодняшний день система электронного репортирования продолжает успешно использоваться и совершенствоваться. • Е 2 В реализует систему глобального фармаконадзора для ВСЕХ типов медицинских продуктов, включая исследуемые и маркетируемые препараты, охватывая разные по химическому/органическому составу - биотехнологические препараты, вакцины, косметические, ветеринарные, растительные препараты и т. д.
Зачем нужен стандартизированный формат и электронный обмен данными о НЯ (ICSR)? • Электронное репортирование ускоряет передачу информации и обеспечивает мгновенный доступ к данным для дальнейшей их обработки и анализа. Это позволяет регуляторам, держателям регистрационных удостоверений, медицинским работникам и потребителям быть своевременно информированными о решениях в отношении использования лекарств. • Гармонизированный стандарт электронного репортирования позволяет добиться максимальной совместимости данных и избежать ряд технических сложностей, связанных с обработкой информации. • В Японии, США, странах Европейского союза гармонизированный стандарт электронного репортирования E 2 B был принят на протяжении последних 10 лет, и на сегодняшний день система электронного репортирования продолжает успешно использоваться и совершенствоваться. • Е 2 В реализует систему глобального фармаконадзора для ВСЕХ типов медицинских продуктов, включая исследуемые и маркетируемые препараты, охватывая разные по химическому/органическому составу - биотехнологические препараты, вакцины, косметические, ветеринарные, растительные препараты и т. д.
 Преимущества электронного репортирования и обмена информацией в формате Е 2 В для ICSR - обеспечивает более эффективный обмен данными и обработку информации, содержащейся в индивидуальном сообщении о НЯ (ICSR) - облегчает передачу информации в организации, которым нужна эта информация (например, submit to other manufacturer) - позволяет автоматически направлять, распределять и обрабатывать сообщения на протяжении всего цикла движения кейса (case workflow) - облегчает собирать (агрегировать) данные по безопасности для последующего анализа - позволяет минимизировать ресурсы, требуемые для выполнения активностей, связанных с ручным вводом данных
Преимущества электронного репортирования и обмена информацией в формате Е 2 В для ICSR - обеспечивает более эффективный обмен данными и обработку информации, содержащейся в индивидуальном сообщении о НЯ (ICSR) - облегчает передачу информации в организации, которым нужна эта информация (например, submit to other manufacturer) - позволяет автоматически направлять, распределять и обрабатывать сообщения на протяжении всего цикла движения кейса (case workflow) - облегчает собирать (агрегировать) данные по безопасности для последующего анализа - позволяет минимизировать ресурсы, требуемые для выполнения активностей, связанных с ручным вводом данных
 Необходимые требования и ключевые элементы электронного репортирования Вся доступная информация должна репортироваться в абсолютно структурированном формате с использованием необходимых E 2 B элементов информации и надлежащих стандартных терминологий, включающих: - ISO (коды страны, пол пациента, язык) - MEd. DRA (т. е. история болезни, показание, нежелательное явление/реакция) - UCUM (единицы измерения) - ICH M 5 IDMP (идентификационные коды медицинских продуктов) - XML schema
Необходимые требования и ключевые элементы электронного репортирования Вся доступная информация должна репортироваться в абсолютно структурированном формате с использованием необходимых E 2 B элементов информации и надлежащих стандартных терминологий, включающих: - ISO (коды страны, пол пациента, язык) - MEd. DRA (т. е. история болезни, показание, нежелательное явление/реакция) - UCUM (единицы измерения) - ICH M 5 IDMP (идентификационные коды медицинских продуктов) - XML schema
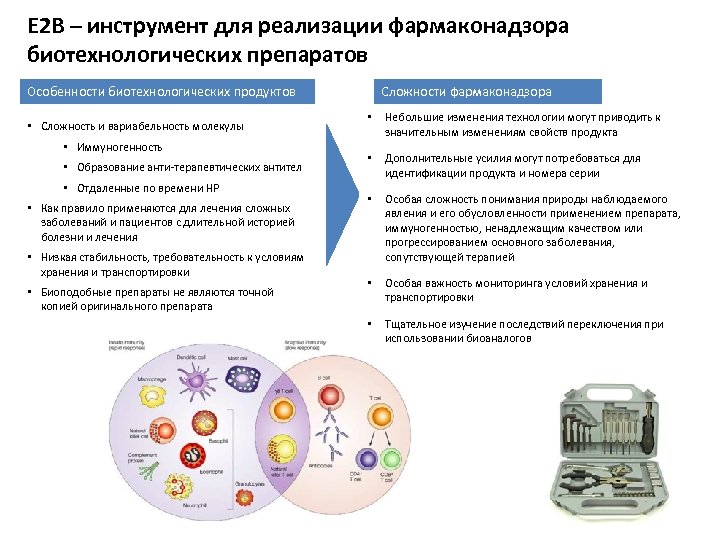 Е 2 В – инструмент для реализации фармаконадзора биотехнологических препаратов Сложности фармаконадзора Особенности биотехнологических продуктов • Сложность и вариабельность молекулы • Иммуногенность • Образование анти-терапевтических антител • Отдаленные по времени НР • Как правило применяются для лечения сложных заболеваний и пациентов с длительной историей болезни и лечения • Низкая стабильность, требовательность к условиям хранения и транспортировки • Биоподобные препараты не являются точной копией оригинального препарата • Небольшие изменения технологии могут приводить к значительным изменениям свойств продукта • Дополнительные усилия могут потребоваться для идентификации продукта и номера серии • Особая сложность понимания природы наблюдаемого явления и его обусловленности применением препарата, иммуногенностью, ненадлежащим качеством или прогрессированием основного заболевания, сопутствующей терапией • Особая важность мониторинга условий хранения и транспортировки • Тщательное изучение последствий переключения при использовании биоаналогов
Е 2 В – инструмент для реализации фармаконадзора биотехнологических препаратов Сложности фармаконадзора Особенности биотехнологических продуктов • Сложность и вариабельность молекулы • Иммуногенность • Образование анти-терапевтических антител • Отдаленные по времени НР • Как правило применяются для лечения сложных заболеваний и пациентов с длительной историей болезни и лечения • Низкая стабильность, требовательность к условиям хранения и транспортировки • Биоподобные препараты не являются точной копией оригинального препарата • Небольшие изменения технологии могут приводить к значительным изменениям свойств продукта • Дополнительные усилия могут потребоваться для идентификации продукта и номера серии • Особая сложность понимания природы наблюдаемого явления и его обусловленности применением препарата, иммуногенностью, ненадлежащим качеством или прогрессированием основного заболевания, сопутствующей терапией • Особая важность мониторинга условий хранения и транспортировки • Тщательное изучение последствий переключения при использовании биоаналогов
 Е 2 В отчет
Е 2 В отчет
 Реализация системы документирования на практике. Хранение информации и защита данных Документы по фармаконадзору – это информация о пациентах и лекарствах; система хранения информации по фармаконадзору – самая требовательная: • Специальные условия хранения документации (water protected, locked cabinets, separate room, authorized access) • Сроки хранения (unlimited time) • Защита информации (information protection and privacy policy) • Бумажный архив • Электронный архив (shared local drives)
Реализация системы документирования на практике. Хранение информации и защита данных Документы по фармаконадзору – это информация о пациентах и лекарствах; система хранения информации по фармаконадзору – самая требовательная: • Специальные условия хранения документации (water protected, locked cabinets, separate room, authorized access) • Сроки хранения (unlimited time) • Защита информации (information protection and privacy policy) • Бумажный архив • Электронный архив (shared local drives)
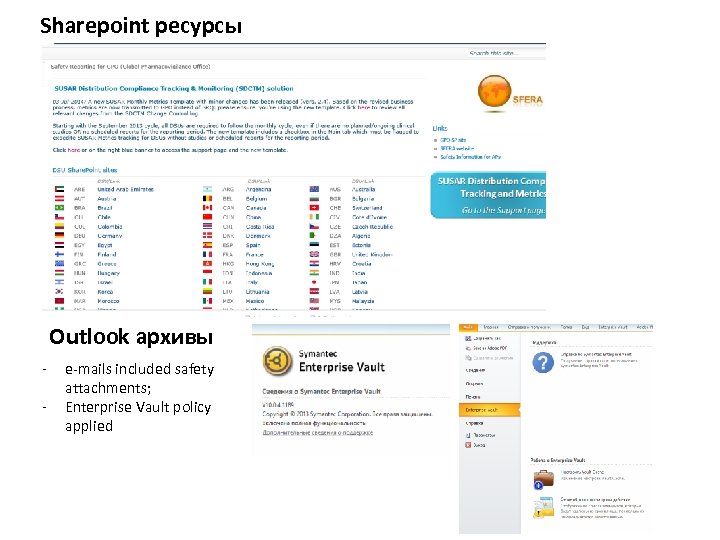 Sharepoint ресурсы Outlook архивы - e-mails included safety attachments; Enterprise Vault policy applied
Sharepoint ресурсы Outlook архивы - e-mails included safety attachments; Enterprise Vault policy applied
 Спасибо!
Спасибо!
 Программа повышения квалификации «Основы надлежащей практики фармаконадзора. Организация работы уполномоченного лица» 17 -19 мая 2016 Практические аспекты инспектирования и аудита системы фармаконадзора Твердохлеб Павел Евгеньевич/Прохорова Татьяна Владимировна
Программа повышения квалификации «Основы надлежащей практики фармаконадзора. Организация работы уполномоченного лица» 17 -19 мая 2016 Практические аспекты инспектирования и аудита системы фармаконадзора Твердохлеб Павел Евгеньевич/Прохорова Татьяна Владимировна
 Фармаконадзор – одна из самых подвергаемых проверкам областей, поскольку все процессы в рамках фармаконадзора связаны с выполнением жестких требований локального законодательства и соблюдений временных рамок репортирования. Но самое главное – эта область связана с рисками в отношении безопасности пациентов, оценкой качества использования лекарственных средств и прямым влиянием на оценку соотношения пользариск для лекарственного препарата.
Фармаконадзор – одна из самых подвергаемых проверкам областей, поскольку все процессы в рамках фармаконадзора связаны с выполнением жестких требований локального законодательства и соблюдений временных рамок репортирования. Но самое главное – эта область связана с рисками в отношении безопасности пациентов, оценкой качества использования лекарственных средств и прямым влиянием на оценку соотношения пользариск для лекарственного препарата.
 Проверки Инспекция Внешние проверки системы фармаконадзора держателя регистрационного удостоверения, проводимые уполномоченным органом страны (инспектор). Опыта проведения инспекции по фармаконадзору ФН в России и странах ЕАЭС не было на протяжении последних 10 -15 лет. Аудит Внутренние проверки системы фармаконадзора держателя регистрационного удостоверения, проводимые силами уполномоченных сотрудников компании (аудиторов). Это систематические и независимые проверки активностей и документов с целью определить, проводились ли эти активности и документировались ли они согласно установленным процедурам и регуляторным требованиям.
Проверки Инспекция Внешние проверки системы фармаконадзора держателя регистрационного удостоверения, проводимые уполномоченным органом страны (инспектор). Опыта проведения инспекции по фармаконадзору ФН в России и странах ЕАЭС не было на протяжении последних 10 -15 лет. Аудит Внутренние проверки системы фармаконадзора держателя регистрационного удостоверения, проводимые силами уполномоченных сотрудников компании (аудиторов). Это систематические и независимые проверки активностей и документов с целью определить, проводились ли эти активности и документировались ли они согласно установленным процедурам и регуляторным требованиям.
 Аудит vs. Инспекция Найдите различия Инспекция Замечания могут поставить под угрозу деятельность компании Строгий контроль над действиями инспектора (со стороны ДРУ) Инспектор из регуляторного органа Нет контроля над действиями аудитора (со стороны ДРУ) Внутренний аудитор (Комплайенс Менеджер) Аудит Замечания хранятся внутри компании (в виде аудиторского отчета)
Аудит vs. Инспекция Найдите различия Инспекция Замечания могут поставить под угрозу деятельность компании Строгий контроль над действиями инспектора (со стороны ДРУ) Инспектор из регуляторного органа Нет контроля над действиями аудитора (со стороны ДРУ) Внутренний аудитор (Комплайенс Менеджер) Аудит Замечания хранятся внутри компании (в виде аудиторского отчета)
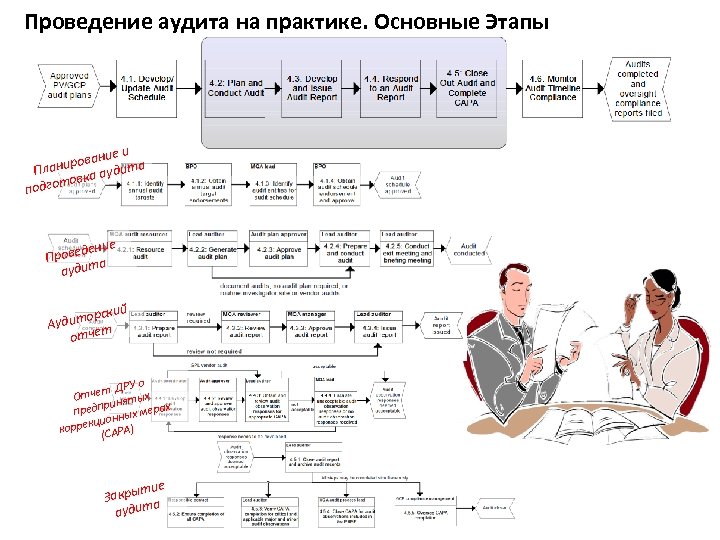 Проведение аудита на практике. Основные Этапы и вание аниро аудита Пл товка подго дение Прове а аудит рский удито А отчет ДРУ о тчет ятых О рин предп ных мерах кцион корре (CAPA) тие Закры а аудит
Проведение аудита на практике. Основные Этапы и вание аниро аудита Пл товка подго дение Прове а аудит рский удито А отчет ДРУ о тчет ятых О рин предп ных мерах кцион корре (CAPA) тие Закры а аудит
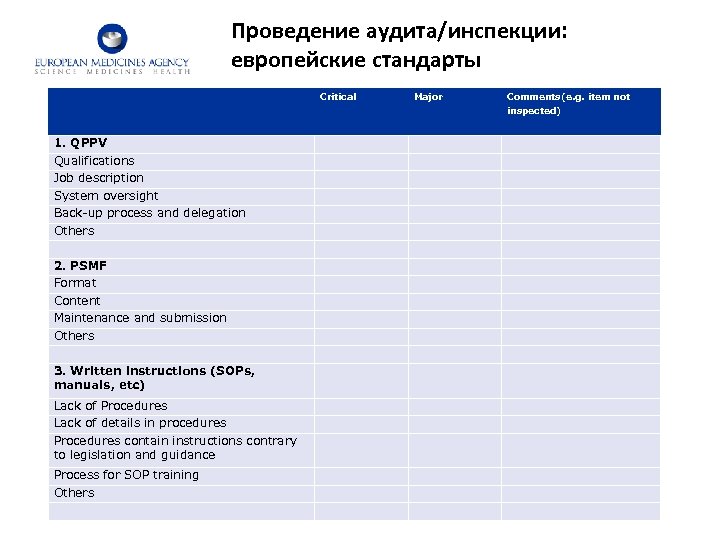 Проведение аудита/инспекции: европейские стандарты Critical Major Comments(e. g. item not inspected) 1. QPPV Qualifications Job description System oversight Back-up process and delegation Others 2. PSMF Format Content Maintenance and submission Others 3. Written instructions (SOPs, manuals, etc) Lack of Procedures Lack of details in procedures Procedures contain instructions contrary to legislation and guidance Process for SOP training Others
Проведение аудита/инспекции: европейские стандарты Critical Major Comments(e. g. item not inspected) 1. QPPV Qualifications Job description System oversight Back-up process and delegation Others 2. PSMF Format Content Maintenance and submission Others 3. Written instructions (SOPs, manuals, etc) Lack of Procedures Lack of details in procedures Procedures contain instructions contrary to legislation and guidance Process for SOP training Others
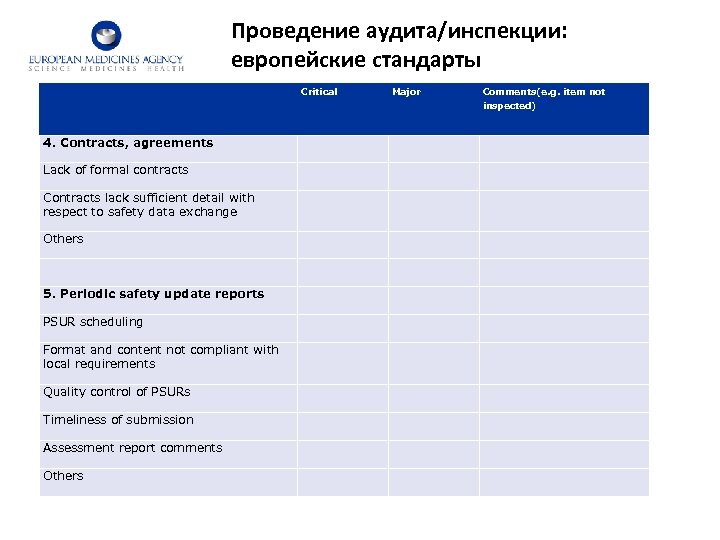 Проведение аудита/инспекции: европейские стандарты Critical Major Comments(e. g. item not inspected) 4. Contracts, agreements Lack of formal contracts Contracts lack sufficient detail with respect to safety data exchange Others 5. Periodic safety update reports PSUR scheduling Format and content not compliant with local requirements Quality control of PSURs Timeliness of submission Assessment report comments Others
Проведение аудита/инспекции: европейские стандарты Critical Major Comments(e. g. item not inspected) 4. Contracts, agreements Lack of formal contracts Contracts lack sufficient detail with respect to safety data exchange Others 5. Periodic safety update reports PSUR scheduling Format and content not compliant with local requirements Quality control of PSURs Timeliness of submission Assessment report comments Others
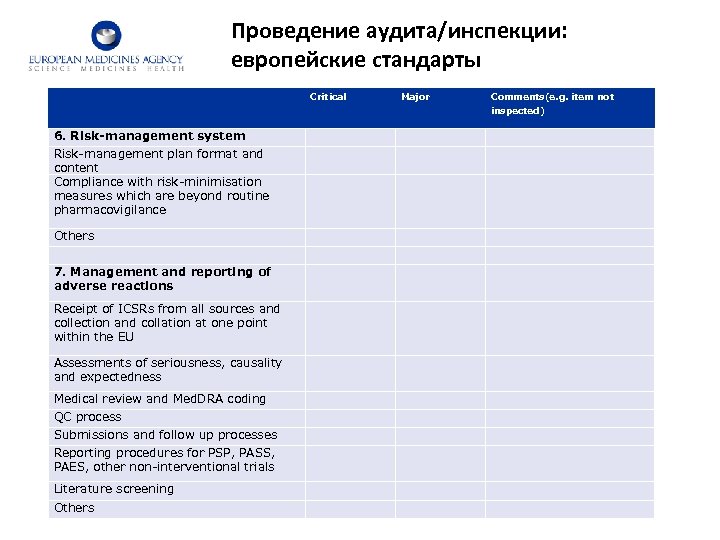 Проведение аудита/инспекции: европейские стандарты Critical Major Comments(e. g. item not inspected) 6. Risk-management system Risk-management plan format and content Compliance with risk-minimisation measures which are beyond routine pharmacovigilance Others 7. Management and reporting of adverse reactions Receipt of ICSRs from all sources and collection and collation at one point within the EU Assessments of seriousness, causality and expectedness Medical review and Med. DRA coding QC process Submissions and follow up processes Reporting procedures for PSP, PASS, PAES, other non-interventional trials Literature screening Others
Проведение аудита/инспекции: европейские стандарты Critical Major Comments(e. g. item not inspected) 6. Risk-management system Risk-management plan format and content Compliance with risk-minimisation measures which are beyond routine pharmacovigilance Others 7. Management and reporting of adverse reactions Receipt of ICSRs from all sources and collection and collation at one point within the EU Assessments of seriousness, causality and expectedness Medical review and Med. DRA coding QC process Submissions and follow up processes Reporting procedures for PSP, PASS, PAES, other non-interventional trials Literature screening Others
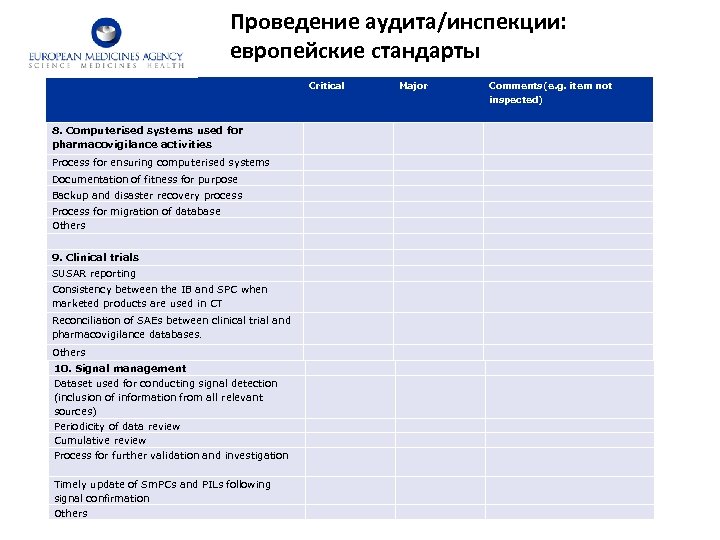 Проведение аудита/инспекции: европейские стандарты Critical Major Comments(e. g. item not inspected) 8. Computerised systems used for pharmacovigilance activities Process for ensuring computerised systems Documentation of fitness for purpose Backup and disaster recovery process Process for migration of database Others 9. Clinical trials SUSAR reporting Consistency between the IB and SPC when marketed products are used in CT Reconciliation of SAEs between clinical trial and pharmacovigilance databases. Others 10. Signal management Dataset used for conducting signal detection (inclusion of information from all relevant sources) Periodicity of data review Cumulative review Process for further validation and investigation Timely update of Sm. PCs and PILs following signal confirmation Others
Проведение аудита/инспекции: европейские стандарты Critical Major Comments(e. g. item not inspected) 8. Computerised systems used for pharmacovigilance activities Process for ensuring computerised systems Documentation of fitness for purpose Backup and disaster recovery process Process for migration of database Others 9. Clinical trials SUSAR reporting Consistency between the IB and SPC when marketed products are used in CT Reconciliation of SAEs between clinical trial and pharmacovigilance databases. Others 10. Signal management Dataset used for conducting signal detection (inclusion of information from all relevant sources) Periodicity of data review Cumulative review Process for further validation and investigation Timely update of Sm. PCs and PILs following signal confirmation Others
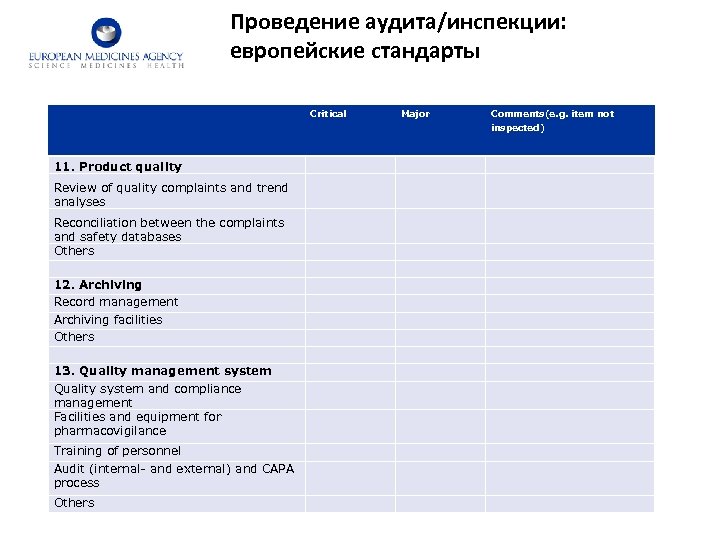 Проведение аудита/инспекции: европейские стандарты Critical Major Comments(e. g. item not inspected) 11. Product quality Review of quality complaints and trend analyses Reconciliation between the complaints and safety databases Others 12. Archiving Record management Archiving facilities Others 13. Quality management system Quality system and compliance management Facilities and equipment for pharmacovigilance Training of personnel Audit (internal- and external) and CAPA process Others
Проведение аудита/инспекции: европейские стандарты Critical Major Comments(e. g. item not inspected) 11. Product quality Review of quality complaints and trend analyses Reconciliation between the complaints and safety databases Others 12. Archiving Record management Archiving facilities Others 13. Quality management system Quality system and compliance management Facilities and equipment for pharmacovigilance Training of personnel Audit (internal- and external) and CAPA process Others
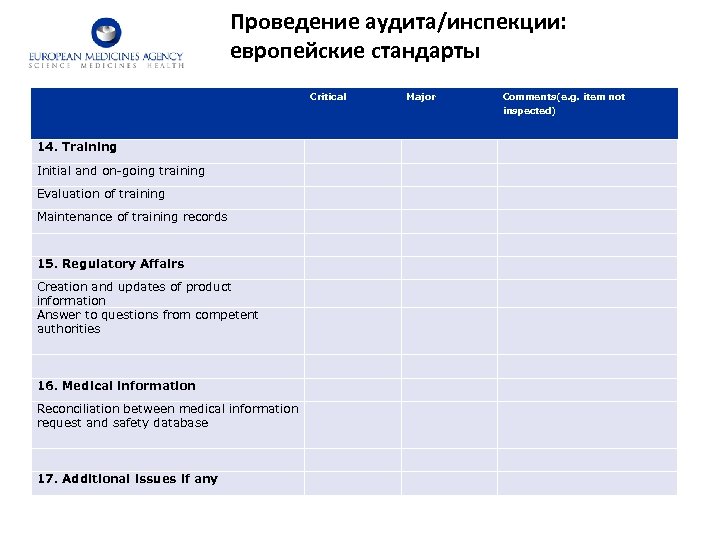 Проведение аудита/инспекции: европейские стандарты Critical Major Comments(e. g. item not inspected) 14. Training Initial and on-going training Evaluation of training Maintenance of training records 15. Regulatory Affairs Creation and updates of product information Answer to questions from competent authorities 16. Medical information Reconciliation between medical information request and safety database 17. Additional issues if any
Проведение аудита/инспекции: европейские стандарты Critical Major Comments(e. g. item not inspected) 14. Training Initial and on-going training Evaluation of training Maintenance of training records 15. Regulatory Affairs Creation and updates of product information Answer to questions from competent authorities 16. Medical information Reconciliation between medical information request and safety database 17. Additional issues if any
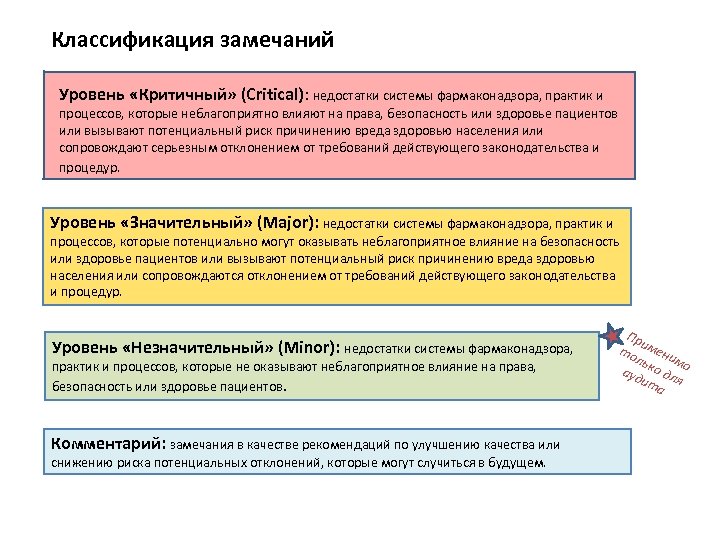 Классификация замечаний Уровень «Критичный» (Critical): недостатки системы фармаконадзора, практик и процессов, которые неблагоприятно влияют на права, безопасность или здоровье пациентов или вызывают потенциальный риск причинению вреда здоровью населения или сопровождают серьезным отклонением от требований действующего законодательства и процедур. Уровень «Значительный» (Major): недостатки системы фармаконадзора, практик и процессов, которые потенциально могут оказывать неблагоприятное влияние на безопасность или здоровье пациентов или вызывают потенциальный риск причинению вреда здоровью населения или сопровождаются отклонением от требований действующего законодательства и процедур. Уровень «Незначительный» (Minor): недостатки системы фармаконадзора, практик и процессов, которые не оказывают неблагоприятное влияние на права, безопасность или здоровье пациентов. Комментарий: замечания в качестве рекомендаций по улучшению качества или снижению риска потенциальных отклонений, которые могут случиться в будущем. Пр и то мени ль м ауд ко дл о ит я а
Классификация замечаний Уровень «Критичный» (Critical): недостатки системы фармаконадзора, практик и процессов, которые неблагоприятно влияют на права, безопасность или здоровье пациентов или вызывают потенциальный риск причинению вреда здоровью населения или сопровождают серьезным отклонением от требований действующего законодательства и процедур. Уровень «Значительный» (Major): недостатки системы фармаконадзора, практик и процессов, которые потенциально могут оказывать неблагоприятное влияние на безопасность или здоровье пациентов или вызывают потенциальный риск причинению вреда здоровью населения или сопровождаются отклонением от требований действующего законодательства и процедур. Уровень «Незначительный» (Minor): недостатки системы фармаконадзора, практик и процессов, которые не оказывают неблагоприятное влияние на права, безопасность или здоровье пациентов. Комментарий: замечания в качестве рекомендаций по улучшению качества или снижению риска потенциальных отклонений, которые могут случиться в будущем. Пр и то мени ль м ауд ко дл о ит я а

 Спасибо!
Спасибо!


