L-Proektir-8.ppt
- Количество слайдов: 23

Проектирование и оборудование предприятий нефтехимии (8)
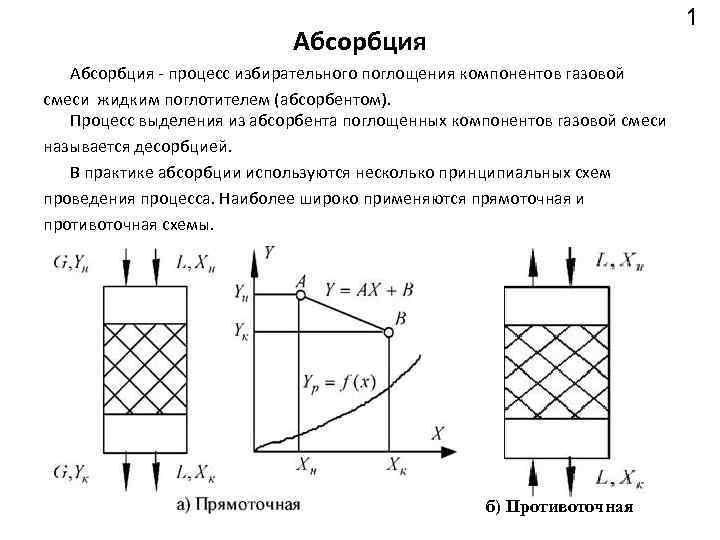
1 Абсорбция процесс избирательного поглощения компонентов газовой смеси жидким поглотителем (абсорбентом). Процесс выделения из абсорбента поглощенных компонентов газовой смеси называется десорбцией. В практике абсорбции используются несколько принципиальных схем проведения процесса. Наиболее широко применяются прямоточная и противоточная схемы. б) Противоточная

2 Рабочая линия представляется на диаграмме отрезком прямой; крайние точки его имеют координаты Yн, Хк и Yк, Xc соответственно. Значение Хс можно найти из уравнения материального баланса: G(Yн Yк) = L(Хк Хн) = L n(Хк Хс) Хс = [Хк (n 1) + Хн ]/n Где n отношение количества поглощающей жидкости на входе в аппарат к количеству свежей поглощающей жидкости; Yi=G/Gn+1 и Xi=L/Lo – приведенные концентрации; G и L – мольные потоки любого компонента на i той тарелке в газе и жидкости, соответственно. С обычными концентрациями приведенные связаны следующим образом: уi=G/Gi=(Gn+1/G) Yi и хi=L/Li=(Lo/Li) Хi Количество вещества М, поглощаемого при абсорбции, прямо пропорционально поверхности контакта газовой и жидкой фаз S, движущей силе процесса Р, у или х и коэффициенту пропорциональности К, зависящему от гидродинамического режима и физико химических свойств системы. М = КР S(РГ РР) = КУ S(у у. Р) = КХ S(х. Р х) Для i той ступени контакта уравнение равновесия имеет вид: yi=Kixi Используя связь обычных и приведенных концентраций, можно записать (Gn+1/G) Yi = Кi (Lo/Li) Хi или Li/(Кi Gi) Yi = (Lo/Gn+1) Хi

3 Входящий в последнее уравнение комплекс величин Li/(Кi Gi)= Аi называется фактором абсорбции, а отношение (Lo/Gn+1)=l – удельным расходом абсорбента. Тогда, комбинируя все приведенные равенства, можно записать уравнение равновесия в виде: Ai Yi=l Xi В приведенных концентрациях уравнение материального баланса абсорбера запишется как: Gn+1(Yn+1 Y 1)=LO(Xn Xo) или Yn+1 Y 1=l (Xn Xo) Отсюда можно определить удельный расход абсорбента: l=(Yn+1 Y 1)/(Xn Xo) Наконец, коэффициент извлечения при абсорбции равен: =(Yn+1 Y 1)/Yn+1 Процесс абсорбции может происходить в том случае, если рабочая концентрация компонента в газе выше равновесной. Следовательно, рабочая линия должна располагаться выше равновесной кривой.
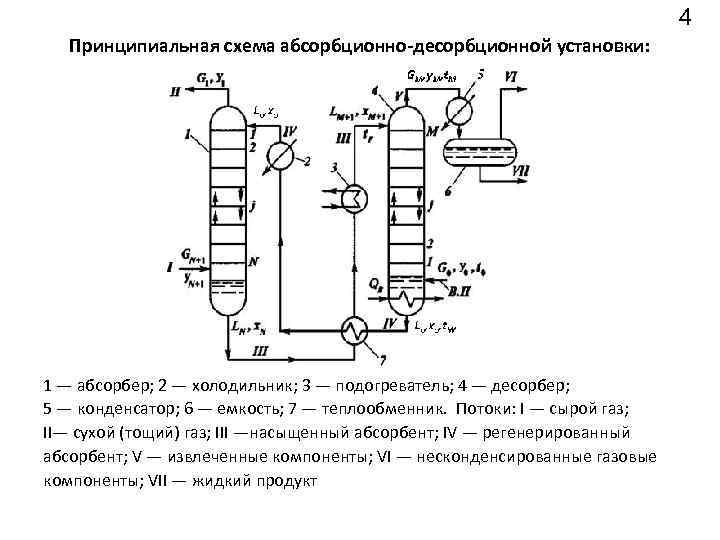
4 Принципиальная схема абсорбционно-десорбционной установки: 1 — абсорбер; 2 — холодильник; 3 — подогреватель; 4 — десорбер; 5 — конденсатор; 6 — емкость; 7 — теплообменник. Потоки: I — сырой газ; II— сухой (тощий) газ; III —насыщенный абсорбент; IV — регенерированный абсорбент; V — извлеченные компоненты; VI — несконденсированные газовые компоненты; VII — жидкий продукт
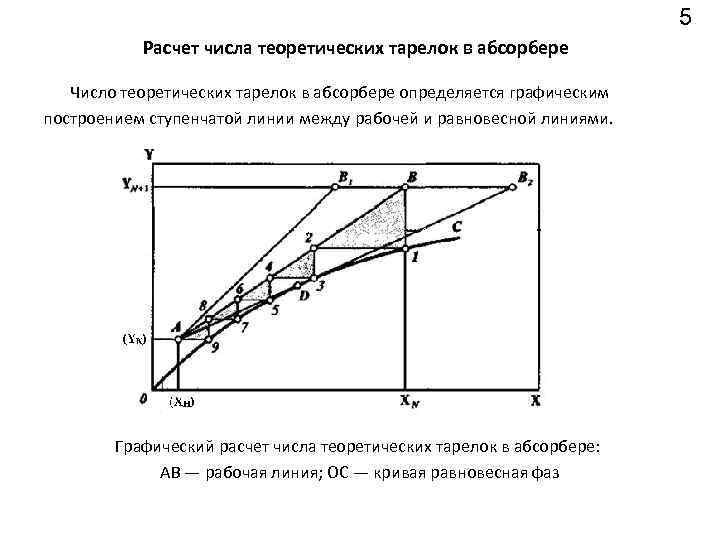
5 Расчет числа теоретических тарелок в абсорбере Число теоретических тарелок в абсорбере определяется графическим построением ступенчатой линии между рабочей и равновесной линиями. Графический расчет числа теоретических тарелок в абсорбере: АВ — рабочая линия; ОС — кривая равновесная фаз

6 Входящий в абсорбер газ и уходящий насыщенный абсорбент встречаются в нижнем сечении, т. е. их составы должны удовлетворять уравнению рабочей линии (точка В). В результате взаимодействия потоков газа и жидкости на нижней тарелке абсорбера образуются равновесные потоки газа и жидкости, составы которых определяются точкой 1 на равновесной кривой. Проведя горизонталь до пересечения в точке 2 с рабочей линией, получим состав жидкости, стекающий с вышерасположенной тарелки. Продолжив аналогичные построения, достигнем точки А , находящейся на рабочей линии, координаты которой определяются составами уходящего из абсорбера газа Yк и свежего абсорбента Xн. В данном случае число теоретических тарелок равно пяти. Увеличение расхода абсорбента изменяет положение рабочей линии, приводя к уменьшению числа тарелок (прямая АВ 1 ). Уменьшение удельного расхода абсорбента приводит к повороту рабочей линии вокруг точки А. В результате при некотором минимальном расходе абсорбента рабочая линия займет положение ADB 2 , касаясь линии равновесия в точке D. В этом случае заданное извлечение может быть получено только при бесконечном числе тарелок.
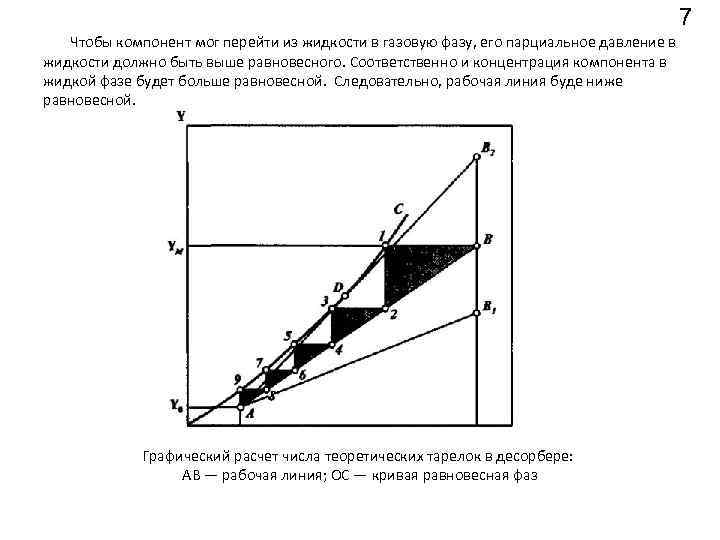
7 Чтобы компонент мог перейти из жидкости в газовую фазу, его парциальное давление в жидкости должно быть выше равновесного. Соответственно и концентрация компонента в жидкой фазе будет больше равновесной. Следовательно, рабочая линия буде ниже равновесной. Графический расчет числа теоретических тарелок в десорбере: АВ — рабочая линия; ОС — кривая равновесная фаз
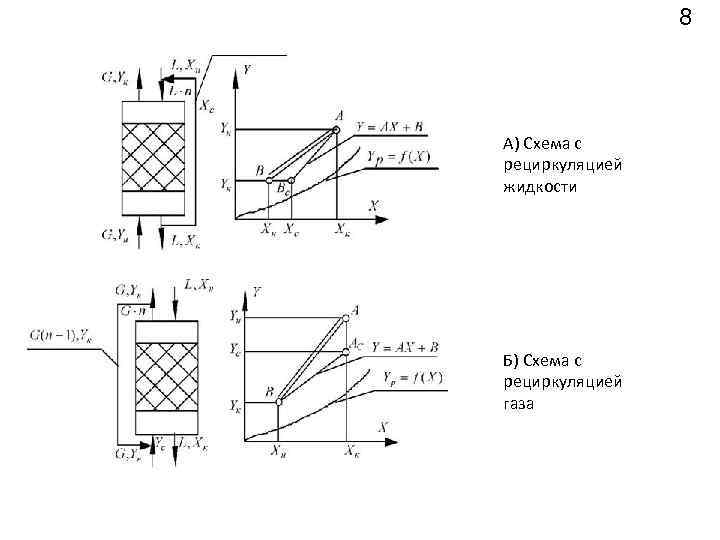
8 А) Схема с рециркуляцией жидкости Б) Схема с рециркуляцией газа
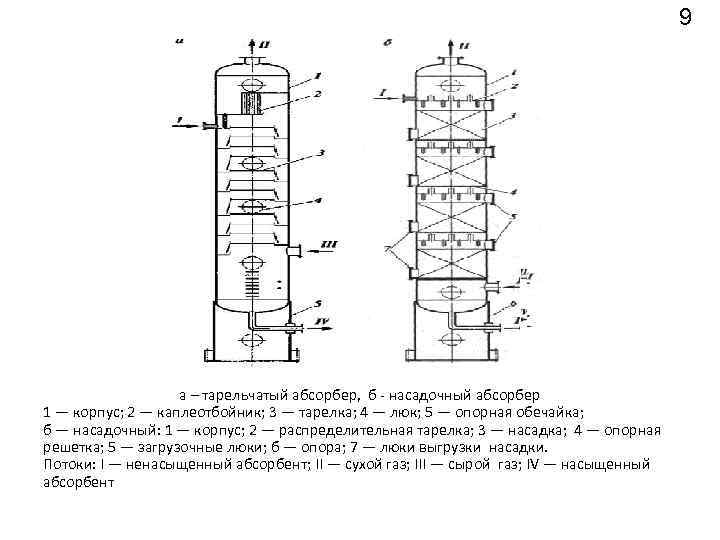
9 а – тарельчатый абсорбер, б насадочный абсорбер 1 — корпус; 2 — каплеотбойник; 3 — тарелка; 4 — люк; 5 — опорная обечайка; б — насадочный: 1 — корпус; 2 — распределительная тарелка; 3 — насадка; 4 — опорная решетка; 5 — загрузочные люки; б — опора; 7 — люки выгрузки насадки. Потоки: I — ненасыщенный абсорбент; II — сухой газ; III — сырой газ; IV — насыщенный абсорбент

10 Многофункциональный трехсекционный абсорбер Исходный газ по тангенциально расположенному штуцеру поступает в первую по ходу газа секцию сепарации. Отделение капельной жидкости в этой секции осуществляется при прохождении газа через сетчатый отбойник 1 и сепарационную тарелку 2, на которой установлены центробежные сепарирующие элементы. Вторая секция предназначена для осушки газа и включает четыре тарелки 4 с контактными элементами центробежного типа.

11 ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ПРОЦЕССА АБСОРБЦИИ 1. Существует оптимальное место ввода сырья в колонну 2. Существует минимальная величина подачи абсорбента и тепла в кипятильник 3. Нельзя достичь 100% чистоты продукта, 100% чистота может быть достигнута при бесконечном числе тарелок 4. Чистота газа улучшается при увеличении абсорбента или орошения, и колебания режима сокращают четкость абсорбции 5. В режиме полного орошения число тарелок наименьшее 6. Чем больше разность температур кипения компонентов и больше относительная летучесть ключевых компонентов в сырье, тем меньше число тарелок и меньше затраты энергии на абсорбцию 7. В неполных колоннах можно получить чистым только один продукт. 8. Два сырья, отличающиеся между собой температурами и составами следует вводить в колонну отдельно 9. Кратность орошения по тарелкам величина переменная 10. Изменение температур и концентраций по тарелкам различны

12 Адсорбция — всеобщее и повсеместное явление, имеющее место всегда и везде, где есть поверхность раздела между фазами. Наибольшее практическое значение имеет адсорбция поверхностно активных веществ и адсорбция примесей из газа или жидкости специальными высокоэффективными адсорбентами. В качестве адсорбентов могут выступать разнообразные материалы с высокой удельной поверхностью: пористый углерод (наиболее распространённая форма — активированный уголь), силикагели, цеолиты, а также некоторые группы природных минералов и синтетических веществ. Поглощаемое вещество, еще находящееся в объеме фазы, называют адсорбтив, поглощенное — адсорбат, поглощающее примеси из газа или жидкости твердое вещество (в случае газа и жидкости) или жидкость (в случае газа) — адсорбент.
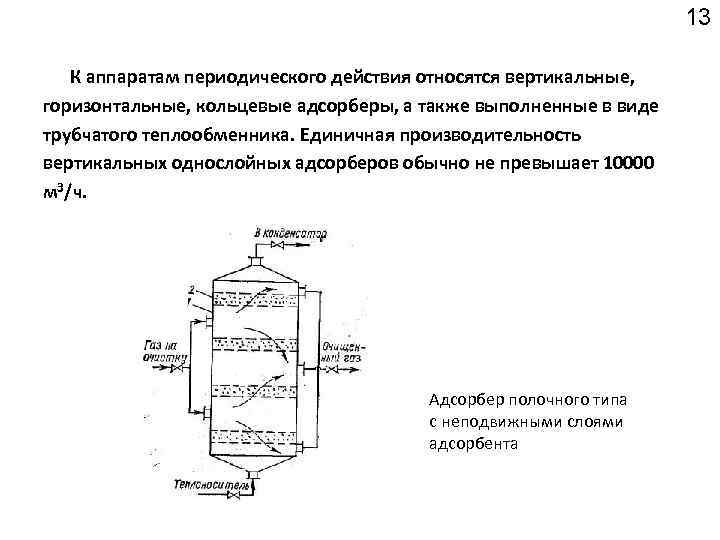
13 К аппаратам периодического действия относятся вертикальные, горизонтальные, кольцевые адсорберы, а также выполненные в виде трубчатого теплообменника. Единичная производительность вертикальных однослойных адсорберов обычно не превышает 10000 м³/ч. Адсорбер полочного типа с неподвижными слоями адсорбента
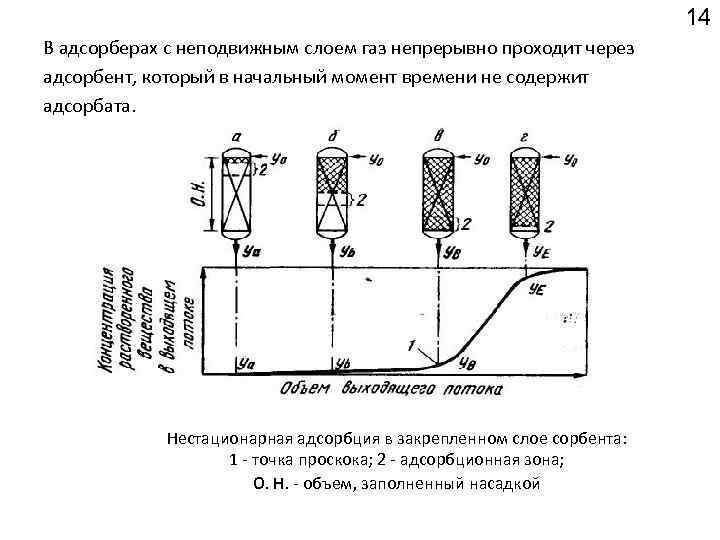
14 В адсорберах с неподвижным слоем газ непрерывно проходит через адсорбент, который в начальный момент времени не содержит адсорбата. Нестационарная адсорбция в закрепленном слое сорбента: 1 точка проскока; 2 адсорбционная зона; О. Н. объем, заполненный насадкой
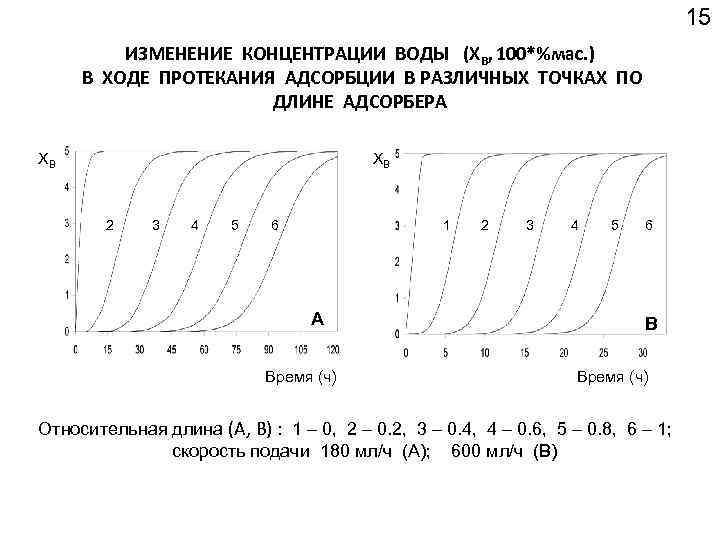
15 ИЗМЕНЕНИЕ КОНЦЕНТРАЦИИ ВОДЫ (XB, 100*%мас. ) В ХОДЕ ПРОТЕКАНИЯ АДСОРБЦИИ В РАЗЛИЧНЫХ ТОЧКАХ ПО ДЛИНЕ АДСОРБЕРА ХВ ХВ 2 3 4 5 6 1 А Время (ч) 2 3 4 5 6 В Время (ч) Относительная длина (А, B) : 1 – 0, 2 – 0. 2, 3 – 0. 4, 4 – 0. 6, 5 – 0. 8, 6 – 1; скорость подачи 180 мл/ч (A); 600 мл/ч (В)
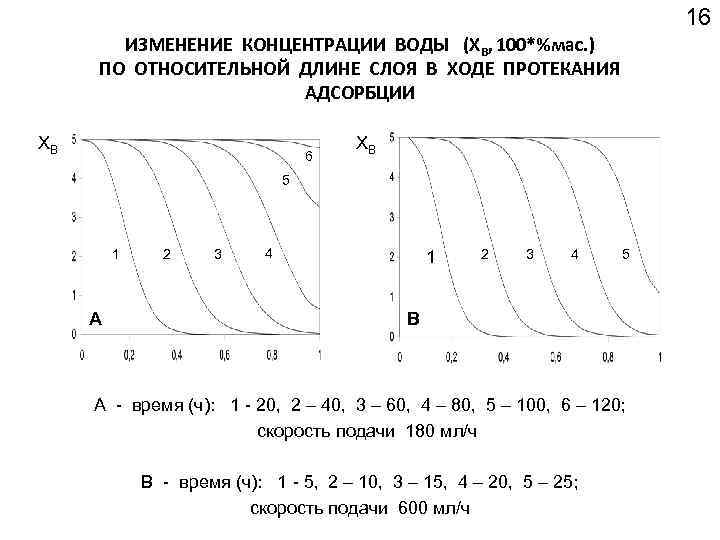
16 ИЗМЕНЕНИЕ КОНЦЕНТРАЦИИ ВОДЫ (XB, 100*%мас. ) ПО ОТНОСИТЕЛЬНОЙ ДЛИНЕ СЛОЯ В ХОДЕ ПРОТЕКАНИЯ АДСОРБЦИИ XB 6 XB 5 1 А 2 3 4 1 2 3 4 5 В А - время (ч): 1 - 20, 2 – 40, 3 – 60, 4 – 80, 5 – 100, 6 – 120; скорость подачи 180 мл/ч B - время (ч): 1 - 5, 2 – 10, 3 – 15, 4 – 20, 5 – 25; скорость подачи 600 мл/ч

17 Причиной адсорбции являются неспецифические (то есть не зависящие от природы вещества) Ван дер Ваальсовы силы. Адсорбция, осложненная химическим взаимодействием между адсорбентом и адсорбатом, является особым случаем. Явления такого рода называют хемосорбцией и химической адсорбцией. «Обычную» адсорбцию в случае, когда требуется подчеркнуть природу сил взаимодействия, называют физической адсорбцией. Физическая адсорбция является обратимым процессом, условие равновесия определяется равными скоростями адсорбции молекул адсорбтива P на вакантных местах поверхности адсорбента S* и десорбции — освобождения адсорбата из связанного состояния S − P: S* + P ↔ [S-P] уравнение равновесия в таком случае: K = [S-P]/([S*] [P]) где K — константа равновесия, [S − P] и [S*] — доли поверхности адсорбента, занятые и незанятые адсорбатом, а [P] — концентрация адсорбтива. Количественно процесс физической мономолекулярной адсорбции в случае, когда межмолекулярным взаимодействием адсорбата можно пренебречь, описывается уравнением изотермы адсорбции.

18 Вывод уравнений изотермы адсорбции основывается на следующих основных предположениях: • 1. Прежде всего, предполагается, что адсорбция происходит на отдельных адсорбционных центрах. При этом считается, что каждый адсорбционный центр может удерживать на себе только одну газовую молекулу, поверхность имеет адсорбционные центры лишь одного определенного сорта, характеризующиеся определенной (одной и той же для всех центров) теплотой адсорбции , т. е. одной и той же по отношению к молекулам данного сорта энергией связи. Такая поверхность называется энергетически однородной. • 2. Считается, что адсорбированные молекулы не взаимодействуют друг с другом. • 3. Предполагается, что число адсорбционных центров на поверхности является постоянной заданной величиной, характерной для данной поверхности. Общее число центров при этом не изменяется с изменением температуры и не зависит от степени заполнения поверхности. • 4. Предполагается, что каждый данный адсорбционный центр может связываться с каждой данной молекулой лишь одним определенным образом.

19 ИЗОТЕРМЫ АДСОРБЦИИ 1. Ленгмюр: или q=a/ S; x=C/Co; k. L=KLCo 2. Ленгмюр. Фрейндлих: или 3. Радке-Праусниц: 4. Редлих-Петерсон: ; q=a/ S; x=C/Co; k. LF=KLF

20 Кинетика адсорбции Рассмотрим применение кинетического подхода для случая однородной поверхности в контакте с газом адсорбата. Согласно кинетической теории газов поток I молекул (атомов) газа, попадающий на поверхность, описывается выражением: где р парциальное давление газа адсорбата, m масса молекул (ато мов) газа, kв постоянная Больцмана, Т температура. Однако не все попадающие на поверхность молекулы адсорбиру ются на ней и дают вклад в скорость адсорбции. Отношение потока адсорбции к падающему потоку определяется как коэффициент прилипания или вероятность прилипания S. Таким образом, скорость адсорбции Wа равна: Wа = S L Общее выражение для коэффициента прилипания в случае активационной адсорбции записывается как: Где: σ коэффициент конденсации, отвечает за ориентационные эффекты; f(Θ) — функция, зависящая от покрытия, которая описывает вероятность молекулы найти адсорбционное состояние.

21 Кинетика десорбции Процесс, в котором атом (или молекула) адсорбата получает от тепловых колебаний атомов поверхности достаточно энергии, чтобы покинуть поверхность, называется термической десорбцией. В кинетическом приближении десорбция описывается в терминах скорости десорбции rdes, которая равна числу частиц (атомов или молекул), десорбирующихся с единицы площади в единицу времени имеет вид: где f*(Θ) описывает зависимость от покрытия, σ* — стерический коэффициент десорбции (эмпирический поправочный коэффициент или множитель, учитывающий отклонение теоретических расчетов от опытных данных). В предположении, что все адсорбированные атомы или молекулы занимают идентичные места и не взаимодействуют друг с другом, скорость десорбции выражается выражением Полани Вигнера: где Edes — энергия активации десорбции, n — порядок кинетики десорбции, kn константа скорости десорбции.

L-Proektir-8.ppt