фотометрическое титрование.pptx
- Количество слайдов: 18
 ПРОДОЛЖЕНИЕ ТЕМЫ: МЕТОДЫ ОПРЕДЕЛЕНИЯ КОНЦЕНТРАЦИЙ ОКРАШЕННЫХ РАСТВОРОВ 7. ФОТОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
ПРОДОЛЖЕНИЕ ТЕМЫ: МЕТОДЫ ОПРЕДЕЛЕНИЯ КОНЦЕНТРАЦИЙ ОКРАШЕННЫХ РАСТВОРОВ 7. ФОТОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
 При спектрофотометрическом титровании могут быть использованы все типы химических реакций. Особенно широко используют реакции комплексообразования. НООС-Н 2 С CH 2 COOH N CH 2 N HOOC-H 2 C CH 2 COOH Метод спектрофотометрического титрования основан на последовательном измерении поглощения раствора, которое меняется в процессе титрования
При спектрофотометрическом титровании могут быть использованы все типы химических реакций. Особенно широко используют реакции комплексообразования. НООС-Н 2 С CH 2 COOH N CH 2 N HOOC-H 2 C CH 2 COOH Метод спектрофотометрического титрования основан на последовательном измерении поглощения раствора, которое меняется в процессе титрования
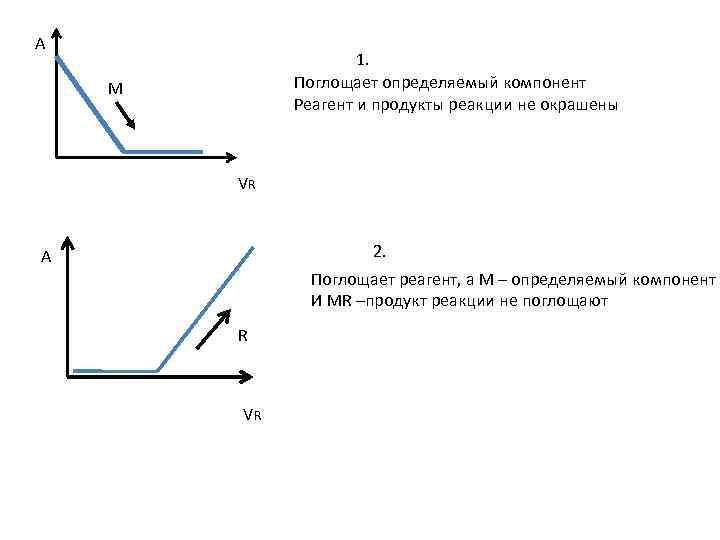 А 1. Поглощает определяемый компонент Реагент и продукты реакции не окрашены М VR 2. А Поглощает реагент, а М – определяемый компонент И MR –продукт реакции не поглощают R VR
А 1. Поглощает определяемый компонент Реагент и продукты реакции не окрашены М VR 2. А Поглощает реагент, а М – определяемый компонент И MR –продукт реакции не поглощают R VR
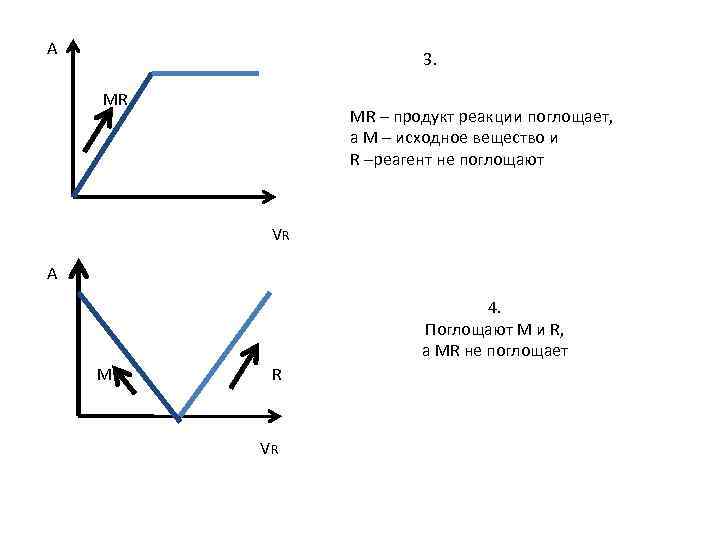 A 3. MR MR – продукт реакции поглощает, а М – исходное вещество и R –реагент не поглощают VR A 4. Поглощают М и R, а MR не поглощает M R VR
A 3. MR MR – продукт реакции поглощает, а М – исходное вещество и R –реагент не поглощают VR A 4. Поглощают М и R, а MR не поглощает M R VR
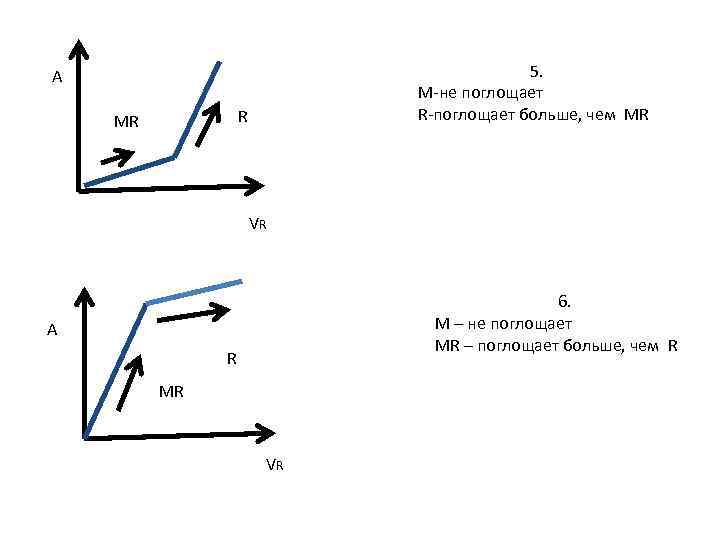 5. M-не поглощает R-поглощает больше, чем MR А R MR VR 6. М – не поглощает MR – поглощает больше, чем R А R MR VR
5. M-не поглощает R-поглощает больше, чем MR А R MR VR 6. М – не поглощает MR – поглощает больше, чем R А R MR VR
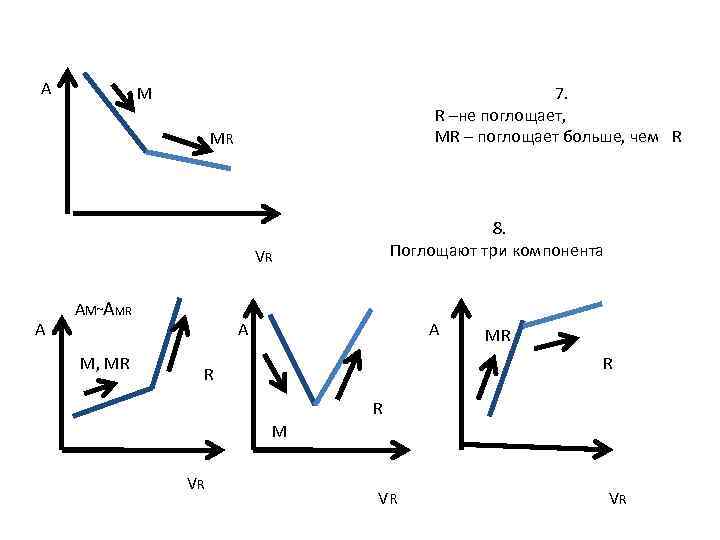 А M 7. R –не поглощает, MR – поглощает больше, чем R MR 8. Поглощают три компонента VR А AM~AMR M, MR А А MR R M VR VR VR
А M 7. R –не поглощает, MR – поглощает больше, чем R MR 8. Поглощают три компонента VR А AM~AMR M, MR А А MR R M VR VR VR
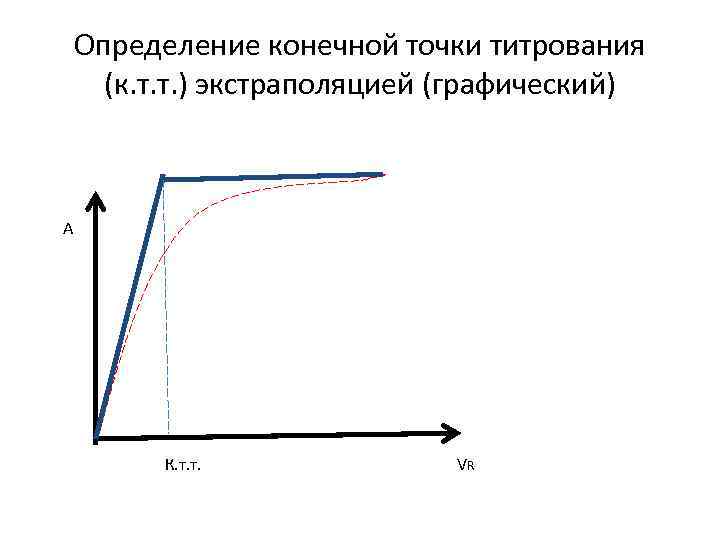 Определение конечной точки титрования (к. т. т. ) экстраполяцией (графический) А К. т. т. VR
Определение конечной точки титрования (к. т. т. ) экстраполяцией (графический) А К. т. т. VR
 Определение конечной точки титрования алгераическим методом A 1=a 1 + b 1* V; A 2=a 2 + b 2* V; V = (a 2 -a 1)/(b 1 -b 2) Необходимо учитывать: 1. Ошибка разбавления велика при малом объеме титруемого раствора и малой концентрации титранта; 2. Магнитная мешалка не должна находиться на пути прохождения света; 3. Сосуд для титрования надо прятать от рассеянного света; 4. Правильно выбрать λ.
Определение конечной точки титрования алгераическим методом A 1=a 1 + b 1* V; A 2=a 2 + b 2* V; V = (a 2 -a 1)/(b 1 -b 2) Необходимо учитывать: 1. Ошибка разбавления велика при малом объеме титруемого раствора и малой концентрации титранта; 2. Магнитная мешалка не должна находиться на пути прохождения света; 3. Сосуд для титрования надо прятать от рассеянного света; 4. Правильно выбрать λ.
 Возможности и преимущества метода фотометрического титрования • Быстрота, простота и хорошая воспроизводимость; • Возможность анализировать сильно разбавленные, окрашенные и мутные растворы; • Возможность проводить анализ в присутствии других окрашенных растворов; • Возможность использования обратимых реакций с малой константой; • Специфичность метода; • Определение состава комплексов • Более широкая область определения, чем визуальная (УФ, ближняя ИК) • Автоматизация.
Возможности и преимущества метода фотометрического титрования • Быстрота, простота и хорошая воспроизводимость; • Возможность анализировать сильно разбавленные, окрашенные и мутные растворы; • Возможность проводить анализ в присутствии других окрашенных растворов; • Возможность использования обратимых реакций с малой константой; • Специфичность метода; • Определение состава комплексов • Более широкая область определения, чем визуальная (УФ, ближняя ИК) • Автоматизация.
 КИНЕТИЧЕСКИЕ МЕТОДЫ АНАЛИЗА: • Метод тангенсов • Способ фиксированного времени • Способ фиксированной концентрации
КИНЕТИЧЕСКИЕ МЕТОДЫ АНАЛИЗА: • Метод тангенсов • Способ фиксированного времени • Способ фиксированной концентрации
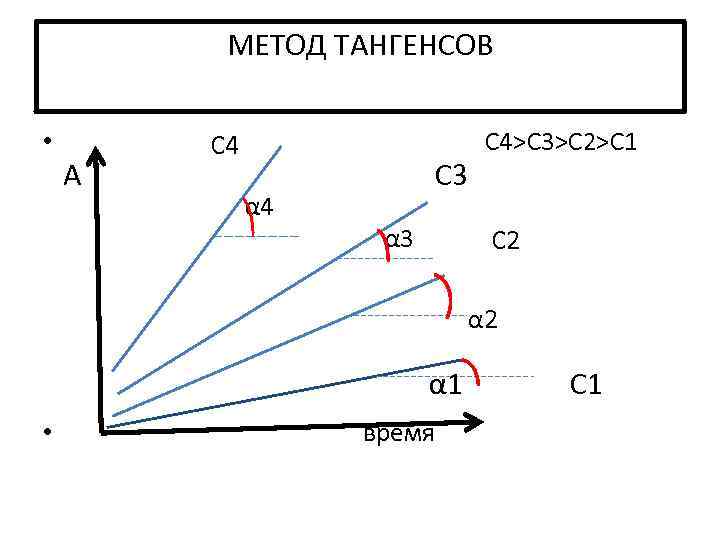 МЕТОД ТАНГЕНСОВ • С 4>C 3>C 2>C 1 С 4 А С 3 α 4 α 3 С 2 α 1 • время С 1
МЕТОД ТАНГЕНСОВ • С 4>C 3>C 2>C 1 С 4 А С 3 α 4 α 3 С 2 α 1 • время С 1
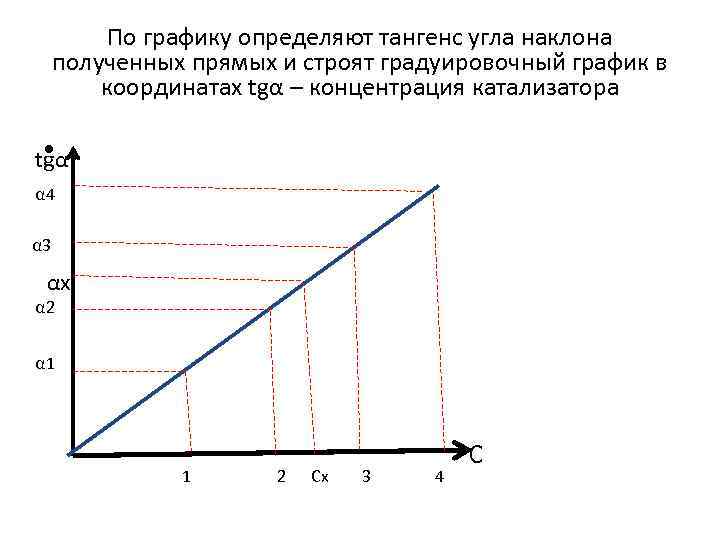 По графику определяют тангенс угла наклона полученных прямых и строят градуировочный график в координатах tgα – концентрация катализатора • tgα. α 4 α 3 αх α 2 α 1 1 2 Сх 3 4 С
По графику определяют тангенс угла наклона полученных прямых и строят градуировочный график в координатах tgα – концентрация катализатора • tgα. α 4 α 3 αх α 2 α 1 1 2 Сх 3 4 С
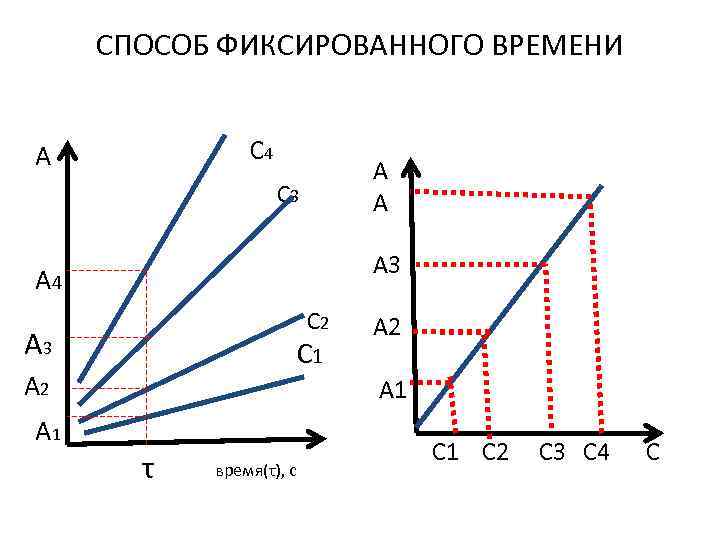 СПОСОБ ФИКСИРОВАННОГО ВРЕМЕНИ С 4 А С 3 А 4 С 2 А 3 С 1 А 2 А 1 А А τ время(τ), с А 2 А 1 С 1 С 2 С 3 С 4 С
СПОСОБ ФИКСИРОВАННОГО ВРЕМЕНИ С 4 А С 3 А 4 С 2 А 3 С 1 А 2 А 1 А А τ время(τ), с А 2 А 1 С 1 С 2 С 3 С 4 С
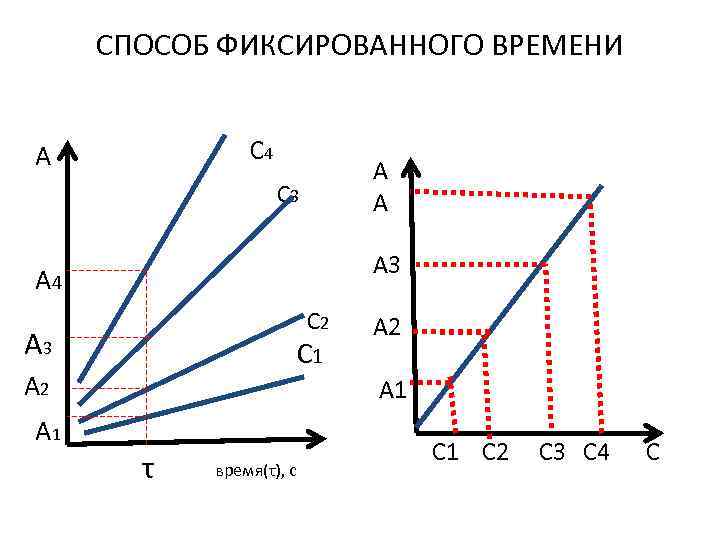 СПОСОБ ФИКСИРОВАННОГО ВРЕМЕНИ С 4 А С 3 А 4 С 2 А 3 С 1 А 2 А 1 А А τ время(τ), с А 2 А 1 С 1 С 2 С 3 С 4 С
СПОСОБ ФИКСИРОВАННОГО ВРЕМЕНИ С 4 А С 3 А 4 С 2 А 3 С 1 А 2 А 1 А А τ время(τ), с А 2 А 1 С 1 С 2 С 3 С 4 С
 АНАЛИЗ МНОГОКОМПОНЕНТНЫХ СИСТЕМ • Классический метод спектрофотометрического анализа • многокомпонентных систем основан на решении системы уравнений, число которых должно быть равно или больше числа определяемых компонентов. При соблюдении закона аддитивности для каждой длины волны оптическая плотность раствора, состоящего из n компонентов , равна сумме оптических плотностей всех компонентов: • Аλ= Аλ 1+ Аλ 2+. . . + Аλn
АНАЛИЗ МНОГОКОМПОНЕНТНЫХ СИСТЕМ • Классический метод спектрофотометрического анализа • многокомпонентных систем основан на решении системы уравнений, число которых должно быть равно или больше числа определяемых компонентов. При соблюдении закона аддитивности для каждой длины волны оптическая плотность раствора, состоящего из n компонентов , равна сумме оптических плотностей всех компонентов: • Аλ= Аλ 1+ Аλ 2+. . . + Аλn
 1. Кривые спектров поглощения компонентов смеси накладываются по всему диапазону длин волн Измерив оптические плотности растворов при n длинах волн и определив предварительно εiλi для всех компонентов при n длинах волн решаем системы уравнений: Аλ 1= ε 1λ 1*C 1*ℓ+ ε 2λ 1*C 2*ℓ+. . . + εnλ 1*Cn*ℓ Аλ 2= ε 1λ 2*C 1*ℓ+ ε 2λ 2*C 2*ℓ+. . . + εnλ 2*Cn*ℓ. . . . . Аλn= ε 1λn*C 1*ℓ+ ε 2λn*C 2*ℓ+. . . + εnλn*Cn*ℓ
1. Кривые спектров поглощения компонентов смеси накладываются по всему диапазону длин волн Измерив оптические плотности растворов при n длинах волн и определив предварительно εiλi для всех компонентов при n длинах волн решаем системы уравнений: Аλ 1= ε 1λ 1*C 1*ℓ+ ε 2λ 1*C 2*ℓ+. . . + εnλ 1*Cn*ℓ Аλ 2= ε 1λ 2*C 1*ℓ+ ε 2λ 2*C 2*ℓ+. . . + εnλ 2*Cn*ℓ. . . . . Аλn= ε 1λn*C 1*ℓ+ ε 2λn*C 2*ℓ+. . . + εnλn*Cn*ℓ
 2. Кривые спектров поглощения накладываются не по всему диапазону длин волн C 1= Аλ 1/ ε 1λ 1*ℓ (1) Аλ 2= ε 1λ 2*C 1*ℓ+ ε 2λ 2*C 2*ℓ (2) C 2=( Аλ 2*ε 1λ 1 - ε 1λ 2* Аλ 1 )/ ε 2λ 2* ε 1λ 1*ℓ (3)
2. Кривые спектров поглощения накладываются не по всему диапазону длин волн C 1= Аλ 1/ ε 1λ 1*ℓ (1) Аλ 2= ε 1λ 2*C 1*ℓ+ ε 2λ 2*C 2*ℓ (2) C 2=( Аλ 2*ε 1λ 1 - ε 1λ 2* Аλ 1 )/ ε 2λ 2* ε 1λ 1*ℓ (3)
 3. Кривые спектров поглощения не накладываются ни при каких длинах волн • Концентрация каждого из компонентов может быть вычислена по уравнению: • Ci= Аi/ εiλi*ℓ • Если предварительно были определены значения εiλi
3. Кривые спектров поглощения не накладываются ни при каких длинах волн • Концентрация каждого из компонентов может быть вычислена по уравнению: • Ci= Аi/ εiλi*ℓ • Если предварительно были определены значения εiλi


