 Процессы полимеризации n CH 2 H 2 C CH n 100; n > 100 ( – CH 2– ) n C H 3 + H 2 C CH 2 H 2 C C CH 3 CH 2 CH 3 2 H 2 C CH CH CH 2 + H X X CH 2 CH CH CH 3 Производство полимеров в США (тыс. тонн) ü Полиэтилен 1640 ü Полипропилен 1230 ü Этилен-пропилендиеновый сополимер 160 ü cis-1, 4 -полибутадиен 350 ü cis-1, 4 -полиизопрен 63 Лекции 17, 18 1
Процессы полимеризации n CH 2 H 2 C CH n 100; n > 100 ( – CH 2– ) n C H 3 + H 2 C CH 2 H 2 C C CH 3 CH 2 CH 3 2 H 2 C CH CH CH 2 + H X X CH 2 CH CH CH 3 Производство полимеров в США (тыс. тонн) ü Полиэтилен 1640 ü Полипропилен 1230 ü Этилен-пропилендиеновый сополимер 160 ü cis-1, 4 -полибутадиен 350 ü cis-1, 4 -полиизопрен 63 Лекции 17, 18 1
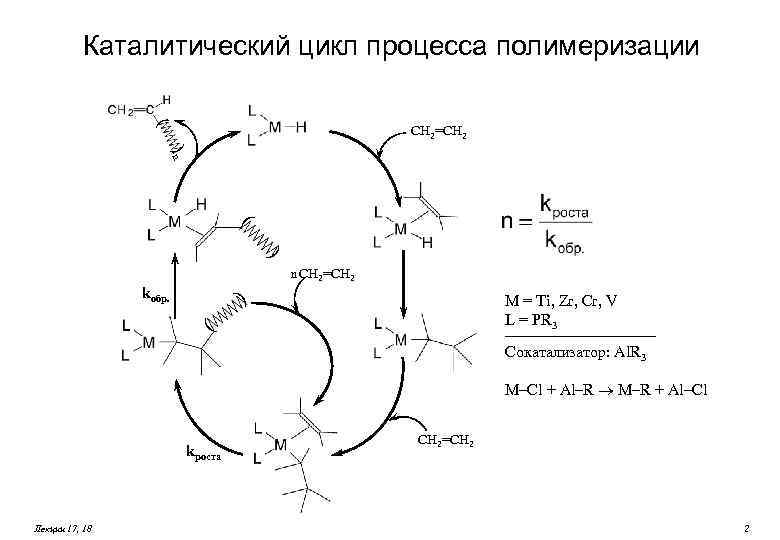 Каталитический цикл процесса полимеризации ( CH 2=CH 2 )n ( ) n CH 2=CH 2 kобр. ) M = Ti, Zr, Cr, V L = PR 3 ( Сокатализатор: Al. R 3 M–Cl + Al–R ® M–R + Al–Cl kроста Лекции 17, 18 CH 2=CH 2 2
Каталитический цикл процесса полимеризации ( CH 2=CH 2 )n ( ) n CH 2=CH 2 kобр. ) M = Ti, Zr, Cr, V L = PR 3 ( Сокатализатор: Al. R 3 M–Cl + Al–R ® M–R + Al–Cl kроста Лекции 17, 18 CH 2=CH 2 2
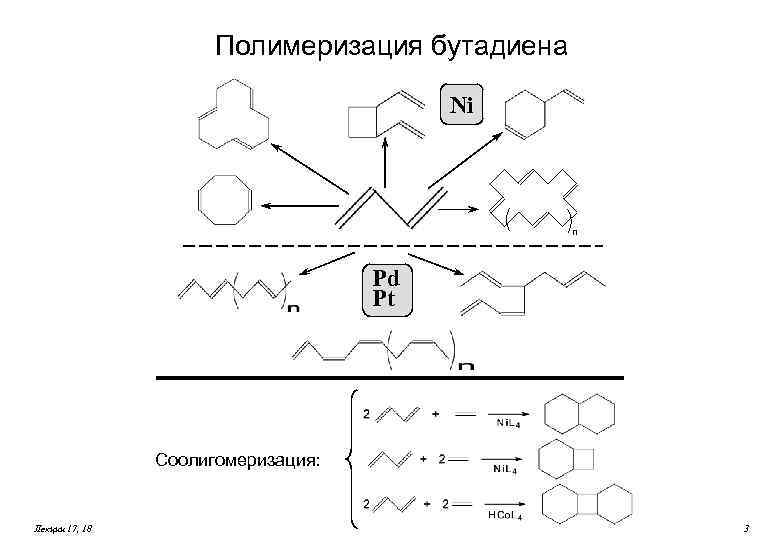 Полимеризация бутадиена Ni n Pd Pt Соолигомеризация: Лекции 17, 18 3
Полимеризация бутадиена Ni n Pd Pt Соолигомеризация: Лекции 17, 18 3
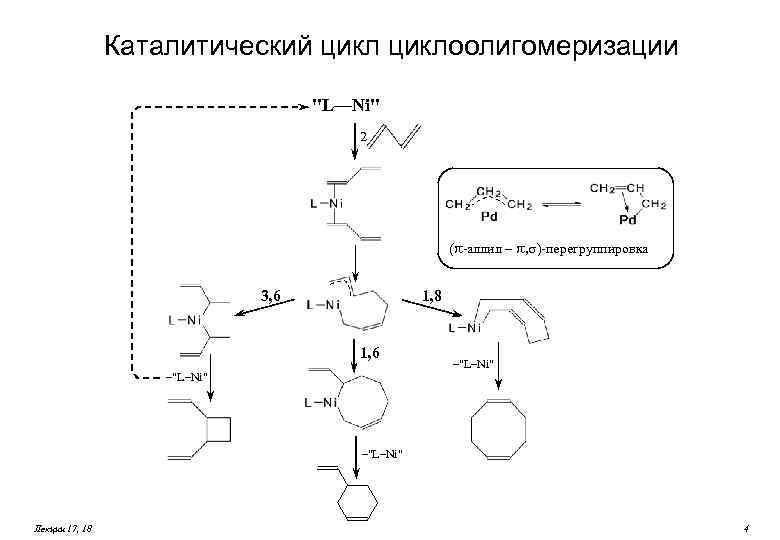 Каталитический циклоолигомеризации "L—Ni" 2 ( -аллил – , )-перегруппировка 1, 8 3, 6 1, 6 –"L–Ni" Лекции 17, 18 4
Каталитический циклоолигомеризации "L—Ni" 2 ( -аллил – , )-перегруппировка 1, 8 3, 6 1, 6 –"L–Ni" Лекции 17, 18 4
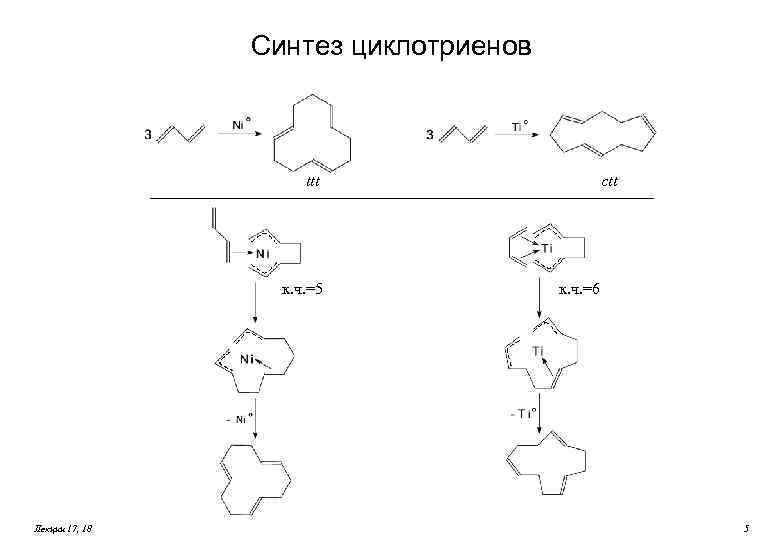 Синтез циклотриенов ttt к. ч. =5 Лекции 17, 18 ctt к. ч. =6 5
Синтез циклотриенов ttt к. ч. =5 Лекции 17, 18 ctt к. ч. =6 5
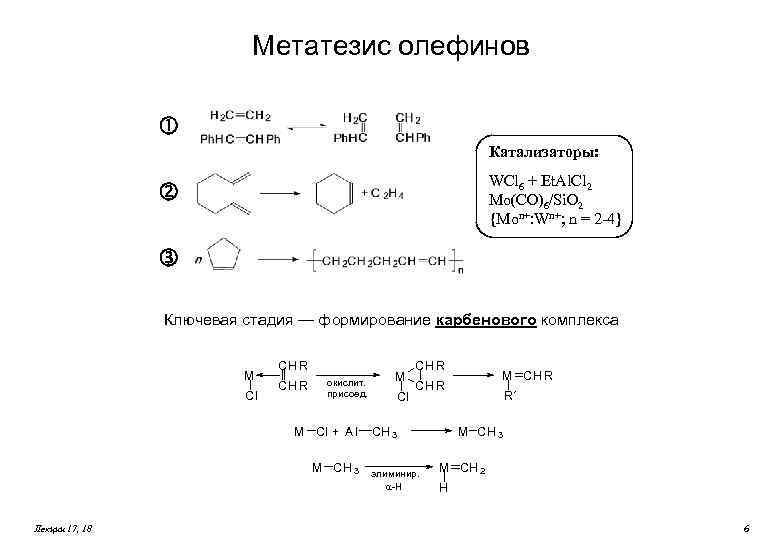 Метатезис олефинов Катализаторы: WCl 6 + Et. Al. Cl 2 Mo(CO)6/Si. O 2 {Mon+: Wn+; n = 2 -4} Ключевая стадия — формирование карбенового комплекса M Cl CH R окислит. присоед. M Cl + A l M CH 3 Лекции 17, 18 M Cl CH R M CH R CH 3 элиминир. -H R´ M CH 3 M CH 2 H 6
Метатезис олефинов Катализаторы: WCl 6 + Et. Al. Cl 2 Mo(CO)6/Si. O 2 {Mon+: Wn+; n = 2 -4} Ключевая стадия — формирование карбенового комплекса M Cl CH R окислит. присоед. M Cl + A l M CH 3 Лекции 17, 18 M Cl CH R M CH R CH 3 элиминир. -H R´ M CH 3 M CH 2 H 6
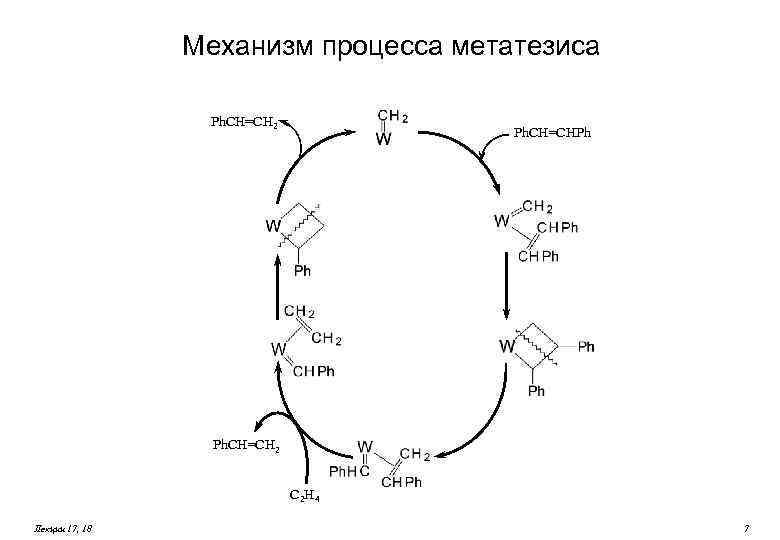 Механизм процесса метатезиса Ph. CH=CH 2 Ph. CH=CHPh Ph. CH=CH 2 C 2 H 4 Лекции 17, 18 7
Механизм процесса метатезиса Ph. CH=CH 2 Ph. CH=CHPh Ph. CH=CH 2 C 2 H 4 Лекции 17, 18 7
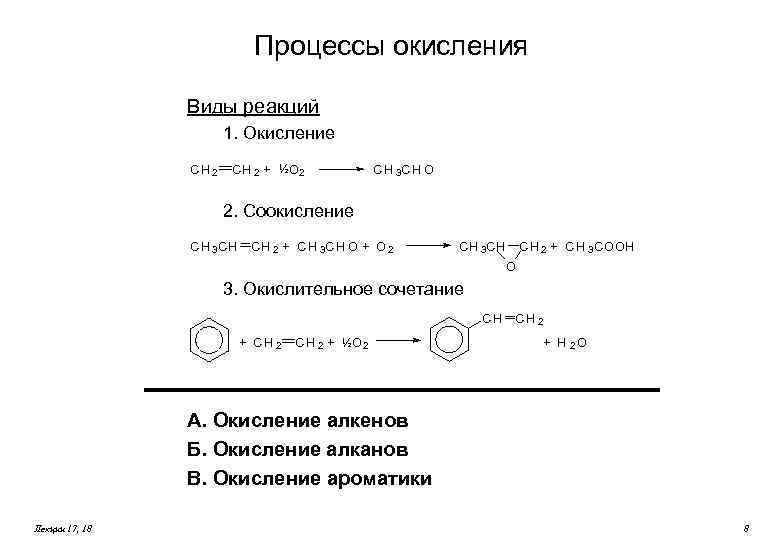 Процессы окисления Виды реакций 1. Окисление CH 2 + ½O 2 C H 3 CH O 2. Соокисление CH 3 CH CH 2 + C H 3 CH O + O 2 CH 3 CH CH 2 + C H 3 COOH O 3. Окислительное сочетание CH + CH 2 + ½O 2 CH 2 + H 2 O А. Окисление алкенов Б. Окисление алканов В. Окисление ароматики Лекции 17, 18 8
Процессы окисления Виды реакций 1. Окисление CH 2 + ½O 2 C H 3 CH O 2. Соокисление CH 3 CH CH 2 + C H 3 CH O + O 2 CH 3 CH CH 2 + C H 3 COOH O 3. Окислительное сочетание CH + CH 2 + ½O 2 CH 2 + H 2 O А. Окисление алкенов Б. Окисление алканов В. Окисление ароматики Лекции 17, 18 8
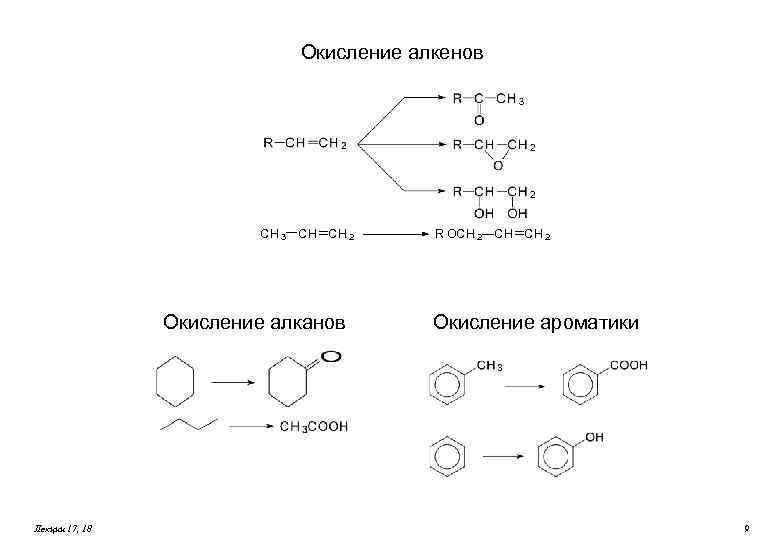 Окисление алкенов CH 3 CH CH 2 Окисление алканов Лекции 17, 18 R OCH 2 CH CH 2 Окисление ароматики 9
Окисление алкенов CH 3 CH CH 2 Окисление алканов Лекции 17, 18 R OCH 2 CH CH 2 Окисление ароматики 9
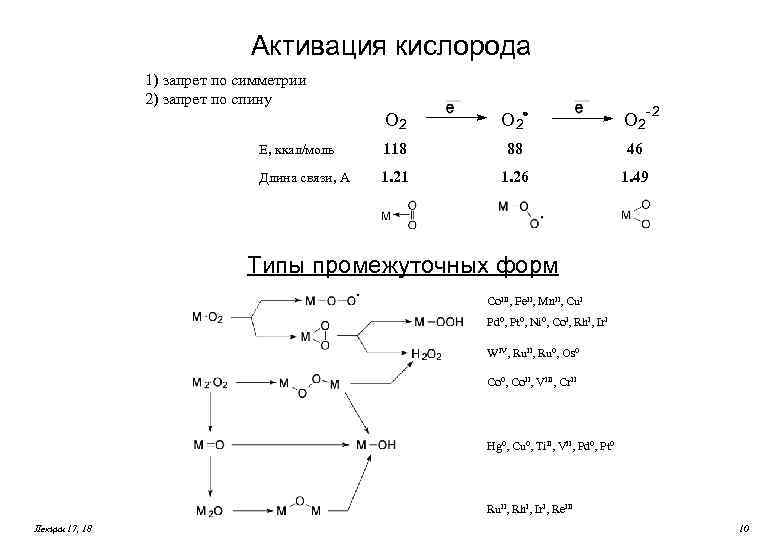 Активация кислорода 1) запрет по симметрии 2) запрет по спину - -2 O 2 O 2 E, ккал/моль 118 88 46 Длина связи, A 1. 21 1. 26 1. 49 Типы промежуточных форм Co. III, Fe. II, Mn. II, Cu. I Pd 0, Pt 0, Ni 0, Co. I, Rh. I, Ir. I WIV, Ru. II, Ru 0, Os 0 Co 0, Co. II, VIII, Cr. II Hg 0, Cu 0, Ti. II, VII, Pd 0, Pt 0 Ru. II, Rh. I, Ir. I, Re. III Лекции 17, 18 10
Активация кислорода 1) запрет по симметрии 2) запрет по спину - -2 O 2 O 2 E, ккал/моль 118 88 46 Длина связи, A 1. 21 1. 26 1. 49 Типы промежуточных форм Co. III, Fe. II, Mn. II, Cu. I Pd 0, Pt 0, Ni 0, Co. I, Rh. I, Ir. I WIV, Ru. II, Ru 0, Os 0 Co 0, Co. II, VIII, Cr. II Hg 0, Cu 0, Ti. II, VII, Pd 0, Pt 0 Ru. II, Rh. I, Ir. I, Re. III Лекции 17, 18 10
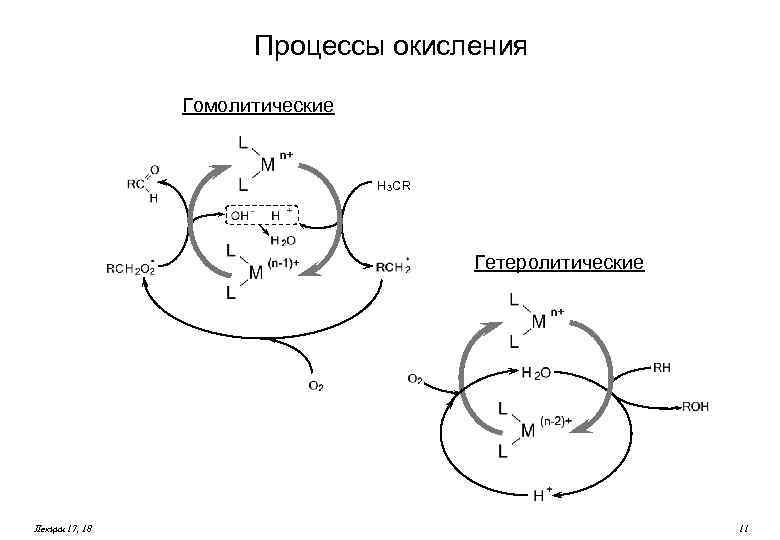 Процессы окисления Гомолитические H 3 CR Гетеролитические Лекции 17, 18 11
Процессы окисления Гомолитические H 3 CR Гетеролитические Лекции 17, 18 11
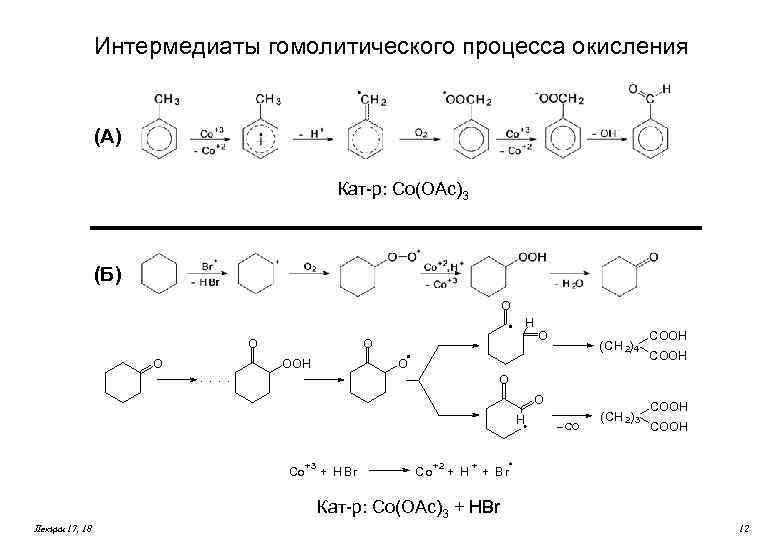 Интермедиаты гомолитического процесса окисления (А) Кат-р: Co(OAc)3 (Б) O H O O . . O OOH O (CH 2) 4 O COOH O O H +3 Co + H Br +2 Co + H + – CO (CH 2) 3 COOH + Br Кат-р: Co(OAc)3 + HBr Лекции 17, 18 12
Интермедиаты гомолитического процесса окисления (А) Кат-р: Co(OAc)3 (Б) O H O O . . O OOH O (CH 2) 4 O COOH O O H +3 Co + H Br +2 Co + H + – CO (CH 2) 3 COOH + Br Кат-р: Co(OAc)3 + HBr Лекции 17, 18 12
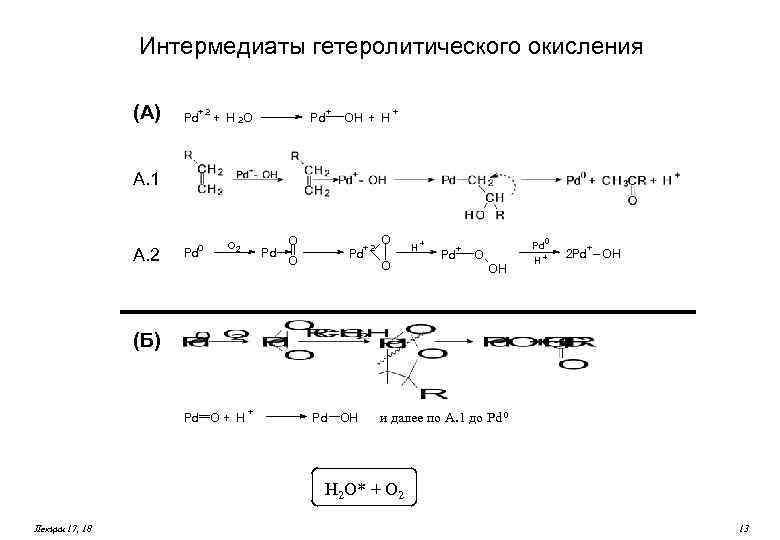 Интермедиаты гетеролитического окисления (А) +2 Pd + + H 2 O Pd OH + А. 1 А. 2 0 Pd O 2 Pd O O +2 Pd O O H+ + Pd Pd 0 O OH H + + 2 Pd – OH (Б) Pd O + H + P d OH и далее по А. 1 до Pd 0 H 2 O* + O 2 Лекции 17, 18 13
Интермедиаты гетеролитического окисления (А) +2 Pd + + H 2 O Pd OH + А. 1 А. 2 0 Pd O 2 Pd O O +2 Pd O O H+ + Pd Pd 0 O OH H + + 2 Pd – OH (Б) Pd O + H + P d OH и далее по А. 1 до Pd 0 H 2 O* + O 2 Лекции 17, 18 13
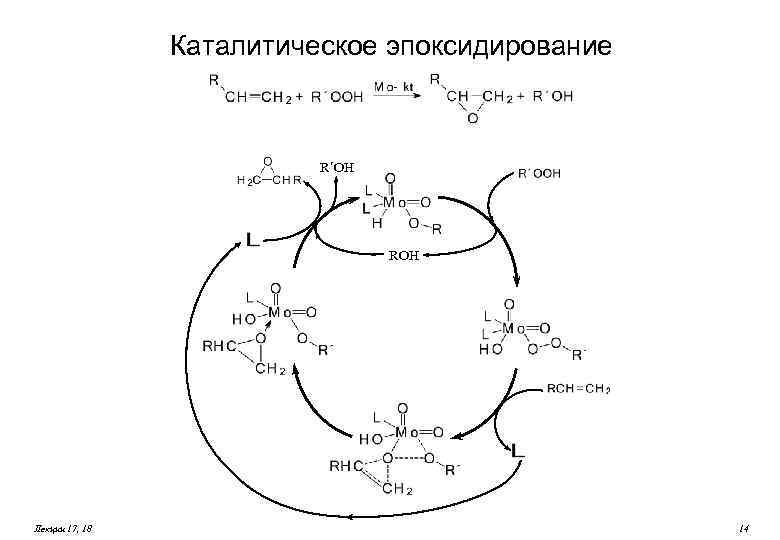 Каталитическое эпоксидирование R´OH ROH Лекции 17, 18 14
Каталитическое эпоксидирование R´OH ROH Лекции 17, 18 14
 Два принципа действия металлокомплексных катализаторов окисления R—H + O 2 продукты А. Стадийный механизм Б. Слитный механизм Лекции 17, 18 15
Два принципа действия металлокомплексных катализаторов окисления R—H + O 2 продукты А. Стадийный механизм Б. Слитный механизм Лекции 17, 18 15