Процессы на поверхности газ-твердое тело.pptx
- Количество слайдов: 92
 Процессы на поверхности раздела твердое тело -газ НТ-10
Процессы на поверхности раздела твердое тело -газ НТ-10
 Поверхность раздела твердое тело-газ Реальная поверхность твердого тела Физическая неоднородность включает в себя микронеровности поверхности различной природы и отклонения структуры поверхности реальных и физических кристаллов от точной периодичности идеального кристалла, описываемого решеткой Бравэ Химическая неоднородность дефекты, обусловленные присутствием в решетке посторонних атомов. Включение посторонних атомов может быть преднамеренным и случайным. Даже в малых количествах посторонние атомы на поверхности твердого тела могут служить «активными центрами» , влияя на процессы адсорбции и катализа Индуцированная неоднородность - обусловлена процессами адсорбции, когда поверхность покрывается слоем адсорбированных атомов из окружающего газа.
Поверхность раздела твердое тело-газ Реальная поверхность твердого тела Физическая неоднородность включает в себя микронеровности поверхности различной природы и отклонения структуры поверхности реальных и физических кристаллов от точной периодичности идеального кристалла, описываемого решеткой Бравэ Химическая неоднородность дефекты, обусловленные присутствием в решетке посторонних атомов. Включение посторонних атомов может быть преднамеренным и случайным. Даже в малых количествах посторонние атомы на поверхности твердого тела могут служить «активными центрами» , влияя на процессы адсорбции и катализа Индуцированная неоднородность - обусловлена процессами адсорбции, когда поверхность покрывается слоем адсорбированных атомов из окружающего газа.
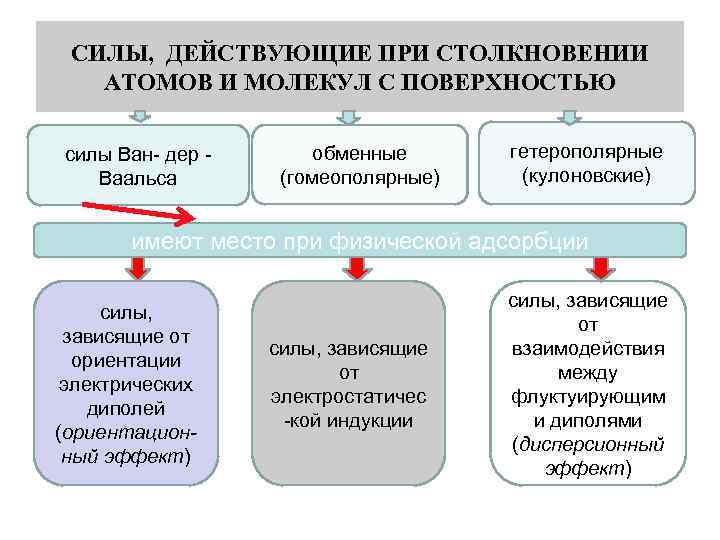 СИЛЫ, ДЕЙСТВУЮЩИЕ ПРИ СТОЛКНОВЕНИИ АТОМОВ И МОЛЕКУЛ С ПОВЕРХНОСТЬЮ силы Ван- дер Ваальса обменные (гомеополярные) гетерополярные (кулоновские) имеют место при физической адсорбции силы, зависящие от ориентации электрических диполей (ориентационный эффект) силы, зависящие от электростатичес -кой индукции силы, зависящие от взаимодействия между флуктуирующим и диполями (дисперсионный эффект)
СИЛЫ, ДЕЙСТВУЮЩИЕ ПРИ СТОЛКНОВЕНИИ АТОМОВ И МОЛЕКУЛ С ПОВЕРХНОСТЬЮ силы Ван- дер Ваальса обменные (гомеополярные) гетерополярные (кулоновские) имеют место при физической адсорбции силы, зависящие от ориентации электрических диполей (ориентационный эффект) силы, зависящие от электростатичес -кой индукции силы, зависящие от взаимодействия между флуктуирующим и диполями (дисперсионный эффект)
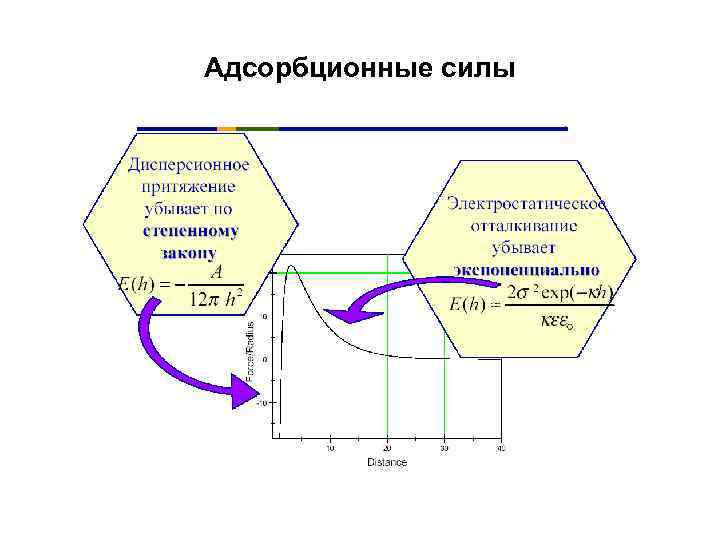 Адсорбционные силы
Адсорбционные силы
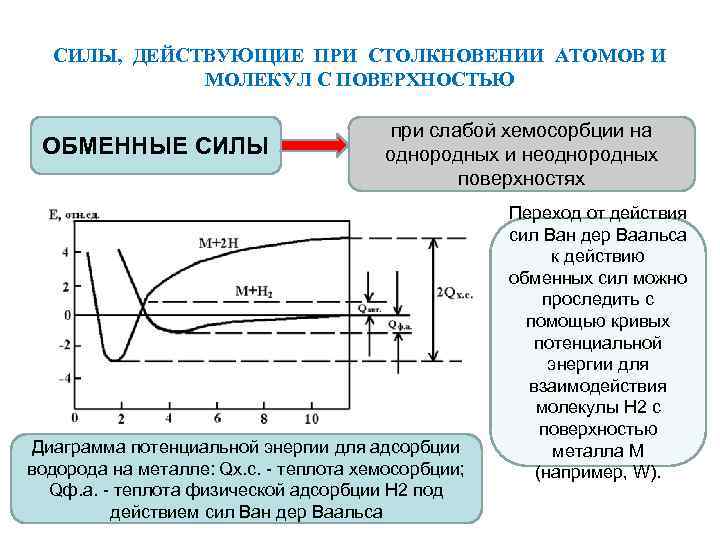 СИЛЫ, ДЕЙСТВУЮЩИЕ ПРИ СТОЛКНОВЕНИИ АТОМОВ И МОЛЕКУЛ С ПОВЕРХНОСТЬЮ ОБМЕННЫЕ СИЛЫ при слабой хемосорбции на однородных и неоднородных поверхностях Диаграмма потенциальной энергии для адсорбции водорода на металле: Qх. с. - теплота хемосорбции; Qф. а. - теплота физической адсорбции Н 2 под действием сил Ван дер Ваальса Переход от действия сил Ван дер Ваальса к действию обменных сил можно проследить с помощью кривых потенциальной энергии для взаимодействия молекулы H 2 с поверхностью металла М (например, W).
СИЛЫ, ДЕЙСТВУЮЩИЕ ПРИ СТОЛКНОВЕНИИ АТОМОВ И МОЛЕКУЛ С ПОВЕРХНОСТЬЮ ОБМЕННЫЕ СИЛЫ при слабой хемосорбции на однородных и неоднородных поверхностях Диаграмма потенциальной энергии для адсорбции водорода на металле: Qх. с. - теплота хемосорбции; Qф. а. - теплота физической адсорбции Н 2 под действием сил Ван дер Ваальса Переход от действия сил Ван дер Ваальса к действию обменных сил можно проследить с помощью кривых потенциальной энергии для взаимодействия молекулы H 2 с поверхностью металла М (например, W).
 СИЛЫ, ДЕЙСТВУЮЩИЕ ПРИ СТОЛКНОВЕНИИ АТОМОВ И МОЛЕКУЛ С ПОВЕРХНОСТЬЮ По мере приближения молекулы Н 2 к поверхности металла она может быть адсорбирована «физически» , так что взаимодействие будет описываться кривой М + Н 2. Если молекула получает некоторую энергию активации Qакт. (эта энергия может быть очень мала и даже равна нулю), то система может перейти на потенциальную кривую М + 2 Н , на которой (после диссоциации молекулы водорода на атомы) ее атомные составляющие становятся слабо хемосорбированными. Такая слабая хемосорбция характеризуется тем, что в противоположность случаю сил связи Ван дер Ваальса электронная оболочка адсорбированного атома может проникать в электронную оболочку металла.
СИЛЫ, ДЕЙСТВУЮЩИЕ ПРИ СТОЛКНОВЕНИИ АТОМОВ И МОЛЕКУЛ С ПОВЕРХНОСТЬЮ По мере приближения молекулы Н 2 к поверхности металла она может быть адсорбирована «физически» , так что взаимодействие будет описываться кривой М + Н 2. Если молекула получает некоторую энергию активации Qакт. (эта энергия может быть очень мала и даже равна нулю), то система может перейти на потенциальную кривую М + 2 Н , на которой (после диссоциации молекулы водорода на атомы) ее атомные составляющие становятся слабо хемосорбированными. Такая слабая хемосорбция характеризуется тем, что в противоположность случаю сил связи Ван дер Ваальса электронная оболочка адсорбированного атома может проникать в электронную оболочку металла.
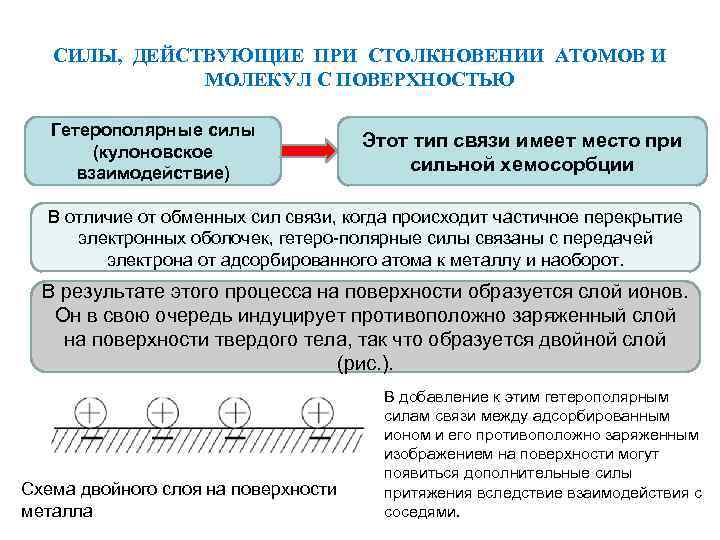 СИЛЫ, ДЕЙСТВУЮЩИЕ ПРИ СТОЛКНОВЕНИИ АТОМОВ И МОЛЕКУЛ С ПОВЕРХНОСТЬЮ Гетерополярные силы (кулоновское взаимодействие) Этот тип связи имеет место при сильной хемосорбции В отличие от обменных сил связи, когда происходит частичное перекрытие электронных оболочек, гетеро-полярные силы связаны с передачей электрона от адсорбированного атома к металлу и наоборот. В результате этого процесса на поверхности образуется слой ионов. Он в свою очередь индуцирует противоположно заряженный слой на поверхности твердого тела, так что образуется двойной слой (рис. ). Схема двойного слоя на поверхности металла В добавление к этим гетерополярным силам связи между адсорбированным ионом и его противоположно заряженным изображением на поверхности могут появиться дополнительные силы притяжения вследствие взаимодействия с соседями.
СИЛЫ, ДЕЙСТВУЮЩИЕ ПРИ СТОЛКНОВЕНИИ АТОМОВ И МОЛЕКУЛ С ПОВЕРХНОСТЬЮ Гетерополярные силы (кулоновское взаимодействие) Этот тип связи имеет место при сильной хемосорбции В отличие от обменных сил связи, когда происходит частичное перекрытие электронных оболочек, гетеро-полярные силы связаны с передачей электрона от адсорбированного атома к металлу и наоборот. В результате этого процесса на поверхности образуется слой ионов. Он в свою очередь индуцирует противоположно заряженный слой на поверхности твердого тела, так что образуется двойной слой (рис. ). Схема двойного слоя на поверхности металла В добавление к этим гетерополярным силам связи между адсорбированным ионом и его противоположно заряженным изображением на поверхности могут появиться дополнительные силы притяжения вследствие взаимодействия с соседями.
 Адсорбция Поверхностная энергия стремится к самопроизвольному уменьшению. Это выражается в уменьшении межфазной поверхности или поверхностного натяжения: Gs = σ·S К явлениям, происходящим к вследствие стремления к самопроизвольному снижению поверхностного натяжения, относится адсорбция. На любой границе раздела существует «поверхностный слой» (ПС) – переходная область от одной объемной фазы к другой. Поверхностный слой имеет очень малую толщину (всего несколько молекул), но в нем сосредоточен весь избыток поверхностной энергии и массы вещества.
Адсорбция Поверхностная энергия стремится к самопроизвольному уменьшению. Это выражается в уменьшении межфазной поверхности или поверхностного натяжения: Gs = σ·S К явлениям, происходящим к вследствие стремления к самопроизвольному снижению поверхностного натяжения, относится адсорбция. На любой границе раздела существует «поверхностный слой» (ПС) – переходная область от одной объемной фазы к другой. Поверхностный слой имеет очень малую толщину (всего несколько молекул), но в нем сосредоточен весь избыток поверхностной энергии и массы вещества.
 Адсорбция АДСОРБЦИЯ Этот процесс происходит вследствие стремления к минимуму поверхностной энергии или энергии Гиббса системы. процесс самопроизвольного перераспределения компонентов системы между поверхностным слоем и объемной фазой С термодинамической точки зрения адсорбция – самопроизвольный процесс выравнивания химических потенциалов в объеме системы и в межфазном (приповерхностном) слое
Адсорбция АДСОРБЦИЯ Этот процесс происходит вследствие стремления к минимуму поверхностной энергии или энергии Гиббса системы. процесс самопроизвольного перераспределения компонентов системы между поверхностным слоем и объемной фазой С термодинамической точки зрения адсорбция – самопроизвольный процесс выравнивания химических потенциалов в объеме системы и в межфазном (приповерхностном) слое
 Основные термины и определения Адсорбция — процесс самопроизвольного перераспределения вещества между поверхностным слоем и объемом фазы. Основные закономерности адсорбции • Правило выравнивания полярностей ( П. А. Ребиндер ) • Вещество может адсорбироваться на поверхности раздела фаз, если его присутствие в межфазном слое уравнивает разность полярностей этих фаз в зоне их контакта.
Основные термины и определения Адсорбция — процесс самопроизвольного перераспределения вещества между поверхностным слоем и объемом фазы. Основные закономерности адсорбции • Правило выравнивания полярностей ( П. А. Ребиндер ) • Вещество может адсорбироваться на поверхности раздела фаз, если его присутствие в межфазном слое уравнивает разность полярностей этих фаз в зоне их контакта.
 ∆G= ∆Н - Т∆S ‹ 0 При адсорбции происходит самопроизвольное снижение удельной свободной поверхностной энергии (поверхностного натяжения). ∆Н – теплота адсорбции (мера интенсивности взаимодействия адсорбата с поверхностью адсорбента). Количественные характеристики адсорбции Избыточная гиббсовская адсорбция (Г ) – избыток адсорбата в поверхностном слое по сравнению с его количеством в объеме фазы, отнесенный к единице площади поверхности или единице массы адсорбента (моль/м 2; моль/г), характеризует адсорбцию на жидкой поверхности. Абсолютная адсорбция (а) – количество адсорбата на единице массы или поверхности адсорбента (моль/г; моль/м 2), используется для характеристики адсорбции на твердой поверхности. 11
∆G= ∆Н - Т∆S ‹ 0 При адсорбции происходит самопроизвольное снижение удельной свободной поверхностной энергии (поверхностного натяжения). ∆Н – теплота адсорбции (мера интенсивности взаимодействия адсорбата с поверхностью адсорбента). Количественные характеристики адсорбции Избыточная гиббсовская адсорбция (Г ) – избыток адсорбата в поверхностном слое по сравнению с его количеством в объеме фазы, отнесенный к единице площади поверхности или единице массы адсорбента (моль/м 2; моль/г), характеризует адсорбцию на жидкой поверхности. Абсолютная адсорбция (а) – количество адсорбата на единице массы или поверхности адсорбента (моль/г; моль/м 2), используется для характеристики адсорбции на твердой поверхности. 11
 Еще несколько терминов • Адсорбентом называют вещество, на котором происходит адсорбция; • Адсорбатом называют уже адсорбированное вещество, находящееся на поверхности или в объеме пор адсорбента; • Адсорбтивом называют вещество, способное адсорбироваться, но еще не адсорбированное. Допускается (когда различия между адсорбцией и абсорбцией малы или механизм поглощения не ясен) использование более общих терминов сорбция, сорбент, сорбат, сорбтив. Два предельных случая адсорбции: адсорбцию химическую или хемосорбцию и физическую или физадсорбцию.
Еще несколько терминов • Адсорбентом называют вещество, на котором происходит адсорбция; • Адсорбатом называют уже адсорбированное вещество, находящееся на поверхности или в объеме пор адсорбента; • Адсорбтивом называют вещество, способное адсорбироваться, но еще не адсорбированное. Допускается (когда различия между адсорбцией и абсорбцией малы или механизм поглощения не ясен) использование более общих терминов сорбция, сорбент, сорбат, сорбтив. Два предельных случая адсорбции: адсорбцию химическую или хемосорбцию и физическую или физадсорбцию.
 Адсорбция на твердом теле Физическая Химическая (хемосорбция) Взаимодействие адсорбента и адсорбата за счет сил Ван-дер. Ваальса и водородных связей. Взаимодействие адсорбента и адсорбата за счет образования химических связей. а) теплота адсорбции от – 10 до – а) теплота адсорбции от ± 40 до 40 к. Дж/моль; ± 400 к. Дж/моль; б) обратима при понижении концентрации адсорбата и при повышении температуры (десорбция); б) необратима, зависит от температуры в соответствии с принципом Ле. Шателье; в) малоспецифична. в) строго специфична. Примеры Физическая адсорбция: адсорбция аммиака на угле. Химическая адсорбция: адсорбция углекислого газа на извести. 13
Адсорбция на твердом теле Физическая Химическая (хемосорбция) Взаимодействие адсорбента и адсорбата за счет сил Ван-дер. Ваальса и водородных связей. Взаимодействие адсорбента и адсорбата за счет образования химических связей. а) теплота адсорбции от – 10 до – а) теплота адсорбции от ± 40 до 40 к. Дж/моль; ± 400 к. Дж/моль; б) обратима при понижении концентрации адсорбата и при повышении температуры (десорбция); б) необратима, зависит от температуры в соответствии с принципом Ле. Шателье; в) малоспецифична. в) строго специфична. Примеры Физическая адсорбция: адсорбция аммиака на угле. Химическая адсорбция: адсорбция углекислого газа на извести. 13
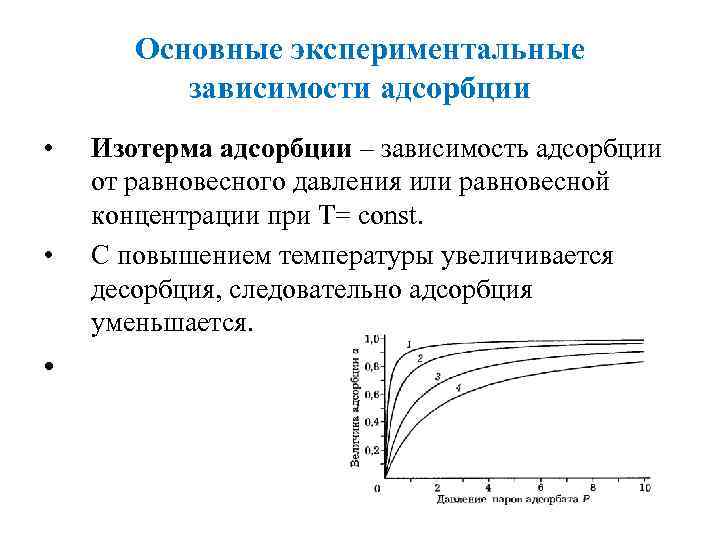 Основные экспериментальные зависимости адсорбции • • • Изотерма адсорбции – зависимость адсорбции от равновесного давления или равновесной концентрации при Т= const. С повышением температуры увеличивается десорбция, следовательно адсорбция уменьшается.
Основные экспериментальные зависимости адсорбции • • • Изотерма адсорбции – зависимость адсорбции от равновесного давления или равновесной концентрации при Т= const. С повышением температуры увеличивается десорбция, следовательно адсорбция уменьшается.
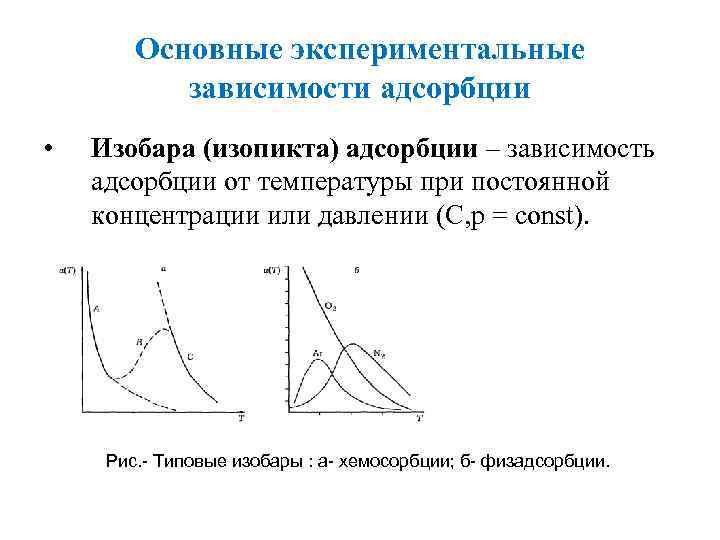 Основные экспериментальные зависимости адсорбции • Изобара (изопикта) адсорбции – зависимость адсорбции от температуры при постоянной концентрации или давлении (С, р = const). Рис. - Типовые изобары : а- хемосорбции; б- физадсорбции.
Основные экспериментальные зависимости адсорбции • Изобара (изопикта) адсорбции – зависимость адсорбции от температуры при постоянной концентрации или давлении (С, р = const). Рис. - Типовые изобары : а- хемосорбции; б- физадсорбции.
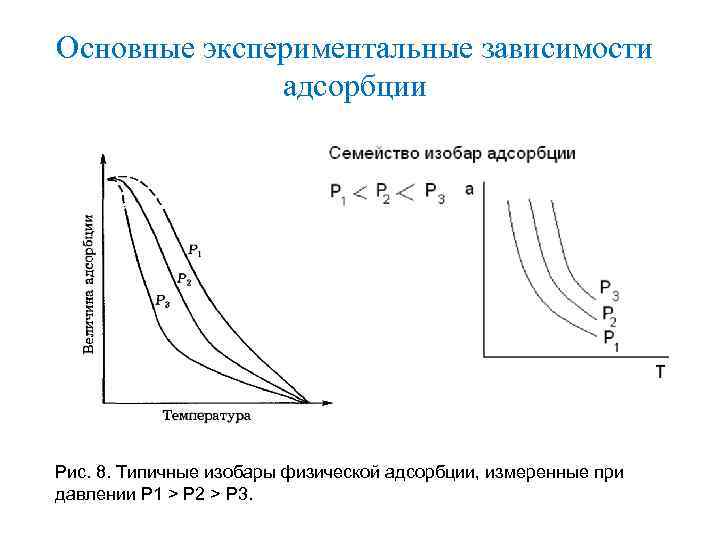 Основные экспериментальные зависимости адсорбции Рис. 8. Типичные изобары физической адсорбции, измеренные при давлении Р 1 > Р 2 > Р 3.
Основные экспериментальные зависимости адсорбции Рис. 8. Типичные изобары физической адсорбции, измеренные при давлении Р 1 > Р 2 > Р 3.
 Основные экспериментальные зависимости адсорбции • • Изостера адсорбции – зависимость концентрации или парциального давления от температуры при постоянной величине адсорбции А= const (расчетная зависимость, позволяющая определить теплоту адсорбции). Наиболее распространенной зависимостью, получаемой экспериментально, является изотерма адсорбции, так как проще всего обеспечить постоянство температуры.
Основные экспериментальные зависимости адсорбции • • Изостера адсорбции – зависимость концентрации или парциального давления от температуры при постоянной величине адсорбции А= const (расчетная зависимость, позволяющая определить теплоту адсорбции). Наиболее распространенной зависимостью, получаемой экспериментально, является изотерма адсорбции, так как проще всего обеспечить постоянство температуры.
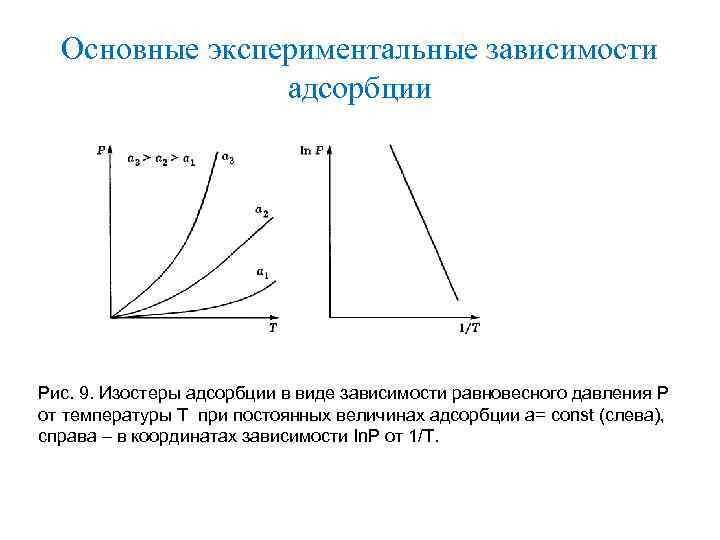 Основные экспериментальные зависимости адсорбции Рис. 9. Изостеры адсорбции в виде зависимости равновесного давления Р от температуры Т при постоянных величинах адсорбции а= const (слева), справа – в координатах зависимости ln. P от 1/Т.
Основные экспериментальные зависимости адсорбции Рис. 9. Изостеры адсорбции в виде зависимости равновесного давления Р от температуры Т при постоянных величинах адсорбции а= const (слева), справа – в координатах зависимости ln. P от 1/Т.
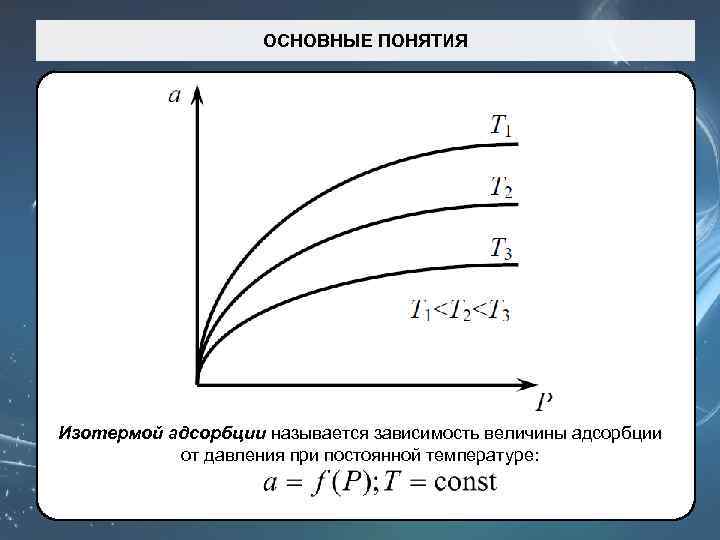 ОСНОВНЫЕ ПОНЯТИЯ Изотермой адсорбции называется зависимость величины адсорбции от давления при постоянной температуре:
ОСНОВНЫЕ ПОНЯТИЯ Изотермой адсорбции называется зависимость величины адсорбции от давления при постоянной температуре:
 Изотерма адсорбции Генри Простейшее уравнение изотермы адсорбции, называемой изотермой (законом) Генри записывается в виде: Г = Кг P Это уравнение применимо при максимальных заполнениях поверхности и малых давлениях, когда газ можно рассматривать как идеальный, а число соударений его молекул с поверхностью, не занятой другими адсорбированными молекулами, n пропорционально Р. Величина адсорбции Г отнесена к единице поверхности, а коэффициент пропорциональности Кг, обычно называют константой Генри. Формально Кг можно рассматривать как константу термодинамического равновесия: Кг =Г/Р, особенность которой в том, что она является смешанной, поскольку содержит давление Р и величину Г – эквивалент концентрации. Название уравнения и его константы связано с именем выдающегося английского физхимика Уильяма Генри (1774 -1836), сделавшего большой вклад в исследования свойств газов, и из-за формальной аналогии между этим законом и открытым У. Генри в 1808 г. законом растворимости газов в жидкостях.
Изотерма адсорбции Генри Простейшее уравнение изотермы адсорбции, называемой изотермой (законом) Генри записывается в виде: Г = Кг P Это уравнение применимо при максимальных заполнениях поверхности и малых давлениях, когда газ можно рассматривать как идеальный, а число соударений его молекул с поверхностью, не занятой другими адсорбированными молекулами, n пропорционально Р. Величина адсорбции Г отнесена к единице поверхности, а коэффициент пропорциональности Кг, обычно называют константой Генри. Формально Кг можно рассматривать как константу термодинамического равновесия: Кг =Г/Р, особенность которой в том, что она является смешанной, поскольку содержит давление Р и величину Г – эквивалент концентрации. Название уравнения и его константы связано с именем выдающегося английского физхимика Уильяма Генри (1774 -1836), сделавшего большой вклад в исследования свойств газов, и из-за формальной аналогии между этим законом и открытым У. Генри в 1808 г. законом растворимости газов в жидкостях.
 Изотерма адсорбции Генри Это уравнение - предельная форма всех теоретических изотерм адсорбции при Р→ 0 и основа стандартизации термодинамических функций, характеризующих адсорбцию. Но этот закон строго выполняется только при малых давлениях и малых степенях заполнения (покрытия) поверхности. При этом степень заполнения поверхности обычно определяется как ϴ = Г/Гмах, где Гмах - предельное содержание молекул на единице поверхности в заполненном монослое.
Изотерма адсорбции Генри Это уравнение - предельная форма всех теоретических изотерм адсорбции при Р→ 0 и основа стандартизации термодинамических функций, характеризующих адсорбцию. Но этот закон строго выполняется только при малых давлениях и малых степенях заполнения (покрытия) поверхности. При этом степень заполнения поверхности обычно определяется как ϴ = Г/Гмах, где Гмах - предельное содержание молекул на единице поверхности в заполненном монослое.
 Изотерма адсорбции Ленгмюра Это уравнение изотермы, описывающее ситуации при больших покрытиях, предложено в 1916 г. выдающимся американским ученым Ирвингом Ленгмюром (1881 -1957), лауреатом Нобелевской премии 1932 г. По смыслу вывода, это уравнение локализованной мономолекулярной адсорбции на однородной поверхности, полученное без учета взаимодействия адсорбат - адсорбат.
Изотерма адсорбции Ленгмюра Это уравнение изотермы, описывающее ситуации при больших покрытиях, предложено в 1916 г. выдающимся американским ученым Ирвингом Ленгмюром (1881 -1957), лауреатом Нобелевской премии 1932 г. По смыслу вывода, это уравнение локализованной мономолекулярной адсорбции на однородной поверхности, полученное без учета взаимодействия адсорбат - адсорбат.
 1. Адсорбция на границе твердое тело – газ На поверхности твердого тела лучше адсорбируются те газы, которые легче конденсируются в жидкость. Например, активированный уголь хорошо адсорбирует аммиак (Ткип. =240 К), но не адсорбирует оксид углерода (II) (Ткип=83 К). Теория мономолекулярной адсорбции Ленгмюра. Изотерма адсорбции Ленгмюра. Допущения Легмюра: 1) поверхность твердого тела состоит из элементарных участков (адсорбционных центров). 2) каждый адсорбционный центр может адсорбировать только одну молекулу газа. 3) адсорбционные центры энергетически эквивалентны (имеют одинаковое сродство к молекулам газа). 4) адсорбированные молекулы не взаимодействуют между собой и не могут перемещаться в поверхностном слое. В таких условиях образуется мономолекулярный слой адсорбированных молекул. 23
1. Адсорбция на границе твердое тело – газ На поверхности твердого тела лучше адсорбируются те газы, которые легче конденсируются в жидкость. Например, активированный уголь хорошо адсорбирует аммиак (Ткип. =240 К), но не адсорбирует оксид углерода (II) (Ткип=83 К). Теория мономолекулярной адсорбции Ленгмюра. Изотерма адсорбции Ленгмюра. Допущения Легмюра: 1) поверхность твердого тела состоит из элементарных участков (адсорбционных центров). 2) каждый адсорбционный центр может адсорбировать только одну молекулу газа. 3) адсорбционные центры энергетически эквивалентны (имеют одинаковое сродство к молекулам газа). 4) адсорбированные молекулы не взаимодействуют между собой и не могут перемещаться в поверхностном слое. В таких условиях образуется мономолекулярный слой адсорбированных молекул. 23
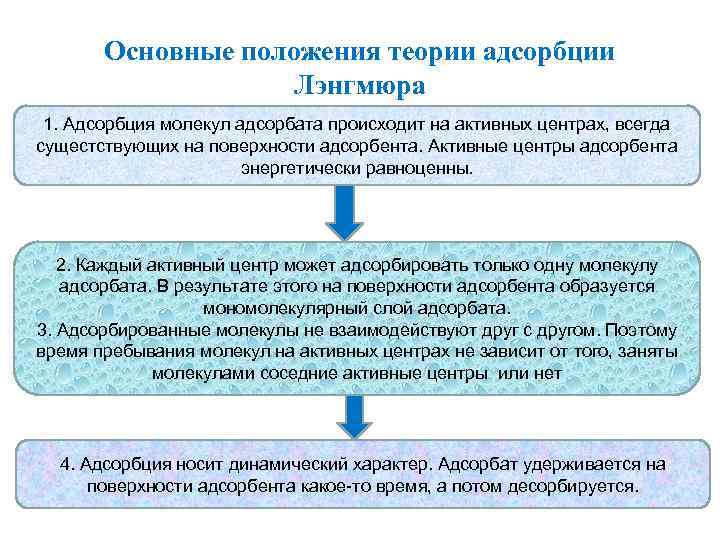 Основные положения теории адсорбции Лэнгмюра 1. Адсорбция молекул адсорбата происходит на активных центрах, всегда сущестствующих на поверхности адсорбента. Активные центры адсорбента энергетически равноценны. 2. Каждый активный центр может адсорбировать только одну молекулу адсорбата. В результате этого на поверхности адсорбента образуется мономолекулярный слой адсорбата. 3. Адсорбированные молекулы не взаимодействуют друг с другом. Поэтому время пребывания молекул на активных центрах не зависит от того, заняты молекулами соседние активные центры или нет 4. Адсорбция носит динамический характер. Адсорбат удерживается на поверхности адсорбента какое-то время, а потом десорбируется.
Основные положения теории адсорбции Лэнгмюра 1. Адсорбция молекул адсорбата происходит на активных центрах, всегда сущестствующих на поверхности адсорбента. Активные центры адсорбента энергетически равноценны. 2. Каждый активный центр может адсорбировать только одну молекулу адсорбата. В результате этого на поверхности адсорбента образуется мономолекулярный слой адсорбата. 3. Адсорбированные молекулы не взаимодействуют друг с другом. Поэтому время пребывания молекул на активных центрах не зависит от того, заняты молекулами соседние активные центры или нет 4. Адсорбция носит динамический характер. Адсорбат удерживается на поверхности адсорбента какое-то время, а потом десорбируется.
 Изотерма адсорбции Ленгмюра Для вывода этого уравнения рассмотрим квазихимическую реакцию между молекулой адсорбата M и активным центром Z на поверхности адсорбента M + [ Z ] = [MZ] (1) где [MZ]- локализованный адсорбционный комплекс. Если пренебречь взаимодействием адсорбат - адсорбат и влиянием образовавшихся адсорбционных комплексов на соседние активные центры и полагать, что число свободных центров на поверхности составляет долю (1 -ϴ) от общего числа центров, а число занятых центров - долю ϴ, то константа равновесия этой реакции К = ϴ/Р( 1 -ϴ) (2) Из (2) следует : ϴ= КР/( 1 + К ·Р) = Г/Гмах (3) или Г= Гмах К ·Р/ [ 1 + К Р ] (4)
Изотерма адсорбции Ленгмюра Для вывода этого уравнения рассмотрим квазихимическую реакцию между молекулой адсорбата M и активным центром Z на поверхности адсорбента M + [ Z ] = [MZ] (1) где [MZ]- локализованный адсорбционный комплекс. Если пренебречь взаимодействием адсорбат - адсорбат и влиянием образовавшихся адсорбционных комплексов на соседние активные центры и полагать, что число свободных центров на поверхности составляет долю (1 -ϴ) от общего числа центров, а число занятых центров - долю ϴ, то константа равновесия этой реакции К = ϴ/Р( 1 -ϴ) (2) Из (2) следует : ϴ= КР/( 1 + К ·Р) = Г/Гмах (3) или Г= Гмах К ·Р/ [ 1 + К Р ] (4)
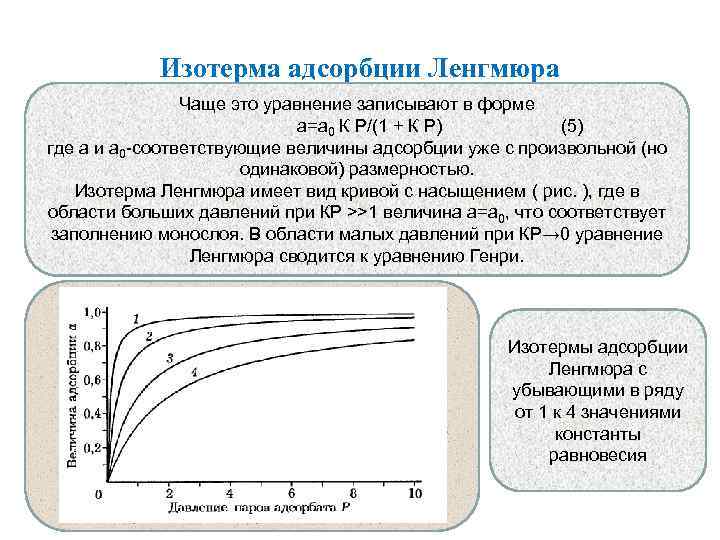 Изотерма адсорбции Ленгмюра Чаще это уравнение записывают в форме а=а 0 К Р/(1 + К Р) (5) где а и а 0 -соответствующие величины адсорбции уже с произвольной (но одинаковой) размерностью. Изотерма Ленгмюра имеет вид кривой с насыщением ( рис. ), где в области больших давлений при КР >>1 величина а=а 0, что соответствует заполнению монослоя. В области малых давлений при КР→ 0 уравнение Ленгмюра сводится к уравнению Генри. Изотермы адсорбции Ленгмюра с убывающими в ряду от 1 к 4 значениями константы равновесия
Изотерма адсорбции Ленгмюра Чаще это уравнение записывают в форме а=а 0 К Р/(1 + К Р) (5) где а и а 0 -соответствующие величины адсорбции уже с произвольной (но одинаковой) размерностью. Изотерма Ленгмюра имеет вид кривой с насыщением ( рис. ), где в области больших давлений при КР >>1 величина а=а 0, что соответствует заполнению монослоя. В области малых давлений при КР→ 0 уравнение Ленгмюра сводится к уравнению Генри. Изотермы адсорбции Ленгмюра с убывающими в ряду от 1 к 4 значениями константы равновесия
 Изотерма адсорбции Ленгмюра Уравнение Ленгмюра широко используется на практике. Для расчета значений а 0 и константы равновесия К оно записывается в линейном виде как: Р/а = 1/(а 0 К) + ( 1/а ) Р (6) или: а/Р = К а 0 - К а (7) или: 1/а = 1/а 0 + ( 1/а 0 К) ( 1/Р ) (8) Константа адсорбционного равновесия К, подобно константам равновесия реакций в газах или растворах, связана со стандартным изменением изохорного потенциала уравнением: ∆F 0 =∆U 0 - T ∆ S 0 = - RT ln K (9) откуда следует К =e S 0/R e- U 0/RT =g e. Q/RT (10) где g- энтропийный множитель, Q- теплота адсорбции.
Изотерма адсорбции Ленгмюра Уравнение Ленгмюра широко используется на практике. Для расчета значений а 0 и константы равновесия К оно записывается в линейном виде как: Р/а = 1/(а 0 К) + ( 1/а ) Р (6) или: а/Р = К а 0 - К а (7) или: 1/а = 1/а 0 + ( 1/а 0 К) ( 1/Р ) (8) Константа адсорбционного равновесия К, подобно константам равновесия реакций в газах или растворах, связана со стандартным изменением изохорного потенциала уравнением: ∆F 0 =∆U 0 - T ∆ S 0 = - RT ln K (9) откуда следует К =e S 0/R e- U 0/RT =g e. Q/RT (10) где g- энтропийный множитель, Q- теплота адсорбции.
 Уравнение адсорбции Лэнгмюра. Г – адсорбция, моль/м 2; Г∞ – предельная адсорбция, моль/м 2; С – равновесная концентрация вещества, моль/дм 3; Р – равновесное давление вещества, Кпа, К – константа адсорбционного равновесия. Характеристика уравнения Лэнгмюра: 1. Имеет теоретическое обоснование; 2. Применимо для подвижной и неподвижной границ раздела фаз; 3. Справедливо для малых и больших концентраций адсорбтива.
Уравнение адсорбции Лэнгмюра. Г – адсорбция, моль/м 2; Г∞ – предельная адсорбция, моль/м 2; С – равновесная концентрация вещества, моль/дм 3; Р – равновесное давление вещества, Кпа, К – константа адсорбционного равновесия. Характеристика уравнения Лэнгмюра: 1. Имеет теоретическое обоснование; 2. Применимо для подвижной и неподвижной границ раздела фаз; 3. Справедливо для малых и больших концентраций адсорбтива.
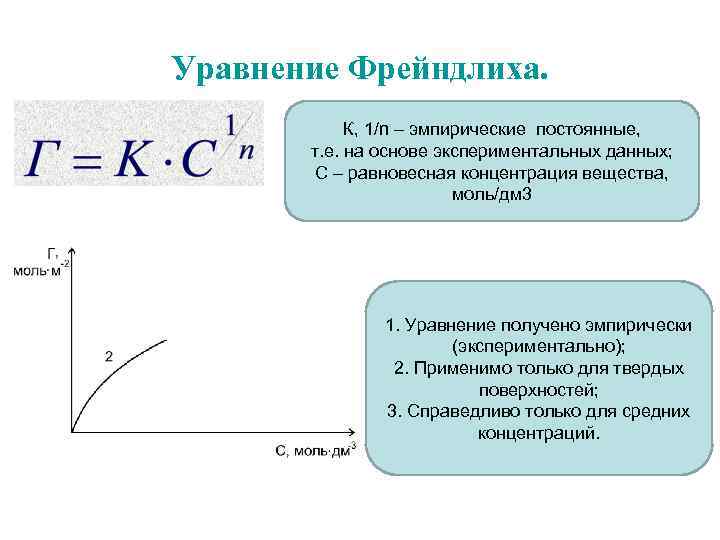 Уравнение Фрейндлиха. К, 1/n – эмпирические постоянные, т. е. на основе экспериментальных данных; С – равновесная концентрация вещества, моль/дм 3 1. Уравнение получено эмпирически (экспериментально); 2. Применимо только для твердых поверхностей; 3. Справедливо только для средних концентраций.
Уравнение Фрейндлиха. К, 1/n – эмпирические постоянные, т. е. на основе экспериментальных данных; С – равновесная концентрация вещества, моль/дм 3 1. Уравнение получено эмпирически (экспериментально); 2. Применимо только для твердых поверхностей; 3. Справедливо только для средних концентраций.
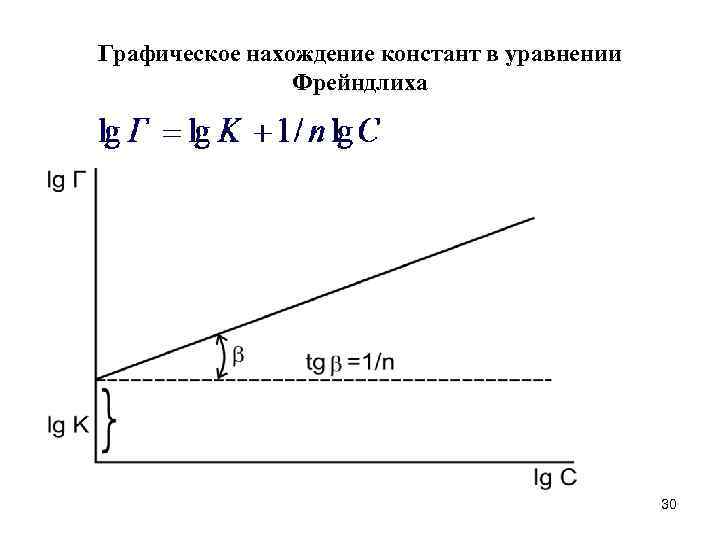 Графическое нахождение констант в уравнении Фрейндлиха 30
Графическое нахождение констант в уравнении Фрейндлиха 30
 Другие уравнения мономолекулярной локализованной адсорбции • Уравнение Ленгмюра и его модификации описывают локализованную мономолекулярную адсорбцию на однородной поверхности, которая не осложнена взаимодействием адсорбированных компонентов между собой. • При наличии такого взаимодействия и тех же прочих условиях используется уравнение Фаулера-Гугенгейма: • Р = [ /K(1 - )] exp[-K 1 /RT] (11)
Другие уравнения мономолекулярной локализованной адсорбции • Уравнение Ленгмюра и его модификации описывают локализованную мономолекулярную адсорбцию на однородной поверхности, которая не осложнена взаимодействием адсорбированных компонентов между собой. • При наличии такого взаимодействия и тех же прочих условиях используется уравнение Фаулера-Гугенгейма: • Р = [ /K(1 - )] exp[-K 1 /RT] (11)
![Другие уравнения мономолекулярной локализованной адсорбции • Уравнение Фаулера-Гугенгейма: • Р = [ϴ/K(1 -ϴ)] exp[-K Другие уравнения мономолекулярной локализованной адсорбции • Уравнение Фаулера-Гугенгейма: • Р = [ϴ/K(1 -ϴ)] exp[-K](https://present5.com/presentation/1/-20366000_253846077.pdf-img/-20366000_253846077.pdf-32.jpg) Другие уравнения мономолекулярной локализованной адсорбции • Уравнение Фаулера-Гугенгейма: • Р = [ϴ/K(1 -ϴ)] exp[-K 1ϴ/RT] (11) • где первый член в квадратных скобках - уравнение Ленгмюра с константой К, характеризующей взаимодействие адсорбат-адсорбент, а константа К 1 в экспоненте характеризует межмолекулярное взаимодействие адсорбат - адсорбат в монослое. • (в свою очередь, константа К - аналог константы Генри и характеризует взаимодействие адсорбат - адсорбент). 32
Другие уравнения мономолекулярной локализованной адсорбции • Уравнение Фаулера-Гугенгейма: • Р = [ϴ/K(1 -ϴ)] exp[-K 1ϴ/RT] (11) • где первый член в квадратных скобках - уравнение Ленгмюра с константой К, характеризующей взаимодействие адсорбат-адсорбент, а константа К 1 в экспоненте характеризует межмолекулярное взаимодействие адсорбат - адсорбат в монослое. • (в свою очередь, константа К - аналог константы Генри и характеризует взаимодействие адсорбат - адсорбент). 32
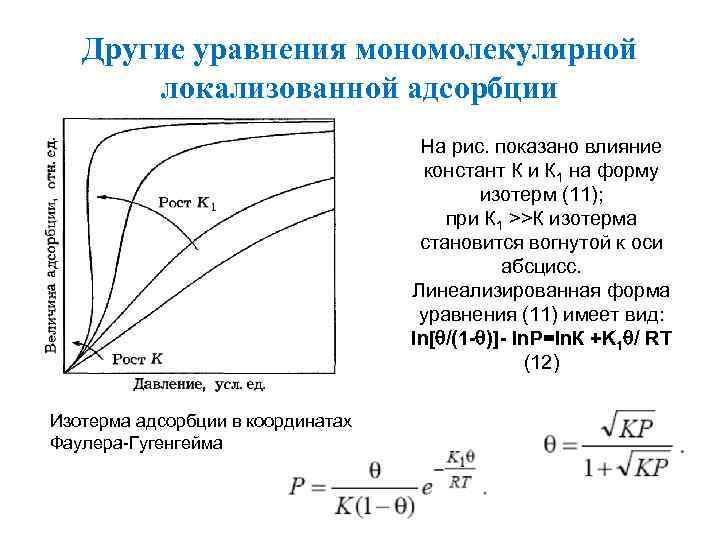 Другие уравнения мономолекулярной локализованной адсорбции На рис. показано влияние констант К и К 1 на форму изотерм (11); при К 1 >>К изотерма становится вогнутой к оси абсцисс. Линеализированная форма уравнения (11) имеет вид: ln[ /(1 - )]- ln. P=ln. К +K 1 / RT (12) Изотерма адсорбции в координатах Фаулера-Гугенгейма
Другие уравнения мономолекулярной локализованной адсорбции На рис. показано влияние констант К и К 1 на форму изотерм (11); при К 1 >>К изотерма становится вогнутой к оси абсцисс. Линеализированная форма уравнения (11) имеет вид: ln[ /(1 - )]- ln. P=ln. К +K 1 / RT (12) Изотерма адсорбции в координатах Фаулера-Гугенгейма
 Другие уравнения мономолекулярной локализованной адсорбции • Среди других уравнений изотерм адсорбции на однородной поверхности, учитывающих взаимодействие адсорбат–адсорбат, отметим уравнение, которое предложено А. В. Киселевым в форме: Р = ϴ/К(1 -ϴ)(1+ К 1ϴ) с тем же смыслом констант, что и уравнение Фаулера–Гугенгейма.
Другие уравнения мономолекулярной локализованной адсорбции • Среди других уравнений изотерм адсорбции на однородной поверхности, учитывающих взаимодействие адсорбат–адсорбат, отметим уравнение, которое предложено А. В. Киселевым в форме: Р = ϴ/К(1 -ϴ)(1+ К 1ϴ) с тем же смыслом констант, что и уравнение Фаулера–Гугенгейма.
 Другие уравнения мономолекулярной локализованной адсорбции • Дальнодействие сил при физической адсорбции обуславливает образование нескольких слоев адсорбированных молекул. Заполнение второго слоя маловероятно до тех пор, пока на поверхности находятся только отдельные изолированные молекулы, т. к. силы взаимодействия между единичной адсорбированной молекулой и ударяющейся о нее молекулой обычно малы по сравнению с силами на поверхности адсорбента, где в взаимодействии одновременно участвует большое число молекул. • Но по мере увеличения поверхностной концентрации адсорбата возрастает вероятность одновременного взаимодействия ударяющейся молекулы адсорбтива с 3, 4 и более адсорбированными ранее молекулами. “Время жизни” τ возрастает до значений, при которых на отдельных участках поверхности может начинаться полимолекулярная адсорбция. 35
Другие уравнения мономолекулярной локализованной адсорбции • Дальнодействие сил при физической адсорбции обуславливает образование нескольких слоев адсорбированных молекул. Заполнение второго слоя маловероятно до тех пор, пока на поверхности находятся только отдельные изолированные молекулы, т. к. силы взаимодействия между единичной адсорбированной молекулой и ударяющейся о нее молекулой обычно малы по сравнению с силами на поверхности адсорбента, где в взаимодействии одновременно участвует большое число молекул. • Но по мере увеличения поверхностной концентрации адсорбата возрастает вероятность одновременного взаимодействия ударяющейся молекулы адсорбтива с 3, 4 и более адсорбированными ранее молекулами. “Время жизни” τ возрастает до значений, при которых на отдельных участках поверхности может начинаться полимолекулярная адсорбция. 35
 Полимолекулярная адсорбция Простейшее уравнение полимолекулярной адсорбции, полученное независимо на основе разных предпосылок разными авторами и обычно называемое уравнением Френкеля-Хелси. Хилла (сокращенно ФХХ), имеет вид: ϴ= В 1 (RTln(P/P 0) -n (13) или t = B 2 (RTln(P/P ) -n (14) где t- среднестатистическая толщина полимолекулярной пленки адсорбата на поверхности адсорбента, получаемая делением объема адсорбата на величину поверхности адсорбента (при расчете объема адсорбата его плотность часто отождествляется с плотностью нормальной жидкой фазы). Френкель и Хилл вывели это уравнение путем интегрировавания выражений для дисперсионного потенциала без учета сил отталкивания, действие которых во втором и последующих монослоях становится пренебрежимо малым. В этом случае величина показателя степени n=3, а значения констант определяются из констант взаимодействия.
Полимолекулярная адсорбция Простейшее уравнение полимолекулярной адсорбции, полученное независимо на основе разных предпосылок разными авторами и обычно называемое уравнением Френкеля-Хелси. Хилла (сокращенно ФХХ), имеет вид: ϴ= В 1 (RTln(P/P 0) -n (13) или t = B 2 (RTln(P/P ) -n (14) где t- среднестатистическая толщина полимолекулярной пленки адсорбата на поверхности адсорбента, получаемая делением объема адсорбата на величину поверхности адсорбента (при расчете объема адсорбата его плотность часто отождествляется с плотностью нормальной жидкой фазы). Френкель и Хилл вывели это уравнение путем интегрировавания выражений для дисперсионного потенциала без учета сил отталкивания, действие которых во втором и последующих монослоях становится пренебрежимо малым. В этом случае величина показателя степени n=3, а значения констант определяются из констант взаимодействия.
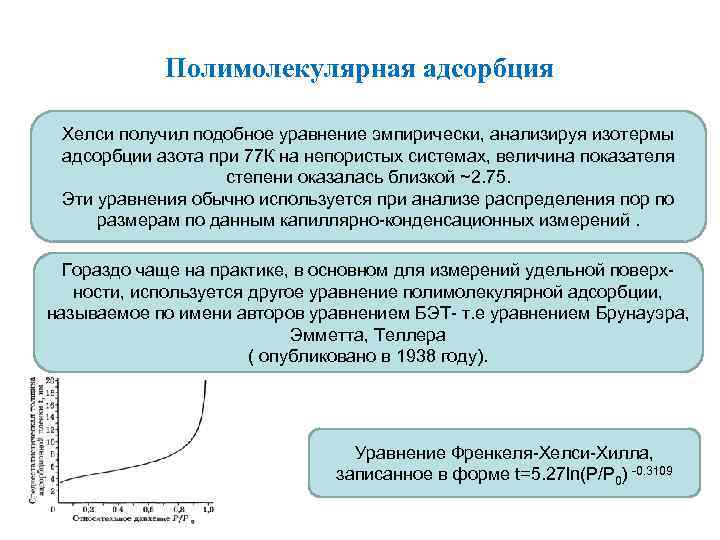 Полимолекулярная адсорбция Хелси получил подобное уравнение эмпирически, анализируя изотермы адсорбции азота при 77 К на непористых системах, величина показателя степени оказалась близкой ~2. 75. Эти уравнения обычно используется при анализе распределения пор по размерам по данным капиллярно-конденсационных измерений. Гораздо чаще на практике, в основном для измерений удельной поверхности, используется другое уравнение полимолекулярной адсорбции, называемое по имени авторов уравнением БЭТ- т. е уравнением Брунауэра, Эмметта, Теллера ( опубликовано в 1938 году). Уравнение Френкеля-Хелси-Хилла, записанное в форме t=5. 27 ln(P/P 0) -0. 3109
Полимолекулярная адсорбция Хелси получил подобное уравнение эмпирически, анализируя изотермы адсорбции азота при 77 К на непористых системах, величина показателя степени оказалась близкой ~2. 75. Эти уравнения обычно используется при анализе распределения пор по размерам по данным капиллярно-конденсационных измерений. Гораздо чаще на практике, в основном для измерений удельной поверхности, используется другое уравнение полимолекулярной адсорбции, называемое по имени авторов уравнением БЭТ- т. е уравнением Брунауэра, Эмметта, Теллера ( опубликовано в 1938 году). Уравнение Френкеля-Хелси-Хилла, записанное в форме t=5. 27 ln(P/P 0) -0. 3109
 Уравнение БЭТ При выводе этого уравнения использованы допущения Ленгмюра: 1. рассматривается адсорбция на однородной поверхности без учета взаимодействия между молекулами в плоскости слоя, 2. но дополнительно вводится учет «вертикальных» межмолекулярных взаимодействий адсорбат–адсорбат. 3. Предполагается, что ударяющиеся молекулы, попадая на уже занятые места, не покидают их немедленно, а образуют адсорбционные комплексы из групп молекул. 4. По мере приближения к давлению насыщения Р 0 сначала сокращается число свободных мест, а затем мест, занятых комплексами из одной, двух, трех и т. д. молекул.
Уравнение БЭТ При выводе этого уравнения использованы допущения Ленгмюра: 1. рассматривается адсорбция на однородной поверхности без учета взаимодействия между молекулами в плоскости слоя, 2. но дополнительно вводится учет «вертикальных» межмолекулярных взаимодействий адсорбат–адсорбат. 3. Предполагается, что ударяющиеся молекулы, попадая на уже занятые места, не покидают их немедленно, а образуют адсорбционные комплексы из групп молекул. 4. По мере приближения к давлению насыщения Р 0 сначала сокращается число свободных мест, а затем мест, занятых комплексами из одной, двух, трех и т. д. молекул.
 Уравнение БЭТ полимолекулярной адсорбции • Рассмотрим такую полимолекулярную адсорбцию как серию квазихимических реакций образования единичных и кратных комплексов: • адсорбтив + свободная поверхность <=> [единичные комплексы], • адсорбтив + единичные комплексы <=> [двойные комплексы], • адсорбтив + двойные комплексы <=> [тройные комплексы] и т. д.
Уравнение БЭТ полимолекулярной адсорбции • Рассмотрим такую полимолекулярную адсорбцию как серию квазихимических реакций образования единичных и кратных комплексов: • адсорбтив + свободная поверхность <=> [единичные комплексы], • адсорбтив + единичные комплексы <=> [двойные комплексы], • адсорбтив + двойные комплексы <=> [тройные комплексы] и т. д.
 Уравнение БЭТ полимолекулярной адсорбции • Пусть θ 1, θ 2, θ 3, θ 4, … – доля поверхности, занятая единичными, двойными, тройными и т. д. комплексами. Общая величина адсорбции, а с учетом всех типов комплексов и их кратности, определяется как: • а = аm(θ 1 + 2 θ 2 + 3 θ 3 + 4 θ 4 +. . . ), (16) • где аm – емкость плотного монослоя. Выражения для констант равновесия соответствующих квазихимических реакций записываются в виде K 1 = θ 1/(Pθ 0); • K 2 = θ 2/(Pθ 1); K 3 = θ 3/(Рθ 2) и т. д. (θ 0 – доля свободной поверхности).
Уравнение БЭТ полимолекулярной адсорбции • Пусть θ 1, θ 2, θ 3, θ 4, … – доля поверхности, занятая единичными, двойными, тройными и т. д. комплексами. Общая величина адсорбции, а с учетом всех типов комплексов и их кратности, определяется как: • а = аm(θ 1 + 2 θ 2 + 3 θ 3 + 4 θ 4 +. . . ), (16) • где аm – емкость плотного монослоя. Выражения для констант равновесия соответствующих квазихимических реакций записываются в виде K 1 = θ 1/(Pθ 0); • K 2 = θ 2/(Pθ 1); K 3 = θ 3/(Рθ 2) и т. д. (θ 0 – доля свободной поверхности).
 Уравнение БЭТ полимолекулярной адсорбции • Величина константы K 1 обычно намного больше значений K 2, K 3, K 4, …, так как сила взаимодействия быстро убывает по мере увеличения расстояния от поверхности. • Константы K 2, K 3, K 4 и т. д. также не равны другу, однако разница между ними обычно намного меньше их отличия от K 1. • Поэтому принимается допущение, что все эти константы, кроме K 1, равны другу и близки константе равновесия на границе жидкость–пар, равной • KL = 1/Р 0, где Р 0 -давление насыщенных паров жидкой фазы адсорбтива при данной температуре.
Уравнение БЭТ полимолекулярной адсорбции • Величина константы K 1 обычно намного больше значений K 2, K 3, K 4, …, так как сила взаимодействия быстро убывает по мере увеличения расстояния от поверхности. • Константы K 2, K 3, K 4 и т. д. также не равны другу, однако разница между ними обычно намного меньше их отличия от K 1. • Поэтому принимается допущение, что все эти константы, кроме K 1, равны другу и близки константе равновесия на границе жидкость–пар, равной • KL = 1/Р 0, где Р 0 -давление насыщенных паров жидкой фазы адсорбтива при данной температуре.
 Уравнение БЭТ полимолекулярной адсорбции • Это допущение позволяет переписать уравнения в виде блока уравнений (17): • 1= К 1 Р 0 • 2= К 2 Р 1= КL P 1= 1( Р/Р 0) • 3= К 3 Р 2= (КL P)2 = 1( Р/Р 0) • 4= К 4 Р 3= (КL P)3 = 1( Р/Р 0 )
Уравнение БЭТ полимолекулярной адсорбции • Это допущение позволяет переписать уравнения в виде блока уравнений (17): • 1= К 1 Р 0 • 2= К 2 Р 1= КL P 1= 1( Р/Р 0) • 3= К 3 Р 2= (КL P)2 = 1( Р/Р 0) • 4= К 4 Р 3= (КL P)3 = 1( Р/Р 0 )
 Уравнение БЭТ полимолекулярной адсорбции • Вводя эти уравнения в (16), получим • а = аm. К 1 Рϴ 0 [ 1 + 2 Р/Р 0 + 3 ( Р/Р 0)2 +. . ) (18) • С другой стороны, баланс заполнения поверхности можно представить в виде : • ϴ 0+ϴ 1+ϴ 2+ϴ 3+ϴ 4+. . . =ϴ 0{1+K 1 P[1+P/P 0+(P/P 0)2 +. . . ]}= 1. 0 • В этом уравнении выражение в квадратных скобках, где все значения Р/Р 0 < 1, представляет убывающую геометрическую прогрессию • 1+P/P 0+(P/P 0)2+(P/P 0)3. . . = 1/(1 -Р/Р 0) (19) 43
Уравнение БЭТ полимолекулярной адсорбции • Вводя эти уравнения в (16), получим • а = аm. К 1 Рϴ 0 [ 1 + 2 Р/Р 0 + 3 ( Р/Р 0)2 +. . ) (18) • С другой стороны, баланс заполнения поверхности можно представить в виде : • ϴ 0+ϴ 1+ϴ 2+ϴ 3+ϴ 4+. . . =ϴ 0{1+K 1 P[1+P/P 0+(P/P 0)2 +. . . ]}= 1. 0 • В этом уравнении выражение в квадратных скобках, где все значения Р/Р 0 < 1, представляет убывающую геометрическую прогрессию • 1+P/P 0+(P/P 0)2+(P/P 0)3. . . = 1/(1 -Р/Р 0) (19) 43
![Уравнение БЭТ полимолекулярной адсорбции • а = аm. C (Р/Р 0)/{[1 -(Р/Р 0)] [1+(C-1)(Р/Р Уравнение БЭТ полимолекулярной адсорбции • а = аm. C (Р/Р 0)/{[1 -(Р/Р 0)] [1+(C-1)(Р/Р](https://present5.com/presentation/1/-20366000_253846077.pdf-img/-20366000_253846077.pdf-44.jpg) Уравнение БЭТ полимолекулярной адсорбции • а = аm. C (Р/Р 0)/{[1 -(Р/Р 0)] [1+(C-1)(Р/Р 0)]} • уравнение БЭТ.
Уравнение БЭТ полимолекулярной адсорбции • а = аm. C (Р/Р 0)/{[1 -(Р/Р 0)] [1+(C-1)(Р/Р 0)]} • уравнение БЭТ.
 Уравнение БЭТ полимолекулярной адсорбции • Это уравнение имеет две константы аm и C, которые легко определяются из линейной формы уравнения БЭТ • Y=h/a(1 -h)=1/( аm. C)+(C-1)h/ аm. C • ( где h=Р/Р 0) из наклона и отсекаемого на оси ординат отрезка соответствующего графика зависимости Y от h.
Уравнение БЭТ полимолекулярной адсорбции • Это уравнение имеет две константы аm и C, которые легко определяются из линейной формы уравнения БЭТ • Y=h/a(1 -h)=1/( аm. C)+(C-1)h/ аm. C • ( где h=Р/Р 0) из наклона и отсекаемого на оси ординат отрезка соответствующего графика зависимости Y от h.
 Уравнение БЭТ полимолекулярной адсорбции n Константа аm равна емкости заполненного монослоя, а константа С, которую называют энергетической константой уравнения БЭТ и часто обозначают как СБЭТ , согласно современной трактовке, равна : n СБЭТ =e S/R e (Q-L) /RT n где первая экспонента связана с изменениями энтропии при адсорбции, n а вторая - с так называемой чистой теплотой адсорбции, равной разнице изостерической теплоты адсорбции Q и теплоты конденсации чистого адсорбтива L в жидкость (т. е. скрытой теплоты испарения).
Уравнение БЭТ полимолекулярной адсорбции n Константа аm равна емкости заполненного монослоя, а константа С, которую называют энергетической константой уравнения БЭТ и часто обозначают как СБЭТ , согласно современной трактовке, равна : n СБЭТ =e S/R e (Q-L) /RT n где первая экспонента связана с изменениями энтропии при адсорбции, n а вторая - с так называемой чистой теплотой адсорбции, равной разнице изостерической теплоты адсорбции Q и теплоты конденсации чистого адсорбтива L в жидкость (т. е. скрытой теплоты испарения).
 Уравнение БЭТ полимолекулярной адсорбции n При С>> 1 и малых значениях Р/Р 0 уравнение БЭТ трансформируется в уравнение Ленгмюра. n Это уравнение широкое используется для расчета емкости монослоя am, по которой далее рассчитывается площадь удельной поверхности катализаторов и адсорбентов. Если величина аm выражена в молях на г адсорбента, то удельная поверхность А с размерностью м 2/г определяется по формуле n А = а m NA n где NA - число Авогадро, - площадка, приходящаяся на одну молекулу в заполненном монослое на поверхности адсорбента.
Уравнение БЭТ полимолекулярной адсорбции n При С>> 1 и малых значениях Р/Р 0 уравнение БЭТ трансформируется в уравнение Ленгмюра. n Это уравнение широкое используется для расчета емкости монослоя am, по которой далее рассчитывается площадь удельной поверхности катализаторов и адсорбентов. Если величина аm выражена в молях на г адсорбента, то удельная поверхность А с размерностью м 2/г определяется по формуле n А = а m NA n где NA - число Авогадро, - площадка, приходящаяся на одну молекулу в заполненном монослое на поверхности адсорбента.
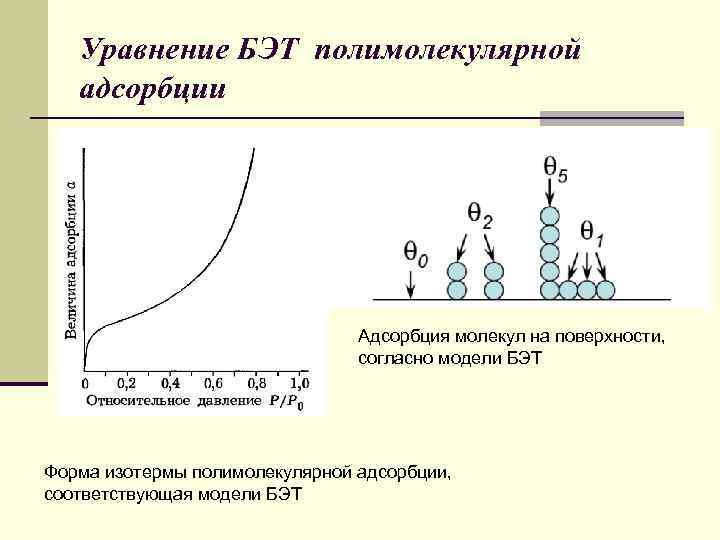 Уравнение БЭТ полимолекулярной адсорбции Адсорбция молекул на поверхности, согласно модели БЭТ Форма изотермы полимолекулярной адсорбции, соответствующая модели БЭТ
Уравнение БЭТ полимолекулярной адсорбции Адсорбция молекул на поверхности, согласно модели БЭТ Форма изотермы полимолекулярной адсорбции, соответствующая модели БЭТ
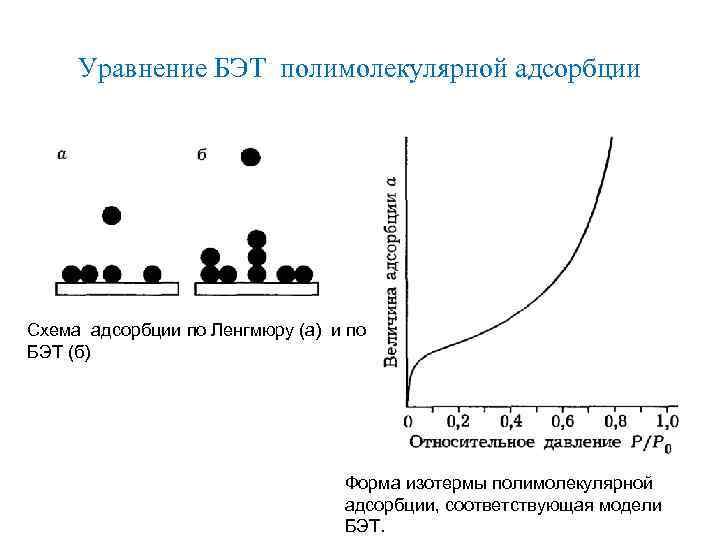 Уравнение БЭТ полимолекулярной адсорбции Схема адсорбции по Ленгмюру (а) и по БЭТ (б) Форма изотермы полимолекулярной адсорбции, соответствующая модели БЭТ.
Уравнение БЭТ полимолекулярной адсорбции Схема адсорбции по Ленгмюру (а) и по БЭТ (б) Форма изотермы полимолекулярной адсорбции, соответствующая модели БЭТ.
 Уравнение БЭТ полимолекулярной адсорбции n Модель БЭТ основывается на трёх важных допущениях: n 1. Считается, что поверхность адсорбента является однородной и, следовательно, все адсорбционные центры энергетически эквивалентны. n 2. Адсорбционные центры послойно заполняют молекулы адсорбата, причём молекулы во всех слоях, следующих за первым, рассматриваются как совершенно идентичные. n 3. Модель учитывает лишь силы взаимодействия между молекулами адсорбата и адсорбента ( «вертикальные» силы) и пренебрегает силами взаимодействия между молекулами адсорбата на поверхности в данном адсорбционном слое ( «горизонтальные» силы).
Уравнение БЭТ полимолекулярной адсорбции n Модель БЭТ основывается на трёх важных допущениях: n 1. Считается, что поверхность адсорбента является однородной и, следовательно, все адсорбционные центры энергетически эквивалентны. n 2. Адсорбционные центры послойно заполняют молекулы адсорбата, причём молекулы во всех слоях, следующих за первым, рассматриваются как совершенно идентичные. n 3. Модель учитывает лишь силы взаимодействия между молекулами адсорбата и адсорбента ( «вертикальные» силы) и пренебрегает силами взаимодействия между молекулами адсорбата на поверхности в данном адсорбционном слое ( «горизонтальные» силы).
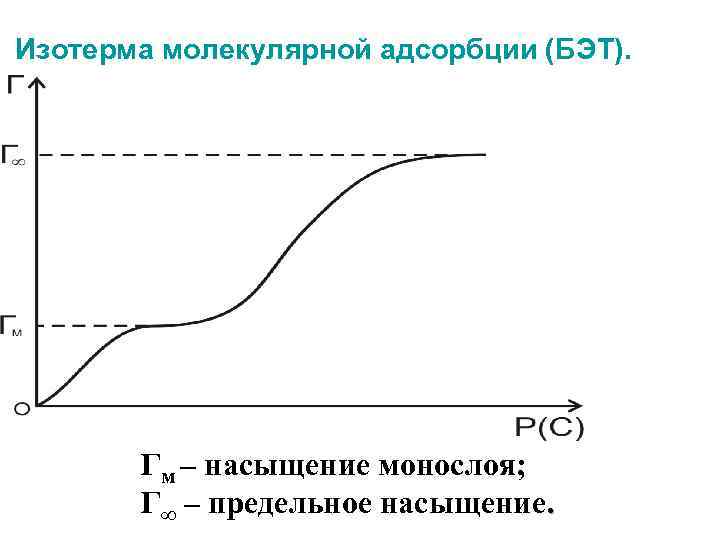 Изотерма молекулярной адсорбции (БЭТ). Гм – насыщение монослоя; Г∞ – предельное насыщение.
Изотерма молекулярной адсорбции (БЭТ). Гм – насыщение монослоя; Г∞ – предельное насыщение.
 Уравнения изотерм адсорбции де Бура-Хилла и Фольмера.
Уравнения изотерм адсорбции де Бура-Хилла и Фольмера.
 Уравнения изотерм адсорбции де Бура-Хилла и Фольмера Анализ численных значений К 1 Р 0 и К 2 показывает, что они могут изменяться, как правило, в диапазоне 0 10, где поддиапазон 0 1 соответствуют очень слабым, а область значений 10 очень сильным межмолекулярным взаимодействиям. 53
Уравнения изотерм адсорбции де Бура-Хилла и Фольмера Анализ численных значений К 1 Р 0 и К 2 показывает, что они могут изменяться, как правило, в диапазоне 0 10, где поддиапазон 0 1 соответствуют очень слабым, а область значений 10 очень сильным межмолекулярным взаимодействиям. 53
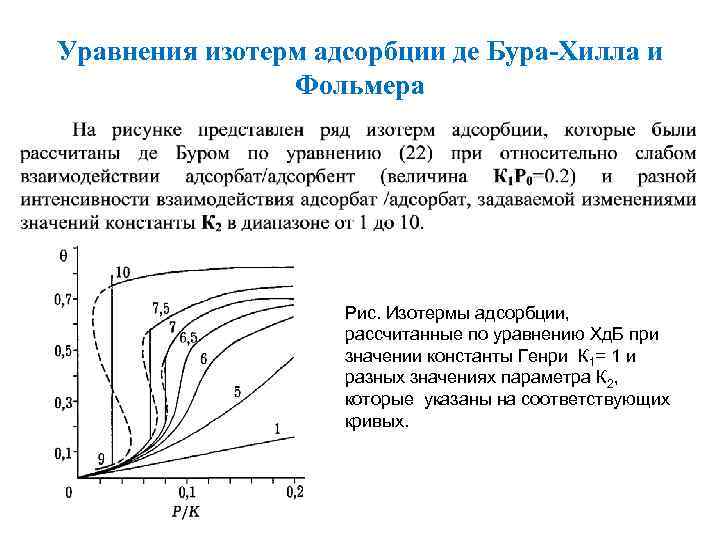 Уравнения изотерм адсорбции де Бура-Хилла и Фольмера Рис. Изотермы адсорбции, рассчитанные по уравнению Хд. Б при значении константы Генри К 1= 1 и разных значениях параметра К 2, которые указаны на соответствующих кривых.
Уравнения изотерм адсорбции де Бура-Хилла и Фольмера Рис. Изотермы адсорбции, рассчитанные по уравнению Хд. Б при значении константы Генри К 1= 1 и разных значениях параметра К 2, которые указаны на соответствующих кривых.
 Уравнения изотерм адсорбции де Бура-Хилла и Фольмера • Если исключить возможность пересыщений, то, исходя из формы полученных кривых, следует ожидать скачкообразный рост адсорбции при некоторых постоянных значениях давления. • Этот скачок соответствует двумерной конденсации сорбата, а область скачка - сосуществованию двух поверхностных фаз - “двумерного газа” и “двумерной жидкости”. • Аналогичные расчеты показывают, что увеличение значений К 1 Р 0 смещает зоны двумерной конденсации вправо - в область более высоких давлений в газовой фазе.
Уравнения изотерм адсорбции де Бура-Хилла и Фольмера • Если исключить возможность пересыщений, то, исходя из формы полученных кривых, следует ожидать скачкообразный рост адсорбции при некоторых постоянных значениях давления. • Этот скачок соответствует двумерной конденсации сорбата, а область скачка - сосуществованию двух поверхностных фаз - “двумерного газа” и “двумерной жидкости”. • Аналогичные расчеты показывают, что увеличение значений К 1 Р 0 смещает зоны двумерной конденсации вправо - в область более высоких давлений в газовой фазе.
 Уравнения изотерм адсорбции де Бура-Хилла и Фольмера • Все рассмотренные изотермы рассчитаны для адсорбции на идеально одно-родной поверхности, наиболее характерной для границы жидкость/пар. Соответственно, полученные уравнения наиболее эффективны, например, для исследования адсорбции ПАВ на поверхности растворов, где действительно наблюдаются двумерные фазовые превращения газ/жидкость/твердоподобная пленка, и проявляются дополнительные особенности, связанные с изменением ориентации адсор-бированных молекул относительно поверхности и т. д. . • В случае твердых тел достаточно однородная поверхность может быть получена только в исключительных случаях - на графитизированных сажах, моно-кристаллах и т. д. При этом применение уравнения Хилла - де Бура дает разумные результаты.
Уравнения изотерм адсорбции де Бура-Хилла и Фольмера • Все рассмотренные изотермы рассчитаны для адсорбции на идеально одно-родной поверхности, наиболее характерной для границы жидкость/пар. Соответственно, полученные уравнения наиболее эффективны, например, для исследования адсорбции ПАВ на поверхности растворов, где действительно наблюдаются двумерные фазовые превращения газ/жидкость/твердоподобная пленка, и проявляются дополнительные особенности, связанные с изменением ориентации адсор-бированных молекул относительно поверхности и т. д. . • В случае твердых тел достаточно однородная поверхность может быть получена только в исключительных случаях - на графитизированных сажах, моно-кристаллах и т. д. При этом применение уравнения Хилла - де Бура дает разумные результаты.
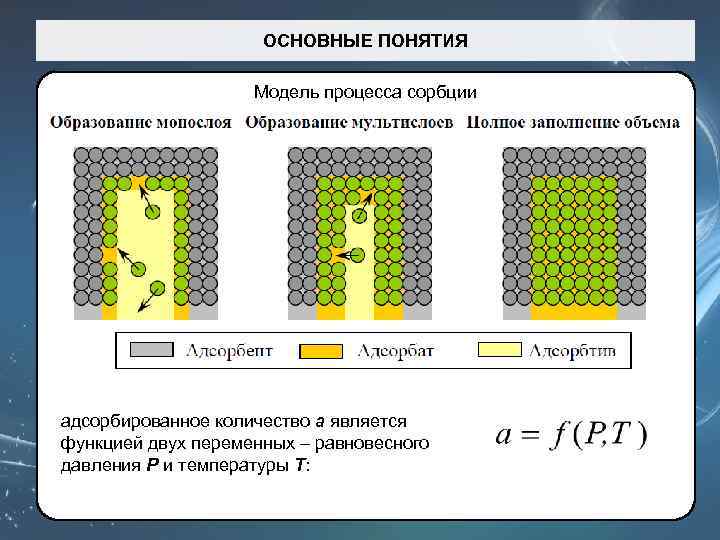 ОСНОВНЫЕ ПОНЯТИЯ Модель процесса сорбции адсорбированное количество a является функцией двух переменных – равновесного давления P и температуры T:
ОСНОВНЫЕ ПОНЯТИЯ Модель процесса сорбции адсорбированное количество a является функцией двух переменных – равновесного давления P и температуры T:
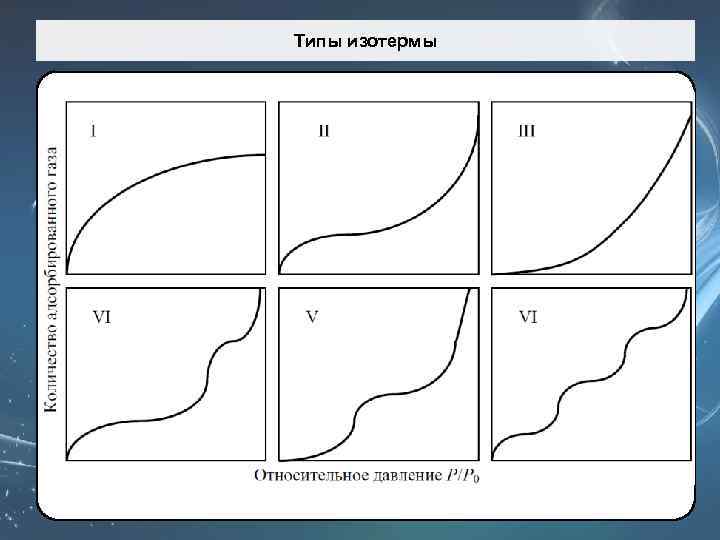 Типы изотермы
Типы изотермы
 Типы изотермы Первый типа (I) изотермы (изотерма Лангмюра) присущи, в основном, микропористым образцам с относительно не большой поверхностью (активированный уголь или цеолит). Второй тип (II) отвечает полимолекулярной адсорбции. Такая изотерма присуща непористым или макропористым адсорбентам.
Типы изотермы Первый типа (I) изотермы (изотерма Лангмюра) присущи, в основном, микропористым образцам с относительно не большой поверхностью (активированный уголь или цеолит). Второй тип (II) отвечает полимолекулярной адсорбции. Такая изотерма присуща непористым или макропористым адсорбентам.
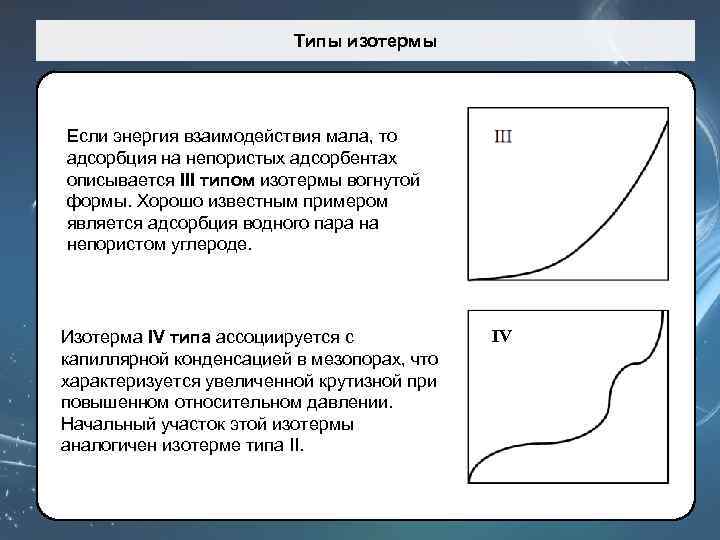 Типы изотермы Если энергия взаимодействия мала, то адсорбция на непористых адсорбентах описывается III типом изотермы вогнутой формы. Хорошо известным примером является адсорбция водного пара на непористом углероде. Изотерма IV типа ассоциируется с капиллярной конденсацией в мезопорах, что характеризуется увеличенной крутизной при повышенном относительном давлении. Начальный участок этой изотермы аналогичен изотерме типа II. IV
Типы изотермы Если энергия взаимодействия мала, то адсорбция на непористых адсорбентах описывается III типом изотермы вогнутой формы. Хорошо известным примером является адсорбция водного пара на непористом углероде. Изотерма IV типа ассоциируется с капиллярной конденсацией в мезопорах, что характеризуется увеличенной крутизной при повышенном относительном давлении. Начальный участок этой изотермы аналогичен изотерме типа II. IV
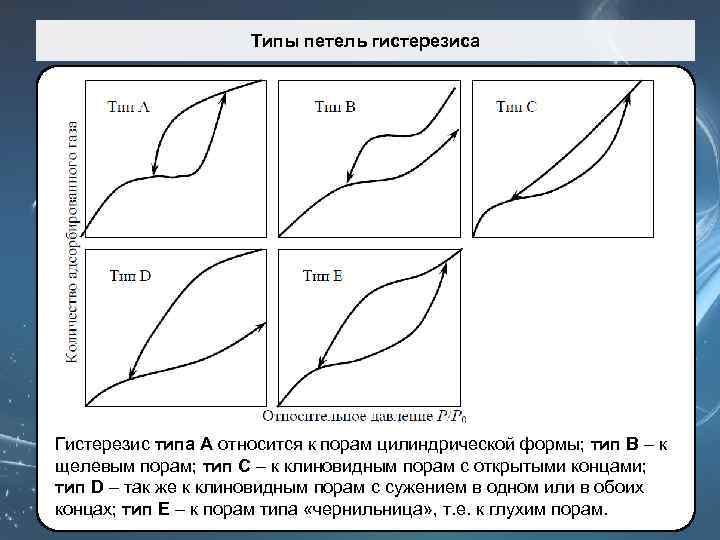 Типы петель гистерезиса Гистерезис типа A относится к порам цилиндрической формы; тип B – к щелевым порам; тип C – к клиновидным порам с открытыми концами; тип D – так же к клиновидным порам с сужением в одном или в обоих концах; тип Е – к порам типа «чернильница» , т. е. к глухим порам.
Типы петель гистерезиса Гистерезис типа A относится к порам цилиндрической формы; тип B – к щелевым порам; тип C – к клиновидным порам с открытыми концами; тип D – так же к клиновидным порам с сужением в одном или в обоих концах; тип Е – к порам типа «чернильница» , т. е. к глухим порам.
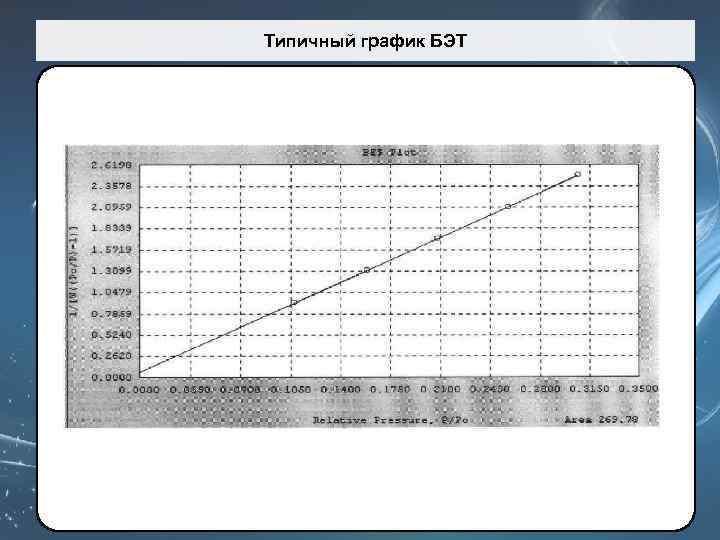
 Определение удельной поверхности – модель БЭТ Уравнение БЭТ (Брунауэра-Эммета-Теллера): где P – давление газа, P 0 – давление его насыщенных паров, W - масса газа, адсорбированного при относительном давлении Р/Р 0, Wm – вес адсорбированного вещества, образующего покрывающий всю поверхность монослой, С – константа ВЕТ, относящаяся к энергии адсорбции в первом адсорбированном слое и, следовательно, ее значение характеризует взаимодействие адсорбент/адсорбат. Удельную площадь поверхности S твердого вещества можно рассчитать из общей площади поверхности St и массы навески w по уравнению: Acs=16, 2 Å2
Определение удельной поверхности – модель БЭТ Уравнение БЭТ (Брунауэра-Эммета-Теллера): где P – давление газа, P 0 – давление его насыщенных паров, W - масса газа, адсорбированного при относительном давлении Р/Р 0, Wm – вес адсорбированного вещества, образующего покрывающий всю поверхность монослой, С – константа ВЕТ, относящаяся к энергии адсорбции в первом адсорбированном слое и, следовательно, ее значение характеризует взаимодействие адсорбент/адсорбат. Удельную площадь поверхности S твердого вещества можно рассчитать из общей площади поверхности St и массы навески w по уравнению: Acs=16, 2 Å2
 Типичный график БЭТ
Типичный график БЭТ
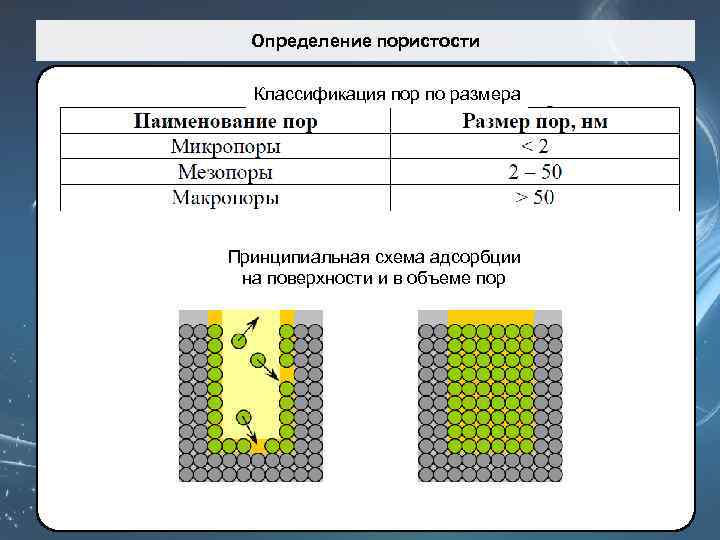 Определение пористости Классификация пор по размера Принципиальная схема адсорбции на поверхности и в объеме пор
Определение пористости Классификация пор по размера Принципиальная схема адсорбции на поверхности и в объеме пор
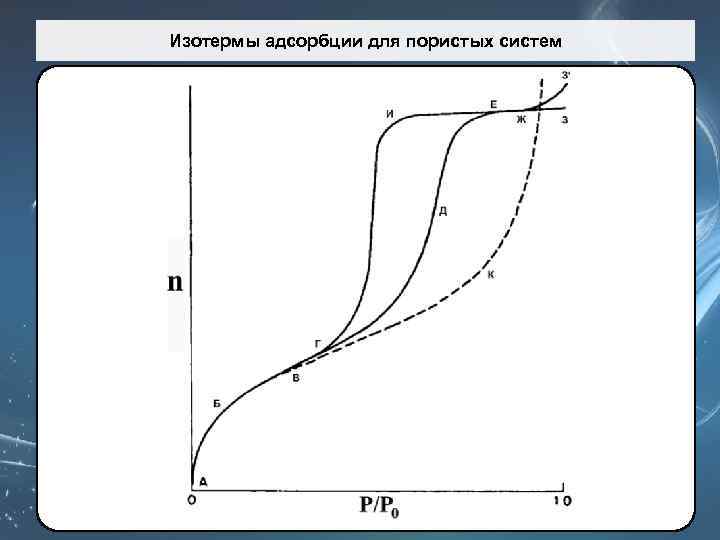 Изотермы адсорбции для пористых систем
Изотермы адсорбции для пористых систем
 Распределение пор по размерам - Метод Баррета-Джойнера-Халенды (BJH)
Распределение пор по размерам - Метод Баррета-Джойнера-Халенды (BJH)
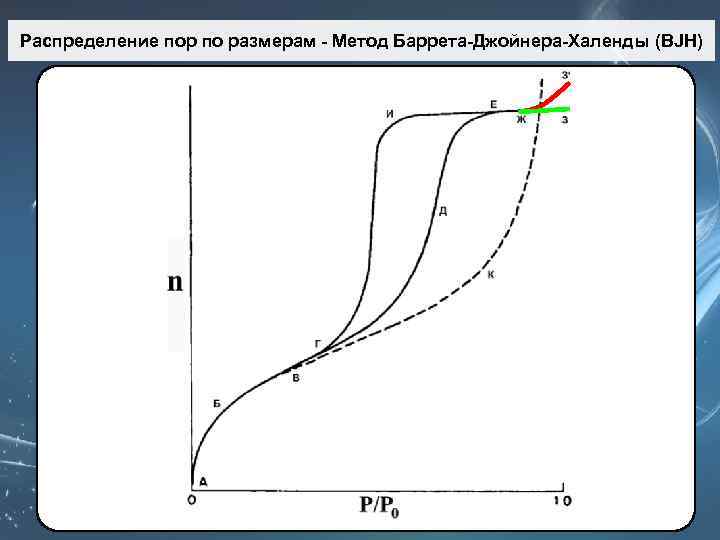
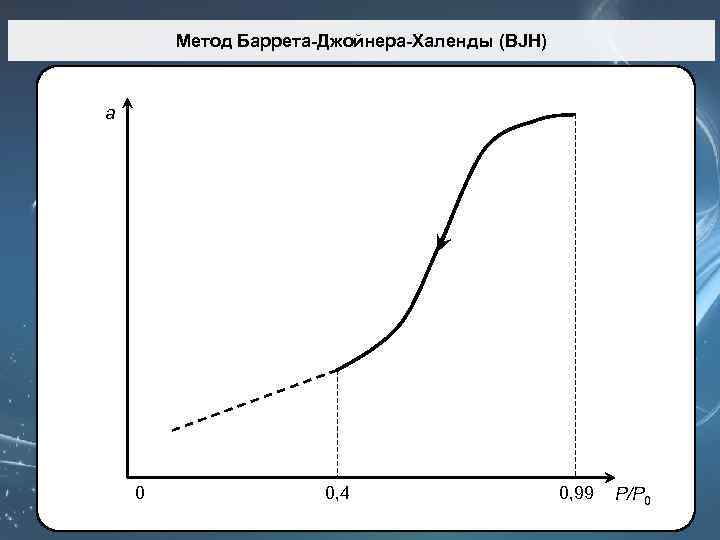
 Метод Баррета-Джойнера-Халенды (BJH) Метод Barrett-Joyner-Halenda (BJH), предложенный в 1951 г. основан на допущениях: 1. Поры имеют форму цилиндра 2. Истинный радиус пор равен: где t – толщина адсорбированного слоя. Радиус пор по Кельвину (r. K) – это радиус при котором в порах происходит конденсация при относительном давлении Р/Р 0. t r. K
Метод Баррета-Джойнера-Халенды (BJH) Метод Barrett-Joyner-Halenda (BJH), предложенный в 1951 г. основан на допущениях: 1. Поры имеют форму цилиндра 2. Истинный радиус пор равен: где t – толщина адсорбированного слоя. Радиус пор по Кельвину (r. K) – это радиус при котором в порах происходит конденсация при относительном давлении Р/Р 0. t r. K
 Метод Баррета-Джойнера-Халенды (BJH) a 0 0, 4 0, 99 P/P 0
Метод Баррета-Джойнера-Халенды (BJH) a 0 0, 4 0, 99 P/P 0
 NOVA 2200 e Quantachrome Точность измерений давления: 0, 016 мм. рт. ст, 2*10 -5 P 0 Измеряемая площадь поверхности (м 2/г): минимальная: 0, 01 максимальная: >2, 000 Диаметр пор: 3, 5 - 2, 000Å Минимальный измеряемый объем пор: 2, 2*10 -6 см 3 Прибор позволяет получать следующие данные об образце: • Изотермы адсорбции-десорбции • Площадь поверхности: Одноточечный метод BET • Площадь поверхности: Многоточечный метод BET • Площадь микропор • Объем микропор • Распределение мезо- и макропор по размерам: Модель BJH
NOVA 2200 e Quantachrome Точность измерений давления: 0, 016 мм. рт. ст, 2*10 -5 P 0 Измеряемая площадь поверхности (м 2/г): минимальная: 0, 01 максимальная: >2, 000 Диаметр пор: 3, 5 - 2, 000Å Минимальный измеряемый объем пор: 2, 2*10 -6 см 3 Прибор позволяет получать следующие данные об образце: • Изотермы адсорбции-десорбции • Площадь поверхности: Одноточечный метод BET • Площадь поверхности: Многоточечный метод BET • Площадь микропор • Объем микропор • Распределение мезо- и макропор по размерам: Модель BJH
 NOVA 2200 e Quantachrome
NOVA 2200 e Quantachrome
 Основные типы изотерм адсорбции газов и паров по классификации IUPAC
Основные типы изотерм адсорбции газов и паров по классификации IUPAC
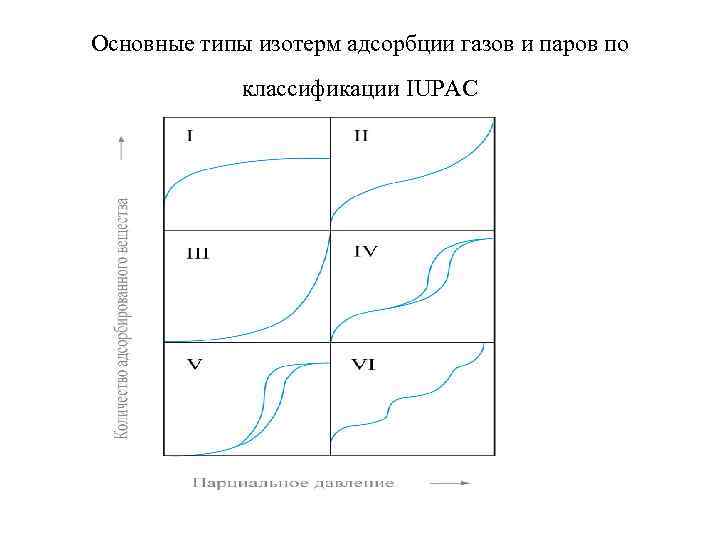
 Основные типы изотерм адсорбции газов и паров по классификации IUPAC • I-Vтипы соответствуют классификации Брунауэра (1940 г) • VI-характерен для адсорбции инертных газов при 77 К на однородной поверхности графитированных саж или монокристаллов; ступеньки соответствуют последовательному заполнению отдельных монослоев. • В области малых давлений все ИА имеют участки, где выполняется уравнение Генри; наклон этих участков определяется взаимодействием адсорбат-адсорбент. • Изотермы I типа – характерны для физической адсорбции в микропористых системах ; а также для хемосорбции, соответствующей мономолекулярной адсорбции.
Основные типы изотерм адсорбции газов и паров по классификации IUPAC • I-Vтипы соответствуют классификации Брунауэра (1940 г) • VI-характерен для адсорбции инертных газов при 77 К на однородной поверхности графитированных саж или монокристаллов; ступеньки соответствуют последовательному заполнению отдельных монослоев. • В области малых давлений все ИА имеют участки, где выполняется уравнение Генри; наклон этих участков определяется взаимодействием адсорбат-адсорбент. • Изотермы I типа – характерны для физической адсорбции в микропористых системах ; а также для хемосорбции, соответствующей мономолекулярной адсорбции.
 Основные типы изотерм адсорбции газов и паров по классификации IUPAC • Изотермы II -типа – характерны для непористых или макропористых адсорбентов с сильным взаимодействием адсорбат-адсорбент (Г-Х), о чем свидетельствует выпуклый начальный участок ИА. • Ослабление такого взаимодействия приводит к ИА III – типа, характерны для непористых носителей. • ИА III –типа сравнительно редко встречающийся тип изотерм образования полислоя из газовой среды на твердом адсорбенте, для тел, потенциал монослоя которых мал и имеет тот же порядок, что и теплота конденсации адсорбтива. Изотермы III типа характерны для случая слабого взаимодействия газа с адсорбентом при адсорбции на непористых твердых телах.
Основные типы изотерм адсорбции газов и паров по классификации IUPAC • Изотермы II -типа – характерны для непористых или макропористых адсорбентов с сильным взаимодействием адсорбат-адсорбент (Г-Х), о чем свидетельствует выпуклый начальный участок ИА. • Ослабление такого взаимодействия приводит к ИА III – типа, характерны для непористых носителей. • ИА III –типа сравнительно редко встречающийся тип изотерм образования полислоя из газовой среды на твердом адсорбенте, для тел, потенциал монослоя которых мал и имеет тот же порядок, что и теплота конденсации адсорбтива. Изотермы III типа характерны для случая слабого взаимодействия газа с адсорбентом при адсорбции на непористых твердых телах.
 Основные типы изотерм адсорбции газов и паров по классификации IUPAC • ИА IV и. V-типов –характерны для адсорбции на пористом твердом теле, отличаются тем, что для них характерна конечная адсорбция приближении давления пара к давлению насыщенного пара Рs; имеют петлю капиллярного конденсационного гистерезиса, что указывает на наличие мезопор (2 -100 нм)
Основные типы изотерм адсорбции газов и паров по классификации IUPAC • ИА IV и. V-типов –характерны для адсорбции на пористом твердом теле, отличаются тем, что для них характерна конечная адсорбция приближении давления пара к давлению насыщенного пара Рs; имеют петлю капиллярного конденсационного гистерезиса, что указывает на наличие мезопор (2 -100 нм)
 Основные типы изотерм адсорбции газов и паров по классификации IUPAC • Изотермы IV и V типов характерны для адсорбции в высокопористых телах, причем изотерма V типа отвечает случаю слабого взаимодействия газ/адсорбент. • А наличие петель на этих изотермах связано с капиллярной конденсацией.
Основные типы изотерм адсорбции газов и паров по классификации IUPAC • Изотермы IV и V типов характерны для адсорбции в высокопористых телах, причем изотерма V типа отвечает случаю слабого взаимодействия газ/адсорбент. • А наличие петель на этих изотермах связано с капиллярной конденсацией.
 Основные положения теории Поляни • • Адсорбция обусловлена чисто физическими силами (силами Ван-дер. Ваальса). Основной вклад вносят дальнодействующие дисперсионные силы аддитивные и не зависящие от температуры. На поверхности адсорбента нет активных центров (энергетически однородная поверхность).
Основные положения теории Поляни • • Адсорбция обусловлена чисто физическими силами (силами Ван-дер. Ваальса). Основной вклад вносят дальнодействующие дисперсионные силы аддитивные и не зависящие от температуры. На поверхности адсорбента нет активных центров (энергетически однородная поверхность).
 Основные положения теории Поляни • • Адсорбция обусловлена чисто физическими силами (силами Ван-дер. Ваальса). Основной вклад вносят дальнодействующие дисперсионные силы аддитивные и не зависящие от температуры. На поверхности адсорбента нет активных центров (энергетически однородная поверхность).
Основные положения теории Поляни • • Адсорбция обусловлена чисто физическими силами (силами Ван-дер. Ваальса). Основной вклад вносят дальнодействующие дисперсионные силы аддитивные и не зависящие от температуры. На поверхности адсорбента нет активных центров (энергетически однородная поверхность).
 Основные положения теории Поляни • • • Адсорбционные силы действуют на больших расстояниях, что приводит к образованию полимолекулярного слоя. По мере удаления от поверхности действие адсорбционных сил уменьшается и на некотором расстоянии становится практически равным нулю. Адсорбционные силы не зависят от температуры. Практически все адсорбированное вещество находится на поверхности адсорбента в жидком состоянии.
Основные положения теории Поляни • • • Адсорбционные силы действуют на больших расстояниях, что приводит к образованию полимолекулярного слоя. По мере удаления от поверхности действие адсорбционных сил уменьшается и на некотором расстоянии становится практически равным нулю. Адсорбционные силы не зависят от температуры. Практически все адсорбированное вещество находится на поверхности адсорбента в жидком состоянии.
 Основные положения теории Поляни • Характеристическая кривая не зависит от температуры и индивидуальна и характерна для каждого вида адсорбента для сходных адсорбатов. • Адсорбционные потенциалы для разных адсорбатов на одном и том же адсорбенте находятся в постоянном соотношении. • Это соотношение называется коэффициентом афинности ( близости, сродства) : • β = ε 1/ ε 2
Основные положения теории Поляни • Характеристическая кривая не зависит от температуры и индивидуальна и характерна для каждого вида адсорбента для сходных адсорбатов. • Адсорбционные потенциалы для разных адсорбатов на одном и том же адсорбенте находятся в постоянном соотношении. • Это соотношение называется коэффициентом афинности ( близости, сродства) : • β = ε 1/ ε 2
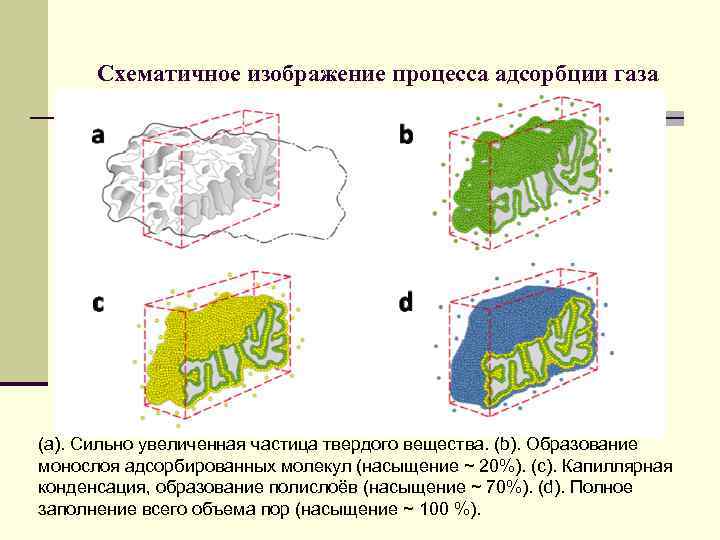 Схематичное изображение процесса адсорбции газа (а). Сильно увеличенная частица твердого вещества. (b). Образование монослоя адсорбированных молекул (насыщение ~ 20%). (c). Капиллярная конденсация, образование полислоёв (насыщение ~ 70%). (d). Полное заполнение всего объема пор (насыщение ~ 100 %).
Схематичное изображение процесса адсорбции газа (а). Сильно увеличенная частица твердого вещества. (b). Образование монослоя адсорбированных молекул (насыщение ~ 20%). (c). Капиллярная конденсация, образование полислоёв (насыщение ~ 70%). (d). Полное заполнение всего объема пор (насыщение ~ 100 %).
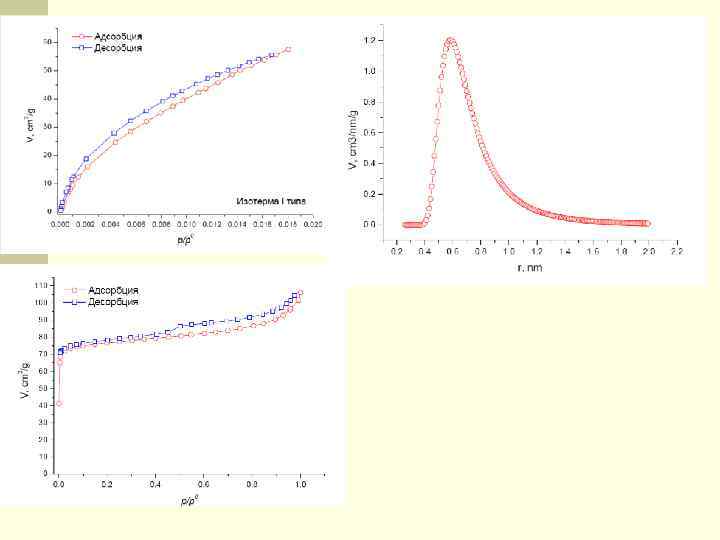
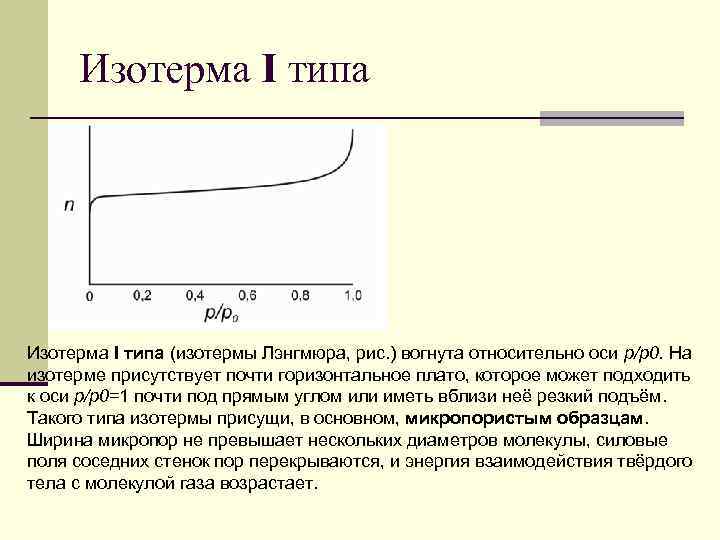 Изотерма I типа (изотермы Лэнгмюра, рис. ) вогнута относительно оси р/р0. На изотерме присутствует почти горизонтальное плато, которое может подходить к оси р/р0=1 почти под прямым углом или иметь вблизи неё резкий подъём. Такого типа изотермы присущи, в основном, микропористым образцам. Ширина микропор не превышает нескольких диаметров молекулы, силовые поля соседних стенок пор перекрываются, и энергия взаимодействия твёрдого тела с молекулой газа возрастает.
Изотерма I типа (изотермы Лэнгмюра, рис. ) вогнута относительно оси р/р0. На изотерме присутствует почти горизонтальное плато, которое может подходить к оси р/р0=1 почти под прямым углом или иметь вблизи неё резкий подъём. Такого типа изотермы присущи, в основном, микропористым образцам. Ширина микропор не превышает нескольких диаметров молекулы, силовые поля соседних стенок пор перекрываются, и энергия взаимодействия твёрдого тела с молекулой газа возрастает.
 Изотерма I типа n Это вызывает отклонение изотермы, особенно в области малых относительных давлений, в n область больших величин адсорбции. n Подобного рода взаимодействия достаточно сильны, чтобы полное заполнение пор происходило при очень низком относительном давлении. n Изотермы этого типа описывают адсорбцию на углеродных адсорбентах, цеолитах, силикагелях.
Изотерма I типа n Это вызывает отклонение изотермы, особенно в области малых относительных давлений, в n область больших величин адсорбции. n Подобного рода взаимодействия достаточно сильны, чтобы полное заполнение пор происходило при очень низком относительном давлении. n Изотермы этого типа описывают адсорбцию на углеродных адсорбентах, цеолитах, силикагелях.
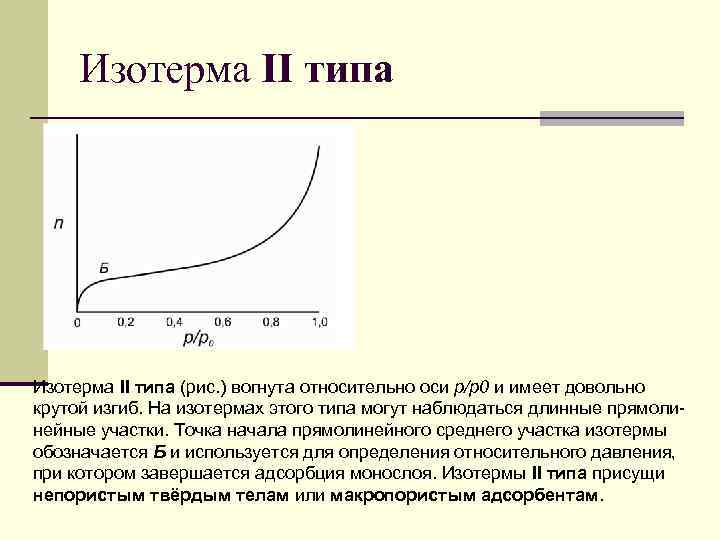 Изотерма II типа (рис. ) вогнута относительно оси р/р0 и имеет довольно крутой изгиб. На изотермах этого типа могут наблюдаться длинные прямолинейные участки. Точка начала прямолинейного среднего участка изотермы обозначается Б и используется для определения относительного давления, при котором завершается адсорбция монослоя. Изотермы II типа присущи непористым твёрдым телам или макропористым адсорбентам.
Изотерма II типа (рис. ) вогнута относительно оси р/р0 и имеет довольно крутой изгиб. На изотермах этого типа могут наблюдаться длинные прямолинейные участки. Точка начала прямолинейного среднего участка изотермы обозначается Б и используется для определения относительного давления, при котором завершается адсорбция монослоя. Изотермы II типа присущи непористым твёрдым телам или макропористым адсорбентам.
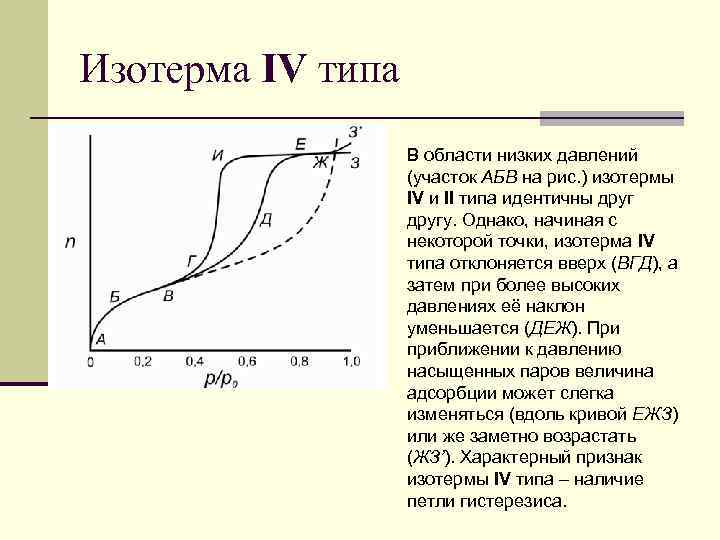 Изотерма IV типа В области низких давлений (участок АБВ на рис. ) изотермы IV и II типа идентичны другу. Однако, начиная с некоторой точки, изотерма IV типа отклоняется вверх (ВГД), а затем при более высоких давлениях её наклон уменьшается (ДЕЖ). При приближении к давлению насыщенных паров величина адсорбции может слегка изменяться (вдоль кривой ЕЖЗ) или же заметно возрастать (ЖЗ’). Характерный признак изотермы IV типа – наличие петли гистерезиса.
Изотерма IV типа В области низких давлений (участок АБВ на рис. ) изотермы IV и II типа идентичны другу. Однако, начиная с некоторой точки, изотерма IV типа отклоняется вверх (ВГД), а затем при более высоких давлениях её наклон уменьшается (ДЕЖ). При приближении к давлению насыщенных паров величина адсорбции может слегка изменяться (вдоль кривой ЕЖЗ) или же заметно возрастать (ЖЗ’). Характерный признак изотермы IV типа – наличие петли гистерезиса.
 Изотерма IV типа n Форма петли может быть различной для разных адсорбционных систем; n однако, как видно из рис. , величина адсорбции при любом данном относительном давлении для десорбционной ветви (ЕИГ) всегда больше, чем для адсорбционной (ГДЕ). n Петля является воспроизводимой, если десорбция начинается с точки, расположенной выше точки Е, которая представляет собой верхнюю точку петли. n IV тип изотерм адсорбции характерен для мезопористых твёрдых тел
Изотерма IV типа n Форма петли может быть различной для разных адсорбционных систем; n однако, как видно из рис. , величина адсорбции при любом данном относительном давлении для десорбционной ветви (ЕИГ) всегда больше, чем для адсорбционной (ГДЕ). n Петля является воспроизводимой, если десорбция начинается с точки, расположенной выше точки Е, которая представляет собой верхнюю точку петли. n IV тип изотерм адсорбции характерен для мезопористых твёрдых тел
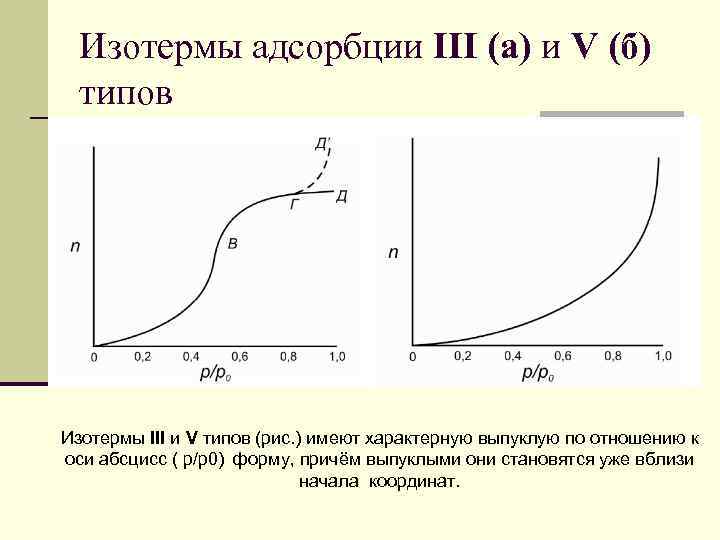 Изотермы адсорбции III (а) и V (б) типов Изотермы III и V типов (рис. ) имеют характерную выпуклую по отношению к оси абсцисс ( р/р0) форму, причём выпуклыми они становятся уже вблизи начала координат.
Изотермы адсорбции III (а) и V (б) типов Изотермы III и V типов (рис. ) имеют характерную выпуклую по отношению к оси абсцисс ( р/р0) форму, причём выпуклыми они становятся уже вблизи начала координат.
 Изотермы адсорбции III (а) и V (б) типов n Изотерма III типа остаётся выпуклой на всём своём протяжении, в то время как на изотерме V типа при довольно высоких относительных давлениях (часто при р/р0 ≥ 0. 5) имеется точка перегиба, так что изотерма изгибается и в области полимолекулярной адсорбции принимает форму плато (ГД на рис. б). n Иногда при давлении, близкому к давлению насыщенных паров, наблюдается подъём изотермы (ГД’ на рис. б) приписываемый адсорбции в крупных мезопорах и макропорах.
Изотермы адсорбции III (а) и V (б) типов n Изотерма III типа остаётся выпуклой на всём своём протяжении, в то время как на изотерме V типа при довольно высоких относительных давлениях (часто при р/р0 ≥ 0. 5) имеется точка перегиба, так что изотерма изгибается и в области полимолекулярной адсорбции принимает форму плато (ГД на рис. б). n Иногда при давлении, близкому к давлению насыщенных паров, наблюдается подъём изотермы (ГД’ на рис. б) приписываемый адсорбции в крупных мезопорах и макропорах.
 Изотермы адсорбции III (а) и V (б) типов n Изотермы адсорбции III и V типов характерны для систем, в которых дисперсионное взаимодействие газ – твёрдое тело меньше взаимодействия молекул адсорбата друг с другом. n Из-за слабого взаимодействия адсорбент – адсорбат поглощение газа при низких давлениях мало; однако, как скоро молекула оказывается адсорбированной, силы взаимодействия адсорбат – адсорбат промотируют дальнейшую адсорбцию, то есть процесс имеет кооперативный характер, и изотерма становится выпуклой по отношению к оси давлений.
Изотермы адсорбции III (а) и V (б) типов n Изотермы адсорбции III и V типов характерны для систем, в которых дисперсионное взаимодействие газ – твёрдое тело меньше взаимодействия молекул адсорбата друг с другом. n Из-за слабого взаимодействия адсорбент – адсорбат поглощение газа при низких давлениях мало; однако, как скоро молекула оказывается адсорбированной, силы взаимодействия адсорбат – адсорбат промотируют дальнейшую адсорбцию, то есть процесс имеет кооперативный характер, и изотерма становится выпуклой по отношению к оси давлений.
 Изотермы адсорбции III (а) и V (б) типов n Изотермы III типа наблюдаются при адсорбции на непористых и макропористых твёрдых телах, n а изотермы V типа – при адсорбции на мезопористых и микропористых. n Экспериментально изотермы III типа получены для адсорбции паров воды и алканов на неполярных твёрдых телах (например, углеродных адсорбентах, органических высокомолекулярных полимерах: полиэтилен, полиметилметакрилат).
Изотермы адсорбции III (а) и V (б) типов n Изотермы III типа наблюдаются при адсорбции на непористых и макропористых твёрдых телах, n а изотермы V типа – при адсорбции на мезопористых и микропористых. n Экспериментально изотермы III типа получены для адсорбции паров воды и алканов на неполярных твёрдых телах (например, углеродных адсорбентах, органических высокомолекулярных полимерах: полиэтилен, полиметилметакрилат).

 Спасибо за внимание!
Спасибо за внимание!


