Lecture_3_2014.ppt
- Количество слайдов: 26
 ПРОЦЕССЫ НА ПОРИСТОМ ЗЕРНЕ КАТАЛИЗАТОРА Инженерная химия каталитических процессов
ПРОЦЕССЫ НА ПОРИСТОМ ЗЕРНЕ КАТАЛИЗАТОРА Инженерная химия каталитических процессов
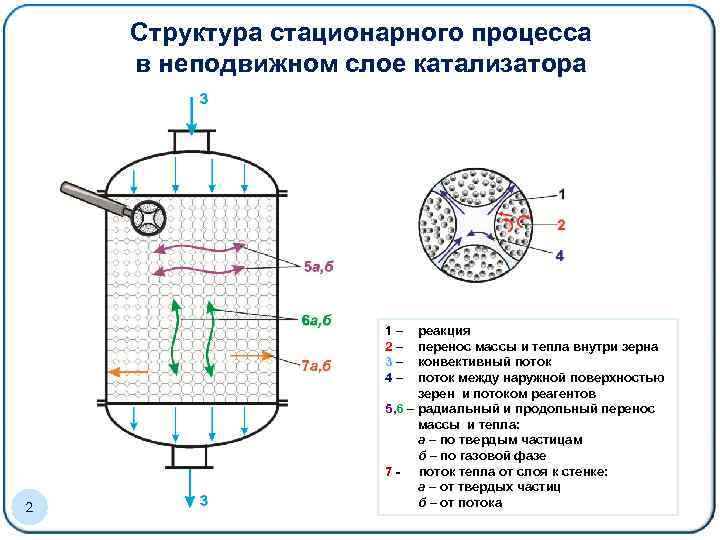 Структура стационарного процесса Образец заголовка в неподвижном слое катализатора 1– 2– 3– 4– 2 реакция перенос массы и тепла внутри зерна конвективный поток между наружной поверхностью зерен и потоком реагентов 5, 6 – радиальный и продольный перенос массы и тепла: а – по твердым частицам б – по газовой фазе 7 - поток тепла от слоя к стенке: а – от твердых частиц б – от потока
Структура стационарного процесса Образец заголовка в неподвижном слое катализатора 1– 2– 3– 4– 2 реакция перенос массы и тепла внутри зерна конвективный поток между наружной поверхностью зерен и потоком реагентов 5, 6 – радиальный и продольный перенос массы и тепла: а – по твердым частицам б – по газовой фазе 7 - поток тепла от слоя к стенке: а – от твердых частиц б – от потока
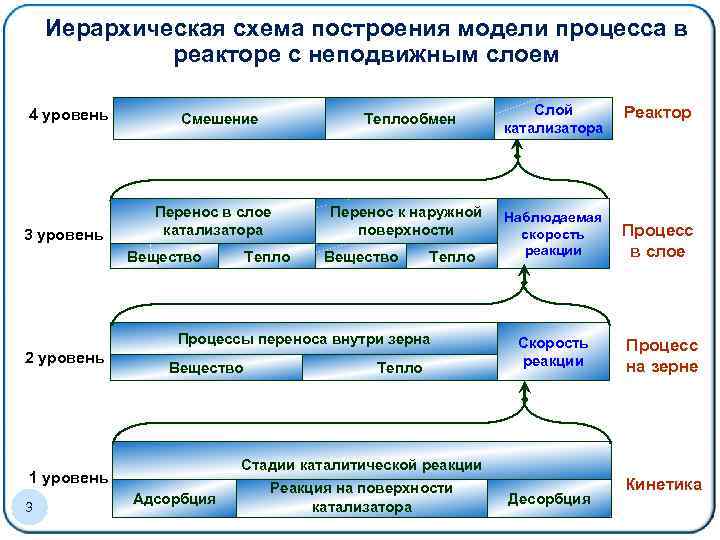 Иерархическая схема построения модели процесса в реакторе с неподвижным слоем Образец заголовка 4 уровень 3 уровень Смешение Теплообмен Перенос в слое катализатора Вещество Тепло Перенос к наружной поверхности Вещество Тепло Процессы переноса внутри зерна 2 уровень Вещество Реактор Наблюдаемая скорость реакции Процесс в слое Скорость реакции Процесс на зерне Стадии каталитической реакции 1 уровень 3 Тепло Слой катализатора Адсорбция Реакция на поверхности катализатора Десорбция Кинетика
Иерархическая схема построения модели процесса в реакторе с неподвижным слоем Образец заголовка 4 уровень 3 уровень Смешение Теплообмен Перенос в слое катализатора Вещество Тепло Перенос к наружной поверхности Вещество Тепло Процессы переноса внутри зерна 2 уровень Вещество Реактор Наблюдаемая скорость реакции Процесс в слое Скорость реакции Процесс на зерне Стадии каталитической реакции 1 уровень 3 Тепло Слой катализатора Адсорбция Реакция на поверхности катализатора Десорбция Кинетика
 Скорость каталитической реакции Образец заголовка Реакция Скорость превращения i-го вещества в процессе катализа определяется как количество этого вещества, прореагировавшего в единицу времени в единице Y, характеризующей количество катализатора. ― Для ключевого компонента А 1 ― Скорость реакции i 0 - исходные вещества, 4 i 0 – продукты r i - скорости расходования и образования компонентов Y – количество катализатора: поверхность [м 2] , масса [г] , объем [см 3]
Скорость каталитической реакции Образец заголовка Реакция Скорость превращения i-го вещества в процессе катализа определяется как количество этого вещества, прореагировавшего в единицу времени в единице Y, характеризующей количество катализатора. ― Для ключевого компонента А 1 ― Скорость реакции i 0 - исходные вещества, 4 i 0 – продукты r i - скорости расходования и образования компонентов Y – количество катализатора: поверхность [м 2] , масса [г] , объем [см 3]
 Скорость каталитической реакции Образец заголовка Реакция Ø Ø 5 Скорость реакции в общем виде: Без изменения объема газовой фазы: Ø Размерности Y – поверхность [м 2], вес [г] или объем катализатора [см 3], V - объем системы, см 3, ci - концентрации компонентов, моль/см 3
Скорость каталитической реакции Образец заголовка Реакция Ø Ø 5 Скорость реакции в общем виде: Без изменения объема газовой фазы: Ø Размерности Y – поверхность [м 2], вес [г] или объем катализатора [см 3], V - объем системы, см 3, ci - концентрации компонентов, моль/см 3
 Общий вид кинетической модели Образец заголовка Кинетическая модель для стационарных условий 1. Экспериментальное определение скоростей каталитической реакции в отсутствии влияния процессов массо- и теплопереноса 2. Вывод кинетических уравнений скоростей реакции • с использованием феноменологического подхода • на основе данных о механизме реакции 3. Решение обратной задачи – определение параметров 4. Дискриминация и выбор кинетических уравнений 6 6
Общий вид кинетической модели Образец заголовка Кинетическая модель для стационарных условий 1. Экспериментальное определение скоростей каталитической реакции в отсутствии влияния процессов массо- и теплопереноса 2. Вывод кинетических уравнений скоростей реакции • с использованием феноменологического подхода • на основе данных о механизме реакции 3. Решение обратной задачи – определение параметров 4. Дискриминация и выбор кинетических уравнений 6 6
 Кинетические Образец заголовка модели для стационарных условий Экспериментальное определение скоростей каталитической реакции § Проведение экспериментов в лабораторных реакторах в отсутствии влияния внутренней и внешней диффузии при T = const § Расчет скоростей реакции, используя величины измеренных концентраций (конверсий) реагентов и продуктов и данные о рабочих условиях – загрузке катализатора, скорости подачи реакционной смеси, температуре и т. д. Область рабочих условий должна охватывать всю область параметров, которые встречаются при практической реализации процесса 7 7
Кинетические Образец заголовка модели для стационарных условий Экспериментальное определение скоростей каталитической реакции § Проведение экспериментов в лабораторных реакторах в отсутствии влияния внутренней и внешней диффузии при T = const § Расчет скоростей реакции, используя величины измеренных концентраций (конверсий) реагентов и продуктов и данные о рабочих условиях – загрузке катализатора, скорости подачи реакционной смеси, температуре и т. д. Область рабочих условий должна охватывать всю область параметров, которые встречаются при практической реализации процесса 7 7
 Математические модели лабораторных реакторов Образец заголовка T = const • Реакторы идеального вытеснения (plug flow reactor) • Реактор идеального смешения (continious stirred tank reactor) 8
Математические модели лабораторных реакторов Образец заголовка T = const • Реакторы идеального вытеснения (plug flow reactor) • Реактор идеального смешения (continious stirred tank reactor) 8
 Кинетические Образец заголовка модели для стационарных условий Требования § Выполнение закона сохранения вещества § Плавный переход модели в тривиальные решения: § Непрерывность по концентрациям § Экстраполяция в рамках условий эксперимента Типичный вид кинетических уравнений: а) степенные зависимости на основе закона действующих масс б) зависимости типа Лэнгмюра - Хиншельвуда 9 9 c 0, r 0;
Кинетические Образец заголовка модели для стационарных условий Требования § Выполнение закона сохранения вещества § Плавный переход модели в тривиальные решения: § Непрерывность по концентрациям § Экстраполяция в рамках условий эксперимента Типичный вид кинетических уравнений: а) степенные зависимости на основе закона действующих масс б) зависимости типа Лэнгмюра - Хиншельвуда 9 9 c 0, r 0;
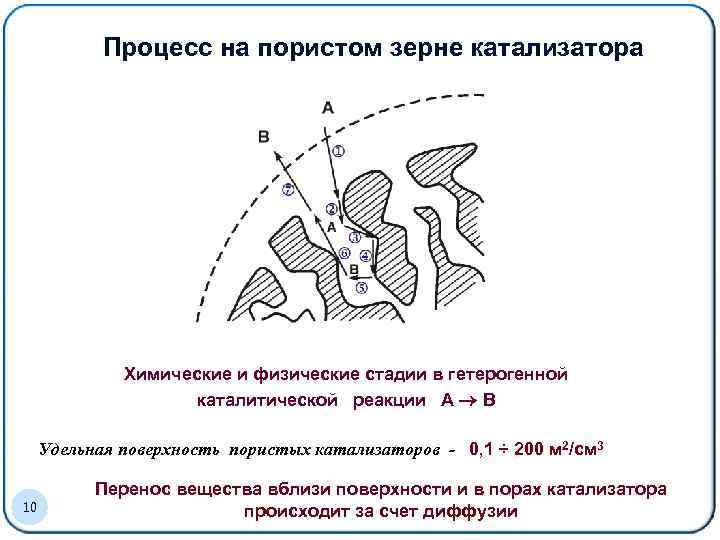 Процесс. Образец заголовка на пористом зерне катализатора Химические и физические стадии в гетерогенной каталитической реакции А В Удельная поверхность пористых катализаторов - 0, 1 ÷ 200 м 2/см 3 10 Перенос вещества вблизи поверхности и в порах катализатора происходит за счет диффузии
Процесс. Образец заголовка на пористом зерне катализатора Химические и физические стадии в гетерогенной каталитической реакции А В Удельная поверхность пористых катализаторов - 0, 1 ÷ 200 м 2/см 3 10 Перенос вещества вблизи поверхности и в порах катализатора происходит за счет диффузии
 Внутренняя поверхность пористого катализатора • Размер микроглобулы rp 10 - 104 А 0 • Размер макроглобулы: - Неподвижный слой Rp 0. 5 – 2 см - Псевдоожиженный слой Rp 10 – 1000 m Оценка удельной поверхности непористой гранулы (шара) Радиус гранулы Rp, см Внешняя поверхность непористой гранулы, S = 4 Rp 2, см 2 Объем непористой гранулы, Vm = 4 / 3 Rp 3 , см 3 Удельная поверхность непористой гранулы, Sp = S / Vp, см 2/ см 3 11 0, 25 1 0, 75 12 0, 06 4 12 3
Внутренняя поверхность пористого катализатора • Размер микроглобулы rp 10 - 104 А 0 • Размер макроглобулы: - Неподвижный слой Rp 0. 5 – 2 см - Псевдоожиженный слой Rp 10 – 1000 m Оценка удельной поверхности непористой гранулы (шара) Радиус гранулы Rp, см Внешняя поверхность непористой гранулы, S = 4 Rp 2, см 2 Объем непористой гранулы, Vm = 4 / 3 Rp 3 , см 3 Удельная поверхность непористой гранулы, Sp = S / Vp, см 2/ см 3 11 0, 25 1 0, 75 12 0, 06 4 12 3
 Внутренняя поверхность пористого катализатора Удельная поверхность промышленных пористых катализаторов в среднем Удельная поверхность непористой гранулы Ss 0, 1 ÷ 200 м 2/см 3 Ss 10 – 20 м 2/ см 3 Sp 10 см 2/ см 3 Отношение удельной поверхности для пористой и непористой гранул шара Отношение объемов макро- и микроглобул: Доля объема пор от общего объема = 0, 3 – 0, 8 гранулы или пористость зерна 12 Гранула катализатора содержит более 107 мелких частиц (микроглобул), поэтому рассматривается как квазигомогенная среда
Внутренняя поверхность пористого катализатора Удельная поверхность промышленных пористых катализаторов в среднем Удельная поверхность непористой гранулы Ss 0, 1 ÷ 200 м 2/см 3 Ss 10 – 20 м 2/ см 3 Sp 10 см 2/ см 3 Отношение удельной поверхности для пористой и непористой гранул шара Отношение объемов макро- и микроглобул: Доля объема пор от общего объема = 0, 3 – 0, 8 гранулы или пористость зерна 12 Гранула катализатора содержит более 107 мелких частиц (микроглобул), поэтому рассматривается как квазигомогенная среда
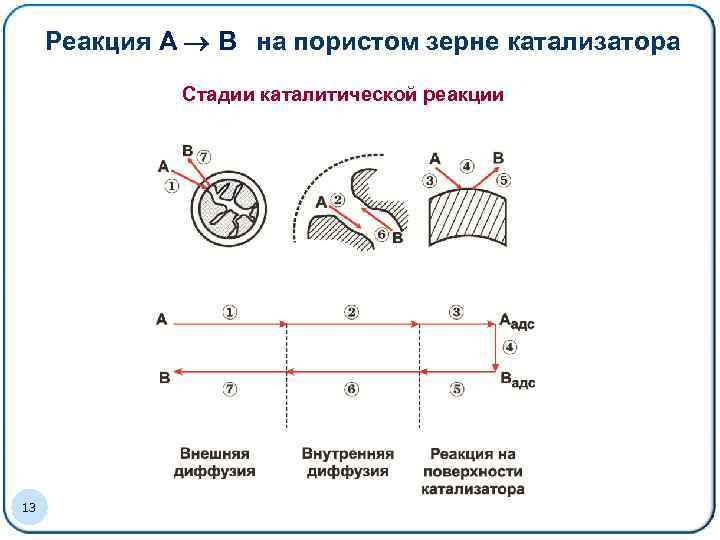 Реакция A B на пористом зерне катализатора Стадии каталитической реакции 13
Реакция A B на пористом зерне катализатора Стадии каталитической реакции 13
 Процесс на пористом зерне катализатора Стадии процесса 1. Перенос реагентов из газового потока, проходящего через слой катализатора, к внешней поверхности гранулы 2. Перенос исходных реагентов от внешней поверхности гранул катализатора к их центру 3. Адсорбция реагентов на поверхности катализатора 4. Реакция на поверхности 5. Десорбция продуктов в газовую фазу 6. Перенос продуктов реакции и непрореагировавших веществ из глубины гранулы к внешней поверхности 7. Перенос продуктов реакции и непрореагировавших веществ от внешней поверхности гранулы в поток 14 ü 3, 4, 5 - Реакция ü 2, 6 Внутренняя диффузия 1, 7 Внешняя диффузия
Процесс на пористом зерне катализатора Стадии процесса 1. Перенос реагентов из газового потока, проходящего через слой катализатора, к внешней поверхности гранулы 2. Перенос исходных реагентов от внешней поверхности гранул катализатора к их центру 3. Адсорбция реагентов на поверхности катализатора 4. Реакция на поверхности 5. Десорбция продуктов в газовую фазу 6. Перенос продуктов реакции и непрореагировавших веществ из глубины гранулы к внешней поверхности 7. Перенос продуктов реакции и непрореагировавших веществ от внешней поверхности гранулы в поток 14 ü 3, 4, 5 - Реакция ü 2, 6 Внутренняя диффузия 1, 7 Внешняя диффузия
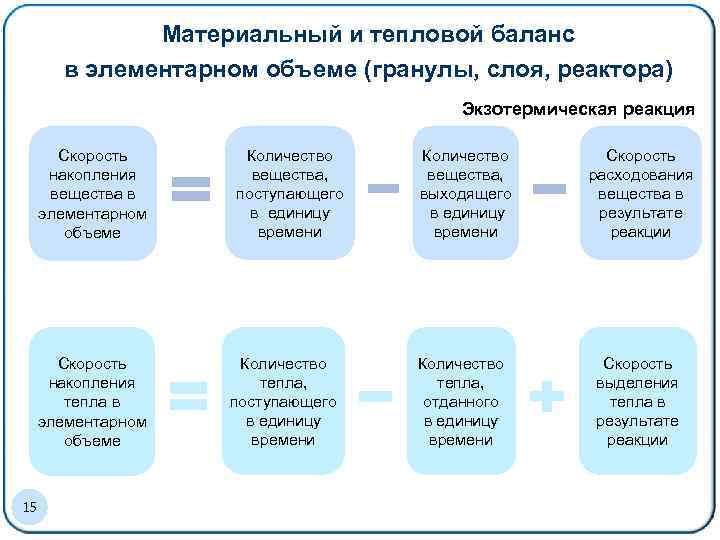 Материальный и тепловой баланс в элементарном объеме (гранулы, слоя, реактора) Экзотермическая реакция Скорость накопления вещества в элементарном объеме Скорость накопления тепла в элементарном объеме 15 Количество вещества, поступающего в единицу времени Количество тепла, поступающего в единицу времени Количество вещества, выходящего в единицу времени Скорость расходования вещества в результате реакции Количество тепла, отданного в единицу времени Скорость выделения тепла в результате реакции
Материальный и тепловой баланс в элементарном объеме (гранулы, слоя, реактора) Экзотермическая реакция Скорость накопления вещества в элементарном объеме Скорость накопления тепла в элементарном объеме 15 Количество вещества, поступающего в единицу времени Количество тепла, поступающего в единицу времени Количество вещества, выходящего в единицу времени Скорость расходования вещества в результате реакции Количество тепла, отданного в единицу времени Скорость выделения тепла в результате реакции
 Основные законы молекулярного переноса массы и тепла в неподвижной газовой среде C + ∆C, T + ∆T C, T q. D, q. T • Закон Фика Диффузионный поток в неподвижной среде через единицу поверхности в единицу времени пропорционален градиенту концентраций D - коэффициент диффузии • Закон Фурье Тепловой поток в неподвижной среде через единицу поверхности в единицу времени пропорционален градиенту температур 16 - коэффициент теплопроводности
Основные законы молекулярного переноса массы и тепла в неподвижной газовой среде C + ∆C, T + ∆T C, T q. D, q. T • Закон Фика Диффузионный поток в неподвижной среде через единицу поверхности в единицу времени пропорционален градиенту концентраций D - коэффициент диффузии • Закон Фурье Тепловой поток в неподвижной среде через единицу поверхности в единицу времени пропорционален градиенту температур 16 - коэффициент теплопроводности
 Формы зерен катализатора 17 потоки газа через каналы монолитных систем
Формы зерен катализатора 17 потоки газа через каналы монолитных систем
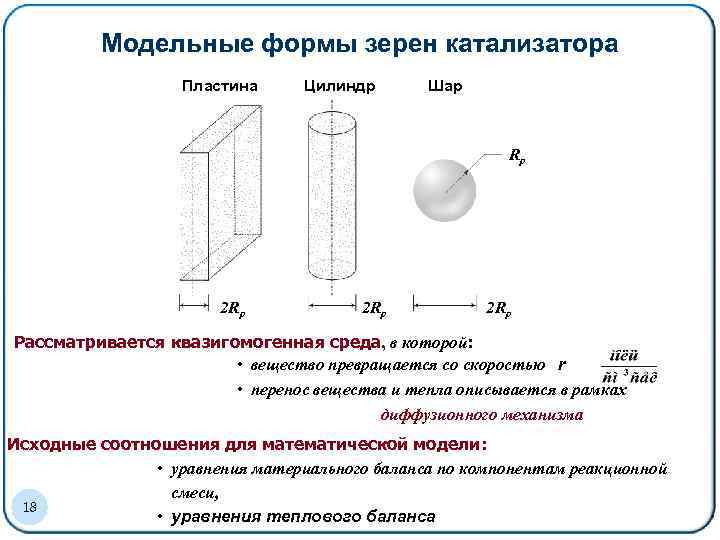 Модельные формы зерен катализатора Пластина Цилиндр Шар Rp 2 Rp 2 Rp Рассматривается квазигомогенная среда, в которой: • вещество превращается со скоростью r • перенос вещества и тепла описывается в рамках диффузионного механизма Исходные соотношения для математической модели: • уравнения материального баланса по компонентам реакционной смеси, 18 • уравнения теплового баланса
Модельные формы зерен катализатора Пластина Цилиндр Шар Rp 2 Rp 2 Rp Рассматривается квазигомогенная среда, в которой: • вещество превращается со скоростью r • перенос вещества и тепла описывается в рамках диффузионного механизма Исходные соотношения для математической модели: • уравнения материального баланса по компонентам реакционной смеси, 18 • уравнения теплового баланса
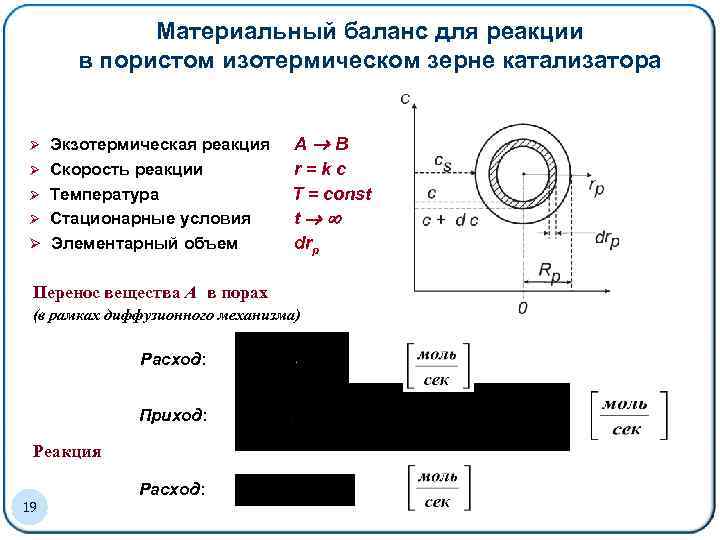 Материальный баланс для реакции в пористом изотермическом зерне катализатора Ø Ø Ø Экзотермическая реакция Скорость реакции Температура Стационарные условия Элементарный объем А В r=kc T = const t drp Перенос вещества А в порах (в рамках диффузионного механизма) Расход: Приход: Реакция 19 Расход:
Материальный баланс для реакции в пористом изотермическом зерне катализатора Ø Ø Ø Экзотермическая реакция Скорость реакции Температура Стационарные условия Элементарный объем А В r=kc T = const t drp Перенос вещества А в порах (в рамках диффузионного механизма) Расход: Приход: Реакция 19 Расход:
 Математическая модель процесса в пористом изотермическом зерне катализатора A B Реакция r=kc = Скорость переноса вещества за счет диффузии = Скорость расходования вещества за счет реакции шар 20 Диффузионная модель с источником вещества
Математическая модель процесса в пористом изотермическом зерне катализатора A B Реакция r=kc = Скорость переноса вещества за счет диффузии = Скорость расходования вещества за счет реакции шар 20 Диффузионная модель с источником вещества
 Математическая модель процесса в пористом изотермическом зерне катализатора Реакция A B r=kc n = 0 пластина n = 1 цилиндр n = 2 шар Для пластины Безразмерные параметры Критерий Тиле – отношение характерных времен (time 21 scales) внутренней диффузии R 2/De и реакции 1/k
Математическая модель процесса в пористом изотермическом зерне катализатора Реакция A B r=kc n = 0 пластина n = 1 цилиндр n = 2 шар Для пластины Безразмерные параметры Критерий Тиле – отношение характерных времен (time 21 scales) внутренней диффузии R 2/De и реакции 1/k
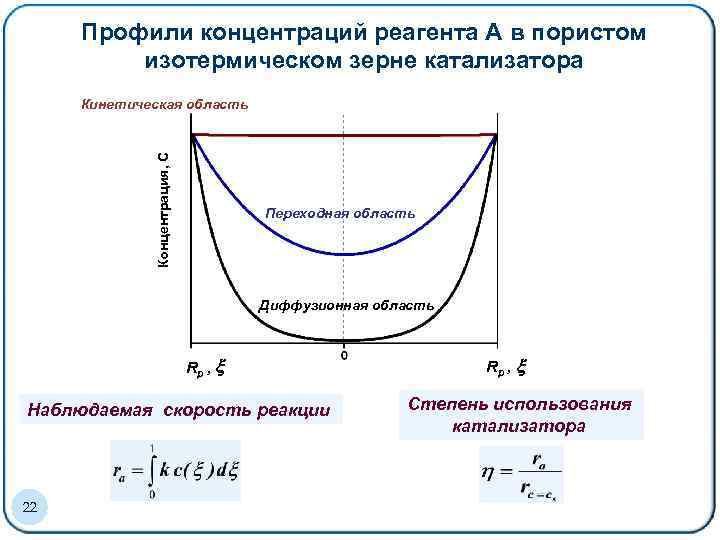 Профили концентраций реагента А в пористом изотермическом зерне катализатора Концентрация, С Кинетическая область Переходная область Диффузионная область Rp , Наблюдаемая скорость реакции 22 Rp , Степень использования катализатора
Профили концентраций реагента А в пористом изотермическом зерне катализатора Концентрация, С Кинетическая область Переходная область Диффузионная область Rp , Наблюдаемая скорость реакции 22 Rp , Степень использования катализатора
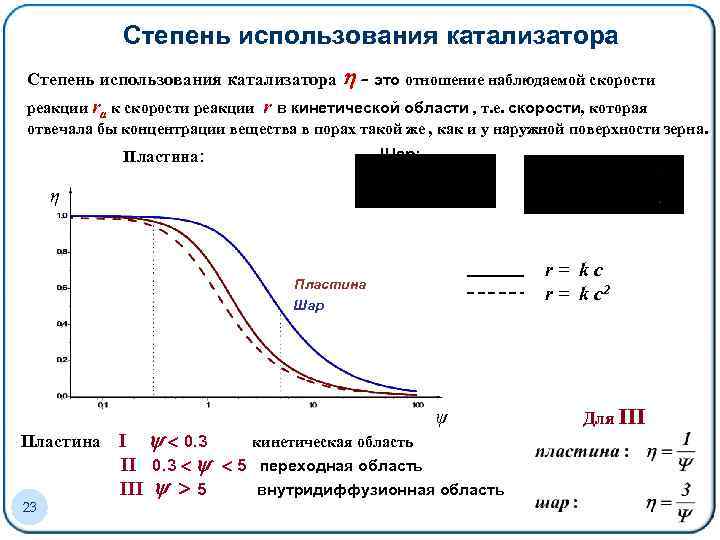 Степень использования катализатора - это отношение наблюдаемой скорости реакции ra к скорости реакции r в кинетической области , т. е. cкорости, которая отвечала бы концентрации вещества в порах такой же , как и у наружной поверхности зерна. Шар: Пластина: η r= kc r = k c 2 Пластина Шар ψ Пластина 23 I 0. 3 кинетическая область II 0. 3 5 переходная область III 5 внутридиффузионная область Для III
Степень использования катализатора - это отношение наблюдаемой скорости реакции ra к скорости реакции r в кинетической области , т. е. cкорости, которая отвечала бы концентрации вещества в порах такой же , как и у наружной поверхности зерна. Шар: Пластина: η r= kc r = k c 2 Пластина Шар ψ Пластина 23 I 0. 3 кинетическая область II 0. 3 5 переходная область III 5 внутридиффузионная область Для III
 Эффективный коэффициент диффузии в грануле катализатора Характер диффузии в грануле зависит от радиуса пор и длины свободного пробега молекул : < 0. 1 молекулярная диффузия 0. 1 < < 10 переходная область > 10 кнудсеновская диффузия - диаметр молекулы, n – число молекул в единице объема При атмосферном давлении 103 А 0, переходная область 102 А 0 < < 104 А 0 24 - пористость, - форма, - извилистость, - шероховатость
Эффективный коэффициент диффузии в грануле катализатора Характер диффузии в грануле зависит от радиуса пор и длины свободного пробега молекул : < 0. 1 молекулярная диффузия 0. 1 < < 10 переходная область > 10 кнудсеновская диффузия - диаметр молекулы, n – число молекул в единице объема При атмосферном давлении 103 А 0, переходная область 102 А 0 < < 104 А 0 24 - пористость, - форма, - извилистость, - шероховатость
 Оценка критерия Тиле Неподвижный слой k 0. 5 - 5 cек-1, Rp 2 - 5 мм, De 0. 03 - 0. 1 cм 2/сек, Псевдоожиженный слой k 0. 5 - 5 cек-1, Rp 100 - 200 м, De 0. 03 - 0. 1 cм 2/сек, Ø 0. 5 – 10 < 0. 01 Приведенный радиус - отношение объема зерна к его внешней поверхности пластина Для приведенного радиуса зависимости шар цилиндр = ( ) практически совпадают для всех форм зерна Ø Энергия активации Во внутридиффузионной области 25 наблюдаемая скорость реакции равна: т. е. наблюдаемая энергия активации равна:
Оценка критерия Тиле Неподвижный слой k 0. 5 - 5 cек-1, Rp 2 - 5 мм, De 0. 03 - 0. 1 cм 2/сек, Псевдоожиженный слой k 0. 5 - 5 cек-1, Rp 100 - 200 м, De 0. 03 - 0. 1 cм 2/сек, Ø 0. 5 – 10 < 0. 01 Приведенный радиус - отношение объема зерна к его внешней поверхности пластина Для приведенного радиуса зависимости шар цилиндр = ( ) практически совпадают для всех форм зерна Ø Энергия активации Во внутридиффузионной области 25 наблюдаемая скорость реакции равна: т. е. наблюдаемая энергия активации равна:
 Влияние внутренней диффузии Ø Обратимые реакции A B r. A = k 1 c. A – k-1 c. B; c. A + c. B = cs r. A = (k 1 + k-1) c. A – k-1 cs Влияние сильнее, чем для необратимых реакций Ø Сложные реакции Cелективность снижается в переходной и внутридиффузионной области n 1 > n 2 n 1 < n 2 26 - селективность снижается - селективность возрастает n 1 = n 2 - нет изменения селективности Диффузионное торможение в бóльшей степени снижает ту скорость реакции, которая быстрее уменьшается с ростом глубины превращения, т. е. чем выше порядок реакции
Влияние внутренней диффузии Ø Обратимые реакции A B r. A = k 1 c. A – k-1 c. B; c. A + c. B = cs r. A = (k 1 + k-1) c. A – k-1 cs Влияние сильнее, чем для необратимых реакций Ø Сложные реакции Cелективность снижается в переходной и внутридиффузионной области n 1 > n 2 n 1 < n 2 26 - селективность снижается - селективность возрастает n 1 = n 2 - нет изменения селективности Диффузионное торможение в бóльшей степени снижает ту скорость реакции, которая быстрее уменьшается с ростом глубины превращения, т. е. чем выше порядок реакции


