2-й закон.ppt
- Количество слайдов: 35
 Процесс, в котором система возвращается в исходное состояние без каких-либо изменений в ней и в окружающей среде называется обратимым термодинамическим процессом. Все обратимые процессы являются равновесными.
Процесс, в котором система возвращается в исходное состояние без каких-либо изменений в ней и в окружающей среде называется обратимым термодинамическим процессом. Все обратимые процессы являются равновесными.
 Равновесный процесс характеризуется: -бесконечно малой скоростью -в каждый момент времени параметры системы отличаются на бесконечно малую величину, - максимальной работой.
Равновесный процесс характеризуется: -бесконечно малой скоростью -в каждый момент времени параметры системы отличаются на бесконечно малую величину, - максимальной работой.
 Необратимым называется процесс, который нельзя провести в противоположном направлении через все те же самые промежуточные состояния, что и в прямом направлении.
Необратимым называется процесс, который нельзя провести в противоположном направлении через все те же самые промежуточные состояния, что и в прямом направлении.
 2 -ое начало термодинамики
2 -ое начало термодинамики
 Рудольф Юлиус Эммануель Клаузиус (1822 -1888) Ввел понятие энтропии (1865 г. )
Рудольф Юлиус Эммануель Клаузиус (1822 -1888) Ввел понятие энтропии (1865 г. )
 Равновесный (обратимый) Неравновесный процесс (необратимый) процесс Принцип существования Принцип возрастания энтропии Для любой термодинамической системы существует функция состояния S , называемая энтропией, такая, что ее бесконечно малое изменение равно: d. S = δQ / T. d. S — приращение энтропии; δQ — минимальная теплота подведенная к системе; T — абсолютная температура. d. S > δQ / T.
Равновесный (обратимый) Неравновесный процесс (необратимый) процесс Принцип существования Принцип возрастания энтропии Для любой термодинамической системы существует функция состояния S , называемая энтропией, такая, что ее бесконечно малое изменение равно: d. S = δQ / T. d. S — приращение энтропии; δQ — минимальная теплота подведенная к системе; T — абсолютная температура. d. S > δQ / T.
 Равновесный (обратимый) процесс Неравновесный (необратимый) процесс Изолированная система (δQ=0) d. S = 0 d. S > 0
Равновесный (обратимый) процесс Неравновесный (необратимый) процесс Изолированная система (δQ=0) d. S = 0 d. S > 0
 В изолированных системах самопроизвольно могут протекать только такие процессы, в которых энтропия увеличивается: d. S > 0
В изолированных системах самопроизвольно могут протекать только такие процессы, в которых энтропия увеличивается: d. S > 0
 Закрытые системы m=const, δQ ╪ 0 а) изохорноизотермические условия (V, T=const).
Закрытые системы m=const, δQ ╪ 0 а) изохорноизотермические условия (V, T=const).
 Первый закон термодинамики для малого изменения состояния системы будет иметь вид: U – функция состояния системы; d. U – её полный дифференциал, а δQ и δА таковыми не являются.
Первый закон термодинамики для малого изменения состояния системы будет иметь вид: U – функция состояния системы; d. U – её полный дифференциал, а δQ и δА таковыми не являются.
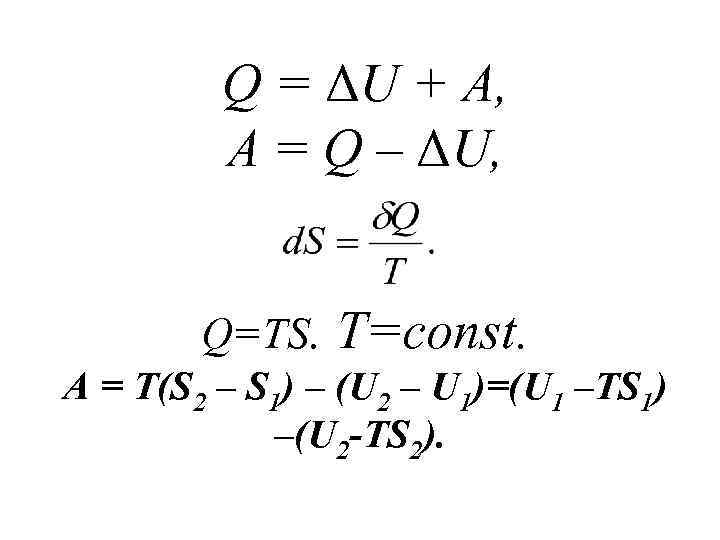 Q = ΔU + A, A = Q – ΔU, Q=TS. T=const. A = T(S 2 – S 1) – (U 2 – U 1)=(U 1 –TS 1) –(U 2 -TS 2).
Q = ΔU + A, A = Q – ΔU, Q=TS. T=const. A = T(S 2 – S 1) – (U 2 – U 1)=(U 1 –TS 1) –(U 2 -TS 2).
 U – TS = F Энергия Гельмгольца Изохорно-изотермический потенциал А = (U 1 –TS 1) –(U 2 -TS 2)= F 1 – F 2 = –ΔF, Аравн = –ΔF.
U – TS = F Энергия Гельмгольца Изохорно-изотермический потенциал А = (U 1 –TS 1) –(U 2 -TS 2)= F 1 – F 2 = –ΔF, Аравн = –ΔF.
 В самопроизвольном процессе А>0. А = –ΔF. Значит: ΔF<0. Это критерий направления самопроизвольного процесса.
В самопроизвольном процессе А>0. А = –ΔF. Значит: ΔF<0. Это критерий направления самопроизвольного процесса.
 В закрытой системе в изохорно-изотермических условиях самопроизвольный процесс протекает в сторону уменьшения энергии Гельмгольца F (изохорно-изотермического потенциала)
В закрытой системе в изохорно-изотермических условиях самопроизвольный процесс протекает в сторону уменьшения энергии Гельмгольца F (изохорно-изотермического потенциала)
 Закрытые системы m=const, δQ ╪ 0 б) изобарноизотермические условия (p, T=const).
Закрытые системы m=const, δQ ╪ 0 б) изобарноизотермические условия (p, T=const).
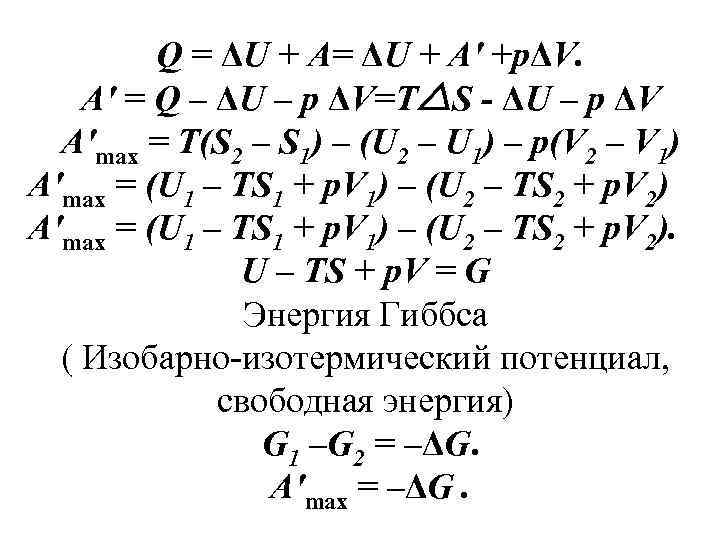 Q = ΔU + A′ +pΔV. A′ = Q – ΔU – p ΔV=T S - ΔU – p ΔV A′max = T(S 2 – S 1) – (U 2 – U 1) – p(V 2 – V 1) A′max = (U 1 – TS 1 + p. V 1) – (U 2 – TS 2 + p. V 2). U – TS + p. V = G Энергия Гиббса ( Изобарно-изотермический потенциал, свободная энергия) G 1 –G 2 = –ΔG. A′max = –ΔG.
Q = ΔU + A′ +pΔV. A′ = Q – ΔU – p ΔV=T S - ΔU – p ΔV A′max = T(S 2 – S 1) – (U 2 – U 1) – p(V 2 – V 1) A′max = (U 1 – TS 1 + p. V 1) – (U 2 – TS 2 + p. V 2). U – TS + p. V = G Энергия Гиббса ( Изобарно-изотермический потенциал, свободная энергия) G 1 –G 2 = –ΔG. A′max = –ΔG.
 Изменение энергии Гиббса (ΔG) равно максимальной работе, взятой с противоположным знаком, которую система может выполнить в изобарно -изотермических условиях: A′max = –ΔG.
Изменение энергии Гиббса (ΔG) равно максимальной работе, взятой с противоположным знаком, которую система может выполнить в изобарно -изотермических условиях: A′max = –ΔG.
 В самопроизвольном процессе А>0. А = –ΔG. Значит: ΔG<0. Это критерий направления самопроизвольного процесса в изобарно-изотермических условиях.
В самопроизвольном процессе А>0. А = –ΔG. Значит: ΔG<0. Это критерий направления самопроизвольного процесса в изобарно-изотермических условиях.
 В закрытой системе в изобарноизотермических условиях самопроизвольный процесс протекает в сторону уменьшения энергии Гиббса ΔG (изобарно-изотермического потенциала, свободной энергии).
В закрытой системе в изобарноизотермических условиях самопроизвольный процесс протекает в сторону уменьшения энергии Гиббса ΔG (изобарно-изотермического потенциала, свободной энергии).
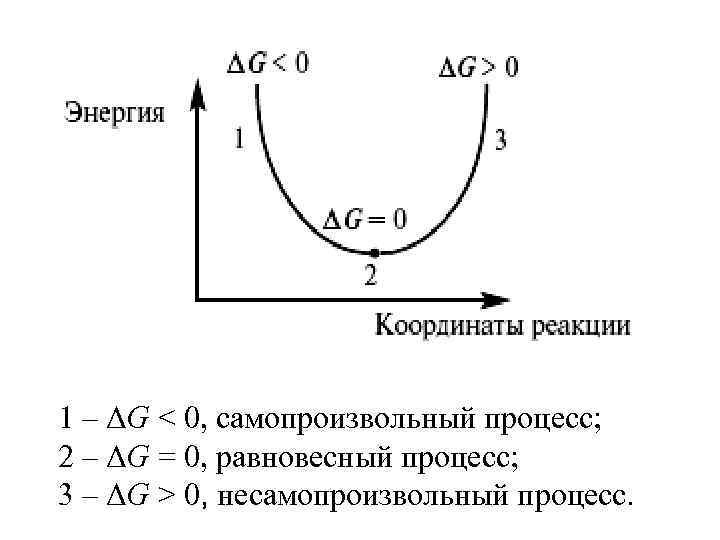 1 – ΔG < 0, самопроизвольный процесс; 2 – ΔG = 0, равновесный процесс; 3 – ΔG > 0, несамопроизвольный процесс.
1 – ΔG < 0, самопроизвольный процесс; 2 – ΔG = 0, равновесный процесс; 3 – ΔG > 0, несамопроизвольный процесс.
 Условия самопроизвольного протекания реакций (∆G= ∆H-T∆S<0) 1. Экзотермические реакции: ΔH < 0. Если ΔS > 0, то ΔG <0. 2. Эндотермические реакции: ΔH > 0. Если │TΔS│> │ΔН│, то ΔG <0. Это имеет место при ΔS > 0 или высоких температурах.
Условия самопроизвольного протекания реакций (∆G= ∆H-T∆S<0) 1. Экзотермические реакции: ΔH < 0. Если ΔS > 0, то ΔG <0. 2. Эндотермические реакции: ΔH > 0. Если │TΔS│> │ΔН│, то ΔG <0. Это имеет место при ΔS > 0 или высоких температурах.
 Изменение ΔGх. р. (как и ΔН и ΔS) не зависит от пути перехода системы из начального состояния в конечное и подчиняется следствию из закона Гесса: ΔGх. р. = Σ ΔGконеч. в-в – Σ ΔGисх. в-в.
Изменение ΔGх. р. (как и ΔН и ΔS) не зависит от пути перехода системы из начального состояния в конечное и подчиняется следствию из закона Гесса: ΔGх. р. = Σ ΔGконеч. в-в – Σ ΔGисх. в-в.
 Третье начало термодинамики
Третье начало термодинамики
 Макросостояние системы определяется с помощью макропараметров (V, P, T, m и других). Микросостояние системы определяется состоянием всех её частиц. (μ-состояние) – состояние, определяемое состоянием
Макросостояние системы определяется с помощью макропараметров (V, P, T, m и других). Микросостояние системы определяется состоянием всех её частиц. (μ-состояние) – состояние, определяемое состоянием
 Микропараметры характеризуют отдельную частицу. Например, массу молекулы, ее скорость, энергию.
Микропараметры характеризуют отдельную частицу. Например, массу молекулы, ее скорость, энергию.
 • Т/д рассматривает системы, состоящие из множества микрочастиц • Микрочастицы находятся в постоянном движении • Эти движения определяют все функции и параметры систем и называются т/д вероятностью системы (W) • Т/д-я вероятность является мерой беспорядка в системе
• Т/д рассматривает системы, состоящие из множества микрочастиц • Микрочастицы находятся в постоянном движении • Эти движения определяют все функции и параметры систем и называются т/д вероятностью системы (W) • Т/д-я вероятность является мерой беспорядка в системе
 Термодинамической вероятностью W называют число микросостояний, реализующих данное макросостояние.
Термодинамической вероятностью W называют число микросостояний, реализующих данное макросостояние.
 Количественная связь между энтропией S и термодинамической вероятностью W выражается формулой Больцмана: S = k∙ln. W (k – постоянная Больцмана)
Количественная связь между энтропией S и термодинамической вероятностью W выражается формулой Больцмана: S = k∙ln. W (k – постоянная Больцмана)
 Третье начало термодинамики Энтропия идеального совершенного кристалла при стремлении абсолютной температуры к нулю стремится к нулю : S = k∙ln. W → 0 при Т → 0 (W → 1).
Третье начало термодинамики Энтропия идеального совершенного кристалла при стремлении абсолютной температуры к нулю стремится к нулю : S = k∙ln. W → 0 при Т → 0 (W → 1).
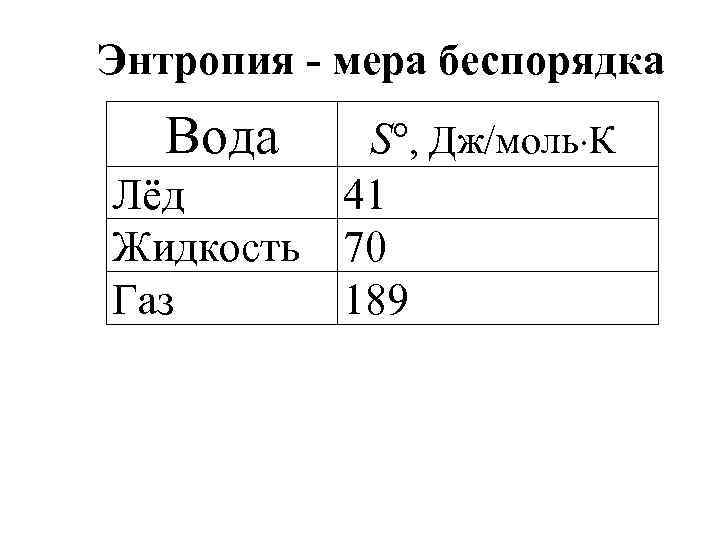 Энтропия - мера беспорядка Вода S , Дж/моль К Лёд 41 Жидкость 70 Газ 189
Энтропия - мера беспорядка Вода S , Дж/моль К Лёд 41 Жидкость 70 Газ 189
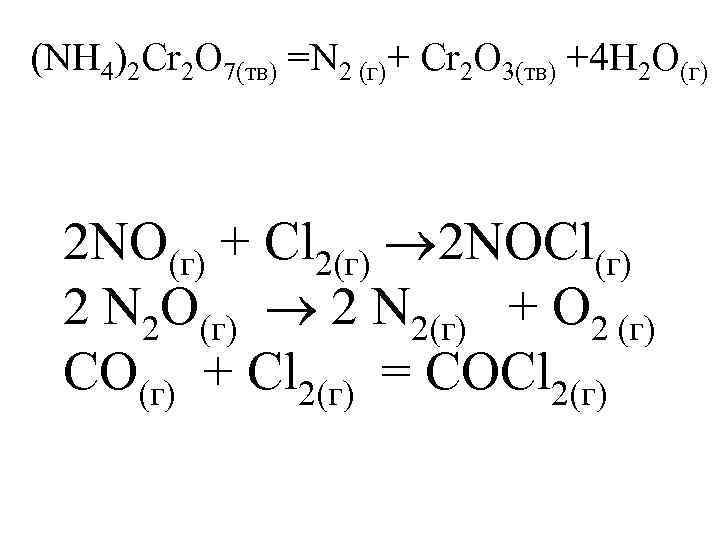 (NH 4)2 Cr 2 O 7(тв) =N 2 (г)+ Cr 2 O 3(тв) +4 H 2 O(г) 2 NO(г) + Cl 2(г) 2 NOCl(г) 2 N 2 O(г) 2 N 2(г) + O 2 (г) CO(г) + Cl 2(г) = COCl 2(г)
(NH 4)2 Cr 2 O 7(тв) =N 2 (г)+ Cr 2 O 3(тв) +4 H 2 O(г) 2 NO(г) + Cl 2(г) 2 NOCl(г) 2 N 2 O(г) 2 N 2(г) + O 2 (г) CO(г) + Cl 2(г) = COCl 2(г)
 Критерий направленности процессов • Равновесие G = 0; Н = Т S • Самопроизвольный процесс G < 0; Н - Т S < 0 • Несамопроизвольный процесс G > 0; Н - Т S > 0
Критерий направленности процессов • Равновесие G = 0; Н = Т S • Самопроизвольный процесс G < 0; Н - Т S < 0 • Несамопроизвольный процесс G > 0; Н - Т S > 0
 Влияние отдельных факторов на изменение энергии Гиббса Н S G Направление <0 >0 <0 <0 <0 и >0 Возможна при любой to Невозможна при любой to Возможна при >0 >0 >0 и <0 низкой o t Возможна при o высоких t
Влияние отдельных факторов на изменение энергии Гиббса Н S G Направление <0 >0 <0 <0 <0 и >0 Возможна при любой to Невозможна при любой to Возможна при >0 >0 >0 и <0 низкой o t Возможна при o высоких t
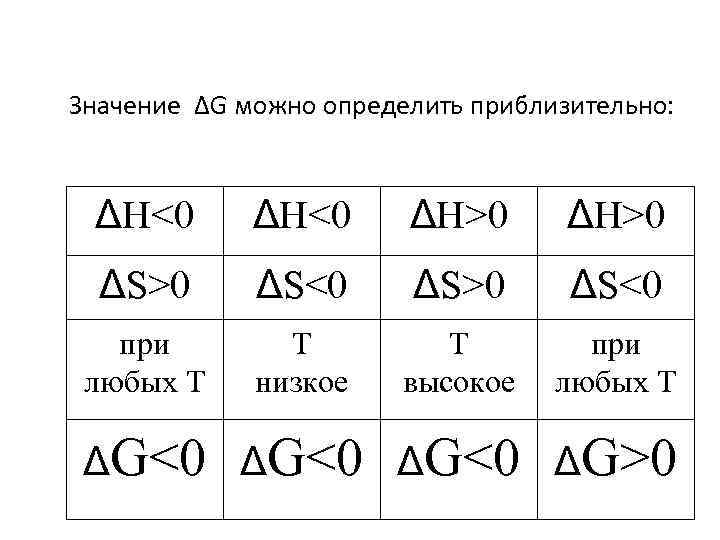 Значение ΔG можно определить приблизительно: ΔH<0 ΔH>0 ΔS>0 ΔS<0 при любых Т Т низкое Т высокое при любых Т ΔG<0 ΔG>0
Значение ΔG можно определить приблизительно: ΔH<0 ΔH>0 ΔS>0 ΔS<0 при любых Т Т низкое Т высокое при любых Т ΔG<0 ΔG>0
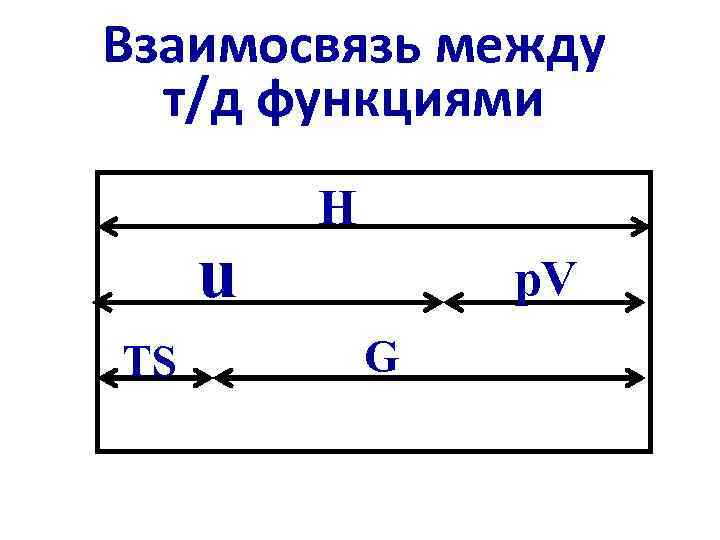 Взаимосвязь между т/д функциями u TS Н p. V G
Взаимосвязь между т/д функциями u TS Н p. V G


